Тканевая инженерия
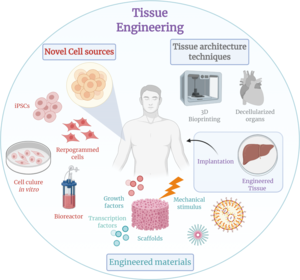
Тканевая инженерия — это биомедицинская инженерная дисциплина, которая использует сочетание клеток , инженерных методов , материалов и подходящих биохимических и физико-химических факторов для восстановления, поддержания, улучшения или замены различных типов биологических тканей. Тканевая инженерия часто предполагает использование клеток, помещенных на тканевые каркасы , для формирования новой жизнеспособной ткани в медицинских целях, но не ограничивается применениями, включающими клетки и тканевые каркасы. Хотя когда-то это направление было отнесено к категории биоматериалов , с ростом масштабов и важности оно может рассматриваться как отдельная область. [1]
Хотя большинство определений тканевой инженерии охватывают широкий спектр применений, на практике этот термин тесно связан с применениями, которые восстанавливают или заменяют части или целые ткани (т.е. органы , кости , хрящи , [2] кровеносные сосуды , мочевой пузырь , кожа , мышцы и т. д.). Часто задействованным тканям для правильного функционирования требуются определенные механические и структурные свойства. Этот термин также применялся к усилиям по выполнению определенных биохимических функций с использованием клеток внутри искусственно созданной системы поддержки (например, искусственной поджелудочной железы или биоискусственной печени ). Термин регенеративная медицина часто используется как синоним тканевой инженерии, хотя те, кто занимается регенеративной медициной, уделяют больше внимания использованию стволовых клеток или клеток-предшественников для производства тканей.
Обзор [ править ]

Обычно применяемое определение тканевой инженерии, сформулированное Лангером. [3] и Ваканти, [4] - это « междисциплинарная область, которая применяет принципы инженерии и наук о жизни для разработки биологических заменителей, которые восстанавливают, поддерживают или улучшают функцию [биологической ткани] или целого органа». [5] Кроме того, Лангер и Ваканти также утверждают, что существует три основных типа тканевой инженерии: клетки, тканеиндуцирующие вещества и подход «клетки + матрица» (часто называемый каркасом). Тканевую инженерию также определяют как «понимание принципов роста тканей и их применение для производства функциональной замены ткани для клинического использования». [6] Далее в описании говорится, что «основополагающим предположением тканевой инженерии является то, что использование естественной биологии системы позволит добиться большего успеха в разработке терапевтических стратегий, направленных на замену, восстановление, поддержание или улучшение функции ткани». [6]
Разработки в междисциплинарной области тканевой инженерии привели к появлению нового набора запасных частей для тканей и стратегий их реализации. Научные достижения в области биоматериалов , стволовых клеток, факторов роста и дифференцировки, а также биомиметических сред создали уникальные возможности для изготовления или улучшения существующих тканей в лаборатории из комбинаций спроектированных внеклеточных матриц («каркасов»), клеток и биологически активных молекул. Среди основных проблем, с которыми сейчас сталкивается тканевая инженерия, — необходимость более сложной функциональности, биомеханической стабильности и васкуляризации в выращенных в лаборатории тканях, предназначенных для трансплантации. [7]
Этимология [ править ]
Историческое происхождение этого термина неясно, поскольку определение этого слова изменилось за последние несколько десятилетий. Этот термин впервые появился в публикации 1984 года, в которой описывалась организация эндотелийподобной мембраны на поверхности давно имплантированного синтетического офтальмологического протеза. [8]
Первое современное использование этого термина, как оно признано сегодня, было в 1985 году исследователем, физиологом и биоинженером Юань-Ченг Фунгом из Центра инженерных исследований. Он предложил объединить термины ткань (в отношении фундаментальных взаимоотношений между клетками и органами) и инженерия (в отношении области модификации указанных тканей). Официально термин был принят в 1987 году. [8]
История [ править ]
(до 17 века Древняя эпоха )
Элементарное понимание внутренней работы тканей человека может возникнуть гораздо раньше, чем многие ожидают. Еще в период неолита швы использовались для закрытия ран и облегчения заживления. Позже в таких обществах, как Древний Египет, были разработаны более совершенные материалы для зашивания ран, такие как льняные швы. Около 2500 г. до н.э. в древней Индии были разработаны кожные трансплантаты путем разрезания кожи с ягодицы и пришивания ее к ранам в ухе, носу или губах. Древние египтяне часто пересаживали кожу трупов живым людям и даже пытались использовать мед в качестве антибиотика, а жир — в качестве защитного барьера для предотвращения инфекции. В I и II веках нашей эры галло-римляне разработали имплантаты из кованого железа, а зубные имплантаты можно было найти у древних майя.
(17–19 Просвещение века )
Хотя эти древние общества разработали методы, которые намного опередили свое время, им все еще не хватало механистического понимания того, как тело реагирует на эти процедуры. Этот механистический подход возник одновременно с развитием эмпирического метода науки, впервые предложенного Рене Декартом. Сэр Исаак Ньютон начал описывать тело как «физико-химическую машину» и утверждал, что болезнь — это сбой в машине.
В 17 веке Роберт Гук открыл клетку, а письмо Бенедикта де Спинозы выдвинуло идею гомеостаза между динамическими процессами в организме. Эксперименты с гидрой, проведенные Авраамом Трамбли в 18 веке, начали углубляться в регенеративные способности клеток. В XIX веке лучшее понимание того, как различные металлы взаимодействуют с организмом, привело к разработке более совершенных шовных материалов и переходу к винтовым и пластинчатым имплантатам для фиксации кости. Кроме того, в середине 1800-х годов впервые была выдвинута гипотеза, что взаимодействие клеток с окружающей средой и пролиферация клеток жизненно важны для регенерации тканей.
Современная эпоха (20 и века 21 )
С течением времени и развитием технологий существует постоянная потребность в изменении подхода, который исследователи применяют в своих исследованиях. Тканевая инженерия продолжала развиваться на протяжении веков. Вначале люди рассматривали и использовали образцы непосредственно из трупов людей или животных. Теперь тканевые инженеры имеют возможность переделывать многие ткани организма с помощью современных методов, таких как микрообработка и трехмерная биопечать, в сочетании с нативными тканевыми клетками/стволовыми клетками. Эти достижения позволили исследователям создавать новые ткани гораздо более эффективным способом. Например, эти методы позволяют добиться большей персонализации, что обеспечивает лучшую биосовместимость, снижение иммунного ответа, клеточную интеграцию и долговечность. Нет сомнений в том, что эти методы будут продолжать развиваться, поскольку в течение последнего десятилетия мы продолжали наблюдать развитие микрообработки и биопечати.
В 1960 году Вихтерле и Лим первыми опубликовали эксперименты с гидрогелями для биомедицинских применений, используя их при изготовлении контактных линз. Работа в этой области развивалась медленно в течение следующих двух десятилетий, но позже получила развитие, когда гидрогели были перепрофилированы для доставки лекарств. В 1984 году Чарльз Халл разработал биопечать, превратив струйный принтер Hewlett-Packard в устройство, способное наносить клетки в 2D. Трехмерная (3-D) печать — это тип аддитивного производства, который с тех пор нашел различные применения в медицинской технике благодаря своей высокой точности и эффективности. С разработкой биологом Джеймсом Томпсоном первых линий стволовых клеток человека в 1998 году, за которой последовала трансплантация первых выращенных в лаборатории внутренних органов в 1999 году и создание первого биопринтера в 2003 году в Университете Миссури, когда они напечатали сфероиды без необходимости использования каркасов, 3- Биопечать D стала более широко использоваться в медицинской сфере, чем когда-либо прежде. На данный момент ученым удалось напечатать мини-органоиды и органы на чипах , которые позволили получить практическое представление о функциях человеческого тела. Фармацевтические компании используют эти модели для тестирования лекарств, прежде чем перейти к исследованиям на животных. Однако полностью функциональный и структурно подобный орган до сих пор не напечатан. Сообщается, что команда из Университета Юты напечатала уши и успешно трансплантировала их детям, рожденным с дефектами, из-за которых уши частично развились.
Сегодня гидрогели считаются предпочтительным выбором биочернил для трехмерной биопечати, поскольку они имитируют естественный ЕСМ клеток, а также обладают сильными механическими свойствами, способными поддерживать трехмерные структуры. Кроме того, гидрогели в сочетании с 3D-биопечатью позволяют исследователям создавать различные каркасы, которые можно использовать для формирования новых тканей или органов. Ткани, напечатанные на 3D-принтере, по-прежнему сталкиваются со многими проблемами, такими как добавление сосудистой сети. Между тем, 3D-печать частей тканей определенно улучшит наше понимание человеческого тела, тем самым ускоряя как фундаментальные, так и клинические исследования.
Примеры [ править ]

По определению Лангера и Ваканти, [5] примеры тканевой инженерии попадают в одну или несколько из трех категорий: «только клетки», «клетки и каркас» или «факторы, индуцирующие ткани».
- Мясо in vitro : Съедобная искусственная мышечная ткань животных, культивированная in vitro .
- Биоискусственное устройство печени , «Временная печень», Экстракорпоральное устройство поддержки печени (ELAD): Линия клеток гепатоцитов человека (линия C3A) в половолоконном биореакторе может имитировать печеночную функцию печени в острых случаях печеночной недостаточности. Полностью работоспособный ELAD будет временно функционировать как печень человека, избегая таким образом трансплантации и обеспечивая регенерацию собственной печени.
- Искусственная поджелудочная железа . Исследования включают использование островковых клеток для регулирования уровня сахара в крови, особенно в случаях диабета . Биохимические факторы могут быть использованы для того, чтобы заставить плюрипотентные стволовые клетки человека дифференцироваться (превращаться в) клетки, которые функционируют аналогично бета-клеткам , которые находятся в островковых клетках, отвечающих за выработку инсулина .
- Искусственные мочевые пузыри : Энтони Атала [9] ( Университет Уэйк Форест ) успешно имплантировал искусственные мочевые пузыри, построенные из культивируемых клеток, высеянных на каркас в форме мочевого пузыря, семи из примерно 20 человек-испытуемых в рамках долгосрочного эксперимента . [10]
- Хрящ : выращенный в лаборатории хрящ, культивированный in vitro на каркасе, успешно использовался в качестве аутологичного трансплантата для восстановления коленей пациентов. [11]
- Хрящ без каркаса: хрящ, созданный без использования экзогенного каркасного материала. В этой методологии весь материал в конструкции является клеточным, вырабатываемым непосредственно клетками. [12]
- Биоискусственное сердце : Дорис Тейлор В лаборатории было создано биосовместимое крысиное сердце путем рецеллюляризации децеллюляризированного крысиного сердца. Этот каркас и клетки были помещены в биореактор , где они созрели и превратились в частично или полностью трансплантируемый орган. [13] работу назвали «ориентирной». Лаборатория сначала удалила клетки из сердца крысы (процесс, называемый « децеллюляризацией »), а затем ввела стволовые клетки крысы в децеллюляризированное сердце крысы. [14]
- Тканеинженерные кровеносные сосуды : [15] Кровеносные сосуды, выращенные в лаборатории и которые можно использовать для восстановления поврежденных кровеносных сосудов, не вызывая иммунного ответа . Тканеинженерные кровеносные сосуды были разработаны с помощью множества различных подходов. Их можно имплантировать в виде заранее засеянных клеточных кровеносных сосудов. [16] в виде бесклеточных сосудистых трансплантатов, изготовленных из децеллюляризированных сосудов или синтетических сосудистых трансплантатов . [17]
- Искусственная кожа , созданная из клеток кожи человека, заключенных в гидрогель , например, в случае биопечатных конструкций для ремонта ожогов на поле боя. [18]
- Искусственный костный мозг : костный мозг, культивируемый in vitro для трансплантации, служит подходом «просто клеток» к тканевой инженерии. [19]
- Тканевая инженерия кости. Структурная матрица может состоять из таких металлов, как титан, полимеров с различной скоростью разложения или определенных типов керамики. [20] Материалы часто выбираются для привлечения остеобластов , чтобы помочь реформировать кость и вернуть биологическую функцию. [21] Различные типы ячеек можно добавлять непосредственно в матрицу, чтобы ускорить процесс. [20]
- Пенис, выращенный в лаборатории : Децеллюляризированные каркасы пенисов кроликов рецеллюляризировались гладкомышечными и эндотелиальными клетками. Затем этот орган был трансплантирован живым кроликам, и он функционировал так же, как и нативный орган, что позволяет предположить его потенциал для лечения травм половых органов . [22]
- Тканевая инженерия слизистой оболочки полости рта использует подход клеток и каркасов для воспроизведения трехмерной структуры и функции слизистой оболочки полости рта .
Клетки как строительные блоки [ править ]

Клетки являются одним из основных компонентов успеха тканевой инженерии. Тканевая инженерия использует клетки в качестве стратегии создания/замены новой ткани. Примеры включают фибробласты, используемые для восстановления или обновления кожи, [23] хондроциты, используемые для восстановления хряща (продукт, одобренный MACI–FDA), и гепатоциты, используемые в системах поддержки печени.
Клетки можно использовать отдельно или с опорными матрицами для целей тканевой инженерии. Адекватная среда для стимулирования роста, дифференциации и интеграции клеток с существующей тканью является критическим фактором для строительных блоков на основе клеток. [24] Манипулирование любым из этих клеточных процессов создает альтернативные пути развития новой ткани (например, перепрограммирование клеток – соматических клеток, васкуляризация).
Изоляция [ править ]
Методы выделения клеток зависят от источника клеток. Центрифугирование и аферез представляют собой методы, используемые для извлечения клеток из биожидкостей (например, крови). В то время как процессы пищеварения, обычно с использованием ферментов для удаления внеклеточного матрикса (ECM), необходимы перед методами центрифугирования или афереза для извлечения клеток из тканей/органов. Трипсин и коллагеназа являются наиболее распространенными ферментами, используемыми для пищеварения тканей. В то время как трипсин зависит от температуры, коллагеназа менее чувствительна к изменениям температуры.
Источники клеток [ править ]

Первичные клетки – это те, которые непосредственно выделены из ткани хозяина. Эти клетки представляют собой модель клеточного поведения ex-vivo без каких-либо генетических, эпигенетических изменений или изменений в развитии; что делает их более точной репликацией условий in vivo, чем клетки, полученные другими методами. [25] Однако это ограничение также может затруднить их изучение. Это зрелые клетки, часто терминально дифференцированные, а это означает, что для многих типов клеток пролиферация затруднена или невозможна. Кроме того, микроокружение, в котором существуют эти клетки, узкоспециализировано, что часто затрудняет репликацию этих условий. [26]
Вторичные клетки Часть клеток из первичной культуры перемещают в новый репозиторий/сосуд для продолжения культивирования. Среду из первичной культуры удаляют, клетки, которые желательно перенести, получают и затем культивируют в новом сосуде со свежей питательной средой. [ нужна ссылка ] Вторичная культура клеток полезна для того, чтобы гарантировать, что у клеток есть и пространство, и питательные вещества, необходимые им для роста. Вторичные культуры чаще всего используются в любом сценарии, в котором желательно большее количество клеток, чем можно найти в первичной культуре. Вторичные клетки имеют те же ограничения, что и первичные клетки (см. выше), но имеют дополнительный риск заражения при переносе в новый сосуд.
Генетические классификации клеток [ править ]
Аутологичные: донор и реципиент клеток — один и тот же человек. Клетки собирают, культивируют или хранят, а затем повторно вводят хозяину. В результате повторного введения собственных клеток хозяина антигенный ответ не возникает. Иммунная система организма распознает эти повторно имплантированные клетки как свои собственные и не подвергает их атаке. Зависимость аутологичных клеток от здоровья клеток-хозяев и заболеваемости донорского участка может быть сдерживающим фактором для их использования. Мезенхимальные стволовые клетки, полученные из жировой ткани и костного мозга, обычно являются аутологичными по своей природе и могут использоваться множеством способов: от помощи в восстановлении скелетной ткани до пополнения бета-клеток у пациентов с диабетом. [27] [28] [29] [30]
Аллогенные: клетки получают из тела донора того же вида, что и реципиент. Несмотря на то, что существуют некоторые этические ограничения на использование человеческих клеток для исследований in vitro (т.е. разработка химер тканей головного мозга человека [31] ), использование дермальных фибробластов крайней плоти человека демонстрирует иммунологически безопасный и, следовательно, жизнеспособный выбор для аллогенной тканевой инженерии кожи.
Ксеногенные: эти клетки представляют собой изолированные клетки альтернативных видов реципиента. Ярким примером использования ксеногенных тканей является создание сердечно-сосудистых имплантатов из клеток животных. Химерное животноводческое хозяйство вызывает этические опасения по поводу возможности улучшения сознания в результате имплантации человеческих органов животным. [32]
Сингенные или изогенные: эти клетки описывают клетки, рожденные с идентичным генетическим кодом. Это дает иммунологическое преимущество, аналогичное эффекту аутологичных клеточных линий (см. выше). [33] Аутологичные клетки можно считать сингенными, но классификация также распространяется на клетки, полученные неаутологично, например клетки идентичного близнеца, генетически идентичные (клонированные) исследовательские модели или индуцированные стволовые клетки (иСК). [34] по отношению к донору.
Стволовые клетки [ править ]
Стволовые клетки — это недифференцированные клетки, способные делиться в культуре и давать начало различным формам специализированных клеток. Стволовые клетки делятся на «взрослые» и «эмбриональные» стволовые клетки в зависимости от их источника. Хотя до сих пор ведутся большие этические дебаты, связанные с использованием эмбриональных стволовых клеток, считается, что другой альтернативный источник – индуцированные плюрипотентные стволовые клетки – может быть полезен для восстановления больных или поврежденных тканей или может использоваться для выращивания новых органов. .
Тотипотентные клетки — это стволовые клетки, которые могут делиться на дальнейшие стволовые клетки или дифференцироваться в клетки любого типа в организме, включая внеэмбриональные ткани.
Плюрипотентные клетки — это стволовые клетки, которые могут дифференцироваться в любой тип клеток организма, за исключением внеэмбриональных тканей. индуцированные плюрипотентные стволовые клетки (иПСК) представляют собой подкласс плюрипотентных стволовых клеток, напоминающих эмбриональные стволовые клетки (ЭСК), которые были получены из взрослых дифференцированных клеток. ИПСК создаются путем изменения экспрессии транскрипционных факторов во взрослых клетках до тех пор, пока они не станут похожими на эмбриональные стволовые клетки. [ нужна ссылка ]
Мультипотентные стволовые клетки можно дифференцировать в любые клетки того же класса, например, в клетки крови или кости . Типичным примером мультипотентных клеток являются мезенхимальные стволовые клетки (МСК).
Строительные леса [ править ]
Каркасы — это материалы, которые были разработаны для обеспечения желаемых клеточных взаимодействий, способствующих формированию новых функциональных тканей для медицинских целей. В эти структуры часто «засеивают» клетки, способные поддерживать формирование трехмерной ткани. Каркасы имитируют внеклеточный матрикс нативной ткани, повторяя среду in vivo и позволяя клеткам влиять на свое собственное микроокружение. Обычно они служат как минимум одной из следующих целей: обеспечение прикрепления и миграции клеток, доставка и удержание клеток и биохимических факторов, обеспечение диффузии жизненно важных питательных веществ клеток и экспрессируемых продуктов, а также оказание определенных механических и биологических воздействий для изменения поведения клеточной фазы. .
В 2009 году междисциплинарная группа под руководством торакального хирурга Торстена Уоллеса имплантировала первый биоискусственный трансплантат, который обеспечивает врожденную сосудистую сеть для посттрансплантационного питания пациента, ожидающего реконструкции трахеи. [35]

Для достижения цели реконструкции тканей каркасы должны отвечать некоторым специфическим требованиям. Высокая пористость и адекватный размер пор необходимы для облегчения засева клеток и диффузии по всей структуре как клеток, так и питательных веществ. Биоразлагаемость часто является важным фактором, поскольку предпочтительно, чтобы каркасы поглощались окружающими тканями без необходимости хирургического удаления. Скорость, с которой происходит деградация, должна максимально совпадать со скоростью образования тканей: это означает, что, пока клетки создают вокруг себя свою собственную естественную матричную структуру, каркас способен обеспечить структурную целостность внутри тела, и в конечном итоге это произойдет. разрушаются, оставляя новообразованную ткань, которая принимает на себя механическую нагрузку. Инъекционная способность также важна для клинического применения.Недавние исследования в области печати органов показывают, насколько важен хороший контроль 3D-среды для обеспечения воспроизводимости экспериментов и получения лучших результатов.
Материалы [ править ]
Выбор материала является важным аспектом изготовления строительных лесов. Используемые материалы могут быть натуральными или синтетическими, биоразлагаемыми или небиоразлагаемыми. Кроме того, они должны быть биосовместимы, то есть не оказывать вредного воздействия на клетки. [37] Силикон, например, представляет собой синтетический, не биоразлагаемый материал, обычно используемый в качестве материала для доставки лекарств. [38] [39] в то время как желатин является биоразлагаемым природным материалом, обычно используемым в каркасах клеточных культур. [40] [41] [42]
Материал, необходимый для каждого применения, различен и зависит от желаемых механических свойств материала. Например, для тканевой инженерии дефектов длинных костей потребуется жесткий каркас с прочностью на сжатие, аналогичной прочности кортикальной кости (100-150 МПа), что намного выше по сравнению с каркасом для регенерации кожи. [43] [44]
Существует несколько универсальных синтетических материалов, используемых для самых разных применений строительных лесов. Одним из таких широко используемых материалов является полимолочная кислота (PLA), синтетический полимер. PLA – полимолочная кислота. Это полиэстер, который разлагается в организме человека с образованием молочной кислоты — природного химического вещества, которое легко выводится из организма. Аналогичными материалами являются полигликолевая кислота (ПГК) и поликапролактон (ПКЛ): механизм их разложения аналогичен механизму разложения PLA, но PCL разлагается медленнее, а PGA разлагается быстрее. [ нужна ссылка ] PLA обычно комбинируют с PGA для создания полимолочной гликолевой кислоты (PLGA). Это особенно полезно, поскольку деградацию PLGA можно регулировать путем изменения весового процентного содержания PLA и PGA: больше PLA – более медленная деградация, больше PGA – более быстрая деградация. Эта возможность настройки, наряду с биосовместимостью, делает его чрезвычайно полезным материалом для создания каркасов. [45]
различные производные внеклеточного матрикса Каркасы также могут быть построены из природных материалов: в частности, были изучены , чтобы оценить их способность поддерживать рост клеток. Материалы на основе белка, такие как коллаген или фибрин , и полисахаридные материалы, такие как хитозан. [46] или гликозаминогликаны (ГАГ), все оказались подходящими с точки зрения клеточной совместимости. Среди ГАГ гиалуроновая кислота , возможно, в сочетании со сшивающими агентами (например, глутаральдегидом , водорастворимым карбодиимидом и т. д.), является одним из возможных вариантов выбора в качестве материала каркаса. Благодаря ковалентному присоединению тиоловых групп к этим полимерам они могут сшиваться посредством образования дисульфидных связей. [47] Использование тиолированных полимеров ( тиомеров ) в качестве каркасного материала для тканевой инженерии было впервые представлено на 4-м Центральноевропейском симпозиуме по фармацевтическим технологиям в Вене в 2001 году. [48] Поскольку тиомеры биосовместимы, обладают свойствами имитирования клеток и эффективно поддерживают пролиферацию и дифференцировку различных типов клеток, они широко используются в качестве каркасов для тканевой инженерии. [49] [50] [51] Кроме того, тиомеры, такие как тиолированная гиалуроновая кислота [52] и тиолированный хитозан [53] Было показано, что они обладают ранозаживляющими свойствами и являются предметом многочисленных клинических испытаний . [54] Кроме того, фрагмент белка внеклеточного матрикса, такой как пептид RGD , может быть связан с небиоактивным материалом для содействия прикреплению клеток. [55] Другой формой каркаса является децеллюляризованная ткань. Это процесс, при котором химические вещества используются для извлечения клеток из тканей, оставляя только внеклеточный матрикс. Преимущество этого заключается в том, что полностью сформированная матрица специфична для желаемого типа ткани. Однако децеллюризованный каркас может вызвать иммунные проблемы с будущими введенными клетками.
Синтез [ править ]


В литературе описан ряд различных методов приготовления пористых структур для использования в качестве каркасов для тканевой инженерии. Каждый из этих методов имеет свои преимущества, но ни один из них не лишен недостатков.
Самостоятельная сборка нановолокна [ править ]
Молекулярная самосборка — один из немногих методов создания биоматериалов со свойствами, аналогичными по масштабу и химическому составу природному внеклеточному матриксу (ECM) in vivo , что является решающим шагом на пути к тканевой инженерии сложных тканей. [56] Более того, эти гидрогелевые каркасы продемонстрировали превосходство в токсикологии и биосовместимости in vivo по сравнению с традиционными макрокаркасами и материалами животного происхождения.
Текстильные технологии [ править ]
Эти методы включают в себя все подходы, которые успешно применяются для изготовления нетканых сеток из различных полимеров . В частности, нетканые полигликолидные структуры были протестированы для применения в тканевой инженерии: было обнаружено, что такие волокнистые структуры полезны для выращивания различных типов клеток. Основные недостатки связаны с трудностями получения высокой пористости и регулярного размера пор.
и Заливка растворителем выщелачивание частиц
Литье растворителем и дисперсное выщелачивание (SCPL) позволяет получать структуры с регулярной пористостью, но ограниченной толщиной. Сначала полимер растворяют в подходящем органическом растворителе (например, полимолочную кислоту можно растворить в дихлорметане ), затем раствор заливают в форму, заполненную частицами порогена. Таким порогеном может быть неорганическая соль, такая как хлорид натрия , кристаллы сахарозы , желатиновые сферы или парафиновые сферы. Размер частиц порообразователя будет влиять на размер пор каркаса, в то время как соотношение полимера и порообразователя напрямую коррелирует с величиной пористости конечной структуры. После отливки полимерного раствора растворителю дают полностью испариться, затем композитную структуру в форме погружают в ванну с жидкостью, подходящей для растворения порообразователя: водой в случае хлорида натрия, сахарозой и желатином или алифатическим раствором. растворитель, например гексан, для использования с парафином. После полного растворения порообразователя образуется пористая структура. Помимо небольшого диапазона толщины, который можно получить, еще один недостаток SCPL заключается в использовании органических растворителей, которые необходимо полностью удалить, чтобы избежать любого возможного повреждения клеток, высеянных на каркас.
Газовое вспенивание [ править ]
Чтобы преодолеть необходимость использования органических растворителей и твердых порообразователей, была разработана методика использования газа в качестве порообразователя. Сначала методом компрессионного формования с использованием нагретой формы приготавливают дискообразные конструкции из желаемого полимера. Затем диски помещают в камеру, где они подвергаются воздействию CO 2 под высоким давлением в течение нескольких дней. Давление внутри камеры постепенно восстанавливается до атмосферного уровня. Во время этой процедуры поры образуются молекулами углекислого газа, которые покидают полимер, в результате чего образуется губчатая структура. Основные проблемы, возникающие в результате такого метода, вызваны чрезмерным нагревом, используемым во время прессования (что препятствует включению любого термолабильного материала в полимерную матрицу), а также тем фактом, что поры не образуют взаимосвязанной структуры.
Эмульгирование, сублимационная сушка [ править ]
Этот метод не требует использования твердого порообразователя, такого как SCPL. Сначала синтетический полимер растворяют в подходящем растворителе (например, полимолочной кислоте в дихлорметане), затем к раствору полимера добавляют воду и две жидкости смешивают для получения эмульсии . Прежде чем две фазы смогут разделиться, эмульсию заливают в форму и быстро замораживают путем погружения в жидкий азот . Замороженную эмульсию затем подвергают лиофилизации для удаления диспергированной воды и растворителя, в результате чего остается затвердевшая пористая полимерная структура. Хотя эмульгирование и сублимационная сушка позволяют ускорить приготовление по сравнению с SCPL (поскольку он не требует трудоемкого этапа выщелачивания), он все же требует использования растворителей. Кроме того, размер пор относительно мал, а пористость часто неравномерна. Сублимационная сушка сама по себе также является широко используемым методом изготовления каркасов. В частности, его используют для приготовления коллагеновых губок: коллаген растворяют в кислых растворах уксусная или соляная кислота , отлитые в форму, замороженные жидким азотом и затем лиофилизированные .
Термически индуцированное разделение фаз [ править ]
Как и предыдущий метод, процедура разделения фаз TIPS требует использования растворителя с низкой температурой плавления, который легко сублимировать. Например, для растворения полимолочной кислоты можно использовать диоксан , затем путем добавления небольшого количества воды вызывают разделение фаз: образуются фаза, богатая полимером, и фаза, бедная полимером. После охлаждения ниже температуры плавления растворителя и нескольких дней сушки в вакууме для сублимации растворителя получается пористый каркас. Разделение фаз жидкость-жидкость имеет те же недостатки, что и эмульгирование/сушка вымораживанием. [57]
Электроспиннинг [ править ]
Электропрядение — это очень универсальный метод, который можно использовать для производства непрерывных волокон диаметром от нескольких микрон до нескольких нанометров. В типичной установке электропрядения желаемый материал каркаса растворяется в растворителе и помещается в шприц. Этот раствор подается через иглу, и к кончику и проводящей собирающей поверхности подается высокое напряжение. Накопление электростатических сил внутри раствора заставляет его выбрасывать тонкий волокнистый поток к противоположно заряженной или заземленной собирающей поверхности. Во время этого процесса растворитель испаряется, оставляя твердые волокна и высокопористую сетку. Этот метод легко настраивается в зависимости от растворителя, напряжения, рабочего расстояния (расстояния от иглы до поверхности сбора), скорости потока раствора, концентрации растворенного вещества и поверхности сбора. Это позволяет точно контролировать морфологию волокон.
Однако на коммерческом уровне из соображений масштабируемости одновременно работают 40, а иногда и 96 игл. Узкими местами в таких установках являются: 1) поддержание вышеупомянутых переменных одинаково для всех игл и 2) формирование «бусинок» в отдельных волокнах, которые мы, как инженеры, хотим иметь одинаковый диаметр. Изменяя такие переменные, как расстояние до коллектора, величину приложенного напряжения или скорость потока раствора, исследователи могут кардинально изменить общую архитектуру каркаса.
Исторически исследования электропряденых волокнистых каркасов начались, по крайней мере, с конца 1980-х годов, когда Саймон показал, что электропрядение можно использовать для производства волокнистых каркасов нано- и субмикронного размера из полимерных растворов, специально предназначенных для использования в качестве клеточных и тканевых субстратов in vitro . Это раннее использование электроформованных решеток для клеточной культуры и тканевой инженерии показало, что различные типы клеток будут прикрепляться к поликарбонатным волокнам и размножаться на них. Было отмечено, что в отличие от уплощенной морфологии, обычно наблюдаемой в 2D-культуре, клетки, выращенные на волокнах электропрядения, демонстрировали более округлую трехмерную морфологию, обычно наблюдаемую в тканях in vivo . [58]
Технологии CAD/CAM [ править ]
Поскольку большинство из вышеперечисленных методов ограничены, когда дело доходит до контроля пористости и размера пор, компьютерные технологии проектирования и производства в тканевую инженерию были внедрены . Сначала с помощью программного обеспечения САПР проектируется трехмерная структура. Пористость можно настроить с помощью алгоритмов программного обеспечения. [59] Затем каркас создается с помощью струйной печати полимерных порошков или моделирования расплавленным осаждением расплава полимера. [60]
Исследование Эль-Аюби и соавт., проведенное в 2011 году. исследовал «метод 3D-графики для производства ( биосовместимых и биоразлагаемых ) макропористых каркасов из поли-L-лактида с двумя разными размерами пор» посредством изготовления твердых тел произвольной формы (SSF) с помощью компьютерного проектирования (CAD) для изучения терапевтического суставного хряща . замена как «альтернатива обычному восстановлению тканей». [61] Исследование показало, что чем меньше размер пор в сочетании с механическим стрессом в биореакторе (для создания условий, подобных in vivo), тем выше жизнеспособность клеток с потенциальной терапевтической функциональностью за счет уменьшения времени восстановления и повышения эффективности трансплантации. [61]
Лазерная биопечать
В исследовании 2012 года [62] Кох и др. основное внимание уделялось тому, можно ли использовать лазерную биопечать (LaBP) для создания многоклеточных трехмерных узоров в естественном матриксе и функционируют ли сгенерированные конструкции и формируют ли ткани. LaBP упорядочивает небольшие объемы суспензий живых клеток по заданным шаблонам высокого разрешения. [62] Исследование оказалось успешным, исследователи предвидят, что «созданные тканевые конструкции можно будет использовать для испытаний in vivo путем имплантации их в модели животных » (14). На момент этого исследования была синтезирована только ткань человеческой кожи, хотя исследователи прогнозируют, что «путем интеграции дополнительных типов клеток (например, меланоцитов , шванновских клеток , клеток волосяных фолликулов) в напечатанную клеточную конструкцию поведение этих клеток в 3D in vitro микросреду можно проанализировать , аналогичную их естественной», что полезно для открытия лекарств и токсикологических исследований. [62]
Самособирающиеся рекомбинантные наномембраны из шелка паучьего
Густафссон и др. [63] продемонстрировали отдельно стоящие биоактивные мембраны размером в см, но толщиной всего 250 нм, которые образовались в результате самосборки паутины на границе раздела водного раствора. Мембраны уникальным образом сочетают в себе нанотолщину, биоразлагаемость, сверхвысокую деформацию и прочность, проницаемость для белков и способствуют быстрому прикреплению и пролиферации клеток. Они продемонстрировали рост связного слоя кератиноцитов. Эти наномембраны из паучьего шелка также использовались для создания статической in vitro . модели кровеносного сосуда [64]
Тканевая инженерия in situ [ править ]
Регенерация тканей in situ определяется как имплантация биоматериалов (отдельно или в сочетании с клетками и/или биомолекулами) в дефект ткани с использованием окружающего микроокружения организма в качестве естественного биореактора. [65] Этот подход нашел применение в регенерации костной ткани, [66] позволяя формировать клеточно-засеянные конструкции непосредственно в операционной. [67]
Методы сборки [ править ]
Постоянной проблемой тканевой инженерии являются ограничения транспорта массы. Сконструированным тканям обычно не хватает первоначального кровоснабжения, что затрудняет получение имплантированных клеток достаточного количества кислорода и питательных веществ для выживания или правильного функционирования.
Самостоятельная сборка [ править ]
Было показано, что методы самосборки являются перспективными методами тканевой инженерии. Преимущество методов самосборки заключается в том, что они позволяют тканям развивать собственный внеклеточный матрикс, в результате чего получается ткань, которая лучше воспроизводит биохимические и биомеханические свойства нативной ткани. Самособирающийся инженерный суставной хрящ был представлен Джерри Ху и Кириакосом А. Афанасиу в 2006 году. [68] и применение этого процесса привело к созданию инженерного хряща, приближающегося по прочности к нативной ткани. [69] Самосборка — это основная технология, позволяющая собрать клетки, выращенные в лаборатории, в трехмерные формы. Чтобы расщепить ткани на клетки, исследователям сначала необходимо растворить внеклеточный матрикс, который обычно связывает их вместе. После того, как клетки изолированы, они должны сформировать сложные структуры, из которых состоят наши естественные ткани.
Сборка шаблонов на жидкой основе [ править ]
Поверхность воздуха и жидкости, созданная волнами Фарадея, исследуется в качестве шаблона для сборки биологических объектов для тканевой инженерии «снизу вверх». Этот шаблон на жидкой основе можно динамически реконфигурировать за несколько секунд, а сборку на шаблоне можно выполнять масштабируемым и параллельным образом. Была продемонстрирована хорошая жизнеспособность клеток при сборке микромасштабных гидрогелей, клеток, засеянных нейронами шариков-микроносителей, клеточных сфероидов в различные симметричные и периодические структуры. Формирование трехмерной нейронной сети было достигнуто после 14-дневной культуры ткани. [70]
Аддитивное производство [ править ]
Возможно, удастся напечатать органы или, возможно, целые организмы, используя аддитивного производства методы . Последний инновационный метод строительства использует струйный механизм для печати точных слоев клеток в матрице термообратимого геля. Эндотелиальные клетки, клетки, выстилающие кровеносные сосуды, были напечатаны в виде набора сложенных друг на друга колец. При инкубации они сливаются в трубку. [60] [71] В этой области этот метод называют «биопечатью», поскольку он включает в себя печать биологических компонентов в структуре, напоминающей орган фокусировки.
В области трехмерных и высокоточных моделей биологических систем впервые появилось множество проектов и технологий, включая быстрый метод создания тканей и даже целых органов с использованием 3D-принтера, который может биопечать каркаса и клеток слой за слоем в образец рабочей ткани или органа. Устройство представлено в докладе TED доктором Энтони Атала, доктором медицинских наук, директором Уэйк Форест Института регенеративной медицины , профессором У. Бойса и заведующим кафедрой урологии Университета Уэйк Форест, на котором напечатана почка. сцене во время семинара, а затем представлен публике. [72] [73] [74] Ожидается, что эта технология позволит в будущем производить печень для трансплантации, а теоретически для токсикологических также и других биологических исследований.
В 2015 году многофотонная обработка (MPP) была использована для экспериментов in vivo по созданию искусственных хрящевых конструкций. Гистологическое исследование ex vivo показало, что определенная геометрия пор и предварительное выращивание хондроцитов (Cho) перед имплантацией значительно улучшают характеристики созданных трехмерных каркасов. Достигнутая биосовместимость была сопоставима с коммерчески доступными коллагеновыми мембранами. Успешный результат этого исследования подтверждает идею о том, что гибридные органически-неорганические микроструктурированные каркасы с гексагональными порами в сочетании с засевом Cho могут быть успешно реализованы для инженерии хрящевой ткани. [75]
В последнее время тканевая инженерия продвинулась вперед, сосредоточив внимание на васкуляризации. С помощью аддитивного производства на основе двухфотонной полимеризации создаются синтетические трехмерные сети микрососудов из трубчатых гидрогелевых структур. Эти сети могут перфузировать ткани размером в несколько кубических миллиметров, обеспечивая долгосрочную жизнеспособность и рост клеток in vitro. Это нововведение знаменует собой значительный шаг вперед в тканевой инженерии, облегчая разработку сложных моделей тканей человека. [76]
Строительные леса [ править ]
В 2013 году с использованием трехмерного каркаса Matrigel в различных конфигурациях существенные органоиды in vitro были получены поджелудочной железы. Кластеры небольшого количества клеток размножались до 40 000 клеток в течение одной недели. Кластеры трансформируются в клетки, которые вырабатывают либо пищеварительные ферменты , либо гормоны, такие как инсулин , и самоорганизуются в разветвленные органоиды поджелудочной железы, напоминающие поджелудочную железу. [77]
Клетки чувствительны к окружающей среде, например к жесткости геля и контакту с другими клетками. Отдельные клетки не процветают; для последующего развития органоидов требовалось минимум четыре близлежащих клетки. Модификации состава среды привели к образованию либо полых сфер, состоящих в основном из предшественников поджелудочной железы, либо сложных органоидов, которые спонтанно подвергаются морфогенезу и дифференцировке поджелудочной железы. Поддержание и расширение панкреатических предшественников требуют активной передачи сигналов Notch и FGF , повторяя in vivo сигнальные взаимодействия ниш. [77]
Органоиды рассматривались как потенциальные мини-органы для тестирования лекарств и резервных клеток, продуцирующих инсулин. [77]
Помимо каркасов Matrigel 3-D, были разработаны и другие системы коллагеновых гелей. Каркасы из коллагена и гиалуроновой кислоты использовались для моделирования молочной железы in vitro при совместном культивировании эпителиальных и адипоцитных клеток. Набор HyStem — это еще одна трехмерная платформа, содержащая компоненты ЕСМ и гиалуроновую кислоту, которая использовалась для исследований рака. Кроме того, компоненты гидрогеля могут быть химически модифицированы, чтобы способствовать сшиванию и улучшению их механических свойств.
Культура ткани [ править ]
Во многих случаях создание функциональных тканей и биологических структур in vitro требует обширного культивирования для обеспечения выживания, роста и стимулирования функциональности. В целом, в культуре должны поддерживаться основные потребности клеток, которые включают кислород , pH , влажность , температуру , питательные вещества и осмотического давления поддержание .
Тканеинженерные культуры также создают дополнительные проблемы при поддержании условий культивирования. В стандартной культуре клеток диффузия часто является единственным средством транспорта питательных веществ и метаболитов. Однако по мере того, как культура становится больше и сложнее, как в случае с искусственными органами и целыми тканями, для поддержания культуры необходимо использовать другие механизмы, такие как создание капиллярных сетей внутри ткани.

Другая проблема с тканевой культурой — введение правильных факторов или стимулов, необходимых для стимуляции функциональности. Во многих случаях простой культуры обслуживания недостаточно. факторы роста , гормоны Иногда требуются , специфические метаболиты или питательные вещества, химические и физические стимулы. Например, некоторые клетки реагируют на изменения напряжения кислорода в рамках своего нормального развития, например хондроциты , которые должны адаптироваться к условиям низкого содержания кислорода или гипоксии во время развития скелета. Другие, такие как эндотелиальные клетки, реагируют на напряжение сдвига от потока жидкости, которое возникает в кровеносных сосудах . Механические стимулы, такие как импульсы давления, по-видимому, полезны для всех видов сердечно-сосудистых тканей, таких как сердечные клапаны, кровеносные сосуды или перикард.
Биореакторы [ править ]
В тканевой инженерии биореактор — это устройство, которое пытается имитировать физиологическую среду, чтобы стимулировать рост клеток или тканей in vitro. Физиологическая среда может состоять из множества различных параметров, таких как температура, давление, концентрация кислорода или углекислого газа или осмоляльность жидкой среды, и может распространяться на все виды биологических, химических или механических стимулов. Поэтому существуют системы, которые могут включать в себя приложение к ткани таких сил, как электромагнитные силы, механическое давление или давление жидкости. Эти системы могут быть двух- или трехмерными. Биореакторы могут использоваться как в академических, так и в промышленных целях. Также коммерчески доступны биореакторы общего и специального назначения, которые могут обеспечивать статическую химическую стимуляцию или комбинацию химической и механической стимуляции.
клеток На пролиферацию и дифференцировку в значительной степени влияют механические факторы. [78] и биохимический [79] сигналы в окружающей среде внеклеточного матрикса . Биореакторы обычно разрабатываются для имитации конкретной физиологической среды выращиваемой ткани (например, изгиб и сдвиг жидкости для роста ткани сердца). [80] Это может позволить специализированным клеточным линиям процветать в культурах, копирующих их нативную среду, но также делает биореакторы привлекательными инструментами для культивирования стволовых клеток . Успешный биореактор на основе стволовых клеток эффективен для размножения стволовых клеток с однородными свойствами и/или содействия контролируемой, воспроизводимой дифференцировке в выбранные типы зрелых клеток. [81]
Существует множество биореакторов, предназначенных для 3D-культур клеток. Существуют небольшие пластиковые цилиндрические камеры, а также стеклянные камеры с регулируемой внутренней влажностью и влажностью, специально разработанные для выращивания клеток в трех измерениях. [82] В биореакторе используются биоактивные синтетические материалы, такие как мембраны из полиэтилентерефталата, для окружения сфероидных клеток в среде, поддерживающей высокий уровень питательных веществ. [83] [84] Их легко открывать и закрывать, поэтому сфероиды клеток можно вынимать для тестирования, при этом в камере сохраняется 100% влажность. [85] Эта влажность важна для достижения максимального роста и функционирования клеток. Камера биореактора является частью более крупного устройства, которое вращается, чтобы обеспечить одинаковый рост клеток в каждом направлении в трех измерениях. [85]
Компания QuinXell Technologies, в настоящее время принадлежащая компании Quintech Life Sciences из Сингапура, разработала биореактор, известный как двухосный биореактор TisXell , который специально разработан для целей тканевой инженерии. Это первый биореактор в мире, имеющий сферическую стеклянную камеру с двухосным вращением; специально для имитации вращения плода в утробе матери; что обеспечивает благоприятную среду для роста тканей. [86]
Несколько форм механической стимуляции также были объединены в одном биореакторе. Используя анализ экспрессии генов, одно академическое исследование показало, что применение комбинации циклического напряжения и ультразвуковой стимуляции к клеткам преостеобластов в биореакторе ускоряет созревание и дифференцировку матрикса. [87] Технология этого биореактора комбинированной стимуляции может быть использована для более быстрого и эффективного выращивания костных клеток в будущих клинических методах лечения стволовыми клетками. [88]
MC2 Biotek также разработала биореактор, известный как ProtoTissue. [82] который использует газообмен для поддержания высокого уровня кислорода в клеточной камере; Улучшение по сравнению с предыдущими биореакторами, поскольку более высокий уровень кислорода помогает клеткам расти и нормально дышать . [89]
Активные области исследований биореакторов включают увеличение масштабов производства и улучшение физиологической среды, и то, и другое может повысить эффективность и действенность биореакторов в исследованиях или клиническом использовании. Биореакторы в настоящее время используются, среди прочего, для изучения терапии на клеточном и тканевом уровне, реакции клеток и тканей на конкретные изменения физиологической среды, а также развития заболеваний и травм.
волокон Генерация длинных
В 2013 году группа из Токийского университета порядка 100 мкм . разработала наполненные клетками волокна длиной до метра и размером [90] Эти волокна были созданы с помощью микрофлюидного устройства , формирующего двойной коаксиальный ламинарный поток. Каждый «слой» микрофлюидного устройства (клетки, посеянные в ЕСМ , гидрогелевую оболочку и, наконец, раствор хлорида кальция). Высеянные клетки культивируют внутри гидрогелевой оболочки в течение нескольких дней, а затем оболочку удаляют вместе с жизнеспособными клеточными волокнами. В ядро ЕСМ были вставлены различные типы клеток, включая миоциты , эндотелиальные клетки , волокна нервных клеток и эпителиальных клеток волокна . Затем эта группа показала, что эти волокна можно сплетать вместе для изготовления тканей или органов по механизму, аналогичному текстильному ткачеству . Преимущество фиброзной морфологии состоит в том, что она представляет собой альтернативу традиционной конструкции каркаса, а многие органы (например, мышцы) состоят из фиброзных клеток.
Биоискусственные органы [ править ]
Искусственный орган — это инженерное устройство, которое может быть экстракорпоральным или имплантироваться для поддержки поврежденных или вышедших из строя систем органов. [91] Биоискусственные органы обычно создаются с целью восстановить критические биологические функции, например, при замене больных сердца и легких, или обеспечить радикальное улучшение качества жизни, например, при использовании искусственной кожи у жертв ожогов. [91] Хотя некоторые примеры биоискусственных органов все еще находятся на стадии разработки из-за ограничений, связанных с созданием функциональных органов, другие в настоящее время используются в клинических условиях экспериментально и коммерчески. [92]
Легкое [ править ]
Аппараты экстракорпоральной мембранной оксигенации (ЭКМО), также известные как аппараты сердца и легких, представляют собой адаптацию методов искусственного кровообращения , обеспечивающих поддержку сердца и легких. [93] Он используется в первую очередь для поддержки легких в течение длительного, но все же временного периода времени (1–30 дней) и обеспечения выздоровления от обратимых заболеваний. [93] Роберт Бартлетт известен как отец ЭКМО и провел первое лечение новорожденного с помощью аппарата ЭКМО в 1975 году. [94]
Кожа
Тканеинженерная кожа — это тип биоискусственного органа, который часто используется для лечения ожогов, язв диабетической стопы или других крупных ран, которые не могут хорошо зажить сами по себе. Искусственную кожу можно изготовить из аутотрансплантатов, аллотрансплантатов и ксенотрансплантатов. Аутотрансплантированная кожа получается из собственной кожи пациента, что позволяет дерме быстрее заживлять, а донорский участок можно повторно собирать несколько раз. Аллотрансплантат кожи часто получается из трупной кожи и в основном используется для лечения жертв ожогов. Наконец, ксенотрансплантированная кожа происходит от животных и обеспечивает временную структуру заживления кожи. Они способствуют регенерации кожи, но не могут стать частью кожи хозяина. [23] Тканеинженерная кожа теперь доступна в коммерческих продуктах. Интегра, первоначально использовавшаяся только для лечения ожогов, состоит из коллагеновой матрицы и хондроитинсульфата, которые можно использовать в качестве заменителя кожи. Хондроитинсульфат действует как компонент протеогликанов, который помогает формировать внеклеточный матрикс. [95] Интегру можно заселять и реваскуляризировать, сохраняя при этом структуру дермального коллагена, что делает ее биоискусственным органом. [96] Дермаграфт, еще один коммерческий продукт тканеинженерной разработки кожи, сделан из живых фибробластов. Эти фибробласты размножаются и производят факторы роста, коллаген и белки внеклеточного матрикса, которые помогают строить грануляционную ткань. [97]
Сердце [ править ]
Поскольку число пациентов, ожидающих трансплантации сердца, постоянно увеличивается с течением времени, а число пациентов в списке ожидания превышает доступность органов, [98] искусственные органы, используемые в качестве заместительной терапии при терминальной сердечной недостаточности, помогут облегчить эту трудность. Искусственные сердца обычно используются в качестве альтернативы трансплантации сердца или могут применяться в качестве заместительной терапии при неизлечимой сердечной недостаточности. [99] Тотальное искусственное сердце (ТАС), впервые предложенное доктором Владимиром Петровичем Демиховым в 1937 году, [100] оказался идеальной альтернативой. С тех пор он был разработан и усовершенствован как механический насос, который обеспечивает долговременную поддержку кровообращения и заменяет больные или поврежденные желудочки сердца, которые не могут должным образом перекачивать кровь, восстанавливая, таким образом, легочный и системный кровоток. [101] Некоторые из нынешних TAH включают AbioCor, устройство, одобренное FDA, которое состоит из двух искусственных желудочков и их клапанов, не требует подкожных соединений и показано пациентам с бивентрикулярной сердечной недостаточностью. В 2010 году SynCardia выпустила портативный драйвер Freedom, который позволяет пациентам иметь портативное устройство, не ограничиваясь больницей. [102]
Почка [ править ]
Хотя трансплантация почки возможна, почечную недостаточность чаще лечат с помощью искусственной почки. [103] Первые искусственные почки и большинство из тех, что используются в настоящее время, являются экстракорпоральными, например, при гемодиализе, при котором кровь фильтруется напрямую, или при перитонеальном диализе, при котором фильтрация осуществляется через жидкость в брюшной полости. [103] [104] Чтобы способствовать биологическим функциям почек, таким как выработка метаболических факторов или гормонов, некоторые искусственные почки включают в себя почечные клетки. [103] [104] Достигнут прогресс в том, чтобы сделать эти устройства меньшими по размеру и более мобильными или даже имплантируемыми . Одной из проблем, с которой еще предстоит столкнуться в этих небольших устройствах, является борьба с ограниченным объемом и, следовательно, с ограниченными возможностями фильтрации. [103]
Также были созданы биокаркасы, обеспечивающие основу для регенерации нормальной ткани почек. Эти каркасы включают естественные каркасы (например, децеллюляризированные почки, [105] коллагеновый гидрогель, [106] [107] или фиброин шелка [108] ), синтетические каркасы (например, полимолочная гликолевая кислота] [109] [110] или другие полимеры), или комбинацию двух или более натуральных и синтетических каркасов. Эти каркасы можно имплантировать в организм либо без обработки клеток, либо после периода посева и инкубации стволовых клеток. Исследования in vitro и In vivo проводятся для сравнения и оптимизации типа каркаса, а также для оценки того, повышает ли засев клеток перед имплантацией жизнеспособность, регенерацию и эффективное функционирование почек. Недавний систематический обзор и метаанализ сравнили результаты опубликованных исследований на животных и выявили, что улучшение результатов наблюдается при использовании гибридных (смешанных) каркасов и посева клеток; [111] однако метаанализ этих результатов не соответствовал оценке описательных результатов обзора. Поэтому целесообразны дальнейшие исследования с участием более крупных животных и новых каркасов, а также более прозрачное воспроизведение предыдущих исследований.
Биомиметика [ править ]
этого раздела Тон или стиль могут не отражать энциклопедический тон , используемый в Википедии . ( декабрь 2019 г. ) |
Биомиметика — это область, целью которой является производство материалов и систем, повторяющих те, что присутствуют в природе. [112] В контексте тканевой инженерии это распространенный подход, используемый инженерами для создания материалов для этих приложений, которые сравнимы с нативными тканями с точки зрения их структуры, свойств и биосовместимости. Свойства материала во многом зависят от физических, структурных и химических характеристик этого материала. Впоследствии биомиметический подход к проектированию систем станет важным в интеграции материалов, и потребуется достаточное понимание биологических процессов и взаимодействий. Репликация биологических систем и процессов также может использоваться при синтезе биоматериалов для достижения условий, обеспечивающих производство желаемого биологического материала. Следовательно, если синтезируется материал, имеющий одинаковые характеристики биологических тканей как структурно, так и химически, то в идеале синтезированный материал будет иметь схожие свойства. Эта техника имеет обширную историю, берущую свое начало в идее использования природных явлений в качестве вдохновения для решения человеческих проблем. Многие современные достижения в области технологий были вдохновлены природой и природными системами, включая самолеты, автомобили, архитектуру и даже промышленные системы. Достижения в области нанотехнологий инициировали применение этого метода в микро- и наномасштабные проблемы, включая тканевую инженерию. Этот метод использовался для разработки синтетических костных тканей, сосудистых технологий, каркасных материалов и методов интеграции, а также функционализированных наночастиц. [112]
Построение нейронных сетей в мягком материале [ править ]
В 2018 году ученые из Университета Брандейса сообщили о своем исследовании мягкого материала, покрытого химическими сетями, которые могут имитировать плавное и скоординированное поведение нервной ткани. Это исследование финансировалось Исследовательской лабораторией армии США . [113] Исследователи представили экспериментальную систему нейронных сетей, теоретически смоделированную как системы реакции-диффузии . Внутри сети находился ряд узорчатых реакторов, каждый из которых осуществлял реакцию Белоусова-Жаботинского (БЗ). Эти реакторы могли бы функционировать в масштабе нанолитров. [114]
Исследователи утверждают, что вдохновением для их проекта послужило передвижение синего ленточного угря . Движениями угря управляют электрические импульсы, определяемые классом нейронных сетей, называемых центральным генератором шаблонов . Центральные генераторы паттернов функционируют в автономной нервной системе, контролируя такие функции организма, как дыхание, движение и перистальтика . [115]
Спроектированными качествами реактора были топология сети, граничные условия , начальные условия, объем реактора, сила связи и синаптическая полярность реактора (независимо от того, является ли его поведение тормозящим или возбуждающим). [115] эмульсионная система БЗ с твердым эластомером полидиметилсилоксаном Разработана (ПДМС). Сообщается, что как свето-, так и бромпроницаемые ПДМС являются жизнеспособными методами создания кардиостимулятора для нейронных сетей. [114]
Рынок [ править ]
Историю рынка тканевой инженерии можно разделить на три основные части. Время до краха биотехнологического рынка в начале 2000-х годов, крах и время после него.
Начало [ править ]
Самый ранний прогресс в исследованиях тканевой инженерии был достигнут в США. Это связано с менее строгими правилами в отношении исследований стволовых клеток и более доступным финансированием, чем в других странах. Это приводит к созданию академических стартапов, многие из которых происходят из Гарварда или Массачусетского технологического института . Примером могут служить BioHybrid Technologies, основатель которой Билл Чик учился в Гарвардской медицинской школе и сосредоточился на создании искусственной поджелудочной железы. Другим примером может служить компания Organogenic Inc., основатель которой учился в Массачусетском технологическом институте и работал над продуктами для инженерии кожи. Другими компаниями, имеющими связи с MIT, являются TEI Biosciences, Therics и Guilford Pharmaceuticals. [8] Возобновление интереса к биотехнологиям в 1980-х годах привело к тому, что многие частные инвесторы инвестировали в эти новые технологии, хотя бизнес-модели этих ранних стартапов часто были не очень ясными и не обеспечивали пути к долгосрочной прибыльности. [116] Правительственные спонсоры были более сдержанными в своем финансировании, поскольку тканевая инженерия считалась инвестицией с высоким риском. [8]
В Великобритании рынок стартовал медленнее, хотя правила в отношении исследований стволовых клеток также не были строгими. В основном это связано с тем, что все больше инвесторов менее готовы вкладывать средства в эти новые технологии, которые считались инвестициями с высоким уровнем риска. [116] Еще одна проблема, с которой столкнулись британские компании, заключалась в том, чтобы заставить Национальную службу здравоохранения платить за их продукцию. Это особенно важно потому, что Национальная служба здравоохранения проводит анализ экономической эффективности всех поддерживаемых продуктов. Новые технологии часто не преуспевают в этом отношении. [116]
В Японии ситуация с регулированием была совершенно иной. Во-первых, культивирование клеток было разрешено только в условиях больницы, а во-вторых, академическим ученым, нанятым в государственных университетах, не разрешалось работать вне работы до 1998 года. Более того, японским властям потребовалось больше времени для одобрения новых лекарств и методов лечения, чем их американским и европейским коллегам. [116]
По этим причинам на заре развития японского рынка основное внимание уделялось получению продуктов, которые уже были одобрены в других местах Японии, и их продаже. В отличие от рынка США, первыми игроками в Японии были в основном крупные фирмы или дочерние компании таких крупных фирм, как J-TEC, Menicon и Terumo, а не маленькие стартапы. [116] После законодательных изменений в 2014 году, которые позволили культивировать клетки за пределами больниц, скорость исследований в Японии возросла, и японские компании также начали разрабатывать свои собственные продукты. [116]
Авария [ править ]
Вскоре после большого бума начали появляться первые проблемы. Были проблемы с одобрением продуктов FDA , и если они были одобрены, часто возникали трудности с тем, чтобы заставить страховых компаний платить за продукты и добиться их принятия поставщиками медицинских услуг. [116] [117]
Например, органогенез столкнулся с проблемами сбыта своей продукции и ее интеграции в систему здравоохранения. Частично это связано с трудностями обращения с живыми клетками и возросшими трудностями, с которыми сталкиваются врачи при использовании этих продуктов по сравнению с традиционными методами. [116]
Другим примером может служить продукт для кожи Advanced Tissue Sciences Dermagraft, который не смог бы создать достаточно высокий спрос без возмещения расходов со стороны страховых компаний. Причинами этого были цена в 4000 долларов и то обстоятельство, что компания Extra Advanced Tissue Sciences изо всех сил пыталась привлечь внимание врачей к своему продукту. [116]
Приведенные выше примеры демонстрируют, как компании боролись за получение прибыли. Это, в свою очередь, приводит к тому, что инвесторы теряют терпение и прекращают дальнейшее финансирование. В результате несколько компаний тканевой инженерии, таких как Organogenices и Advanced Tissue Sciences, в начале 2000-х годов объявили о банкротстве. В то время это были единственные компании, предлагающие на рынке коммерческие продукты для кожи. [117]
Возрождение [ править ]
Технологии обанкротившихся или переживающих трудности компаний часто покупались другими компаниями, которые продолжали развитие в рамках более консервативных бизнес-моделей. [117] Примерами компаний, которые продавали свою продукцию после сворачивания, были Curis. [117] и Интерцитекс. [116]
Многие компании отказались от своих долгосрочных целей по разработке полностью функциональных органов в пользу продуктов и технологий, которые могли бы принести прибыль в краткосрочной перспективе. [116] Примерами таких продуктов являются продукты косметической и испытательной промышленности.
В других случаях, например, в случае с Advanced Tissue Sciences, основатели создавали новые компании. [116]
В 2010-х годах нормативная база также начала способствовать ускорению выхода на рынок, особенно в США, поскольку FDA создало новые центры и пути, специально нацеленные на продукты, полученные из живых клеток, такие как Центр оценки и исследования биологических препаратов . [116]
Первые продукты тканевой инженерии начали приносить коммерческую прибыль в 2010-х годах. [117]
Регламент [ править ]
В настоящее время в Европе регулирование разделено на три области регулирования: медицинское оборудование , лекарственные препараты и биологические препараты . Продукты тканевой инженерии часто имеют гибридную природу, поскольку зачастую состоят из клеток и несущей структуры. Некоторые продукты могут быть одобрены в качестве лекарственных средств, другие должны получить одобрение в качестве медицинских изделий. [118] Дерксен объясняет в своей диссертации, что исследователи тканевой инженерии иногда сталкиваются с регулированием, которое не соответствует характеристикам тканевой инженерии. [119]
В Европе наблюдаются новые режимы регулирования, которые решают эти проблемы. [120] Объяснение трудностям в поиске консенсуса регулирующих органов по этому вопросу дает опрос, проведенный в Великобритании. [118] Авторы связывают эти проблемы с тесным родством и совпадением с другими технологиями, такими как ксенотрансплантация . Поэтому регулирующие органы не могут заниматься этим отдельно. [118] Регулирование еще более осложняется этическими противоречиями, связанными с этой и смежными областями исследований (например, споры о стволовых клетках , этика трансплантации органов ). Тот же опрос, о котором говорилось выше. [118] показывает на примере трансплантации аутологичного хряща, что конкретная технология может рассматриваться как «чистая» или «загрязненная» одним и тем же социальным субъектом.
Два регуляторных движения наиболее актуальны для тканевой инженерии в Европейском Союзе . Это Директива 2004/23/EC о стандартах качества и безопасности при закупке и переработке человеческих тканей. [121] который был принят Европейским парламентом в 2004 году и предложенный регламент в отношении продуктов, модифицированных тканями человека. Последний был разработан под эгидой Генерального директората по предпринимательству Европейской комиссии и представлен в Брюсселе в 2004 году. [122]
См. также [ править ]
- Биомедицинская инженерия
- Биологическая инженерия
- Биомолекулярная инженерия
- Биохимическая инженерия
- Клеточная инженерия
- Химическая инженерия
- Биоматериал ЕСМ
- Биореактор in vivo
- Индуцированные стволовые клетки
- Молекулярный процессор
- Молекулярная самосборка
- Инженерия мышечной ткани
- Национальные институты здравоохранения
- Национальный научный фонд
- Контроль качества в тканевой инженерии
- Регенерация у человека
- Мягкие ткани
- Тиомеры
- Международное общество тканевой инженерии и регенеративной медицины
- Тканевая инженерия клапанов сердца
- Ксенотрансплантация
Примечания [ править ]
- ^ Ким, Ю Сон; Смоук, Молли М.; Мельчиорри, Энтони Дж.; Микос, Антониос Г. (1 января 2019 г.). «Обзор рынка тканевой инженерии в США с 2011 по 2018 год» . Тканевая инженерия. Часть А. 25 (1–2): 1–8. дои : 10.1089/ten.tea.2018.0138 . ISSN 1937-3341 . ПМК 6352506 . ПМИД 30027831 .
- ^ Уитни Г.А., Джаяраман К., Деннис Дж.Э., Мансур Дж.М. (февраль 2017 г.). «Хрящ без каркаса, подвергнутый фрикционному сдвиговому напряжению, повреждается в результате растрескивания и отслаивания поверхности» . Журнал тканевой инженерии и регенеративной медицины . 11 (2): 412–24. дои : 10.1002/терм.1925 . ПМЦ 4641823 . ПМИД 24965503 .
- ^ «Лаборатория Лангера – факультет химической инженерии Массачусетского технологического института» . langerlab.mit.edu . Проверено 13 марта 2023 г.
- ^ «Лаборатория тканевой инженерии и изготовления органов» . Массачусетская больница общего профиля, Бостон, Массачусетс. Архивировано из оригинала 1 декабря 2016 года . Проверено 31 октября 2009 г.
- ^ Jump up to: Перейти обратно: а б Лангер Р., Ваканти Дж. П. (май 1993 г.). «Тканевая инженерия». Наука . 260 (5110): 920–26. Бибкод : 1993Sci...260..920L . дои : 10.1126/science.8493529 . ПМИД 8493529 .
- ^ Jump up to: Перейти обратно: а б Макартур Б.Д., Ореффо Р.О. (январь 2005 г.). «Преодоление разрыва» . Природа . 433 (7021): 19. Бибкод : 2005Natur.433...19M . дои : 10.1038/433019а . ПМИД 15635390 . S2CID 2683429 .
- ^ Томас Д., Сингх Д. (июль 2019 г.). «Новые методы разработки трехмерной сосудистой ткани для хирургических процедур». Американский журнал хирургии . 218 (1): 235–236. дои : 10.1016/j.amjsurg.2018.06.004 . ПМИД 29929908 . S2CID 49350846 .
- ^ Jump up to: Перейти обратно: а б с д Виола Дж., Лал Б., Град О. (14 октября 2003 г.). Появление тканевой инженерии как области исследований (PDF) (Отчет). Абт Ассошиэйтс Инк. «Альтернативная веб-страница» . Проверено 28 апреля 2006 г. - через nsf.gov.
- ^ «Энтони Атала, доктор медицины» . Баптистское здоровье Уэйк Форест .
- ^ «Врачи выращивают органы из собственных клеток пациентов» . CNN . 3 апреля 2006 г.
- ^ Симонит Т (5 июля 2006 г.). «Выращенный в лаборатории хрящ лечит поврежденные колени» . Новый учёный .
- ^ Уитни Г.А., Мера Х., Вайденбехер М., Авадалла А., Мансур Дж.М., Деннис Дж.Э. (август 2012 г.). «Методы производства модифицированных хрящевых листов без каркаса из источников аурикулярных и суставных хондроцитов и прикрепления к пористому танталу» . Биоисследования в открытом доступе . 1 (4): 157–65. дои : 10.1089/biores.2012.0231 . ПМЦ 3559237 . ПМИД 23514898 .
- ^ Отт ХК, Маттисен Т.С., Гох С.К., Блэк Л.Д., Крен С.М., Нетофф Т.И., Тейлор Д.А. (февраль 2008 г.). «Перфузионно-децеллюлярная матрица: использование природной платформы для создания биоискусственного сердца». Природная медицина . 14 (2): 213–21. дои : 10.1038/nm1684 . ПМИД 18193059 . S2CID 12765933 .
- ^ Альтман Л.К. (13 января 2008 г.). «Исследователи создают новое крысиное сердце в лаборатории» . Нью-Йорк Таймс .
- ^ Зилла П., Грейслер Х. (1999). Тканевая инженерия сосудистых протезов . Компания RG Landes. ISBN 978-1-57059-549-3 . [ нужна страница ]
- ^ Нагели К.М., Курал М.Х., Ли Ю, Ван Дж., Хугентоблер Э.А., Никласон Л.Е. (июнь 2022 г.). «Биоинженерия человеческих тканей и будущее сосудистой замены» . Исследование кровообращения . 131 (1): 109–126. дои : 10.1161/CIRCRESAHA.121.319984 . ПМЦ 9213087 . ПМИД 35737757 .
- ^ Чанг В.Г., Никласон Л.Е. (27 марта 2017 г.). «Краткий дискурс о сосудистой тканевой инженерии» . npj Регенеративная медицина . 2 (1): 1–8. дои : 10.1038/s41536-017-0011-6 . ПМК 5649630 . ПМИД 29057097 .
- ^ «Тканевая инженерия» . microfab.com .
- ^ «Кость в бутылке: Попытки создать искусственный костный мозг до сих пор не увенчались успехом» . Экономист . 7 января 2009 г.
- ^ Jump up to: Перейти обратно: а б Амини А.Р., Лоренсен К.Т., Нукаварапу С.П. (2012). «Инженерия костной ткани: последние достижения и проблемы» . Критические обзоры в области биомедицинской инженерии . 40 (5): 363–408. doi : 10.1615/critrevbiomedeng.v40.i5.10 . ПМЦ 3766369 . ПМИД 23339648 .
- ^ Томас Д. (16 апреля 2021 г.). «3D-печать сшиваемых биокомпозитов на основе фосфата кальция для биосовместимой хирургической имплантации». Биопечать . 22 : e00141. doi : 10.1016/j.bprint.2021.e00141 . ISSN 2405-8866 . S2CID 234851322 .
- ^ Чой CQ (9 ноября 2009 г.). «Искусственная ткань пениса оказалась многообещающей в ходе лабораторных испытаний» . Живая наука .
- ^ Jump up to: Перейти обратно: а б Виг К., Чаудхари А., Трипати С., Диксит С., Саху Р., Пиллаи С. и др. (апрель 2017 г.). «Достижения в регенерации кожи с использованием тканевой инженерии» . Международный журнал молекулярных наук . 18 (4): 789. doi : 10.3390/ijms18040789 . ПМЦ 5412373 . ПМИД 28387714 .
- ^ Хит, Калифорния (январь 2000 г.). «Клетки для тканевой инженерии». Тенденции в биотехнологии . 18 (1): 17–19. дои : 10.1016/S0167-7799(99)01396-7 . ПМИД 10631775 .
- ^ Вельзер, Дженнифер и др. (ноябрь 2015 г.). «Первичные клетки против клеточных линий» . Исследовательские лаборатории ScienCell.
- ^ Баттери Л.Д., Бишоп А.Э. (2005). «Введение в тканевую инженерию». Биоматериалы, искусственные органы и тканевая инженерия . Том. 279. стр. 193–200. дои : 10.1533/9781845690861.4.193 . ISBN 9781855737372 .
- ^ Пареккадан Б., Милвид Дж. М. (август 2010 г.). «Мезенхимальные стволовые клетки как терапевтическое средство» . Ежегодный обзор биомедицинской инженерии . 12 : 87–117. doi : 10.1146/annurev-bioeng-070909-105309 . ПМЦ 3759519 . ПМИД 20415588 .
- ^ Домингес-Бендала Х., Ланцони Дж., Инверарди Л., Рикорди К. (январь 2012 г.). «Краткий обзор: мезенхимальные стволовые клетки при диабете» . Трансляционная медицина стволовых клеток . 1 (1): 59–63. дои : 10.5966/sctm.2011-0017 . ПМЦ 3727686 . ПМИД 23197641 .
- ^ Бара Дж.Дж., Ричардс Р.Г., Алини М., Стоддарт М.Дж. (июль 2014 г.). «Краткий обзор: мезенхимальные стволовые клетки, полученные из костного мозга, меняют фенотип после культивирования in vitro: значение для фундаментальных исследований и клиники» . Стволовые клетки . 32 (7): 1713–23. дои : 10.1002/stem.1649 . ПМИД 24449458 . S2CID 30744973 .
- ^ Минтир Д., Марра К.Г., Рубин Дж.П. (2013). «Мезенхимальные стволовые клетки жирового происхождения: биология и потенциальное применение». Достижения в области биохимической инженерии/биотехнологии . 129 : 59–71. дои : 10.1007/10_2012_146 . ISBN 978-3-642-35670-4 . ПМИД 22825719 .
- ^ Фарахани Н.А., Грили Х.Т., Хайман С., Кох С., Грейди С., Пашка С.П. и др. (апрель 2018 г.). «Этика экспериментирования с тканями мозга человека» . Природа . 556 (7702): 429–32. Бибкод : 2018Natur.556..429F . дои : 10.1038/d41586-018-04813-x . ПМК 6010307 . ПМИД 29691509 .
- ^ Бурре Р., Мартинес Э., Виалла Ф., Жикель С., Тоннат-Марен А., Де Вос Дж. (июнь 2016 г.). «Химеры человека и животных: этические проблемы выращивания химерных животных, несущих человеческие органы» . Исследования и терапия стволовыми клетками . 7 (1): 87. дои : 10.1186/s13287-016-0345-9 . ПМЦ 4928294 . ПМИД 27356872 .
- ^ Мерфи К. (2016). Иммунобиология Джейнвей . Norton, WW & Company, Inc. ISBN 978-0815345053 . [ нужна страница ]
- ^ Гробарчик Б, Франко Б, Ханон К, Мальгранж Б (октябрь 2015 г.). «Получение изогенной линии iPS клеток человека, точно скорректированной путем редактирования генома с использованием системы CRISPR / Cas9». Обзоры и отчеты о стволовых клетках . 11 (5): 774–87. дои : 10.1007/s12015-015-9600-1 . ПМИД 26059412 . S2CID 18897400 .
- ^ Мерчинг Х., Шанц Дж., Стегер В., Шандар М., Шенк М., Хансманн Дж. и др. (июль 2009 г.). «Создание и трансплантация аутологичной васкуляризированной биоискусственной ткани человека» . Трансплантация . 88 (2): 203–210. дои : 10.1097/TP.0b013e3181ac15e1 . ПМИД 19623015 . S2CID 46083673 .
- ^ Ньюман П., Минетт А., Эллис-Бенке Р., Зрейкат Х. (ноябрь 2013 г.). «Углеродные нанотрубки: их потенциал и подводные камни для регенерации и инженерии костной ткани». Наномедицина . 9 (8): 1139–1158. дои : 10.1016/j.nano.2013.06.001 . ПМИД 23770067 .
- ^ Патрик К.В., Микос АГ, Макинтайр Л.В. (1998). Границы тканевой инженерии (1-е изд.). Оксфорд, Великобритания: Пергамон. ISBN 978-0-08-042689-1 . OCLC 162130841 .
- ^ Стюарт С.А., Домингес-Роблес Х., Доннелли Р.Ф., Ларраньета Э. (декабрь 2018 г.). «Имплантируемые полимерные устройства для доставки лекарств: классификация, производство, материалы и клиническое применение» . Полимеры . 10 (12): 1379. doi : 10.3390/polym10121379 . ПМК 6401754 . ПМИД 30961303 .
- ^ Кадзихара М., Суги Т., Маэда Х., Сано А., Фудзиока К., Урабе Ю. и др. (январь 2003 г.). «Новое устройство для доставки лекарств с использованием силикона: контролируемое высвобождение нерастворимых лекарств или двух видов водорастворимых лекарств» . Химический и фармацевтический вестник . 51 (1): 15–19. дои : 10.1248/cpb.51.15 . ПМИД 12520121 .
- ^ Афеверки С., Шейхи А., Каннан С., Ахадиан С., Хадемхоссейни А. (январь 2019 г.). «Композитные каркасы из желатина и полисахарида для 3D-культуры клеток и тканевой инженерии: на пути к естественной терапии» . Биоинженерия и трансляционная медицина . 4 (1): 96–115. дои : 10.1002/btm2.10124 . ПМК 6336672 . ПМИД 30680322 .
- ^ Мартин К.А., Радхакришнан С., Нагараджан С., Мутхукури С., Дуэньяс Дж.М., Рибеллес Дж.Л. и др. (2019). «Инновационный биорезорбируемый трехмерный каркас на основе желатина, который поддерживает стволовость стволовых клеток, полученных из жировой ткани, и пластичность дифференцированных нейронов» . РСК Прогресс . 9 (25): 14452–64. Бибкод : 2019RSCAd...914452M . дои : 10.1039/C8RA09688K . ISSN 2046-2069 . ПМК 9064131 . ПМИД 35519343 .
- ^ Такаги Ю, Танака С, Томита С, Акияма С, Маки Ю, Ямамото Т, Уэхара М, Добаши Т (2017). «Приготовление желатинового каркаса и культуры клеток фибробластов» . Журнал биореологии . 31 (1): 2–5. дои : 10.17106/jbr.31.2 . ISSN 1867-0466 .
- ^ Рухани-Исфахани С.И., Ньюман П., Зрейкат Х. (январь 2016 г.). «Проектирование и изготовление 3D-печатных каркасов с механической прочностью, сравнимой с кортикальной костью, для восстановления больших дефектов кости» . Научные отчеты . 6 (1): 19468. Бибкод : 2016NatSR...619468R . дои : 10.1038/srep19468 . ПМЦ 4726111 . ПМИД 26782020 .
- ^ Нокурани Ю.Д., Шамлу А., Бахадоран М., Мораввей Х. (август 2021 г.). «Изготовление и характеристика каркасов, содержащих различное количество аллантоина для инженерии тканей кожи» . Научные отчеты . 11 (1): 16164. Бибкод : 2021NatSR..1116164N . дои : 10.1038/s41598-021-95763-4 . ПМЦ 8352935 . ПМИД 34373593 .
- ^ Джентиле П., Чионо В., Карманьола I, Хаттон П.В. (февраль 2014 г.). «Обзор биоматериалов на основе поли(молочной-ко-гликолевой) кислоты (PLGA) для инженерии костной ткани» . Международный журнал молекулярных наук . 15 (3): 3640–59. дои : 10.3390/ijms15033640 . ПМЦ 3975359 . ПМИД 24590126 .
- ^ Парк Дж.Х., Шварц З., Оливарес-Наваррете Р., Боян Б.Д., Танненбаум Р. (май 2011 г.). «Повышение смачиваемости поверхности путем модификации микротекстурированных поверхностей титановых имплантатов полиэлектролитами» . Ленгмюр . 27 (10): 5976–85. дои : 10.1021/la2000415 . ПМЦ 4287413 . ПМИД 21513319 .
- ^ Лейхнер С., Йелькманн М., Бернкоп-Шнурх А. (2019). «Тиолированные полимеры: биоинспирированные полимеры, использующие одну из наиболее важных мостиковых структур в природе». Обзоры расширенной доставки лекарств . 151–152: 191–221. дои : 10.1016/j.addr.2019.04.007 . ПМИД 31028759 . S2CID 135464452 .
- ^ Каст CE, Фрик В., Лозерт У., Бернкоп-Шнурх А. (апрель 2003 г.). «Конъюгат хитозана и тиогликолевой кислоты: новый каркасный материал для тканевой инженерии?». Международный фармацевтический журнал . 256 (1–2): 183–189. дои : 10.1016/S0378-5173(03)00076-0 . ПМИД 12695025 .
- ^ Пэ И.Х., Чон Б.С., Кук М.С., Ким Ш., Ко Дж.Т. (2013). «Оценка тиолированного хитозанового каркаса для местной доставки BMP-2 при остеогенной дифференцировке и эктопическом костеобразовании» . БиоМед Исследования Интернэшнл . 2013 : 878930. doi : 10.1155/2013/878930 . ПМК 3760211 . ПМИД 24024213 .
- ^ Бянь С., Хэ М., Суй Дж., Цай Х., Сунь Ю., Лян Дж. и др. (апрель 2016 г.). «Самосшивающиеся умные гидрогели гиалуроновой кислоты в качестве инъекционных трехмерных каркасов для культуры клеток» . Коллоиды и поверхности. Б. Биоинтерфейсы . 140 : 392–402. дои : 10.1016/j.colsurfb.2016.01.008 . ПМИД 26780252 .
- ^ Гаджендиран М., Ри Дж.С., Ким К. (февраль 2018 г.). «Последние разработки в области тиолированных полимерных гидрогелей для применения в тканевой инженерии». Тканевая инженерия. Часть Б, Обзоры . 24 (1): 66–74. дои : 10.1089/ten.TEB.2016.0442 . ПМИД 28726576 .
- ^ Бауэр С., Джеякумар В., Никулеску-Моржа Е., Керн Д., Нерер С. (декабрь 2017 г.). «Гиалуронаттиомерный гель/матрица опосредовал заживление дефектов суставного хряща у новозеландских белых кроликов — пилотное исследование» . Журнал экспериментальной ортопедии . 4 (1): 14. дои : 10.1186/s40634-017-0089-1 . ПМЦ 5415448 . ПМИД 28470629 .
- ^ Захир-Джуздани Ф., Махбод М., Сулеймани М., Вахшите Ф., Арефян Э., Шахосейни С. и др. (январь 2018 г.). «Хитозан и тиолированный хитозан: новый терапевтический подход для предотвращения помутнения роговицы после химических повреждений». Углеводные полимеры . 179 : 42–49. дои : 10.1016/j.carbpol.2017.09.062 . ПМИД 29111069 .
- ^ «Клинические испытания на людях» (PDF) .
- ^ Помрой Дж. Э., Хелфер А., Бурсак Н. (1 сентября 2020 г.). «Биоматериализация перспектив инженерии сердечной ткани» . Достижения биотехнологии . 42 : 107353. doi : 10.1016/j.biotechadv.2019.02.009 . ПМК 6702110 . ПМИД 30794878 .
- ^ Кэссиди Дж.В. (ноябрь 2014 г.). «Нанотехнологии в регенерации сложных тканей» (PDF) . Информация о регенерации костей и тканей . 5 : 25–35. дои : 10.4137/BTRI.S12331 . ПМЦ 4471123 . ПМИД 26097381 .
- ^ Нам Ю.С., Пак Т.Г. (октябрь 1999 г.). «Биоразлагаемые полимерные микроячеистые пены, полученные модифицированным методом термического разделения фаз». Биоматериалы . 20 (19): 1783–90. дои : 10.1016/S0142-9612(99)00073-3 . ПМИД 10509188 .
- ^ Саймон Э.М. (1988). «Заключительный отчет фазы I Национального института здравоохранения: волокнистые субстраты для клеточных культур (R3RR03544A)» . Исследовательские ворота . Проверено 22 мая 2017 г.
- ^ Мелчелс Ф., Виггенхаузер П.С., Уорн Д., Барри М., Онг Ф.Р., Чонг В.С. и др. (сентябрь 2011 г.). «Реконструкция груди с помощью CAD/CAM» (PDF) . Биофабрикация . 3 (3): 034114. Бибкод : 2011BioFa...3c4114M . дои : 10.1088/1758-5082/3/3/034114 . ПМИД 21900731 . S2CID 206108959 .
- ^ Jump up to: Перейти обратно: а б Елисеев Дж., Ма ПХ (2005). Строительные леса в тканевой инженерии . Бока-Ратон: CRC. ISBN 978-1-57444-521-3 .
- ^ Jump up to: Перейти обратно: а б Ли Джи, Кенни П.А., Ли Э.Х., Бисселл М.Дж. (апрель 2007 г.). «Трехмерные культуральные модели нормальных и злокачественных эпителиальных клеток молочной железы» . Природные методы . 4 (4): 359–65. дои : 10.1038/nmeth1015 . ПМЦ 2933182 . ПМИД 17396127 .
- ^ Jump up to: Перейти обратно: а б с Лай Ю, Астхана А, Кисаалита В.С. (апрель 2011 г.). «Биомаркеры для упрощения платформ 3D-культуры клеток HTS для открытия лекарств: аргументы в пользу цитокинов». Открытие наркотиков сегодня . 16 (7–8): 293–97. дои : 10.1016/j.drudis.2011.01.009 . ПМИД 21277382 .
- ^ Густафссон Л., Тасиопулос К.П., Янссон Р., Квик М., Дуурсма Т., Гассер Т.К., ван дер Вейнгаарт В., Хедхаммар М. (16 августа 2020 г.). «Рекомбинантный паучий шелк образует прочные и эластичные наномембраны, проницаемые для белков и поддерживающие прикрепление и рост клеток» . Передовые функциональные материалы . 30 (40): 2002982. doi : 10.1002/adfm.202002982 .
- ^ Тасиопулос КП, Густафссон Л, ван дер Вейнгаарт В, Хедхаммар М (июль 2021 г.). «Фибриллярные наномембраны рекомбинантного белка паучьего шелка поддерживают совместную культуру клеток в in vitro модели стенки кровеносного сосуда » . ACS Биоматериалы, наука и инженерия . 7 (7): 3332–3339. doi : 10.1021/acsbimaterials.1c00612 . ПМК 8290846 . ПМИД 34169711 .
- ^ Диас, Джулиана Р.; Рибейру, Нильза; Баптиста-Сильва, Сара; Коста-Пинто, Ана Рита; Алвес, Нуно; Оливейра, Ана Л. (2020). «Подходы к регенерации тканей in situ: текущие проблемы и новые разработки» . Границы биоинженерии и биотехнологии . 8 : 85. дои : 10.3389/fbioe.2020.00085 . ISSN 2296-4185 . ПМК 7039825 . ПМИД 32133354 .
- ^ Малек-Хатаби А.; Джавар, штат Ха; Даштимогадам, Э.; Ансари, С.; Хасани-Садрабади, ММ; Мошавериния, А. (2020). «Инженерия костной ткани in situ с использованием нанокомплексов доставки генов» . Акта Биоматериалы . 108 : 326–336. doi : 10.1016/j.actbio.2020.03.008 . ISSN 1878-7568 . ПМИД 32160962 . S2CID 212679291 .
- ^ Красильникова О.А.; Барановский, Д.С.; Якимова, АО; Аргучинская Н.; Кисель, А.; Сосин Д.; Сулина Ю.; Иванов С.А.; Шегай, ПВ; Каприн А.Д.; Клабуков И.Д. (2022). «Интраоперационное создание тканеинженерных трансплантатов с минимально манипулируемыми клетками: новая концепция инженерии костной ткани in situ» . Биоинженерия . 9 (11): 704. doi : 10.3390/bioengineering9110704 . ISSN 2306-5354 . ПМЦ 9687730 . ПМИД 36421105 .
- ^ Ху Дж.К., Афанасиу К.А. (апрель 2006 г.). «Процесс самосборки в инженерии тканей суставного хряща». Тканевая инженерия . 12 (4): 969–79. дои : 10.1089/ten.2006.12.969 . ПМИД 16674308 .
- ^ Ли Дж.К., Хьюве Л.В., Пашос Н., Арьяи А., Гегг К.А., Ху Дж.К., Атанасиу К.А. (август 2017 г.). «Стимуляция напряжением стимулирует образование тканей в системах без каркасов» . Природные материалы . 16 (8): 864–73. Бибкод : 2017NatMa..16..864L . дои : 10.1038/nmat4917 . ПМК 5532069 . ПМИД 28604717 .
- ^ Чен П., Луо З., Гювен С., Тасоглу С., Ганесан А.В., Венг А., Демирчи У (сентябрь 2014 г.). «Микромасштабная сборка, управляемая шаблоном на жидкой основе» . Продвинутые материалы . 26 (34): 5936–41. Бибкод : 2014AdM....26.5936C . дои : 10.1002/adma.201402079 . ПМК 4159433 . ПМИД 24956442 .
- ^ Миронов В., Боланд Т., Труск Т., Форгач Г., Марквальд Р.Р. (апрель 2003 г.). «Печать органов: компьютерная струйная 3D-инженерия тканей». Тенденции в биотехнологии . 21 (4): 157–61. дои : 10.1016/S0167-7799(03)00033-7 . ПМИД 12679063 .
- ^ Альта А (март 2011 г.). «Печать почки человека» . ТЭД . Архивировано из оригинала 26 февраля 2014 года . Проверено 29 ноября 2013 г.
- ^ Ду Ю, Хан Р., Вэнь Ф., Нг Сан Сан С., Ся Л., Воланд Т. и др. (январь 2008 г.). «Синтетическая сэндвич-культура трехмерного монослоя гепатоцитов». Биоматериалы . 29 (3): 290–301. doi : 10.1016/j.bimaterials.2007.09.016 . ПМИД 17964646 .
- ^ Кан Х.В., Ли С.Дж., Ко И.К., Кенгла С., Ю Дж.Дж., Атала А. (март 2016 г.). «Система 3D-биопечати для производства тканевых конструкций человеческого масштаба со структурной целостностью». Природная биотехнология . 34 (3): 312–19. дои : 10.1038/nbt.3413 . ПМИД 26878319 . S2CID 9073831 .
- ^ Мачюлайтис Ю., Девейките М., Рекштите С., Братчиков М., Даринскас А., Шимбелите А. и др. (март 2015 г.). «Доклиническое исследование трехмерных микроструктурированных каркасов из материала SZ2080 для инженерии хрящевой ткани, изготовленных методом фемтосекундной прямой лазерной литографии». Биофабрикация . 7 (1): 015015. Бибкод : 2015BioFa...7a5015M . дои : 10.1088/1758-5090/7/1/015015 . ПМИД 25797444 . S2CID 40712319 .
- ^ Гребенюк Сергей; Абдель Фаттах, Абдель Рахман; Кумар, Манодж; Топрахисар, Бурак; Рустанди, Грегориус; Вананрой, Аня; Лосось, Идрис; Верфайи, Кэтрин; Грилло, Марк; Ранга, Адриан (12 января 2023 г.). «Крупномасштабные перфузируемые ткани с помощью синтетической 3D-мягкой микрофлюидики» . Природные коммуникации . 14 (1): 193. Бибкод : 2023NatCo..14..193G . дои : 10.1038/s41467-022-35619-1 . ISSN 2041-1723 . ПМЦ 9837048 . ПМИД 36635264 .
- ^ Jump up to: Перейти обратно: а б с Греджио С., Де Франчески Ф., Фигейредо-Ларсен М., Гобаа С., Ранга А., Семб Х. и др. (ноябрь 2013 г.). «Искусственные трехмерные ниши деконструируют развитие поджелудочной железы in vitro» . Разработка . 140 (21): 4452–4462. дои : 10.1242/dev.096628 . ПМК 4007719 . ПМИД 24130330 .
Краткое содержание: «Новый 3D-метод для выращивания миниатюрной модели поджелудочной железы» . Курцвейл . 17 октября 2013 г. - ^ Мол Т.М., Чу Д.В., Непонице А., Ворп Д.А. (декабрь 2011 г.). «Механические стимулы по-разному контролируют поведение стволовых клеток: морфологию, пролиферацию и дифференцировку» . Биомеханика и моделирование в механобиологии . 10 (6): 939–53. дои : 10.1007/s10237-010-0285-8 . ПМК 3208754 . ПМИД 21253809 .
- ^ Питтенджер М.Ф., Маккей А.М., Бек С.К., Джайсвал Р.К., Дуглас Р., Моска Дж.Д. и др. (апрель 1999 г.). «Многолинейный потенциал мезенхимальных стволовых клеток взрослого человека». Наука . 284 (5411): 143–47. Бибкод : 1999Sci...284..143P . дои : 10.1126/science.284.5411.143 . ПМИД 10102814 .
- ^ Ли Э.Л., фон Рекум ХА (май 2010 г.). «Платформа для культивирования клеток с механическим кондиционированием и не повреждающим отделением клеток». Журнал исследований биомедицинских материалов. Часть А. 93 (2): 411–18. дои : 10.1002/jbm.a.32754 . ПМИД 20358641 .
- ^ Кинг Дж.А., Миллер В.М. (август 2007 г.). «Разработка биореактора для размножения стволовых клеток и контролируемой дифференцировки» . Современное мнение в области химической биологии . 11 (4): 394–98. дои : 10.1016/j.cbpa.2007.05.034 . ПМК 2038982 . ПМИД 17656148 .
- ^ Jump up to: Перейти обратно: а б «MC2 Biotek – 3D-культура тканей – 3D-система ProtoTissue System™» . Архивировано из оригинала 28 мая 2012 года.
- ^ Прествич Г.Д. (январь 2008 г.). «Оценка эффективности и токсикологии лекарств в трех измерениях: использование синтетических внеклеточных матриц при открытии лекарств». Отчеты о химических исследованиях . 41 (1): 139–48. дои : 10.1021/ar7000827 . ПМИД 17655274 .
- ^ Фридрих Дж., Зайдель С., Эбнер Р., Кунц-Шугхарт Л.А. (2009). «Скрининг наркотиков на основе сфероидов: соображения и практический подход». Протоколы природы . 4 (3): 309–24. дои : 10.1038/nprot.2008.226 . ПМИД 19214182 . S2CID 21783074 .
- ^ Jump up to: Перейти обратно: а б Маркс V (апрель 2013 г.). «Клеточная культура: лучший напиток» . Природа . 496 (7444): 253–58. Бибкод : 2013Natur.496..253M . дои : 10.1038/496253а . ПМИД 23579682 . S2CID 4399610 .
- ^ Чжан ЗИ, Тео Ш., Чонг В.С., Фу Т.Т., Чнг Ю.К., Чулани М., Чан Дж. (май 2009 г.). «Двуосный вращающийся биореактор для культуры фетальных мезенхимальных стволовых клеток для инженерии костной ткани». Биоматериалы . 30 (14): 2694–704. doi : 10.1016/j.bimaterials.2009.01.028 . ПМИД 19223070 .
- ^ Кан К.С., Ли С.Дж., Ли Х.С., Мун В., Чо Д.В. (июнь 2011 г.). «Влияние комбинированной механической стимуляции на пролиферацию и дифференцировку преостеобластов» . Экспериментальная и молекулярная медицина . 43 (6): 367–73. дои : 10.3858/эмм.2011.43.6.040 . ПМК 3128915 . ПМИД 21532314 .
- ^ Россер Дж., Томас DJ (январь 2018 г.). «10 – Биореакторные процессы для созревания 3D-биопечатной ткани». В Thomas DJ, Джессоп З.М., Уитакер И.С. (ред.). 3D-биопечать в реконструктивной хирургии . Издательство Вудхед. стр. 191–215. ISBN 978-0-08-101103-4 .
- ^ Гриффит Л.Г., Шварц М.А. (март 2006 г.). «Изучение сложной физиологии трехмерных тканей in vitro». Обзоры природы. Молекулярно-клеточная биология . 7 (3): 211–24. дои : 10.1038/nrm1858 . ПМИД 16496023 . S2CID 34783641 .
- ^ Оноэ Х., Окицу Т., Ито А., Като-Негиши М., Годзё Р., Кирия Д. и др. (июнь 2013 г.). «Нагруженные клетками микроволокна метровой длины демонстрируют морфологию и функции тканей». Природные материалы . 12 (6): 584–90. Бибкод : 2013NatMa..12..584O . дои : 10.1038/nmat3606 . ПМИД 23542870 .
- ^ Jump up to: Перейти обратно: а б Ван Икс (январь 2019 г.). «Технологии изготовления биоискусственных органов» . Трансплантация клеток . 28 (1): 5–17. дои : 10.1177/0963689718809918 . ПМК 6322143 . ПМИД 30477315 .
- ^ Сава И., Мацумия Г., Мацуда К., Тацуми Е., Абэ Т., Фукунага К. и др. (март 2018 г.). «Журнал «Искусственные органы» 2017: итоги года: Редакционная комиссия журнала «Искусственные органы» . Журнал искусственных органов . 21 (1): 1–7. дои : 10.1007/s10047-018-1018-5 . ПМК 7102331 . ПМИД 29426998 .
- ^ Jump up to: Перейти обратно: а б Чаухан С., Субин С. (1 сентября 2011 г.). «Экстракорпоральная мембранная оксигенация, взгляд анестезиолога: физиология и принципы. Часть 1» . Анналы сердечной анестезии . 14 (3): 218–29. дои : 10.4103/0971-9784.84030 . ПМИД 21860197 .
- ^ «Как началось ЭКМО?» . Больницы и клиники Университета Айовы . 20 июня 2017 года . Проверено 4 декабря 2020 г.
- ^ «Хондроитинсульфат является компонентом шаблона дермальной регенерации Integra®» . fdocuments.us . Проверено 5 декабря 2020 г.
- ^ «Интегра» (PDF) . Проверено 13 марта 2023 г.
- ^ «Дермопласт, полученный из фибробластов человека, дермальный заменитель» . dermagraft.com . Проверено 5 декабря 2020 г.
- ^ Колвин М., Смит Дж.М., Хэдли Н., Скинс М.А., Уччеллини К., Леман Р. и др. (февраль 2019 г.). «Годовой отчет OPTN/SRTR за 2017 год: сердце» . Американский журнал трансплантологии . 19 (Приложение 2): 323–403. дои : 10.1111/ajt.15278 . hdl : 2027.42/172019 . ПМИД 30811894 . S2CID 73510324 .
- ^ Смит, Пенсильвания, Кон В.Е., Фрейзер, Огайо (1 января 2018 г.). «Глава 7 – Тотальные искусственные сердца». Механическая поддержка кровообращения и дыхания . Академическая пресса. стр. 221–44. дои : 10.1016/B978-0-12-810491-0.00007-2 .
- ^ Хан С., Джехангир В. (октябрь 2014 г.). «Эволюция искусственных сердец: обзор и история» . Кардиологические исследования . 5 (5): 121–25. дои : 10.14740/cr354w . ПМЦ 5358116 . ПМИД 28348709 .
- ^ Мелтон Н., Сулеймани Б., Даулинг Р. (ноябрь 2019 г.). «Текущая роль полного искусственного сердца в лечении прогрессирующей сердечной недостаточности». Текущие кардиологические отчеты . 21 (11): 142. дои : 10.1007/s11886-019-1242-5 . ПМИД 31758343 . S2CID 208212152 .
- ^ Кук Дж.А., Шах К.Б., Квадер М.А., Кук Р.Х., Касираджан В., Рао К.К. и др. (декабрь 2015 г.). «Полное искусственное сердце» . Журнал торакальных заболеваний . 7 (12): 2172–80. дои : 10.3978/j.issn.2072-1439.2015.10.70 . ПМК 4703693 . ПМИД 26793338 .
- ^ Jump up to: Перейти обратно: а б с д Тасним Ф., Денг Р., Ху М., Лиур С., Ли Ю, Ни М. и др. (август 2010 г.). «Достижения и проблемы разработки биоискусственной почки» . Фиброгенез и восстановление тканей . 3 (14): 14. дои : 10.1186/1755-1536-3-14 . ПМК 2925816 . ПМИД 20698955 .
- ^ Jump up to: Перейти обратно: а б Хьюмс Х.Д., Баффингтон Д., Вестовер А.Дж., Рой С., Фиссел WH (март 2014 г.). «Биоискусственная почка: современное состояние и перспективы на будущее». Детская нефрология . 29 (3): 343–51. дои : 10.1007/s00467-013-2467-y . ПМИД 23619508 . S2CID 19376597 .
- ^ Су Дж., Сатчелл С.С., Шах Р.Н., Вертхайм Дж.А. (сентябрь 2018 г.). «Децеллюляризированные гидрогели внеклеточного матрикса почек: реологическая характеристика и реакция эндотелиальных клеток клубочков человека на инкапсуляцию» . Журнал исследований биомедицинских материалов. Часть А. 106 (9): 2448–2462. дои : 10.1002/jbm.a.36439 . ПМК 6376869 . ПМИД 29664217 .
- ^ Ли С.Дж., Ван Х.Дж., Ким Т.Х., Чой Дж.С., Кулкарни Дж., Джексон Дж.Д. и др. (февраль 2018 г.). «Регенерация почечной ткани in situ, вызванная инъекцией гидрогеля коллагена» . Трансляционная медицина стволовых клеток . 7 (2): 241–250. дои : 10.1002/sctm.16-0361 . ПМК 5788870 . ПМИД 29380564 .
- ^ У Х, Чжан Р, Ху Б, Хэ Ю, Чжан Ю, Цай Л, Ван Л, Ван Г, Хоу Х, Цю Икс (декабрь 2021 г.). «Пористый гидрогелевый каркас, имитирующий внеклеточный матрикс, с коллагеном, полученным из плавательного пузыря, для регенерации почечной ткани». Китайские химические буквы . 32 (12): 3940–3947. дои : 10.1016/j.cclet.2021.04.043 . S2CID 235570487 .
- ^ Моу Х, Шах Дж., Бхаттачарья Р., Каледжайе Т.Д., Сунь Б., Сюй ПК, Муса С. (апрель 2022 г.). «Биомиметическая электропряденая мембрана поддерживает дифференцировку и созревание эпителия почек из стволовых клеток человека» . Биоинженерия . 9 (5): 188. doi : 10.3390/bioengineering9050188 . ПМЦ 9137565 . ПМИД 35621466 .
- ^ Ли Э, Пак К.В., Чун С.Ю., Ким Х, Квон Т.Г., Чжун Ю.К., Хан Д.К. (август 2016 г.). «Биомиметические пористые каркасы из PLGA, включающие децеллюляризованный внеклеточный матрикс для регенерации тканей почек». Прикладные материалы и интерфейсы ACS . 8 (33): 21145–21154. дои : 10.1021/acsami.6b03771 . ПМИД 27456613 .
- ^ Бертон Т.П., Калланан А. (июнь 2018 г.). «Нетканый путь: электропряденые каркасы из полимолочной кислоты для инженерии тканей почек» . Тканевая инженерия и регенеративная медицина . 15 (3): 301–310. дои : 10.1007/s13770-017-0107-5 . ПМК 6171675 . ПМИД 30603555 .
- ^ Мирмохтадаи М., Хабушан А.С., Мохаммади Б., Садр М., Фарманд Х., Хасаннеджад З., Каджбафзаде А.М. (декабрь 2022 г.). «Инженерия почечной ткани в доклинических моделях почечной недостаточности: систематический обзор и метаанализ». Регенеративная медицина . 17 (12): 941–955. дои : 10.2217/rme-2022-0084 . ПМИД 36154467 . S2CID 252543376 .
- ^ Jump up to: Перейти обратно: а б Хван Дж., Чон Й., Пак Дж.М., Ли К.Х., Хон Дж.В., Чхве Дж. (8 сентября 2015 г.). «Биомиметика: прогнозирование будущего науки, техники и медицины» . Международный журнал наномедицины . 10 : 5701–13. дои : 10.2147/IJN.S83642 . ПМЦ 4572716 . ПМИД 26388692 .
- ^ «Ученые имитируют нервную ткань в рамках исследования, финансируемого армией, которое может привести к созданию искусственной кожи» . Исследовательская лаборатория армии США. 20 марта 2018 года . Проверено 22 сентября 2020 г.
- ^ Jump up to: Перейти обратно: а б Личел Т., Нортон М.М., Церунян В., Фраден С. (февраль 2018 г.). «Инженерные реакционно-диффузионные сети со свойствами нервной ткани». Лаборатория на чипе . 18 (5): 714–22. arXiv : 1711.00444 . дои : 10.1039/C7LC01187C . ПМИД 29297916 . S2CID 3567908 .
- ^ Jump up to: Перейти обратно: а б «Мягкие роботы» . фраденлаб . Проверено 22 августа 2018 г.
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м Умемура М. (3 апреля 2019 г.). «Вызов проблемы «пригодности»: развитие отрасли регенеративной медицины в США, Великобритании и Японии». История бизнеса . 61 (3): 456–480. дои : 10.1080/00076791.2018.1476496 . ISSN 0007-6791 . S2CID 158171857 .
- ^ Jump up to: Перейти обратно: а б с д и Буши А. (декабрь 2002 г.). «Фирмы тканевой инженерии терпят крах». Природная биотехнология . 20 (12): 1178–79. дои : 10.1038/nbt1202-1178 . ПМИД 12454657 . S2CID 9682305 .
- ^ Jump up to: Перейти обратно: а б с д Браун Н., Фолкнер А., Кент Дж., Майкл М. (1 февраля 2006 г.). «Регулирование гибридов: «наведение беспорядка» и «очистка» в тканевой инженерии и трансплантации трансформ» . Социальная теория и здоровье . 4 (1): 1–24. дои : 10.1057/palgrave.sth.8700062 . ПМК 7099299 . ПМИД 32226319 .
- ^ Дерксен М.Х. (2008). Инженерная плоть: к профессиональной ответственности за «живые тела» в тканевой инженерии . Эйндховенский технологический университет. ISBN 978-90-386-1428-1 . [ нужна страница ]
- ^ Кент Дж., Фолкнер А., Гисинк И., Фитцпатрик Д. (1 января 2006 г.). «На пути к управлению технологиями тканевой инженерии человека в Европе: обоснование нового режима регулирования». Технологическое прогнозирование и социальные изменения . Технологии и социальные риски. 73 (1): 41–60. doi : 10.1016/j.techfore.2005.06.006 .
- ^ Директива 2004/23/EC Европейского парламента и Совета от 31 марта 2004 г. об установлении стандартов качества и безопасности донорства, закупок, тестирования, обработки, консервации, хранения и распределения человеческих тканей и клеток , vol. OJ L, 7 апреля 2004 г. , дата обращения 7 мая 2020 г.
- ^ Фолкнер А., Кент Дж., Гисинк И., ФитцПатрик Д. (ноябрь 2006 г.). «Чистота и опасности регенеративной медицины: нормативные инновации в области тканевой инженерии человека» . Социальные науки и медицина . 63 (9): 2277–88. doi : 10.1016/j.socscimed.2006.06.006 . ПМК 7130933 . ПМИД 16905231 .
Ссылки [ править ]
- Дэвис М.Э., Motion JP, Нармонева Д.А., Такахаши Т., Хакуно Д., Камм Р.Д. и др. (февраль 2005 г.). «Инъекционные самособирающиеся пептидные нановолокна создают внутримиокардиальную микросреду для эндотелиальных клеток» . Тираж . 111 (4): 442–50. дои : 10.1161/01.CIR.0000153847.47301.80 . ПМЦ 2754569 . ПМИД 15687132 .
- Дерксен М.Х. (2008). Инженерная плоть: к профессиональной ответственности за «живые тела» в тканевой инженерии . Эйндховенский технологический университет. ISBN 978-90-386-1428-1 .
- Фонтан ГА (15 сентября 2012 г.). «Первое: органы, изготовленные по индивидуальному заказу из собственных клеток организма» . Нью-Йорк Таймс .
- Холмс Т.К., де Лакаль С., Су X, Лю Г, Рич А., Чжан С. (июнь 2000 г.). «Обширный рост нейритов и активное образование синапсов на самособирающихся пептидных каркасах» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (12): 6728–6733. Бибкод : 2000PNAS...97.6728H . дои : 10.1073/pnas.97.12.6728 . ЧВК 18719 . ПМИД 10841570 .
- Идрус А.А. (12 сентября 2018 г.). «Показатели жизненно важной терапии падают на 88%, прекращается лечение печени после неудачи 3-й фазы» . Жестокая биотехнология .
- Ма ПХ (май 2004 г.). «Скаффолды для изготовления тканей» . Материалы сегодня . 7 (5): 30–40. дои : 10.1016/s1369-7021(04)00233-0 .
- Микос А.Г., Теменофф Дж.С. (2000). «Формирование высокопористых биоразлагаемых каркасов для тканевой инженерии» (PDF) . Электронный журнал биотехнологии . 3 (2): 114–19. doi : 10.2225/vol3-issue2-fulltext-5 .
- Нерем Р.М. (2000). Ваканти Дж., Ланца Р.П., Лангер Р.С. (ред.). Принципы тканевой инженерии (2-е изд.). Бостон: Академическая пресса. ISBN 978-0-12-436630-5 .
- Семино С.Э., Касахара Дж., Хаяши Ю., Чжан С. (2004). «Захват мигрирующих нервных клеток гиппокампа в трехмерный каркас из пептидных нановолокон». Тканевая инженерия . 10 (3–4): 643–55. дои : 10.1089/107632704323061997 . ПМИД 15165480 .
- Томпсон Дж., Джонс Н., Аль-Хафаджи А., Малик С., Райх Д., Муньос С. и др. (март 2018 г.). «Экстракорпоральная клеточная терапия (ЭЛАД) при тяжелом алкогольном гепатите: многонациональное проспективное контролируемое рандомизированное исследование» . Трансплантация печени . 24 (3): 380–93. дои : 10.1002/lt.24986 . ПМЦ 5873437 . ПМИД 29171941 .
- Вишвакарма А (2014). Биология стволовых клеток и тканевая инженерия в стоматологии . Эльзевир. ISBN 978-0123971579 .
- Виола Дж., Лал Б., Град О. (14 октября 2003 г.). Появление тканевой инженерии как области исследований (PDF) (Отчет). Абт Ассошиэйтс Инк. «Альтернативная веб-страница» – через nsf.gov.
Внешние ссылки [ править ]
- Клеточная инженерия костной ткани
- Клинический центр тканевой инженерии Инициатива штата Огайо по тканевой инженерии (Национальный центр регенеративной медицины)
- Печать органов. Архивировано 28 августа 2008 г. в Wayback Machine , финансируемой NSF. многоцентровой инициативе
- Инициатива Центра LOEX Университета Лаваля в области тканевой инженерии
