Биоматериал

Биоматериал для — это вещество, созданное взаимодействия с биологическими системами в медицинских целях — либо терапевтических (лечение, усиление, восстановление или замена функций тканей организма), либо диагностических . Соответствующей области исследований, называемой биоматериаловедением или инженерией биоматериалов , около пятидесяти лет. [ нужно обновить ] На протяжении всей своей истории он стабильно рос: многие компании инвестировали большие суммы денег в разработку новых продуктов. Наука о биоматериалах включает в себя элементы медицины , биологии , химии , тканевой инженерии и материаловедения .
Биоматериал отличается от биологического материала, такого как кость , который производится биологической системой . Однако понятия «биоматериал» и «биологический материал» часто используются как синонимы. Кроме того, слово «биоматериал» было предложено в качестве потенциального альтернативного слова для биологически произведенных материалов, таких как кости или грибковые биокомпозиты. [ нужна ссылка ] Кроме того, следует проявлять осторожность при определении биоматериала как биосовместимого , поскольку он зависит от области применения. Биоматериал, который является биосовместимым или подходит для одного применения, может быть не биосовместимым в другом. [1]
Материал, используемый в контакте с живыми тканями, организмами или микроорганизмами. [2] [а] [б] [с]
Введение [ править ]
Биоматериалы могут быть получены либо из природы, либо синтезированы в лаборатории с использованием различных химических подходов с использованием металлических компонентов, полимеров , керамики или композитных материалов . Они часто используются и/или адаптируются для медицинского применения и, таким образом, представляют собой всю или часть живой структуры или биомедицинского устройства, которое выполняет, дополняет или заменяет естественную функцию. Такие функции могут быть относительно пассивными, например, для сердечного клапана , или, возможно, биологически активными с более интерактивными функциями, такими как гидроксиапатитом покрытые тазобедренные имплантаты, . Биоматериалы также широко используются в стоматологии, хирургии и доставке лекарств. Например, в организм можно поместить конструкцию с импрегнированными фармацевтическими продуктами, что обеспечивает пролонгированное высвобождение лекарственного средства в течение длительного периода времени. Биоматериал также может представлять собой аутотрансплантат , аллотрансплантат или ксенотрансплантат, используемый в качестве трансплантационного материала. [ нужна ссылка ]
Биоактивность [ править ]
Способность сконструированного биоматериала вызывать физиологическую реакцию, поддерживающую функцию и производительность биоматериала, известна как биоактивность. Чаще всего в биоактивных очках и биоактивной керамике этот термин относится к способности имплантируемых материалов хорошо связываться с окружающими тканями, выполняя либо остеопроводящую, либо остеопродуктивную роль. [4] Материалы для костных имплантатов часто предназначены для стимулирования роста костей при растворении в окружающей жидкости организма. [5] Таким образом, для многих биоматериалов желательна хорошая биосовместимость наряду с хорошей прочностью и скоростью растворения. Обычно о биоактивности биоматериалов судят по биоминерализации поверхности, при которой нативный слой гидроксиапатита на поверхности образуется . В наши дни разработка клинически полезных биоматериалов значительно ускоряется благодаря появлению вычислительных процедур, которые могут предсказывать молекулярные эффекты биоматериалов в терапевтических условиях на основе ограниченных экспериментов in vitro . [6]
Самостоятельная сборка [ править ]
Самосборка — наиболее распространенный термин, используемый в современном научном сообществе для описания самопроизвольной агрегации частиц (атомов, молекул, коллоидов , мицелл и т. д.) без влияния каких-либо внешних сил. Известно, что большие группы таких частиц собираются в термодинамически стабильные, структурно четко определенные массивы, весьма напоминающие одну из семи кристаллических систем, встречающихся в металлургии и минералогии (например, гранецентрированную кубическую, объемноцентрированную кубическую и т. д.). . Принципиальное отличие равновесной структуры заключается в пространственном масштабе элементарной ячейки (параметре решетки) в каждом конкретном случае.
Молекулярная самосборка широко встречается в биологических системах и обеспечивает основу широкого спектра сложных биологических структур. Сюда входит новый класс механически превосходных биоматериалов, основанных на микроструктурных особенностях и конструкциях, встречающихся в природе. Таким образом, самосборка также становится новой стратегией в химическом синтезе и нанотехнологиях . Молекулярные кристаллы, жидкие кристаллы, коллоиды, мицеллы, эмульсии , полимеры с фазовым разделением, тонкие пленки и самоорганизующиеся монослои — все это примеры типов высокоупорядоченных структур, которые получаются с помощью этих методов. Отличительной чертой этих методов является самоорганизация. [7] [8] [9]
иерархия Структурная
Почти все материалы можно рассматривать как иерархически структурированные, поскольку изменения в пространственном масштабе приводят к различным механизмам деформации и повреждения. [10] Однако в биологических материалах такая иерархическая организация присуща микроструктуре. Одним из первых примеров этого в истории структурной биологии являются ранние по рассеянию рентгеновских лучей по иерархической структуре волос и шерсти . работы Эстбери и Вудса [11] Например, в кости коллаген является строительным блоком органического матрикса — тройной спирали диаметром 1,5 нм. Эти тропоколлагена молекулы интеркалированы с минеральной фазой ( гидроксиапатитом , фосфатом кальция), образуя фибриллы , которые скручиваются в геликоиды чередующихся направлений. Эти « остеоны » являются основными строительными блоками костей, при этом объемное соотношение органической и минеральной фаз составляет примерно 60/40.
На другом уровне сложности кристаллы гидроксиапатита представляют собой минеральные пластинки диаметром примерно от 70 до 100 нм и толщиной 1 нм. Первоначально они зарождаются в промежутках между коллагеновыми фибриллами. [12]
Точно так же иерархия раковины морского ушка начинается на наноуровне, когда органический слой имеет толщину от 20 до 30 нм. Этот слой протекает с монокристаллами арагонита (полиморфной модификации СаСО 3 ), состоящими из «кирпичиков» размерами 0,5 и заканчивающимися слоями примерно 0,3 мм (мезоструктура). [13]
Крабы — это членистоногие, панцирь которых состоит из минерализованного твердого компонента (хрупколомкий) и более мягкого органического компонента, состоящего в основном из хитина . Хрупкий компонент расположен по спирали. Каждый из этих минеральных «стержней» (диаметром 1 мкм) содержит хитин-белковые фибриллы диаметром около 60 нм. Эти фибриллы состоят из каналов диаметром 3 нм, которые соединяют внутреннюю и внешнюю часть оболочки.
Приложения [ править ]
Биоматериалы используются в:
- Замена суставов
- Костные пластины [14]
- Интраокулярные линзы (ИОЛ) для глазной хирургии
- Костный цемент
- Искусственные связки и сухожилия
- Зубные имплантаты для фиксации зубов
- Протезы кровеносных сосудов
- Клапаны сердца
- Устройства для восстановления кожи (искусственные ткани)
- Кохлеарные заменители
- Контактные линзы
- Грудные имплантаты
- Механизмы доставки лекарств
- Экологичные материалы
- Сосудистые трансплантаты
- Стенты
- Нервные проводники
- Хирургические швы , зажимы и скобы для закрытия ран [15]
- Штифты и винты для стабилизации переломов [16]
- Хирургическая сетка [17] [18]
Биоматериалы должны быть совместимы с организмом, и часто возникают проблемы биосовместимости , которые необходимо решить, прежде чем продукт можно будет разместить на рынке и использовать в клинических условиях. По этой причине к биоматериалам обычно предъявляются те же требования, что и к новым лекарственным препаратам. [19] [20] Все компании-производители также обязаны обеспечивать отслеживание всей своей продукции, чтобы в случае обнаружения дефектного продукта можно было отследить другие продукты в той же партии.
Костные трансплантаты [ править ]
Сульфат кальция (его α- и β-полугидраты) — хорошо известный биосовместимый материал, широко используемый в качестве заменителя костного трансплантата в стоматологии или в качестве его связующего. [21] [22]
Клапаны сердца [ править ]
В США 49% из 250 000 процедур замены клапана, выполняемых ежегодно, связаны с установкой механического имплантата клапана. Наиболее широко используемый клапан — двустворчатый дисковый сердечный клапан или клапан Святого Иуды. Механика включает в себя два полукруглых диска, движущихся вперед и назад, оба из которых обеспечивают поток крови, а также способны образовывать уплотнение от обратного потока. Клапан покрыт пиролитическим углеродом и прикреплен к окружающим тканям сеткой из тканого материала под названием дакрон (торговое название полиэтилентерефталата компании Du Pont ). Сетка позволяет тканям тела расти, включая клапан. [23] [ нужна проверка ]
Восстановление кожи [ править ]
В большинстве случаев искусственная ткань выращивается из собственных клеток пациента. Однако, когда повреждение настолько велико, что невозможно использовать собственные клетки пациента, выращивают искусственные клетки ткани. Трудность состоит в том, чтобы найти каркас, на котором клетки смогут расти и организовываться. Характеристики каркаса должны заключаться в том, что он биосовместим, клетки могут прилипать к каркасу, механически прочен и биоразлагаем . Одним из успешных каркасов является сополимер молочной кислот и гликолевой . [23]
Свойства [ править ]
Как обсуждалось ранее, биоматериалы используются в медицинских устройствах для лечения, помощи или замены функций человеческого организма. Применение конкретного биоматериала должно сочетать необходимый состав, свойства материала, структуру и желаемую реакцию in vivo для выполнения желаемой функции. Определены категории различных желаемых свойств, чтобы максимизировать функциональные результаты. [24] [25]
Ответ хоста [ править ]
Реакция хозяина определяется как «реакция организма-хозяина (локальная и системная) на имплантированный материал или устройство». Большинство материалов вступают в реакцию при контакте с телом человека. Успех биоматериала зависит от реакции ткани хозяина на инородный материал. Специфические реакции между тканью хозяина и биоматериалом могут возникать благодаря биосовместимости материала. [25] [26]
и Взаимодействие биоматериала тканей
На функциональность in vivo и долговечность любого имплантируемого медицинского устройства влияет реакция организма на инородный материал. [27] Организм подвергается каскаду процессов, определенных в рамках реакции на инородное тело (FBR), чтобы защитить хозяина от инородного материала. Необходимо понимать взаимодействие между устройством и тканью/кровью хозяина, а также тканью/кровью хозяина и устройством, чтобы предотвратить осложнения и отказ устройства.
Повреждение тканей, вызванное имплантацией устройства, вызывает воспалительные и заживляющие реакции во время FBR. Воспалительная реакция возникает в течение двух периодов времени: острой фазы и хронической фазы. Острая фаза возникает в первые часы или дни имплантации и определяется по экссудации жидкости и белка. [28] наряду с нейтрофильной реакцией. [29] Во время острой фазы организм пытается очистить и залечить рану, доставляя к месту избыток крови, белков и моноцитов. [30] Продолжающееся воспаление приводит к хронической фазе, которую можно классифицировать по наличию моноцитов, макрофагов и лимфоцитов. [29] Кроме того, формируются кровеносные сосуды и соединительная ткань для заживления раненого участка. [31]
Совместимость [ править ]
Биосовместимость связана с поведением биоматериалов в различных средах при различных химических и физических условиях. Этот термин может относиться к конкретным свойствам материала без указания того, где и как этот материал будет использоваться. Например, материал может вызывать слабый иммунный ответ или вообще не вызывать его в данном организме и может или не может интегрироваться с определенным типом клеток или тканью . Иммуноинформированные биоматериалы, которые направляют иммунный ответ, а не пытаются обойти этот процесс, являются многообещающим подходом. [32] Неоднозначность этого термина отражает продолжающееся развитие понимания того, «как биоматериалы взаимодействуют с человеческим телом » и, в конечном итоге, «как эти взаимодействия определяют клинический успех медицинского устройства (например, кардиостимулятора или замены тазобедренного сустава )». Современные медицинские устройства и протезы часто изготавливаются из более чем одного материала, поэтому не всегда достаточно говорить о биосовместимости конкретного материала. [33] Хирургическая имплантация биоматериала в организм запускает воспалительную реакцию организма с последующим заживлением поврежденных тканей. В зависимости от состава имплантируемого материала, поверхности имплантата, механизма усталости и химического разложения возможны и другие реакции. Они могут быть как местными, так и системными. К ним относятся иммунный ответ, реакция на инородное тело с изоляцией имплантата сосудистой соединительной тканью, возможное инфицирование и влияние на срок службы имплантата. Реакция «трансплантат против хозяина» — ауто- и аллоиммунное заболевание, имеющее вариабельное клиническое течение. Оно может проявляться как в острой, так и в хронической форме, поражая множество органов и тканей и вызывая серьезные осложнения в клинической практике, как при трансплантации, так и при внедрении биосовместимых материалов. [34]
Токсичность [ править ]
Биоматериал должен выполнять предназначенную функцию в живом организме, не оказывая негативного влияния на другие ткани и органы организма. Чтобы предотвратить нежелательные взаимодействия органов и тканей, биоматериалы должны быть нетоксичными . Токсичность биоматериала относится к веществам, которые выделяются из биоматериала в условиях in vivo . Биоматериал не должен ничего выделять в окружающую среду, если он не предназначен для этого. Нетоксичность означает, что биоматериал является: неканцерогенным, апирогенным , неаллергенным , совместимым с кровью и невоспалительным . [35] Однако биоматериал можно спроектировать так, чтобы он был токсичен для определенной цели. Например, применение токсичного биоматериала изучается при in vivo и in vitro тестировании иммунотерапии рака . Токсичные биоматериалы открывают возможность манипулировать раковыми клетками и контролировать их. [36] В одном из недавних исследований говорится: «Передовые нанобиоматериалы, в том числе липосомы , полимеры и диоксид кремния , играют жизненно важную роль в совместной доставке лекарств и иммуномодуляторов . Эти системы доставки на основе нанобиоматериалов могут эффективно стимулировать противоопухолевые иммунные реакции и одновременно снижать токсические побочные эффекты». [37] Это яркий пример того, как можно изменить биосовместимость биоматериала для выполнения любой желаемой функции.
Биоразлагаемые биоматериалы [ править ]
Биоразлагаемые биоматериалы относятся к материалам, которые разлагаются в результате естественных ферментативных реакций . Применение биоразлагаемых синтетических полимеров началось в конце 1960-х годов. [38] Биоразлагаемые материалы имеют преимущество перед другими материалами, поскольку они имеют меньший риск вредного воздействия в долгосрочной перспективе. Помимо этических достижений в использовании биоразлагаемых материалов, они также улучшают биосовместимость материалов, используемых для имплантации. [38] Некоторые свойства, включая биосовместимость, важны при рассмотрении различных биоразлагаемых биоматериалов. Биоразлагаемые биоматериалы могут быть синтетическими или природными в зависимости от их источника и типа внеклеточного матрикса (ВКМ). [39]
Биосовместимые пластики [ править ]
Некоторые из наиболее часто используемых биосовместимых материалов (или биоматериалов) являются полимерами из-за присущей им гибкости и настраиваемых механических свойств . Медицинские устройства, изготовленные из пластмасс, часто изготавливаются из нескольких избранных материалов, включая сополимер циклического олефина (COC), поликарбонат (PC), полиэфиримид медицинского назначения (PEI), поливинилхлорид (PVC), полиэфирсульфон (PES), полиэтилен (PE), полиэфирэфиркетон ( PEEK) и даже полипропилен (ПП). Чтобы гарантировать биосовместимость , существует ряд регламентированных тестов, которые материал должен пройти, чтобы быть сертифицированным для использования. К ним относятся тест на биологическую реактивность Фармакопеи США IV (класс IV Фармакопеи США) и биологическая оценка медицинских изделий Международной организации по стандартизации 10993 (ISO 10993). Основной целью испытаний на биосовместимость является количественная оценка острой и хронической токсичности материала и определение любых потенциальных неблагоприятных последствий в условиях использования. Таким образом, испытания, необходимые для данного материала, зависят от его конечного использования (т. е. кровь, центральная нервная система и т. д.). .). [40]
Поверхностные и объемные свойства [ править ]
Двумя свойствами, которые оказывают большое влияние на функциональность биоматериала, являются поверхностные и объемные свойства . [41]
Объемные свойства относятся к физическим и химическим свойствам, которые составляют биоматериал на протяжении всего его срока службы. Их можно специально создавать, чтобы имитировать физико-химические свойства ткани, которую материал заменяет. Это механические свойства, которые возникают из атомной и молекулярной структуры материала.
Важные объемные свойства: [42]
- Химический состав
- Микроструктура
- Эластичность
- Предел прочности
- Плотность
- Твердость
- Электрическая проводимость
- Теплопроводность
Поверхностные свойства относятся к химическим и топографическим особенностям поверхности биоматериала, который будет напрямую взаимодействовать с кровью/тканями хозяина. [43] Поверхностная инженерия и модификация позволяют клиницистам лучше контролировать взаимодействие биоматериала с живой системой хозяина.
Важные свойства поверхности: [44]
- Смачиваемость (поверхностная энергия)
- Химия поверхности
- Текстура поверхности (гладкая/шероховатая)
- Топографические факторы, в том числе: размер, форма, расположение и структура, определяют шероховатость материала. [45]
- Поверхностное натяжение
- Поверхностный заряд
Механические свойства [ править ]
Помимо того, что материал сертифицирован как биосовместимый , биоматериалы должны быть специально разработаны для их целевого применения в медицинском устройстве . Это особенно важно с точки зрения механических свойств , которые определяют поведение данного биоматериала. Одним из наиболее важных параметров материала является модуль Юнга E материала , который описывает упругую реакцию на напряжения . Модули Юнга ткани и подключаемого к ней устройства должны точно совпадать для обеспечения оптимальной совместимости между устройством и телом, независимо от того, имплантировано ли устройство или установлено снаружи. Согласование модуля упругости позволяет ограничить движение и расслоение биоинтерфейса между имплантатом и тканью , а также избежать концентрации напряжений , которая может привести к механическому разрушению . Другими важными свойствами являются прочность на растяжение и сжатие , которые количественно определяют максимальные напряжения, которые материал может выдержать перед разрушением, и могут использоваться для установки предельных напряжений , которым устройство может подвергаться внутри или снаружи тела. В зависимости от применения может быть желательно, чтобы биоматериал имел высокую прочность, чтобы он был устойчив к разрушению при воздействии нагрузки, однако в других применениях может быть выгодно, чтобы материал имел низкую прочность. Существует тщательный баланс между прочностью и жесткостью, который определяет, насколько устойчиво к поломкам устройство из биоматериала. Обычно, как эластичность биоматериала увеличивается, предел прочности при растяжении снижается и наоборот. Одно из применений, где использование высокопрочного материала нежелательно, - это нейронные зонды ; Если в этих случаях используется высокопрочный материал, ткань всегда выйдет из строя раньше устройства (под приложенной нагрузкой ), поскольку модуль Юнга твердой мозговой оболочки и ткани головного мозга составляет порядка 500 Па . Когда это происходит, может произойти необратимое повреждение головного мозга, поэтому биоматериал должен иметь модуль упругости, меньший или равный модулю упругости ткани мозга, и низкую прочность на растяжение, если ожидается приложенная нагрузка. [46] [47]
Для имплантируемых биоматериалов, которые могут испытывать температуры колебания , например, зубных имплантатов , пластичность важна . Материал должен быть пластичным по той же причине, что предел прочности на разрыв не может быть слишком высоким, пластичность позволяет материалу сгибаться без разрушения , а также предотвращает концентрацию напряжений в тканях при изменении температуры. материала Прочность также важна для зубных имплантатов, а также для любого другого жесткого имплантата , несущего нагрузку, например, для замены тазобедренного сустава . Прочность описывает способность материала деформироваться под приложенным напряжением без разрушения , а высокая прочность позволяет имплантатам из биоматериала дольше служить в организме, особенно при воздействии больших напряжений или циклических напряжений , таких как напряжения, прикладываемые к тазобедренному суставу во время бега. [46]
Для медицинских устройств, которые имплантируются или прикрепляются к коже, еще одним важным свойством, требующим рассмотрения, является жесткость при изгибе D . Жесткость при изгибе будет определять, насколько хорошо поверхность устройства может поддерживать конформный контакт с поверхностью ткани , что особенно важно для устройств, измеряющих движение ткани ( деформацию ), электрические сигналы ( импеданс ) или предназначенных для прилипания к коже без расслаивания . как в эпидермальной электронике. Поскольку жесткость на изгиб зависит от толщины материала h в третьей степени ( h 3 ), очень важно, что биоматериал может быть сформирован в тонкие слои в ранее упомянутых приложениях, где конформность имеет первостепенное значение. [48]
Структура [ править ]
Молекулярный состав биоматериала определяет физические и химические свойства биоматериала. Эти композиции создают сложные структуры, которые позволяют биоматериалу функционировать, и поэтому их необходимо определить и понять для разработки биоматериала. биоматериалы могут быть созданы для репликации природных организмов — процесс, известный как биомиметика . [49] Структуру биоматериала можно наблюдать на разных уровнях, чтобы лучше понять свойства и функции материала.
Атомная структура [ править ]

Расположение атомов и ионов внутри материала является одним из наиболее важных структурных свойств биоматериала. Атомную структуру материала можно рассматривать на разных уровнях: субатомном , атомном или молекулярном уровне, а также ультраструктуру, созданную атомами и молекулами. Межмолекулярные силы между атомами и молекулами, из которых состоит материал, будут определять его материальные и химические свойства. [50]
На субатомном уровне наблюдается электрическая структура отдельного атома, чтобы определить его взаимодействие с другими атомами и молекулами. Молекулярная структура наблюдает за расположением атомов внутри материала. Наконец, ультраструктура наблюдает трехмерную структуру, созданную из атомных и молекулярных структур материала. Твердое состояние материала характеризуется внутримолекулярными связями между атомами и молекулами, составляющими материал. Типы внутримолекулярных связей включают: ионные связи , ковалентные связи и металлические связи . Эти связи будут определять физические и химические свойства материала, а также определять тип материала ( керамика , металл или полимер ).
Микроструктура [ править ]
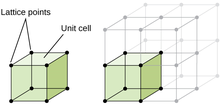
Микроструктура . материала относится к структуре объекта, организма или материала, наблюдаемой при увеличении, превышающем 25 раз [51] Он состоит из фаз различной формы, размера и распределения зерен, пор, осадков и т. д. Большинство твердых микроструктур являются кристаллическими , однако некоторые материалы, такие как определенные полимеры, не кристаллизуются в твердом состоянии. [52]
Кристаллическая структура [ править ]
Кристаллическая структура — это композиция ионов, атомов и молекул, которые удерживаются вместе и упорядочены в трехмерной форме. Основное различие между кристаллической структурой и аморфной структурой заключается в порядке компонентов. Кристаллический материал имеет максимально возможный уровень порядка в материале, где аморфная структура состоит из нарушений структуры упорядочения. [53] Одним из способов описания кристаллических структур является кристаллическая решетка , которая представляет собой трехмерное представление местоположения повторяющегося фактора ( элементарной ячейки ) в структуре, обозначаемой решетками . [54] Существует 14 различных конфигураций расположения атомов в кристаллической структуре, и все они представлены решетками Браве . [ нужна ссылка ]
Дефекты кристаллической структуры [ править ]
При формировании кристаллической структуры могут образовываться различные примеси, неровности и другие дефекты. Эти дефекты могут образоваться в результате деформации твердого тела, быстрого охлаждения или излучения высокой энергии. [55] К типам дефектов относятся точечные дефекты, линейные дефекты, а также краевая дислокация.
Макроструктура [ править ]
Макроструктура относится к общим геометрическим свойствам, которые будут влиять на силу разрушения, жесткость, изгиб, распределение напряжений и вес материала. Чтобы выявить макроструктуру материала, увеличение практически не требуется. Наблюдение за макроструктурой позволяет выявить такие свойства, как полости , пористость , пузырьки газа, расслоение и трещины . [56] Прочность материала и модуль упругости не зависят от макроструктуры.
Природные биоматериалы [ править ]
Биоматериалы могут быть созданы с использованием только материалов, полученных из растений и животных, с целью изменения, замены или восстановления тканей/органов человека. Использование природных биоматериалов применялось еще в Древнем Египте, где коренные жители использовали кожу животных в качестве швов. Более современный пример — замена тазобедренного сустава с использованием материала из слоновой кости, впервые зарегистрированная в Германии в 1891 году. [57]
Ценные критерии жизнеспособных природных биоматериалов:
- Биоразлагаемый
- Биосовместимость
- Способствует прикреплению и росту клеток.
- Нетоксичный
Примеры природных биоматериалов:
Биополимеры [ править ]
Биополимеры – это полимеры, производимые живыми организмами. Целлюлоза и крахмал , белки и пептиды , ДНК и РНК — все это примеры биополимеров, в которых мономерными единицами являются соответственно сахара , аминокислоты и нуклеотиды . [60] Целлюлоза является одновременно самым распространенным биополимером и самым распространенным органическим соединением на Земле. Около 33% всего растительного вещества составляет целлюлоза. [61] [62] Аналогичным образом, шелк (белковый биополимер) вызвал огромный исследовательский интерес во множестве областей, включая тканевую инженерию и регенеративную медицину, микрофлюидику, доставку лекарств. [63] [64]
См. также [ править ]
- Бионика
- Гидрогель
- Полимерная поверхность
- Модификация поверхности биоматериалов белками
- Синтетический биоразлагаемый полимер
- Список биоматериалов
Сноски [ править ]
- ^ Понятие эксплуатации включает в себя полезность для приложений и фундаментальных исследований, чтобы также понять взаимные возмущения. [2]
- ^ Определение «нежизнеспособный материал, используемый в медицинском устройстве, предназначенном для взаимодействия с биологическими системами», рекомендованное в ссылке. [3] не может быть распространено на экологическую область, где люди имеют в виду «материал природного происхождения». [2]
- ^ Этот общий термин не следует путать с терминами биополимер или биомакромолекула . Использование «полимерного биоматериала» рекомендуется, когда речь идет о полимере или полимерном устройстве, представляющем терапевтический или биологический интерес. [2]
Ссылки [ править ]
- ^ Шмальц, Г.; Аренхольдт-Биндслев, Д. (2008). «Глава 1: Основные аспекты» . Биосовместимость стоматологических материалов . Берлин: Springer-Verlag. стр. 1–12. ISBN 9783540777823 . Архивировано из оригинала 9 декабря 2017 года . Проверено 29 февраля 2016 г.
- ^ Jump up to: Перейти обратно: а б с д Верт, М.; Дой, Ю.; Хеллвич, КХ; Хесс, М.; Ходж, П.; Кубиса, П.; Ринаудо, М.; Шуэ, ФО (2012). «Терминология биородственных полимеров и их применение (Рекомендации ИЮПАК 2012 г.)» . Чистая и прикладная химия . 84 (2): 377. doi : 10.1351/PAC-REC-10-12-04 . S2CID 98107080 .
- ^ Уильямс, Д.Ф., изд. (2004). Определения в биоматериалах, материалы согласительной конференции Европейского общества биоматериалов . Амстердам: Эльзевир.
- ^ Цао, Ванпэн; Хенч, Ларри (1996). «Биоактивные материалы». Керамика Интернешнл . 22 (6): 493–507. дои : 10.1016/0272-8842(95)00126-3 .
- ^ Чжу, Х.; и др. (2018). «Наноструктурное понимание поведения растворения гидроксиапатита, легированного Sr». Журнал Европейского керамического общества . 38 (16): 5554–5562. arXiv : 1910.10610 . doi : 10.1016/j.jeurceramsoc.2018.07.056 . S2CID 105932012 .
- ^ Феррейра, Марсель; Милано, Ренато; Ранхель, Элидиано; Пеппеленбош, Майкель; Замбуцци, Виллиан (2020). «OsteoBLAST: вычислительная процедура глобального молекулярного анализа применительно к разработке биоматериалов» . Границы биоинженерии и биотехнологии . 8 : 565901. doi : 10.3389/fbioe.2020.565901 . ПМЦ 7578266 . ПМИД 33117780 .
- ^ Уайтсайдс, Г.; Матиас, Дж.; Сето, К. (1991). «Молекулярная самосборка и нанохимия: химическая стратегия синтеза наноструктур». Наука . 254 (5036): 1312–9. Бибкод : 1991Sci...254.1312W . дои : 10.1126/science.1962191 . ПМИД 1962191 .
- ^ Даббс, DM; Аксай, ИА (2000). «Самособранная керамика, изготовленная по шаблону сложной жидкости». Ежегодный обзор физической химии . 51 : 601–22. Бибкод : 2000ARPC...51..601D . doi : 10.1146/annurev.physchem.51.1.601 . ПМИД 11031294 .
- ^ Арига, К.; Хилл, JP; Ли, М.В.; Вину, А.; Шарве, Р.; Ачарья, С. (2008). «Проблемы и прорывы в последних исследованиях самосборки» . Наука и технология перспективных материалов . 9 (1): 014109. Бибкод : 2008STAdM...9a4109A . дои : 10.1088/1468-6996/9/1/014109 . ПМК 5099804 . ПМИД 27877935 .
- ^ Непал, Дхрити; Кан, Сэвон; Адстедт, Катарина М.; Канхайя, Кришан; Боксталлер, Майкл Р.; Бринсон, Л. Кэтрин; Бюлер, Маркус Дж.; Ковени, Питер В.; Даял, Кошик; Эль-Авади, Джаафар А.; Хендерсон, Люк К.; Каплан, Дэвид Л .; Кетен, Синан; Котов, Николай А.; Шац, Джордж К. (28 ноября 2022 г.). «Иерархически структурированные биоинспирированные нанокомпозиты» (PDF) . Природные материалы . 22 (1): 18–35. дои : 10.1038/s41563-022-01384-1 . ISSN 1476-1122 . ПМИД 36446962 . S2CID 254094123 .
- ^ Страуд, Р.М. (2006). « Присутствующие во время потопа: как возникла структурная биология », Ричард Э. Дикерсон . Белковая наука . 16 (1): 135–136. дои : 10.1110/ps.062627807 . ПМК 2222831 .
- ^ Мейерс, Марк А. (31 июля 2014 г.). Биологическое материаловедение: биологические материалы, биоинспирированные материалы и биоматериалы . Чен, По-Ю. Нью-Йорк. ISBN 978-1-107-01045-1 . OCLC 869269337 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Пал, Субрата (31 августа 2013 г.). Проектирование искусственных суставов и органов человека . Springer Science & Business Media. ISBN 978-1-4614-6255-2 .
- ^ Ибрагим, Х.; Исфахани, С.Н.; Пуорганджи, Б.; Дин, Д.; Элахиния, М. (январь 2017 г.). «Резорбируемые сплавы для фиксации кости, формование и обработка после изготовления» . Материаловедение и инженерия: C . 70 (1): 870–888. дои : 10.1016/j.msec.2016.09.069 . ПМИД 27770965 .
- ^ Пиллаи, ЦКС; Шарма, КП (2010). «Обзорный доклад: Рассасывающиеся полимерные хирургические шовные материалы: химия, производство, свойства, биоразлагаемость и характеристики». Журнал применения биоматериалов . 25 (4): 291–366. CiteSeerX 10.1.1.1013.5873 . дои : 10.1177/0885328210384890 . ПМИД 20971780 . S2CID 20278355 .
- ^ Варис, Э; Ашаммахи, Н; Каарела, О; Раатикайнен, Т; Васениус, Дж. (декабрь 2004 г.). «Применение биорассасывающихся устройств остеофиксации в руке». Журнал хирургии рук (Эдинбург, Шотландия) . 29 (6): 590–8. дои : 10.1016/j.jhsb.2004.02.005 . ПМИД 15542222 . S2CID 24385943 .
- ^ Деасис, Ф.Дж.; Лапин, Б; Гителис, МЭ; Удзики, МБ (2015). «Текущее состояние лапароскопической пластики парастомальной грыжи: метаанализ» . Всемирный журнал гастроэнтерологии . 21 (28): 8670–7. дои : 10.3748/wjg.v21.i28.8670 . ПМЦ 4524825 . ПМИД 26229409 .
- ^ Бэньярд, Д.А.; Буржуа, Ж.М.; Видджероу, AD; Эванс, GR (2015). «Регенеративные биоматериалы: обзор». Пластическая и реконструктивная хирургия . 135 (6): 1740–8. дои : 10.1097/PRS.0000000000001272 . ПМИД 26017603 . S2CID 33728690 .
- ^ Мейерс, Массачусетс; Чен, П.Ю.; Лин, AYM; Секи, Ю. (2008). «Биологические материалы: Структура и механические свойства». Прогресс в материаловедении . 53 : 1–206. CiteSeerX 10.1.1.466.3753 . дои : 10.1016/j.pmatsci.2007.05.002 .
- ^ Эспиноза, HD; Рим, Дж. Э.; Бартела, Ф.; Бюлер, MJ (2009). «Слияние структуры и материала в перламутре и кости - Перспективы биомиметических материалов de novo». Прогресс в материаловедении . 54 (8): 1059–1100. дои : 10.1016/j.pmatsci.2009.05.001 .
- ^ Чжао, Русин; Ян, Жуйцзя; Купер, Пол Р.; Хуршид, Зохаиб; Шаванди, Амин; Ратнаяке, Джитендра (18 мая 2021 г.). «Костные трансплантаты и заменители в стоматологии: обзор современных тенденций и разработок» . Молекулы . 26 (10): 3007. doi : 10.3390/molecules26103007 . ISSN 1420-3049 . ПМЦ 8158510 . ПМИД 34070157 .
- ^ Томас, Марк В.; Пулео, Дэвид А.; Аль-Саббах, Моханад (2005). «Сульфат кальция: обзор» . Журнал долгосрочных эффектов медицинских имплантатов . 15 (6): 599–607. doi : 10.1615/jlongtermeffmedimplants.v15.i6.30 . ISSN 1050-6934 . ПМИД 16393128 .
- ^ Jump up to: Перейти обратно: а б Браун, Теодор Л.; ЛеМэй, Х. Юджин; Берстен, Брюс Э. (2000). Химия Центральная наука . Prentice-Hall, Inc., стр. 451–452 . ISBN 978-0-13-084090-5 .
- ^ «Глава 4: Биоматериалы: Основные принципы». Введение в науку о биоматериалах и инженерию . МИРОВАЯ НАУЧНАЯ. Май 2021 г. стр. 82–93. дои : 10.1142/9789811228186_0004 . ISBN 978-981-12-2817-9 . S2CID 240851982 .
- ^ Jump up to: Перейти обратно: а б Бадилак, Стивен Ф. (08 мая 2015 г.). Реакция хозяина на биоматериалы: влияние реакции хозяина на выбор биоматериала . Академическая пресса. ISBN 978-0-12-800500-2 .
- ^ Уильямс, Дэвид Ф. (1 июля 2008 г.). «О механизмах биосовместимости». Биоматериалы . 29 (20): 2941–2953. doi : 10.1016/j.bimaterials.2008.04.023 . ISSN 0142-9612 . ПМИД 18440630 .
- ^ Мораис, Жаклин (2010). «Взаимодействие биоматериалов и тканей: возможные решения для преодоления реакции инородного тела» . Журнал AAPS . 12 (2): 188–196. дои : 10.1208/s12248-010-9175-3 . ПМЦ 2844517 . ПМИД 20143194 .
- ^ «Экссудат: Медицинская энциклопедия MedlinePlus» . Национальная медицинская библиотека США . Проверено 11 июля 2023 г.
- ^ Jump up to: Перейти обратно: а б Рн, Митчелл (2003). «Острое и хроническое воспаление» . Основная патология Роббинса .
- ^ Джонстон, РБ (24 марта 1988 г.). «Современные понятия: иммунология. Моноциты и макрофаги» . Медицинский журнал Новой Англии . 318 (12): 747–752. дои : 10.1056/NEJM198803243181205 . ISSN 0028-4793 . ПМИД 3279314 .
- ^ Ковач, Э.Дж. (январь 1991 г.). «Фиброгенные цитокины: роль иммунных медиаторов в развитии рубцовой ткани» . Иммунология сегодня . 12 (1): 17–23. дои : 10.1016/0167-5699(91)90107-5 . ISSN 0167-5699 . ПМИД 2015044 .
- ^ Шридхаран, Рукмани; Кавана, Брентон; Кэмерон, Эндрю Р.; Келли, Дэниел Дж.; О'Брайен, Фергал Дж. (февраль 2019 г.). «Жесткость материала влияет на состояние поляризации, функцию и способ миграции макрофагов». Акта Биоматериалы . 89 : 47–59. doi : 10.1016/j.actbio.2019.02.048 . ПМИД 30826478 . S2CID 73489194 .
- ^ Каммула, Раджу Г.; Моррис, Джанин М. (1 мая 2001 г.). «Аспекты оценки биосовместимости медицинских изделий» . Промышленность медицинского оборудования и диагностики .
- ^ Велнар, Томаз; Бунк, Горазд; Клобукар, Роберт; Градисник, Лидия (2016). «Биоматериалы и реакция хозяина против трансплантата: краткий обзор» . Боснийский журнал фундаментальных медицинских наук . 16 (2): 82–90. дои : 10.17305/bjbms.2016.525 . ISSN 1840-4812 . ПМК 4853000 . ПМИД 26894284 .
- ^ Томас, Сабу; Гроэнс, Ив; Нинан, Ниту (8 января 2015 г.). Применение нанотехнологий в тканевой инженерии . Эльзевир Наука. ISBN 9780323328890 . Проверено 6 мая 2022 г.
- ^ Гу, Ло; Муни, Дэвид Дж. (январь 2016 г.). «Биоматериалы и новые противораковые препараты: разработка микросреды» . Обзоры природы. Рак . 16 (1): 56–66. дои : 10.1038/nrc.2015.3 . ISSN 1474-1768 . ПМЦ 4790726 . ПМИД 26694936 .
- ^ Ян, Фань; Ши, Кун; Цзя, Янь-пэн; Хао, Ин; Пэн, Цзинь-жун; Цянь, Чжи Юн (июль 2020 г.). «Передовые биоматериалы для иммунотерапии рака» . Акта Фармакологика Синика . 41 (7): 911–927. дои : 10.1038/s41401-020-0372-z . ISSN 1745-7254 . ПМЦ 7468530 . ПМИД 32123302 .
- ^ Jump up to: Перейти обратно: а б Сонг, Ричард; Мерфи, Максвелл; Ли, Чэньшуан; Тинг, Канг; Су, Чиа; Чжэн, Чжун (24 сентября 2018 г.). «Современная разработка биоразлагаемых полимерных материалов для биомедицинского применения» . Дизайн, разработка и терапия лекарств . 12 : 3117–3145. дои : 10.2147/DDDT.S165440 . ISSN 1177-8881 . ПМК 6161720 . ПМИД 30288019 .
- ^ Сонг, Ричард; Мерфи, Максвелл; Ли, Чэньшуан; Тинг, Канг; Су, Чиа; Чжэн, Чжун (24 сентября 2018 г.). «Современная разработка биоразлагаемых полимерных материалов для биомедицинского применения» . Дизайн, разработка и терапия лекарств . 12 : 3117–3145. дои : 10.2147/DDDT.S165440 . ISSN 1177-8881 . ПМК 6161720 . ПМИД 30288019 .
- ^ Гад, Шейн Кокс; Гад-Макдональд, Саманта (01 декабря 2015 г.). Биоматериалы, медицинские изделия и комбинированные продукты: тестирование биосовместимости и оценка безопасности . ЦРК Пресс. ISBN 978-1-4822-4838-8 .
- ^ «Что такое поверхность, почему важен анализ поверхности» . www.kratos.com . Проверено 6 мая 2022 г.
- ^ Чжан, Гюйген; Вайни, Кристофер (01 января 2020 г.). «1.2.3 – Объемные свойства материалов» . В Вагнере, Уильям Р.; Сакияма-Элберт, Шелли Э.; Чжан, Гюйген; Яшемски, Майкл Дж. (ред.). Биоматериаловедение (Четвертое изд.). Академическая пресса. стр. 41–51. ISBN 978-0-12-816137-1 . Проверено 26 июля 2022 г.
- ^ Роуч, Пол; Эглин, Дэвид; Роде, Кирсти; Перри, Кэрол С. (2007). «Современные биоматериалы: обзор — объемные свойства и последствия модификаций поверхности» . Журнал материаловедения: Материалы в медицине . 18 (7): 1263–1277. дои : 10.1007/s10856-006-0064-3 . ПМИД 17443395 . S2CID 46254118 .
- ^ Фоглер, Эрвин А. (2013). «Глава 8 - Модификация поверхности для биосовместимости». В Лахтакии Ахлеш; Мартин-Пальма, Рауль Х. (ред.). Инженерная биомимикрия . Бостон: Эльзевир. стр. 189–220. ISBN 978-0-12-415995-2 .
- ^ «Как шероховатость поверхности и смачиваемость влияют на биосовместимость» . www.biolinscientific.com . Проверено 6 мая 2022 г.
- ^ Jump up to: Перейти обратно: а б Сайни, Моника; Сингх, Яшпал; Арора, Пуджа; Арора, Випин; Джайн, Крати (январь 2015 г.). «Имплантационные биоматериалы: комплексный обзор» . Всемирный журнал клинических случаев . 3 (1): 52–7. дои : 10.12998/wjcc.v3.i1.52 . ISSN 2307-8960 . ПМЦ 4295219 . ПМИД 25610850 .
- ^ Лакур, Стефани П.; Куртин, Грегуар; Гук, Йохен (2016). «Материалы и технологии для мягких имплантируемых нейропротезов» (PDF) . Материалы обзоров природы . 1 (10): 16063. Бибкод : 2016NatRM...116063L . дои : 10.1038/natrevmats.2016.63 . ISSN 2058-8437 . S2CID 10104005 .
- ^ Чой, Суджи; Ли, Хёндже; Гаффари, Рузбе; Хён, Тэгван; Ким, Дэ Хён (июнь 2016 г.). «Последние достижения в области гибких и растягивающихся биоэлектронных устройств, интегрированных с наноматериалами». Продвинутые материалы . 28 (22): 4203–4218. Бибкод : 2016AdM....28.4203C . дои : 10.1002/adma.201504150 . ISSN 0935-9648 . ПМИД 26779680 . S2CID 205264592 .
- ^ Кун, Лиза Т. (1 января 2005 г.). «Глава 6 – БИОМАТЕРИАЛЫ». В Эндерле, Джон Д.; Бланшар, Сьюзен М.; Бронзино, Джозеф Д. (ред.). Введение в биомедицинскую инженерию (2-е изд.). Бостон: Академическая пресса. стр. 255–312. ISBN 978-0-12-238662-6 .
- ^ Партлоу, Уильям (13 марта 2022 г.). «1 – Биоматериалы» . За пределами открытия . Проверено 6 мая 2022 г.
- ^ «Микроструктура» . Информационный справочник CES — Материаловедение . depts.washington.edu . Проверено 6 мая 2022 г.
- ^ Мерсье, Жан-Пьер; Замбелли, Жеральд; Курц, Вильфрид (2002). Введение в материаловедение . Эльзевир. ISBN 9782842992866 . Проверено 6 мая 2022 г.
- ^ «Кристаллическая структура: определение, структура и связь» . Study.com . Проверено 6 мая 2022 г.
- ^ «10.6 Решетчатые структуры в кристаллических твердых телах. Химия» . opentextbc.ca . Проверено 6 мая 2022 г.
- ^ «Дефект кристалла | Определение, типы и факты | Британника» . www.britanica.com . Проверено 6 мая 2022 г.
- ^ «Макроструктура» . TheFreeDictionary.com . Проверено 6 мая 2022 г.
- ^ «Природные биоматериалы Изабель Хэнд — OpenWetWare» . openwetware.org . Проверено 6 мая 2022 г.
- ^ «Келп (Laminaria digitata) – ирландские водоросли» . Проверено 6 мая 2022 г.
- ^ Рейс, Льюис А; Чиу, Лорейн Л.И.; Ферик, Николь; Фу, Лара; Радишич, Милица (январь 2016 г.). «Биоматериалы в тканевой инженерии миокарда» . Журнал тканевой инженерии и регенеративной медицины . 10 (1): 11–28. дои : 10.1002/сем.1944 . ISSN 1932-7005 . ПМЦ 4933503 . ПМИД 25066525 .
- ^ Бюлер, MJ; Юнг, ЮК (2009). «Деформация и разрушение белковых материалов в физиологически экстремальных условиях и заболеваниях». Природные материалы . 8 (3): 175–88. Бибкод : 2009NatMa...8..175B . дои : 10.1038/nmat2387 . ПМИД 19229265 .
- ^ Ступп, С.И.; Браун, П.В. (1997). «Молекулярные манипуляции с микроструктурами: биоматериалы, керамика и полупроводники». Наука . 277 (5330): 1242–8. дои : 10.1126/science.277.5330.1242 . ПМИД 9271562 .
- ^ Клемм, Д; Хойблен, Б; Финк, HP; Бон, А (2005). «Целлюлоза: потрясающий биополимер и экологически чистое сырье». Angewandte Chemie, международное издание . 44 (22): 3358–93. дои : 10.1002/anie.200460587 . ПМИД 15861454 .
- ^ Конвар, Роктотпал (2019). «Может ли почитаемый шелк стать нанобиоматериалом нового поколения для проектирования биомедицинских устройств, регенеративной медицины и доставки лекарств? Перспективы и заминки». Биодизайн и производство . 2 (4): 278–286. дои : 10.1007/s42242-019-00052-9 . S2CID 208833880 .
- ^ Мехротра, Шрейя (2019). «Комплексный обзор шелка в наномасштабе для регенеративной медицины и смежных применений». АКС Биоматер. наук. англ . 5 (5): 2054–2078. doi : 10.1021/acsbimaterials.8b01560 . ПМИД 33405710 . S2CID 132470283 .