Осмотическое давление
этой статьи В первом разделе содержится информация, которая не включена в другие разделы статьи . ( декабрь 2022 г. ) |
Эта статья нуждается в дополнительных цитатах для проверки . ( декабрь 2022 г. ) |

Осмотическое давление — это минимальное давление , которое необходимо приложить к раствору , чтобы предотвратить поток его чистого растворителя через полупроницаемую мембрану . [1] Его также определяют как меру склонности раствора поглощать чистый растворитель путем осмоса . Потенциальное осмотическое давление — это максимальное осмотическое давление, которое могло бы возникнуть в растворе, если бы он был отделен от чистого растворителя полупроницаемой мембраной.
Осмос возникает, когда два раствора, содержащие разные концентрации растворенного вещества, разделяются избирательно проницаемой мембраной. Молекулы растворителя преимущественно проходят через мембрану из раствора с низкой концентрацией в раствор с более высокой концентрацией растворенного вещества. Перенос молекул растворителя будет продолжаться до тех пор, пока не будет достигнуто равновесие. [1] [2]
Теория и измерения [ править ]

Якобус ван 'т Хофф обнаружил количественную связь между осмотическим давлением и концентрацией растворенного вещества, выраженную следующим уравнением:
где — осмотическое давление, i — безразмерный индекс Вант-Гоффа , c — молярная концентрация растворенного вещества, R — постоянная идеального газа , а T — абсолютная температура (обычно в кельвинах ). Эта формула применяется, когда концентрация растворенного вещества достаточно мала, чтобы раствор можно было рассматривать как идеальный раствор . Пропорциональность концентрации означает, что осмотическое давление является коллигативным свойством . Обратите внимание на сходство этой формулы с законом идеального газа в виде где n — общее число молей молекул газа в объёме V , а n / V — молярная концентрация молекул газа. Хармон Нортроп Морс и Фрейзер показали, что уравнение применимо к более концентрированным растворам, если единицей концентрации является моль, а не моль ; [3] поэтому, когда используется моляльность, это уравнение называется уравнением Морса .
Для более концентрированных растворов уравнение Ван 'т-Гоффа можно расширить до степенного ряда по концентрации растворенного вещества c . В первом приближении
где — идеальное давление, а A — эмпирический параметр. Значение параметра A (и параметров из приближений более высокого порядка) можно использовать для расчета параметров Питцера . Эмпирические параметры используются для количественной оценки поведения растворов ионных и неионных растворов, которые не являются идеальными растворами в термодинамическом смысле.
Ячейка Пфеффера была разработана для измерения осмотического давления.
Приложения [ править ]
Измерение осмотического давления можно использовать для определения молекулярной массы .
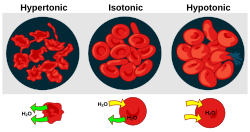
Осмотическое давление является важным фактором, влияющим на биологические клетки. [4] Осморегуляция — это механизм гомеостаза организма, позволяющий достичь баланса осмотического давления.
- Гипертонус – это наличие раствора, вызывающего сокращение клеток.
- Гипотоничность – это наличие раствора, вызывающего набухание клеток.
- Изотоничность – это наличие раствора, который не вызывает изменения объема клеток.
Когда биологическая клетка находится в гипотонической среде, внутри клетки накапливается вода, вода течет через клеточную мембрану в клетку, вызывая ее расширение. В растительных клетках клеточная стенка ограничивает расширение, что приводит к давлению на клеточную стенку изнутри, называемому тургорным давлением . Тургорное давление позволяет травянистым растениям стоять прямо. Это также определяющий фактор того, как растения регулируют апертуру своих устьиц . В клетках животных избыточное осмотическое давление может привести к цитолизу .
Осмотическое давление лежит в основе фильтрации (« обратного осмоса »), процесса, обычно используемого при очистке воды . Очищаемую воду помещают в камеру и подвергают давлению, превышающему осмотическое давление, оказываемое водой и растворенными в ней растворенными веществами. Часть камеры открывается на мембрану с дифференциальной проницаемостью, которая пропускает молекулы воды, но не частицы растворенного вещества. Осмотическое давление океанской воды составляет примерно 27 атм . Обратный осмос опресняет пресную воду из соленой океанской воды .
Вывод формулы Ван'т-Гоффа [ править ]
Рассмотрим систему в момент, когда она достигла равновесия. Условием этого является то, что потенциал растворителя химический (поскольку только он может свободно течь к равновесию) по обе стороны мембраны равен. Отсек, содержащий чистый растворитель, имеет химический потенциал , где это давление. С другой стороны, в отсеке, содержащем растворенное вещество, химический потенциал растворителя зависит от мольной доли растворителя: . Кроме того, этот отсек может принимать разное давление, . Поэтому мы можем записать химический потенциал растворителя как . Если мы напишем Следовательно, баланс химического потенциала равен:
Здесь разница в давлении двух отсеков определяется как осмотическое давление, оказываемое растворенными веществами. Удерживая давление, добавление растворенного вещества снижает химический потенциал ( энтропийный эффект ). Таким образом, давление раствора приходится увеличивать, чтобы компенсировать потерю химического потенциала.
Чтобы найти , осмотическое давление, мы рассматриваем равновесие между раствором, содержащим растворенное вещество, и чистой водой.
Мы можем записать левую часть так:
- ,
где – коэффициент активности растворителя. Продукт также известна как активность растворителя, которая для воды представляет собой активность воды. . Добавка к давлению выражается через выражение для энергии расширения:
где – молярный объем (м³/моль). Подставив представленное выше выражение в уравнение химического потенциала всей системы и переставив его, получим:
Если жидкость несжимаема, то ее молярный объем постоянен. , и интеграл становится . Таким образом, мы получаем
Коэффициент активности является функцией концентрации и температуры, но в случае разбавленных смесей он часто очень близок к 1,0, поэтому
Мольная доля растворенного вещества, , является , так можно заменить на , который, когда мала, ее можно аппроксимировать выражением .
Мольная доля является . Когда мала, ее можно аппроксимировать выражением . Кроме того, молярный объем может быть записан как объем на моль, . Их объединение дает следующее.
Для водных растворов солей необходимо учитывать ионизацию. Например, 1 моль NaCl ионизируется до 2 молей ионов.
См. также [ править ]
Ссылки [ править ]
- ^ Jump up to: Перейти обратно: а б Воет Д., Адил Дж., Пратт К.В. (2001). Основы биохимии (Переизданная ред.). Нью-Йорк: Уайли. п. 30. ISBN 978-0-471-41759-0 .
- ^ Аткинс П.В., де Паула Дж (2010). «Раздел 5.5 (е)». Физическая химия (9-е изд.). Издательство Оксфордского университета . ISBN 978-0-19-954337-3 .
- ^ Льюис Г.Н. (1 мая 1908 г.). «Осмотическое давление концентрированных растворов и законы идеального раствора» . Журнал Американского химического общества . 30 (5): 668–683. дои : 10.1021/ja01947a002 . ISSN 0002-7863 . Архивировано из оригинала 18 июня 2022 г. Проверено 4 июля 2019 г.
- ^ Эстеки М.Х., Маландрино А., Алемраджаби А.А., Шеридан Г.К., Чаррас Г., Моеендарбари Э. (декабрь 2021 г.). «Пороэластическая осморегуляция объема живых клеток» . iScience . 24 (12): 103482. Бибкод : 2021iSci...24j3482E . дои : 10.1016/j.isci.2021.103482 . ПМЦ 8649806 . ПМИД 34927026 .


































