Поликапролактон
 | |
| Имена | |
|---|---|
| Название ИЮПАК (1,7)-Полиоксепан-2-он | |
| Систематическое название ИЮПАК Поли(гексано-6-лактон) | |
| Другие имена Гомополимер 2-оксепанона Полимер 6-капролактона | |
| Идентификаторы | |
| Сокращения | ПКЛ |
| ХимическийПаук |
|
| Характеристики | |
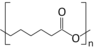
| ( C 6 H 10 O 2 ) н | |
| Плотность | 1,145 г/см 3 |
| Температура плавления | 60 ° С (140 ° F) |
| Теплопроводность | 0,05 Вт/(м·К) при 25°C [1] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |

Поликапролактон ( PCL ) представляет собой синтетический полукристаллический биоразлагаемый полиэфир с температурой плавления около 60 °C и температурой стеклования около -60 °C. [2] [3] Поликапролактон чаще всего используется в производстве специальных полиуретанов . Поликапролактоны придают получаемому полиуретану хорошую устойчивость к воде, маслу, растворителям и хлору .
Этот полимер часто используется в качестве добавки к смолам для улучшения их технологических характеристик и свойств конечного использования (например, ударопрочности ). Будучи совместимым с рядом других материалов, PCL можно смешивать с крахмалом , чтобы снизить его стоимость и повысить биоразлагаемость , или его можно добавлять в качестве полимерного пластификатора к поливинилхлориду (ПВХ).
Поликапролактон также используется для наложения шин, моделирования и в качестве сырья для систем прототипирования, таких как для изготовления плавленых нитей 3D-принтеры .
Синтез
[ редактировать ]PCL получают полимеризацией с раскрытием кольца с ε-капролактона использованием такого катализатора , как октоат олова . Для полимеризации капролактона с раскрытием кольца можно использовать широкий спектр катализаторов. [4]

Биомедицинские приложения
[ редактировать ]PCL разлагается за счет гидролиза его сложноэфирных связей в физиологических условиях (например, в организме человека), поэтому ему уделяется большое внимание при использовании в качестве имплантируемого биоматериала . В частности, он особенно интересен для изготовления имплантируемых устройств длительного действия, поскольку его деградация происходит даже медленнее, чем у полилактида .
PCL широко используется в имплантатах длительного действия и в приложениях с контролируемым высвобождением лекарств. Однако когда дело доходит до тканевой инженерии, PCL имеет некоторые недостатки, такие как медленная скорость деградации, плохие механические свойства и низкая адгезия клеток. Включение керамики на основе фосфата кальция и биоактивных стекол в PCL позволило создать класс гибридных биоматериалов с значительно улучшенными механическими свойствами, контролируемой скоростью деградации и повышенной биологической активностью, которые подходят для инженерии костной ткани. [5]
PCL был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для конкретных применений, используемых в организме человека в качестве (например) устройства для доставки лекарств , шовного материала или адгезионного барьера . [6] PCL используется в быстро развивающейся области эстетики человека после недавнего появления микросферического дермального наполнителя на основе PCL, относящегося к классу стимуляторов коллагена (Ellansé). [7]
Благодаря стимуляции выработки коллагена продукты на основе PCL способны корректировать признаки старения лица, такие как потеря объема и дряблость контуров, обеспечивая немедленный и длительный естественный эффект. [7] [8] Он исследуется в качестве основы для восстановления тканей с помощью тканевой инженерии , мембраны GBR . Он использовался в качестве гидрофобного блока амфифильных синтетических блок -сополимеров, используемых для формирования везикулярной мембраны полимерсом .
В шарики PCL были инкапсулированы различные лекарства для контролируемого высвобождения и адресной доставки лекарств . [9]
В стоматологии (как композит под названием Резилон) его используют в качестве компонента «ночных стражей» (зубных капп) и при пломбировании корневых каналов . Он действует как гуттаперча , имеет аналогичные свойства обработки и для целей повторной обработки может быть размягчен при нагревании или растворен растворителями, такими как хлороформ. Как и в случае с гуттаперчей, существуют основные конусы всех размеров ISO, а также дополнительные конусы разных размеров и конусов. Основное различие между материалом для пломбирования корневых каналов на основе поликапролактона (Resilon и Real Seal) и гуттаперчей заключается в том, что материал на основе PCL является биоразлагаемым. [10] тогда как гуттаперча - нет. В экспертном стоматологическом сообществе нет единого мнения относительно того, желателен ли биоразлагаемый материал для пломбирования корневых каналов, такой как Resilon или Real Seal.
Любитель и прототипирование
[ редактировать ]
PCL также имеет множество применений на рынке любителей, где он известен как Re-Form, Polydoh, Plastimake, NiftyFix, Proto Plastic, InstaMorph, Polymorph, Shapelock, ReMoldables, Plastdude, TechTack или Friendly Plastic. Он обладает физическими свойствами очень прочного, похожего на нейлон пластика, который размягчается до консистенции, напоминающей замазку, всего при 60 °C, что легко достигается путем погружения в горячую воду. [11] Удельная теплоемкость и проводимость PCL достаточно низки, поэтому при такой температуре с ним несложно обращаться вручную. Это делает его идеальным для мелкомасштабного моделирования, изготовления деталей, ремонта пластиковых объектов и быстрого прототипирования там, где не требуется термостойкость. Хотя размягченный PCL легко прилипает ко многим другим пластикам при более высокой температуре, если поверхность охладить, липкость можно свести к минимуму, сохраняя при этом массу гибкой.
Биодеградация
[ редактировать ]Bacillota и Pseudomonadota могут разрушать PCL. [12] Пенициллиум сп. штамм 26-1 может разрушать PCL высокой плотности; хотя и не так быстро, как термотолерантный Aspergillus sp. штамм СТ-01. Виды Clostridium могут разлагать PCL в анаэробных условиях.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Sharma, Adit; Kopylov, Alexey; Zadorozhnyy, Mikhail; Stepashkin, Andrei; Kudelkina, Vera; Wang, Jun-Qiang; Ketov, Sergey; Churyukanova, Margarita; Louzguine-Luzgin, Dmitri; Sarac, Baran; Eckert, Jürgen; Kaloshkin, Sergey; Zadorozhnyy, Vladislav; Kato, Hidemi (2020). "Mg-Based Metallic Glass-Polymer Composites: Investigation of Structure, Thermal Properties, and Biocompatibility" . Metals . 10 (7): 867. doi : 10.3390/met10070867 .
- ^ Кумбар, Сангамеш; Лоуренсен, Катон Т.; Дэн, Мэн (2014). Природные и синтетические биомедицинские полимеры (1-е изд.). Берлингтон, Массачусетс: Elsevier. ISBN 978-0-12-396983-5 .
- ^ Нараян, Роджер Дж. (2019), «Предисловие» , Энциклопедия биомедицинской инженерии , Elsevier, стр. xxxv – xxxvi, doi : 10.1016/b978-0-12-804829-0.05001-x , ISBN 978-0-12-805144-3 , получено 1 ноября 2023 г.
- ^ Лабет М., Тилеманс В. (декабрь 2009 г.). «Синтез поликапролактона: обзор». Обзоры химического общества . 38 (12): 3484–504. дои : 10.1039/B820162P . ПМИД 20449064 .
- ^ Хаджиали Ф, Таджбахш С, Шоджаи А (28 июня 2017 г.). «Изготовление и свойства поликапролактоновых композитов, содержащих керамику на основе фосфата кальция и биоактивные стекла, в инженерии костной ткани: обзор». Обзоры полимеров . 58 (1): 164–207. дои : 10.1080/15583724.2017.1332640 . S2CID 103102150 .
- ^ Ли, Л.; ЛаБарбера, Д.В. (01 января 2017 г.), Чакаламаннил, Сэмюэл; Ротелла, Дэвид; Уорд, Саймон Э. (ред.), «2.16 - Трехмерный скрининг органоидов с высоким содержанием содержания для открытия лекарств» , Comprehensive Medicinal Chemistry III , Oxford: Elsevier, стр. 388–415, doi : 10.1016/b978-0-12- 409547-2.12329-7 , ISBN 978-0-12-803201-5 , получено 14 июля 2020 г.
- ^ Jump up to: а б Моерс-Карпи М.М., Шервуд С. (март 2013 г.). «Поликапролактон для коррекции носогубных складок: 24-месячное проспективное рандомизированное контролируемое клиническое исследование» . Дерматологическая хирургия . 39 (3, часть 1): 457–63. дои : 10.1111/dsu.12054 . ПМЦ 3615178 . ПМИД 23350617 .
- ^ Ким Дж.А., Ван Абель Д. (апрель 2015 г.). «Неоколлагенез в тканях человека после инъекции дермального наполнителя на основе поликапролактона». Журнал косметической и лазерной терапии . 17 (2): 99–101. дои : 10.3109/14764172.2014.968586 . ПМИД 25260139 . S2CID 5799117 .
- ^ Бхавсар, доктор медицинских наук, Амиджи М.М. (2008). «Разработка новой биоразлагаемой композиции полимерных наночастиц в микросферах для локальной доставки плазмидной ДНК в желудочно-кишечный тракт» . AAPS PharmSciTech . 9 (1): 288–94. дои : 10.1208/s12249-007-9021-9 . ПМЦ 2976886 . ПМИД 18446494 .
- ^ Хираиши Н., Яу Дж. Я., Лушин Р. Дж., Армстронг С. Р., Веллер Р. Н., Кинг Н. М., Пэшли Д. Х., Тэй Ф. Р. (август 2007 г.). «Подверженность материала для пломбирования корневых каналов на основе поликапролактона разложению. III. Турбидиметрическая оценка ферментативного гидролиза». Журнал эндодонтии . 33 (8): 952–6. дои : 10.1016/j.joen.2007.05.004 . ПМИД 17878081 .
- ^ Supercilii C. «Справочник по материалам своими руками: полиморфный пластик (термопластик с низкой температурой плавления)» . Инструктажи . Автодеск . Проверено 20 августа 2015 г.
- ^ Токива И., Калабия Б.П., Угву К.У., Айба С. (август 2009 г.). «Биоразлагаемость пластмасс» . Международный журнал молекулярных наук . 10 (9): 3722–42. дои : 10.3390/ijms10093722 . ПМК 2769161 . ПМИД 19865515 .
Дальнейшее чтение
[ редактировать ]- Синха В.Р., Бансал К., Кошик Р., Кумрия Р., Трехан А. (июнь 2004 г.). «Полиэпсилон-капролактоновые микросферы и наносферы: обзор». Международный фармацевтический журнал . 278 (1): 1–23. doi : 10.1016/j.ijpharm.2004.01.044 . ПМИД 15158945 .