Тканевая инженерия клапанов сердца
Тканеинженерные сердечные клапаны (TEHV) предлагают новый и перспективный метод создания живого сердечного клапана для людей, нуждающихся в полной или частичной замене сердечного клапана . В настоящее время ежегодно имплантируется более четверти миллиона протезов клапанов сердца. [1] Предполагается, что число пациентов, нуждающихся в заместительной хирургии, только увеличится и даже утроится в течение следующих пятидесяти лет. [2] Хотя предлагаемые ныне методы лечения, такие как механические клапаны или биологические клапаны, не вредны для здоровья, оба они имеют свои собственные ограничения: механические клапаны требуют пожизненного использования антикоагулянтов, в то время как биологические клапаны подвержены структурной деградации и повторному срабатыванию. [2] [3] Таким образом, тканевая инженерия сердечных клапанов in situ (в исходном положении или месте) представляет собой новый подход, исследующий возможность создания живого сердечного клапана, состоящего из собственных клеток хозяина, способного расти, адаптироваться и взаимодействовать внутри человеческого организма. биологическая система организма. [4]
Исследования еще не дошли до стадии клинических испытаний.
Процедура
[ редактировать ]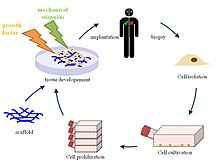
Строительные леса
[ редактировать ]Различные биоматериалы , будь то биологические, синтетические или их комбинации, могут использоваться для создания каркасов, которые при имплантации в организм человека могут способствовать регенерации тканей хозяина . [5] Сначала собирают клетки пациента, которому будет имплантирован каркас. Эти клетки размножаются и засеиваются в созданный каркас, который затем вводится внутрь человеческого тела. [6] Организм человека служит биореактором, который позволяет формировать внеклеточный матрикс (ECM) вместе с волокнистыми белками вокруг каркаса, чтобы обеспечить необходимую среду для сердца и системы кровообращения . [7] Первоначальная имплантация чужеродного каркаса запускает различные сигнальные пути, управляемые реакцией инородного тела на рекрутирование клеток из соседних тканей. [2] Новая сеть нановолокон, окружающая каркас, имитирует естественный ЕСМ тела хозяина. [8] Как только клетки начинают заселять клетку, каркас постепенно разрушается, оставляя после себя построенный сердечный клапан, сделанный из собственных клеток организма-хозяина, который полностью способен к репопуляции клеток и противостоит изменениям окружающей среды внутри организма. [9] Каркас, предназначенный для тканевой инженерии, является одним из наиболее важных компонентов, поскольку он определяет построение, жизнеспособность и функциональность тканей в течение длительного времени после имплантации и деградации. [ нужна ссылка ]
Биологический
[ редактировать ]
Биологические каркасы могут быть созданы из донорской ткани человека или животных; однако ткани животного происхождения часто более популярны, поскольку они более доступны и их больше в изобилии. [10] Ксенотрансплантат от донора вида, отличного от реципиента, сердечные клапаны могут быть от свиньи, коровы или овцы. [8] Если используются ткани человека или животного, первым шагом в создании полезных каркасов является децеллюляризация , что означает полное удаление клеточного содержимого с сохранением матрикса ЕСМ. [11] что является преимуществом по сравнению с изготовлением синтетических лесов с нуля. Использовалось множество методов децеллюляризации, таких как использование неионогенных и ионных детергентов, которые нарушают взаимодействие клеточного материала, или использование ферментов для расщепления пептидных связей, РНК и ДНК. [8]
Изготовленный
[ редактировать ]Существуют также современные подходы, позволяющие создавать каркасы и связывать их с биологическими сигналами. [2] Изготовленные каркасы также могут быть изготовлены с использованием биологических, синтетических материалов или комбинации обоих материалов с нуля, чтобы имитировать нативный сердечный клапан, наблюдаемый с помощью методов визуализации. Поскольку каркас создается из сырья, существует гораздо большая гибкость в контроле свойств каркаса, и его можно более адаптировать. Некоторые типы готовых каркасов включают в себя твердые трехмерные пористые каркасы с большой сетью пор, которая обеспечивает прохождение клеточного мусора, обеспечивая дальнейший рост тканей и сосудов. [12] Трехмерные пористые каркасы могут быть изготовлены с помощью трехмерной печати или различных полимеров, от полигликолевой кислоты (PGA) и полимолочной кислоты (PLA) до более натуральных полимеров, таких как коллаген. [8]
Волокнистые каркасы потенциально могут точно соответствовать структуре ЕСМ за счет использования волокон, которые имеют высокий фактор роста . Методы производства волокнистых каркасов включают электропрядение , [13] [11] при котором жидкий раствор полимеров растягивается под действием высокого электрического напряжения для получения тонких волокон. В отличие от трехмерных пористых каркасов, волокнистые каркасы имеют очень маленький размер пор, что предотвращает проникновение клеток внутри каркаса. [14]
Гидрогелевые каркасы создаются путем сшивания гидрофильных полимеров посредством различных реакций, таких как свободнорадикальная полимеризация или реакция сопряженного присоединения . [8] Гидрогели полезны, потому что они имеют высокое содержание воды, что позволяет легко проходить питательным веществам и мелким материалам. [15]
Биосовместимость
[ редактировать ]Биосовместимость хирургически имплантированного чужеродного биоматериала относится к взаимодействию между биоматериалом и тканью организма хозяина. Клеточная линия, а также тип клеток, такой как фибробласты, могут в значительной степени влиять на реакцию тканей на имплантированные чужеродные устройства путем изменения морфологии клеток. [16] Таким образом, источник клеток, а также адсорбция белка , которая зависит от свойств поверхности биоматериала, играют решающую роль в тканевой реакции и клеточной инфильтрации в месте каркаса. [ нужна ссылка ]
Методология
[ редактировать ]Воспалительная реакция
[ редактировать ]Острое воспаление
[ редактировать ]Имплантация любого инородного устройства или материала хирургическим путем приводит к некоторой степени травмы тканей. Следовательно, особенно при частичном или полном удалении нативного сердечного клапана, травма ткани вызовет каскад воспалительных реакций и вызовет острое воспаление . Во время начальной фазы острого воспаления происходит расширение сосудов , увеличивающее приток крови к месту раны наряду с высвобождением факторов роста, цитокинов и других иммунных клеток. Кроме того, клетки выделяют активные формы кислорода и цитокины, которые вызывают вторичное повреждение окружающих тканей. [17] Эти химические факторы затем способствуют привлечению других иммунореактивных клеток, таких как моноциты или лейкоциты, которые способствуют образованию сгустка крови и богатого белками матрикса. [ нужна ссылка ]
Хроническое воспаление
[ редактировать ]Если острая воспалительная реакция сохраняется, организм переходит в хроническое воспаление . Во время этой продолжительной и системной фазы воспаления одной из основных движущих сил является инфильтрация макрофагов . Макрофаги и лимфоциты вызывают образование новых тканей и кровеносных сосудов, помогая доставлять питательные вещества в участок биоматериала. Затем новая фиброзная ткань инкапсулирует чужеродный биоматериал, чтобы свести к минимуму взаимодействие между биоматериалом и окружающей тканью. Хотя продление хронического воспаления может быть вероятным индикатором инфекции, иногда воспаление может сохраняться в течение пяти лет после операции. Хроническое воспаление, характеризующееся наличием фиброза и воспалительных клеток, наблюдалось в клетках крыс через 30 дней после имплантации устройства. [18]
После хронического воспаления минерализация происходит примерно через 60 дней после имплантации из-за накопления клеточного мусора и кальцификации , что может поставить под угрозу функциональность биосовместимых имплантированных устройств in vivo.

Реакция на инородное тело
[ редактировать ]В нормальных физиологических условиях воспалительные клетки защищают организм от инородных тел, и в организме происходит реакция инородного тела, основанная на адсорбции крови и белков на поверхности биоматериала. В первые две-четыре недели после имплантации существует связь между прикрепленными к биоматериалу макрофагами и экспрессией цитокинов вблизи чужеродного места имплантата, которую можно исследовать с помощью полуколичественной RT-PCR . [19] Макрофаги сливаются вместе, образуя гигантские клетки инородных тел (FBGC), которые аналогичным образом экспрессируют рецепторы цитокинов на своих клеточных мембранах и активно участвуют в воспалительной реакции. Отказ устройства в кардиостимуляторах из органического полиэфира полиуретана (ПЭУ) по сравнению с силиконовым каучуком демонстрирует, что реакция инородного тела действительно может привести к деградации биоматериалов, что приводит к последующим отказам устройства. Предлагается использовать для предотвращения компромиссов в функциональности и долговечности, чтобы минимизировать и замедлить скорость деградации биоматериала. [19]
Преимущества
[ редактировать ]Тканевые сердечные клапаны имеют определенные преимущества перед традиционными биологическими и механическими клапанами:
- Живой клапан. Вариант замены живого сердечного клапана весьма оптимален для детей, поскольку живой клапан обладает способностью расти и реагировать на свою биологическую среду, что особенно полезно для детей, чей организм постоянно меняется. [11] Этот вариант поможет уменьшить количество повторных операций, необходимых в жизни ребенка.
- Индивидуальный процесс. Поскольку каркасы, используемые в тканевой инженерии, могут быть изготовлены с нуля, обеспечивается более высокая степень гибкости и контроля. Это позволяет адаптировать тканеинженерные сердечные клапаны и их свойства, такие как форма каркаса и состав биоматериала, специально для пациента.
Риски и вызовы
[ редактировать ]
Прежде чем тканеинженерные сердечные клапаны смогут быть полностью клинически внедрены, необходимо рассмотреть и изучить множество рисков и проблем:
- Загрязнение. Отдельные исходные материалы могут способствовать созданию микробиологической среды, способствующей восприимчивости вирусов и инфекционных заболеваний. [20] Каждый раз, когда внешний каркас имплантируется в тело человека, загрязнение, хотя оно и неизбежно, может быть уменьшено за счет применения стерильной техники.
- Взаимодействие с каркасом. Существует множество рисков, связанных с взаимодействием между клетками и имплантированным каркасом, поскольку конкретные требования к биосовместимости в ходе текущих исследований в значительной степени неизвестны. [20] Реакция на эти взаимодействия также очень индивидуальна и зависит от биологической среды конкретного пациента; следовательно, ранее исследованные модели на животных не могут точно отражать последствия для человеческого организма. [21] Из-за высокой степени взаимодействия между каркасом и окружающей тканью необходимо тщательно учитывать такие свойства, как биоразлагаемость , биосовместимость и иммуногенность, поскольку они являются ключевыми факторами в характеристиках конечного продукта. [20] [11]
- Структурная сложность. Клапаны сердца с их неоднородной структурой очень сложны и динамичны. [21] тем самым создавая проблему для имитации тканеинженерных клапанов. Новые клапаны должны обладать высокой прочностью, а также соответствовать анатомической форме и механическим функциям родного клапана. [11]
История
[ редактировать ]Синтетические леса
[ редактировать ]проводились засеянные каркасы из полимеров с различными клеточными линиями В исследованиях in vitro , в которых каркасы со временем деградировали, оставляя после себя клеточный матрикс и белки. Первое исследование тканевой инженерии клапанов сердца было опубликовано в 1995 году. [11] В 1995 и 1996 годах Шинока использовал каркас из полигликолевой кислоты (PGA), одобренный FDA для имплантации человеку, и засеял его эндотелиальными клетками и фибробластами овцы с целью замены створки клапана легочной артерии овцы. [22] Результатом исследования Шиноки стал искусственный сердечный клапан, который был намного толще и жестче, что побудило Херструпа провести исследование по замене всех трех створок легочного клапана у овцы с использованием каркаса PGA, покрытого поли-4-гидроксибутиратом (P4HB), и овец. эндотелиальные клетки и миофибробласты. [23]
Биологические каркасы
[ редактировать ]Другой изученный вариант заключался в использовании децеллюляризованных биологических каркасов и засеве их соответствующими клетками in vitro . [21] В 2000 году Стейнхофф имплантировал децеллюляризованный каркас клапана легочной артерии овцы, засеянный эндотелиальными клетками овцы и миофибробластами. [24] Затем в 2002 году Домен создал децеллюляризованный криоконсервированный каркас из легочного аллотрансплантата и засеял его эндотелиальными клетками сосудов человека, чтобы реконструировать выносящий тракт правого желудочка (ПВОТ) у пациента-человека в 2002 году. [25] Перри в 2003 году засеял каркас из PGA, покрытый P4HB, мезенхимальными стволовыми клетками овцы in vitro ; однако исследование in vivo не проводилось. [26] В 2004 году Иваи провел исследование с использованием поли(молочно-ко-гликолевой кислоты) PLGA в сочетании с каркасом из коллагеновых микрогубок, в который были засеяны эндотелиальные и гладкомышечные клетки на участке легочной артерии собаки. [27] Сазерленд в 2005 году использовал каркас овечьих мезенхимальных стволовых клеток, засеянный PGA и поли-L-молочной кислотой (PLLA), для замены всех трех створок легочного клапана у овцы. [28]
in vivo Исследования имплантатов
[ редактировать ]В нескольких исследованиях использовалась тканевая инженерия сердечных клапанов in vivo на животных моделях и людях. В 2000 году Матени провел исследование, в ходе которого он использовал подслизистую оболочку тонкой кишки свиньи для замены одной створки легочного клапана. [29] Ограниченные исследования также проводились в клинических условиях. Например, в 2001 году Элкинс имплантировал пациентам SynerGraft для лечения децеллюляризированных легочных клапанов человека. [30] Саймон аналогичным образом использовал децеллюляризированные свиные клапаны SynerGraft для имплантации детям; [31] однако эти клапаны часто выходили из строя, поскольку вместо них в месте каркаса обнаруживалось не клетки-хозяева, а довольно большое количество воспалительных клеток. [32] [33] [8] Исследования, проведенные Доменом, Конерцем и их коллегами в Берлине (Германия), включали имплантацию биологического клапана свиньи 50 пациентам, перенесшим операцию Росса с 2002 по 2004 год. [33] Целью исследования было использование децеллюляризованного свиного ксенотрансплантата клапана, также называемого Matrix P, у взрослых со средним возрастом 46 лет. Целью исследования было предложить предложение по замене клапана легочной артерии. Хотя некоторые пациенты умерли после операции и были вынуждены пройти повторную операцию, краткосрочные результаты, похоже, хорошие, поскольку клапан ведет себя аналогично нативному, здоровому клапану. [34] (TAVR) сочеталась В одном исследовании на животных процедура транскатетерной замены аортального клапана с тканеинженерными клапанами сердца (TEHV). Стент TAVR, интегрированный с внеклеточным матриксом, полученным из клеток человека, был имплантирован и исследован овцам, у которых клапан поддерживал структурную целостность и клеточную инфильтрацию, что позволило потенциальному клиническому применению распространить TAVR на более молодых пациентов. [35]
Исследовать
[ редактировать ]Хотя многие исследования in vitro и in vivo были проведены на животных моделях, переход от животных моделей к людям еще не начался. Необходимо учитывать такие факторы, как размер участков хирургического разреза, продолжительность процедуры, а также доступные ресурсы и стоимость. [36] Синтетические наноматериалы могут стать основой для создания каркасов, используемых в тканевой инженерии сердечных клапанов. Использование нанотехнологий может помочь расширить полезные свойства изготовленных каркасов, такие как более высокая прочность на разрыв. [37]
См. также
[ редактировать ]- Тканевая инженерия
- Клапанная болезнь сердца
- Замена клапана
- Искусственный сердечный клапан
- Нанотехнологии
Ссылки
[ редактировать ]- ^ Джегатисваран А., Бутани Дж. (2006). «Патология инфекционно-воспалительных заболеваний протезов клапанов сердца». Сердечно-сосудистая патология . 15 (5): 252–255. doi : 10.1016/j.carpath.2006.05.002 . ПМИД 16979031 .
- ^ Jump up to: а б с д Мол А., Смитс А.И., Бутен К.В., Баайенс Ф.П. (май 2009 г.). «Тканевая инженерия клапанов сердца: достижения и текущие проблемы». Экспертиза медицинских изделий . 6 (3): 259–75. дои : 10.1586/erd.09.12 . ПМИД 19419284 . S2CID 5475108 .
- ^ Голдсмит I, Turpie AG, Lip GY (ноябрь 2002 г.). «Кальварная болезнь сердца и протезы клапанов сердца» . БМЖ . 325 (7374): 1228–31. дои : 10.1136/bmj.325.7374.1228 . ПМЦ 1124694 . ПМИД 12446543 .
- ^ Бутен К.В., Смитс А.И., Баайенс Ф.П. (29 мая 2018 г.). «Можем ли мы вырастить клапаны внутри сердца? Перспективы тканевой инженерии сердечного клапана на основе материалов in situ» . Границы сердечно-сосудистой медицины . 5 : 54. doi : 10.3389/fcvm.2018.00054 . ПМЦ 5987128 . ПМИД 29896481 .
- ^ О'Брайен, Фергал Дж. (01 марта 2011 г.). «Биоматериалы и каркасы для тканевой инженерии» . Материалы сегодня . 14 (3): 88–95. дои : 10.1016/S1369-7021(11)70058-X . ISSN 1369-7021 .
- ^ Шмидт Д., Сток Ю.А., Херструп С.П. (август 2007 г.). «Тканевая инженерия клапанов сердца с использованием децеллюляризированных ксеногенных или полимерных стартовых матриц» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 362 (1484): 1505–12. дои : 10.1098/rstb.2007.2131 . ПМК 2440411 . ПМИД 17588875 .
- ^ Гандалья А., Баньо А., Насо Ф., Спина М., Героза Г. (апрель 2011 г.). «Клетки, каркасы и биореакторы для тканеинженерных клапанов сердца: путь от базовых концепций к современным инновациям в области развития» . Европейский журнал кардиоторакальной хирургии . 39 (4): 523–31. doi : 10.1016/j.ejcts.2010.07.030 . ПМИД 21163670 .
- ^ Jump up to: а б с д и ж Яна С., Теффт Б.Дж., Спун Д.Б., Симари Р.Д. (июль 2014 г.). «Каркасы для тканевой инженерии клапанов сердца». Акта Биоматериалы . 10 (7): 2877–93. дои : 10.1016/j.actbio.2014.03.014 . ПМИД 24675108 .
- ^ Сюэ Ю, Сант В., Филиппи Дж., Сант С. (январь 2017 г.). «Биоразлагаемые и биомиметические эластомерные каркасы для тканеинженерных клапанов сердца». Акта Биоматериалы . 48 : 2–19. дои : 10.1016/j.actbio.2016.10.032 . ПМИД 27780764 .
- ^ Алрефаи М.Т., Мурали Д., Пол А., Ридван К.М., Коннелл Дж.М., Шум-Тим Д. (14 мая 2015 г.). «Инженерия и регенерация сердечной ткани с использованием клеточной терапии» . Стволовые клетки и клонирование: достижения и применение . 8 : 81–101. дои : 10.2147/SCCAA.S54204 . ПМЦ 4437607 . ПМИД 25999743 .
- ^ Jump up to: а б с д и ж Чунг Д.И., Дуан Б., Батчер Дж.Т. (2015). «Современный прогресс в тканевой инженерии клапанов сердца: многомасштабные проблемы, многомасштабные решения» . Экспертное мнение о биологической терапии . 15 (8): 1155–72. дои : 10.1517/14712598.2015.1051527 . ПМЦ 4883659 . ПМИД 26027436 .
- ^ Ло К.Л., Чунг С. (декабрь 2013 г.). «Трехмерные каркасы для тканевой инженерии: роль пористости и размера пор» . Тканевая инженерия. Часть B: Обзоры . 19 (6): 485–502. дои : 10.1089/ten.teb.2012.0437 . ПМЦ 3826579 . ПМИД 23672709 .
- ^ Брахим Д.М., Какаругас А., Аллам Н.К. (2017). «Последние достижения в области электропряденых каркасов в качестве матриц для тканеинженерных сердечных клапанов». Материалы сегодня Химия . 5 : 11–23. дои : 10.1016/j.mtchem.2017.05.001 . ISSN 2468-5194 .
- ^ Бружаускайте И, Биронайте Д, Багдонас Е, Бернотене Е (май 2016 г.). «Каркасы и клетки для регенерации тканей: разные размеры пор каркаса — разные клеточные эффекты» . Цитотехнология . 68 (3): 355–69. дои : 10.1007/s10616-015-9895-4 . ПМЦ 4846637 . ПМИД 26091616 .
- ^ Чжу Дж., Марчант Р.Э. (сентябрь 2011 г.). «Расчетные свойства гидрогелевых тканеинженерных каркасов» . Экспертиза медицинских изделий . 8 (5): 607–26. дои : 10.1586/erd.11.27 . ПМК 3206299 . ПМИД 22026626 .
- ^ Мораис Дж. М., Пападимитракопулос Ф., Берджесс DJ (июнь 2010 г.). «Взаимодействие биоматериалов и тканей: возможные решения преодоления реакции на инородное тело» . Журнал AAPS . 12 (2): 188–96. дои : 10.1208/s12248-010-9175-3 . ПМЦ 2844517 . ПМИД 20143194 .
- ^ Миттал, Маниш; Сиддики, Мохаммад Ризван; Тран, Кхим; Редди, Сехар П.; Малик, Асрар Б. (01 марта 2014 г.). «Активные формы кислорода при воспалении и повреждении тканей» . Антиоксиданты и окислительно-восстановительная сигнализация . 20 (7): 1126–1167. дои : 10.1089/ars.2012.5149 . ISSN 1523-0864 . ПМК 3929010 . ПМИД 23991888 .
- ^ Онуки Ю., Бхардвадж У., Пападимитракопулос Ф., Берджесс DJ (ноябрь 2008 г.). «Обзор биосовместимости имплантируемых устройств: текущие проблемы преодоления реакции на инородное тело» . Журнал науки и технологий о диабете . 2 (6): 1003–15. дои : 10.1177/193229680800200610 . ПМЦ 2769826 . ПМИД 19885290 .
- ^ Jump up to: а б Андерсон Дж. М., Родригес А., Чанг Д.Т. (апрель 2008 г.). «Реакция инородного тела на биоматериалы» . Семинары по иммунологии . 20 (2): 86–100. дои : 10.1016/j.smim.2007.11.004 . ПМК 2327202 . ПМИД 18162407 .
- ^ Jump up to: а б с Уильямс Д. (май 2004 г.). «Польза и риск тканевой инженерии» . Материалы сегодня . 7 (5): 24–29. дои : 10.1016/s1369-7021(04)00232-9 .
- ^ Jump up to: а б с Мендельсон К., Шон Ф.Дж. (декабрь 2006 г.). «Тканевая инженерия сердечного клапана: концепции, подходы, прогресс и проблемы» . Анналы биомедицинской инженерии . 34 (12): 1799–819. дои : 10.1007/s10439-006-9163-z . ПМК 1705506 . ПМИД 17053986 .
- ^ Шинока Т., Брейер К.К., Танель Р.Э., Зунд Г., Миура Т., Ма ПХ, Лангер Р., Ваканти Дж.П., Майер Дж.Е. (декабрь 1995 г.). «Тканевая инженерия сердечных клапанов: исследование замены створок клапана на модели ягненка». Анналы торакальной хирургии . 60 (6 Доп.): S513-6. дои : 10.1016/0003-4975(95)00733-4 . ПМИД 8604922 .
- ^ Херструп С.П., Содиан Р., Дебриц С., Ван Дж., Бача Э.А., Мартин Д.П., Моран А.М., Гулезериан К.Дж., Сперлинг Дж.С., Каушал С., Ваканти Дж.П., Шон Ф.Дж., Майер Дж.Е. (ноябрь 2000 г.). «Функциональные живые трехстворчатые сердечные клапаны, выращенные in vitro». Тираж . 102 (19 Приложение 3): III44-9. doi : 10.1161/01.cir.102.suppl_3.iii-44 . ПМИД 11082361 . S2CID 42671847 .
- ^ Стейнхофф Г., Сток У., Карим Н., Мерчинг Х., Тимке А., Мелисс Р.Р., Петиг К., Хаверих А., Бадер А. (ноябрь 2000 г.). «Тканевая инженерия клапанов легочного сердца на кондуитах аллогенного бесклеточного матрикса: восстановление ткани клапана in vivo». Тираж . 102 (19 Приложение 3): III50-5. doi : 10.1161/01.cir.102.suppl_3.iii-50 . ПМИД 11082362 . S2CID 6339507 .
- ^ Домен П.М., Коста Ф., Лопес С.В., Йоши С., Соуза Ф.П., Вилани Р., Коста М.Б., Конерц В. (09.03.2005). «Результаты имплантации децеллюляризированного сердечного клапана свиньи в модель молодой овцы». Форум кардиохирургии . 8 (2): E100–4, обсуждение E104. дои : 10.1532/hsf98.20041140 . ПМИД 15769723 .
- ^ Перри Т.Э., Каушал С., Сазерленд Ф.В., Гулезериан К.Дж., Бишофф Дж., Сакс М., Майер Дж.Э. (март 2003 г.). «Награда Ассоциации директоров торакальной хирургии. Костный мозг как источник клеток для тканевой инженерии сердечных клапанов». Анналы торакальной хирургии . 75 (3): 761–7, обсуждение 767. doi : 10.1016/S0003-4975(02)03776-1 . ПМИД 12645690 .
- ^ Иваи С., Сава Ю., Итикава Х., Такетани С., Учимура Э., Чен Г., Хара М., Мияке Дж., Мацуда Х. (сентябрь 2004 г.). «Биоразлагаемый полимер с коллагеновой микрогубкой служит новым биоинженерным сердечно-сосудистым протезом» . Журнал торакальной и сердечно-сосудистой хирургии . 128 (3): 472–9. дои : 10.1016/j.jtcvs.2004.04.013 . ПМИД 15354111 .
- ^ Сазерленд Ф.В., Перри Т.Е., Ю Ю, Шервуд М.К., Рабкин Э., Масуда Ю., Гарсия Г.А., Маклеллан Д.Л., Энгельмайр Г.К., Сакс М.С., Шон Ф.Дж., Майер Дж.Э. (май 2005 г.). «От стволовых клеток к жизнеспособному аутологичному полулунному клапану сердца» . Тираж . 111 (21): 2783–91. doi : 10.1161/CIRCULATIONAHA.104.498378 . ПМИД 15927990 .
- ^ Мэтени Р.Г., Хатчисон М.Л., Драйден П.Е., Хайлз, доктор медицинских наук, Шаар С.Дж. (ноябрь 2000 г.). «Подслизистая оболочка тонкой кишки свиньи как заменитель створок легочного клапана». Журнал заболеваний сердечного клапана . 9 (6): 769–74, обсуждение 774–5. ПМИД 11128782 .
- ^ Элкинс Р.К., Доусон П.Е., Гольдштейн С., Уолш С.П., Блэк К.С. (май 2001 г.). «Децеллюляризированные аллотрансплантаты клапанов человека». Анналы торакальной хирургии . 71 (5 Доп.): С428-32. дои : 10.1016/S0003-4975(01)02503-6 . ПМИД 11388241 .
- ^ Саймон П., Казимир М.Т., Зеебахер Г., Вайгель Г., Ульрих Р., Зальцер-Мухар У., Ридер Э., Вольнер Э. (июнь 2003 г.). «Ранняя недостаточность тканеинженерного свиного сердечного клапана SYNERGRAFT у педиатрических пациентов» . Европейский журнал кардиоторакальной хирургии . 23 (6): 1002–6, обсуждение 1006. doi : 10.1016/S1010-7940(03)00094-0 . ПМИД 12829079 .
- ^ Сайк Ф., Бос И., Шуберт У., Ведель Т., Сиверс Х.Х. (май 2005 г.). «Гистопатологические данные нового децеллюляризованного гомотрансплантата легкого: исследование аутопсии». Анналы торакальной хирургии . 79 (5): 1755–8. дои : 10.1016/j.athoracsur.2003.11.049 . ПМИД 15854972 .
- ^ Jump up to: а б Веселый I (октябрь 2005 г.). «Тканевая инженерия клапанов сердца» . Исследование кровообращения . 97 (8): 743–55. doi : 10.1161/01.RES.0000185326.04010.9f . ПМИД 16224074 .
- ^ Конертц В., Домен П.М., Лю Дж., Бехольц С., Душе С., Познер С., Лембке А., Эрдбрюггер В. (январь 2005 г.). «Гемодинамические характеристики децеллюляризированного ксенотрансплантата Matrix P для замены клапана легочной артерии во время операции Росса». Журнал заболеваний сердечного клапана . 14 (1): 78–81. ПМИД 15700440 .
- ^ Линтас В., Фиоретта Э.С., Мотта С.Е., Дейкман П.Е., Пенсалфини М., Мацца Е., Калискан Е., Родригес Х., Липиски М., Зауэр М., Цесарович Н., Херструп С.П., Эммерт М.Ю. (декабрь 2018 г.). «Разработка нового тканеинженерного сердечного клапана, полученного из клеток человека, для транскатетерной замены аортального клапана: технико-экономическое обоснование in vitro и in vivo». Журнал сердечно-сосудистых трансляционных исследований . 11 (6): 470–482. дои : 10.1007/s12265-018-9821-1 . ПМИД 30105605 . S2CID 51979398 .
- ^ Шинока Т., Миячи Х. (ноябрь 2016 г.). «Текущее состояние тканевой инженерии сердечного клапана». Всемирный журнал детской и врожденной кардиохирургии . 7 (6): 677–684. дои : 10.1177/2150135116664873 . ПМИД 27834758 . S2CID 42751256 .
- ^ Риппель Р.А., Ганбари Х., Сейфалян А.М. (июль 2012 г.). «Тканеинженерный сердечный клапан: будущее кардиохирургии». Всемирный журнал хирургии . 36 (7): 1581–91. дои : 10.1007/s00268-012-1535-y . ПМИД 22395345 . S2CID 2554899 .