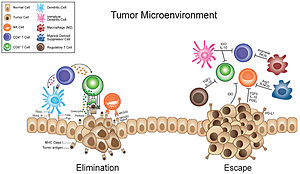
Микроокружение опухоли

Микроокружение опухоли представляет собой сложную экосистему, окружающую опухоль , состоящую из раковых клеток, стромальной ткани (включая кровеносные сосуды , иммунные клетки , фибробласты и сигнальные молекулы ) и внеклеточного матрикса . [2] [3] [4] [5] Взаимное взаимодействие раковых клеток с различными компонентами микроокружения опухоли способствует ее росту и инвазии в здоровые ткани, что коррелирует с резистентностью опухоли к современным методам лечения и плохим прогнозом. Микроокружение опухоли постоянно меняется из-за способности опухоли влиять на микроокружение, высвобождая внеклеточные сигналы, способствуя опухолевому ангиогенезу и индуцируя периферическую иммунную толерантность , в то время как иммунные клетки в микроокружении могут влиять на рост и эволюцию раковых клеток. [2] [6] [7] [8] [9]
История [ править ]
Концепция микроокружения опухоли (ТМО) возникла в 1863 году, когда Рудольф Вирхов установил связь между воспалением и раком. Однако только в 1889 году теория Стивена Пейджета «семя и почва» выявила важную роль ТМЭ в метастазировании рака, подчеркнув сложную взаимосвязь между опухолями и окружающим их микроокружением. Теория показала, что раковые клетки имеют тенденцию к распространению. Пейджет предположил, что метастазы определенного типа рака («семя») часто метастазируют в определенные участки («почва») на основании сходства исходных и вторичных участков опухоли. Другими словами, точно так же, как семенам для роста нужна плодородная почва, раковым клеткам для метастазирования требуется благоприятная микросреда. [10] [11]
В 1928 году Джеймс Юинг бросил вызов теории Пэджета, высказав свой собственный взгляд на метастазы рака. Юинг предположил, что на способность раковых клеток метастазировать в первую очередь влияют механические механизмы, такие как анатомические и гемодинамические факторы сосудистого соединения, при этом опухолевые клетки с большей вероятностью попадают в первый подключенный орган. [10] [12] Эта точка зрения предполагала, что определенные свойства или мутации внутри раковых клеток могут определять их метастатический потенциал независимо от окружающей тканевой среды. [10] Исайя Фидлер сформулировал дополнительную гипотезу в 1970-х годах, предположив, что, хотя механические аспекты кровотока важны, метастатическая колонизация нацелена конкретно на определенные органы, что известно как органотропизм. [13]
В конце 1970-х годов внимание сместилось в сторону понимания роли лимфоцитов в микроокружении опухоли. Появились сообщения с подробным описанием присутствия и активности инфильтрирующих опухоль Т- и В-лимфоцитов , а также естественных клеток-киллеров (NK) . Исследователи заметили, что Т-клетки, инфильтрирующие опухоль, обладают как противоопухолевой цитотоксичностью , так и иммуносупрессивными свойствами. Однако их цитотоксическая активность оказалась ниже по сравнению с лимфоцитами из отдаленных мест, что, вероятно, связано с общим иммуносупрессивным состоянием у лиц с опухолями. [14]
Сосудистая сеть [ править ]
Сосудистая сеть опухоли важна для ее роста, поскольку кровеносные сосуды доставляют в опухоль кислород, питательные вещества и факторы роста. [15] Опухоли диаметром менее 1–2 мм доставляют кислород и питательные вещества посредством пассивной диффузии . В более крупных опухолях центр становится слишком далеко от существующего кровоснабжения, что приводит к тому, что микроокружение опухоли становится гипоксическим и кислым. [16] Активация ангиогенеза обеспечивает питание раковых клеток и связана со злокачественностью опухоли. [17]
и ангиогенез клетки Эндотелиальные
В гипоксической среде ткань посылает сигналы, называемые факторами, индуцируемыми гипоксией (HIF), которые могут стимулировать близлежащие эндотелиальные клетки к секреции таких факторов, как фактор роста эндотелия сосудов (VEGF). VEGF активирует эндотелиальные клетки, что запускает процесс ангиогенеза , когда новые кровеносные сосуды появляются из ранее существовавшей сосудистой сети. [18] Кровеносный сосуд, образующийся в опухолевом окружении, часто не созревает должным образом, в результате чего сосудистая сеть, образующаяся в опухолевом микроокружении, отличается от таковой в нормальной ткани. Образовавшиеся кровеносные сосуды часто бывают «протекающими» и извилистыми, с нарушенным кровотоком. [19] [16] Поскольку опухоли не могут вырасти до больших размеров без надлежащей сосудистой системы, устойчивый ангиогенез считается одним из признаков рака. [20]
На более поздних стадиях прогрессирования опухоли эндотелиальные клетки могут дифференцироваться в ассоциированные с карциномой фибробласты , что способствует метастазированию . [16]
Повышенная проницаемость и эффект удержания [ править ]
Эффект повышенной проницаемости и удержания заключается в наблюдении того, что сосудистая сеть опухолей имеет тенденцию накапливать макромолекулы в кровотоке в большей степени, чем в нормальной ткани. Это происходит из-за «неплотной» сосудистой сети вокруг опухолей и отсутствия лимфатической системы . [21] Проницаемая сосудистая сеть позволяет облегчить доставку терапевтических препаратов к опухоли, а отсутствие лимфатических сосудов способствует усиленному удерживанию. Считается, что проницаемая сосудистая сеть имеет несколько причин, включая недостаточность перицитов и деформацию базальной мембраны . [22]
Гипоксия [ править ]

Хотя ангиогенез может уменьшить гипоксию в микроокружении опухоли, парциальное давление кислорода ниже 5 мм рт. ст. более чем в 50% местно-распространенных солидных опухолей по сравнению с венозной кровью, которая имеет парциальное давление кислорода 40-60 мм рт. ст. [18] [5] Гипоксическая среда приводит к генетической нестабильности за счет подавления генов, участвующих в механизмах репарации ДНК , таких как пути эксцизионной репарации нуклеотидов и пути репарации несовпадений . [23] Эта генетическая нестабильность приводит к большому количеству мутировавших клеток и связана с прогрессированием рака. [5] Периоды легкой и острой гипоксии и реоксигенации могут привести к тому, что раковые клетки адаптируются и приобретут более агрессивные фенотипы. [18]
Гипоксия вызывает активацию факторов, индуцированных гипоксией (HIF), которые являются факторами транскрипции, определяющими, как клетки реагируют на недостаток кислорода. [16] HIF индуцирует транскрипцию тысяч генов, некоторые из которых индуцируют ангиогенез или способствуют метастазированию, что приводит, например, к усилению миграции клеток и ремоделированию матрикса. [24] [4] Повышенная экспрессия HIF может привести к тому, что опухолевые клетки изменят свой метаболизм с аэробного на анаэробный, где они получают энергию посредством гликолиза . [25] Клетки с повышенным метаболизмом глюкозы вырабатывают лактат , который снижает pH микросреды с нейтральных и здоровых 7,35-7,45 до кислых 6,3-7,0. Это явление описано как « эффект Варбурга ». [25] [26] HIF также регулируют иммунные клетки, а повышенная экспрессия может привести к инактивации противоопухолевых функций. Это способствует выживанию опухолевых клеток и затрудняет противоопухолевое лечение. [25]
Стромальные клетки [ править ]
Рак представляет собой сложное заболевание, в котором участвуют как опухолевые клетки, так и окружающие их стромальные клетки. В биологии рака строма определяется как доброкачественные клетки, обнаруженные в поддерживающей ткани, окружающей опухоли. Эти клетки включают фибробласты , иммунные клетки, эндотелиальные клетки и различные другие типы клеток. [27]
Стромальные клетки в микроокружении опухоли представляют собой важный клеточный компонент в развитии рака, влияя на опухолевый метаболизм, рост, метастазирование, уклонение от иммунитета и устойчивость к химиотерапии . Эти клетки могут происходить из соседних нераковых стромальных клеток или подвергаться трансдифференцировке из опухолевых клеток. Стромальные клетки способствуют возникновению, прогрессированию и устойчивости опухоли к лекарственным препаратам, а строма, как известно, развивается по мере развития опухоли. Понимание взаимодействия между раковыми клетками и стромальными клетками имеет важное значение для разработки эффективных методов лечения рака. [27] [28] Изменения в строме, включая активацию фибробластов в фибробласты, ассоциированные с карциномой (CAF), и ремоделирование внеклеточного матрикса (ECM), признаны важными для прогрессирования рака и потенциальными мишенями для терапии и диагностики. [29]
Фибробласты, карциномой ассоциированные с

Фибробласты, ассоциированные с карциномой (CAF), представляют собой гетерогенную группу активированных фибробластов, находящихся в центре реактивной стромы в микроокружении опухоли. Точное определение CAF остается сложной задачей из-за различий в клеточном происхождении и маркерах экспрессии. костного мозга Однако данные свидетельствуют о том, что CAF происходят из активированных резидентных фибробластов, мезенхимальных стволовых клеток (МСК), раковых клеток, претерпевающих эпителиально-мезенхимальный переход (ETM), или эндотелиальных клеток через эндотелиально-мезенхимальный переход (EndMT). [31] [32] [11]
CAF являются одним из наиболее распространенных компонентов опухолевой стромы и особенно обнаруживаются в интерстициальных пространствах при раке молочной железы, предстательной железы и поджелудочной железы. [28] Они взаимодействуют с раковыми клетками, секретируя различные компоненты внеклеточного матрикса или межклеточную адгезию , что важно в регуляции биологического поведения опухолей. Эти регуляции особенно важны для развития опухолей и влияют на рост, инвазию, воспаление и ангиогенез раковых клеток . В некоторых случаях CAF также могут проявлять противоопухолевые свойства. [28] [33] [11]
CAF играют двойную роль в онкогенезе ; один из них способствует росту опухоли, а другой - ингибирует его, причем первый встречается чаще и способствует развитию опухоли и устойчивости к терапии посредством различных механизмов. [11] [33] Различные субпопуляции CAF были идентифицированы при разных типах рака. Например, при раке молочной железы исследования с использованием секвенирования одноклеточной РНК выявили различные фенотипы, включая сосудистые CAF, матричные CAF, циклические CAF и CAF развития. [34] Исследования с использованием протеомного анализа и секвенирования одноклеточной РНК пролили больше света на разнообразные характеристики CAF, выявив различные, а иногда и противоречивые функции. Их функции, по-видимому, зависят от контекста. [31] Такое разнообразие состава стомы не только формирует микроокружение опухоли, но и влияет на поведение опухолевых клеток. [34] [35]
Нацеливание на CAF стало многообещающей стратегией улучшения лечения рака, но исследование сталкивается с рядом проблем. К ним относятся пробелы в нашем понимании происхождения CAF и их разнообразных функций, некоторые из которых могут быть полезны в борьбе с опухолями. [11] [33] [28]
матрикса Ремоделирование внеклеточного

Внеклеточный матрикс (ECM) представляет собой трехмерную сеть белков и протеогликанов в микроокружении и присутствует во всех тканях. ЕСМ представляет собой высокодинамическую структуру и необходим для развития, восстановления, поддержки и гомеостаза тканей . [36] [37] В здоровой коже ЭМС состоит из различных молекул, таких как коллагены , гликопротеины и гликозаминогликаны , которые регулируют функции и механические свойства. Однако в опухолях ЕСМ играет важную роль в формировании микроокружения опухоли и влияет на прогрессирование рака, метастазирование и терапевтический ответ. Этот процесс называется ремоделированием внеклеточного матрикса и характеризуется изменениями содержания белка и ферментативной активности, которые влияют на передачу сигнала и изменения клеточного матрикса. [38] Ремоделирование ЕСМ включает динамические изменения в составе, организации и биомеханических свойствах ЕСМ. Ремоделирование ЕСМ индуцируется такими факторами, как гипоксия , ацидоз , воспалительные клетки или протеазы, секретируемые опухолевыми или стромальными клетками. [39]
Клеточные механизмы [ править ]
Клетки взаимодействуют с ЕСМ и связываются с ним через трансмембранные рецепторы, такие как интегрины , рецептор дискоидинового домена 2 (DDR) и синдеканы . Передача сигналов от ЕСМ внутрь клетки осуществляется различными путями. Одним из основных способов является прямая трансдукция, опосредованная трансмембранными белками, такими как интегрины. [40] Интегрины являются наиболее изученными рецепторами, связывающими ЕСМ, и опосредуют ремоделирование ЕСМ и регулярные клеточные процессы, такие как пролиферация , выживание, миграция и инвазия в ответ на изменения ЕСМ. Они действуют как механопреобразователи, преобразуя механические силы ЕСМ или цитоскелета в химические сигналы. Интегрины могут чувствовать различия между простыми, жесткими двумерными поверхностями и сложными, податливыми трехмерными средами, соответствующим образом изменяя клеточную сигнализацию. [41] [42]
Помимо интегринов, другие клеточные рецепторы, такие как рецептор гликопротеина клеточной поверхности (CD44), DDR2 и рецептор эластин-связывающего белка (EBPR), могут активировать сигнальные пути, такие как фосфатидилинозитол-3-киназа и Akt . Эти рецепторы взаимодействуют с различными компонентами внеклеточного матрикса и создают разнообразные клеточные процессы, которые способствуют как нормальным физиологическим функциям, так и патологическим состояниям, таким как рак. [40]
рака прогрессирование Влияние на
Хотя ремоделирование ЕСМ жестко регулируется в нормальных физиологических условиях, оно также модулирует многие виды поведения опухолевых клеток, связанные с прогрессированием рака. Это включает в себя уклонение от апоптоза , устойчивый ангиогенез, безграничный потенциал репликации и инвазию в ткани. [43] [44] При раке изменения в динамике ЕСМ приводят к изменениям состава, плотности и механических свойств, влияя на агрессивность опухоли и реакцию на терапию. Исследования показывают, что во время ремоделирования ЕСМ возникают как про-, так и противоопухолевые эффекты. На ранних стадиях формирования опухоли стромальные клетки производят избыточное количество белков ЕСМ, вызывая жесткость ткани вокруг опухоли. Некоторыми факторами, способствующими жесткости опухоли, являются повышенное содержание коллагена 1 типа и отложение кислоты. [43] [45] Кроме того, реструктурированный ЕСМ и его фрагменты деградации (матрикины) влияют на сигнальные пути посредством взаимодействий рецепторов клеточной поверхности, что приводит к нарушению регуляции поведения стромальных клеток и возникновению онкогенного микроокружения. [46]
Иммунные клетки [ править ]
Опухоль-ассоциированные иммунные клетки могут быть антагонистическими или стимулирующими опухоль, то есть они могут подавлять или стимулировать рост опухоли. [47] Из-за последствий гипоксии противоопухолевые способности многих противоопухолевых иммунных клеток, таких как цитотоксические Т-клетки и естественные клетки-киллеры, подавляются. С другой стороны, активация иммунных клеток, способствующих развитию опухоли, таких как регуляторные Т-клетки и супрессорные клетки миелоидного происхождения, активируется. [25]



Миелоидные супрессорные клетки опухолеассоциированные и макрофаги
Миелоидные супрессорные клетки представляют собой гетерогенную популяцию клеток миелогенного происхождения. [48] которые считаются способствующими развитию опухоли. [47] Они обладают потенциалом подавлять ответы Т-клеток , [49] может поддерживать ангиогенез , продуцируя такие белки, как фактор роста эндотелия сосудов (VEGF), и может способствовать метастазированию. Связанные с опухолью макрофаги с фенотипом М2 считаются супрессорными клетками миелоидного происхождения. [47]
Связанные с опухолью макрофаги являются центральным компонентом тесной связи между хроническим воспалением и раком и рекрутируются в опухоль в ответ на воспаление, связанное с раком. [50] Их вялая активация NF-κB способствует развитию тлеющего воспаления, наблюдаемого при раке. [51] В отличие от нормальных макрофагов, опухолеассоциированные макрофаги лишены цитотоксической активности. [52] Макрофаги, происходящие из моноцитов, делятся на воспалительные М1-поляризованные макрофаги и противовоспалительные М2-поляризованные макрофаги. М1-поляризованные макрофаги фагоцитируют опухолевые клетки и считаются антагонистами опухоли. [16] С другой стороны, М2-поляризованные макрофаги способствуют развитию опухолей, поскольку они способствуют прогрессированию опухоли, подавляя иммунонадзор. [47] содействие ангиогенезу за счет секреции фактора роста эндотелия сосудов (VEGF) [5] и ремоделирование внеклеточного матрикса. [47] Микроокружение опухоли способствует развитию М2-поляризованных макрофагов, а повышенное количество опухолеассоциированных макрофагов связано с худшим прогнозом. [16] [53] [54]
Связанные с опухолью макрофаги связаны с использованием экзосом , потенцирующей инвазию, для доставки микроРНК в раковые клетки, особенно в клетки рака молочной железы. [49] [55]
Нейтрофилы [ править ]
Нейтрофилы — это полиморфно-ядерные иммунные клетки, которые являются важными компонентами врожденной иммунной системы . Нейтрофилы могут накапливаться в опухолях, а при некоторых видах рака, таких как аденокарцинома легких, их обилие в месте опухоли связано с ухудшением прогноза заболевания. [56] [57] [58] Количество нейтрофилов (и предшественников миелоидных клеток) в крови может быть увеличено у некоторых пациентов с солидными опухолями. [59] [60] [61]
Эксперименты на мышах в основном показали, что опухолеассоциированные нейтрофилы проявляют опухолевые функции. [62] [63] [64] [65] но меньшее количество исследований показывает, что нейтрофилы также могут ингибировать рост опухоли. [66] [67] Нейтрофилы, ассоциированные с опухолью, можно разделить на N1- и N2-поляризованные нейтрофилы. [47] N1-поляризованные нейтрофилы накапливаются в опухоли на ранних стадиях и способствуют гибели опухолевых клеток. На более поздних стадиях N2-поляризованные нейтрофилы способствуют ангиогенезу, секретируя фактор роста эндотелия сосудов (VEGF). [16]
опухоль инфильтрирующие , Лимфоциты
Лимфоциты, инфильтрирующие опухоль, представляют собой лимфоциты, включая Т-клетки, В-клетки и естественные клетки-киллеры, которые проникают в опухоль и обладают способностью распознавать и убивать раковые клетки. [68] Высокая концентрация обычно положительно коррелирует с хорошим прогнозом (802). [69] Этот тип иммунных клеток также может блокировать метастазирование, поскольку естественные клетки-киллеры наиболее эффективны при уничтожении раковых клеток за пределами микроокружения опухоли. [16] Лимфоциты, инфильтрирующие опухоль, используются в терапевтических методах лечения, когда амплифицированные в лаборатории иммунные клетки передаются онкологическим больным, чтобы помочь их иммунной системе бороться с раком. [69] Это лечение показало успех при солидных опухолях, таких как меланома. [70]
Лимфоциты, инфильтрирующие опухоль, могут стать способствующими развитию опухоли из-за иммуносупрессивных механизмов микроокружения опухоли. [69] Раковые клетки вызывают апоптоз активированных Т-клеток путем секреции экзосом, содержащих лиганды смерти, такие как FasL и TRAIL, и тем же методом отключают нормальный цитотоксический ответ естественных клеток-киллеров . [71] [72]
Т-клетки [ править ]
Существует несколько типов Т-клеток, которые важны для онкогенеза, включая цитотоксические Т-клетки (CD8+), Т-хелперы 1 (Th-1) и регуляторные Т-клетки (Tregs). [16] Клетки CD8+ представляют собой антагонистические клетки, распознающие опухолевые антигены и нацеленные на разрушение раковых клеток. Кроме того, клетки CD8+ замедляют прогрессирование опухоли и подавляют ангиогенез, высвобождая гамма-интерферон (IFN-γ). [16] Клетки Th-1 поддерживают активацию и пролиферацию клеток CD8+ путем секреции IFN-γ и интерлейкина-2 (IL-2), а также путем перекрестной презентации опухолевых антигенов. [47] Трег, в отличие от CD8+, способствуют развитию опухоли. Они секретируют факторы роста опухоли и косвенно поддерживают выживаемость рака, взаимодействуя с эндотелиальными клетками и фибробластами, связанными с карциномой. [16] Трег-клетки также обладают иммуносупрессивными механизмами, которые могут сделать клетки CD8+ менее эффективными. [47]
Т-клетки достигают участков опухоли через сосудистую систему, где микроокружение опухоли, по-видимому, преимущественно рекрутирует другие иммунные клетки, а не Т-клетки. Одним из таких механизмов распознавания является высвобождение хемокинов, специфичных для клеточного типа . Другим примером является экспрессия апоптоза индуктора лиганда Fas (FasL) в сосудистой сети опухолей яичников, толстой кишки, простаты, молочной железы, мочевого пузыря и почек. Было показано, что опухоли с высокой экспрессией FasL содержат большое количество Tregs, но мало клеток CD8+. [3]
Т-клетки должны размножаться после прибытия к месту опухоли, чтобы эффективно убивать раковые клетки, выживать в условиях враждебных элементов и мигрировать через строму к раковым клеткам. На это влияет микроокружение опухоли. Дренирующие лимфатические узлы являются вероятным местом репликации Т-клеток, специфичных для рака, хотя это также происходит внутри опухоли. [3]
Исследования [ править ]
Модели [ править ]
Было разработано несколько моделей in vitro и in vivo , целью которых является воспроизведение ТМЕ в контролируемой среде. Иммортализованные опухолевые клеточные линии и первичные клеточные культуры уже давно используются для изучения различных опухолей. Они быстро настраиваются и недороги, но просты и склонны к генетическому дрейфу . [73] Трехмерные модели опухолей были разработаны как более пространственно репрезентативная модель TME. Сфероидные культуры, каркасы и органоиды обычно получают из стволовых клеток или ex vivo и гораздо лучше воссоздают архитектуру опухоли, чем двумерные клеточные культуры. [74]
лекарств Разработка
Достижения в ремоделировании нанотерапии привели к прогрессу в подавлении метастазов рака и снижении вероятности возникновения рака. Стратегии включали регуляцию гипоксии , ангиогенеза , рак-ассоциированных фибробластов (CAF), внеклеточного матрикса (ECM) и опухолеассоциированных макрофагов . Эти подходы были направлены на улучшение противоопухолевого эффекта и повышение чувствительности к другим методам лечения. [75] Исследователи обнаружили, что применение ферумокситола подавляет рост опухоли, индуцируя переход макрофагов в провоспалительные типы. [76] Транспортные средства -наноносители (диаметром ~ 20–200 нм) могут транспортировать лекарства и другие терапевтические молекулы. Эти методы лечения могут быть нацелены на избирательную экстравазацию через сосуды опухоли. [22] [77] Эти усилия включают белковые капсиды [78] и липосомы . [79] Однако, поскольку некоторые важные нормальные ткани, такие как печень и почки, также имеют фенестрированный эндотелий , размер наноносителя (10–100 нм, при этом большее удерживание в опухолях наблюдается при использовании более крупных наноносителей) и заряд (анионный или нейтральный) должны быть определены. обдуманный. [22] Лимфатические сосуды обычно не развиваются вместе с опухолью, что приводит к повышению давления интерстициальной жидкости , что может блокировать доступ опухоли. [22] [80]
Терапия [ править ]
Антитела [ править ]
Бевацизумаб клинически одобрен в США для лечения различных видов рака путем воздействия на VEGF-A , который продуцируется как ассоциированными с карциномой фибробластами , так и опухолеассоциированными макрофагами , тем самым замедляя ангиогенез . Первоначально он был одобрен для лечения метастатического колоректального рака , но теперь его применение распространяется на различные виды рака. [81]
Нацеливание на иммунорегуляторные мембранные рецепторы удалось у некоторых пациентов с меланомой , немелкоклеточной карциномой легкого , уротелиальным раком мочевого пузыря и почечно-клеточным раком . У мышей терапия анти- CTLA-4 приводит к выведению из опухоли FOXP3. + регуляторные Т-клетки (Treg), присутствие которых может нарушать функцию эффекторных Т-клеток. [82]
Ингибиторы киназ [ править ]
Мутированные киназы часто встречаются в раковых клетках, что делает их привлекательными мишенями для противораковых препаратов. Ингибиторы киназ являются мощными, специфичными и нацелены на аномальные киназы, сводя при этом к минимуму токсичность. Ингибиторы киназ расширили возможности лечения различных видов рака. [83]
Ингибиторы тирозинкиназы (ИТК), такие как эрлотиниб , лапатиниб и гефитиниб , воздействуют на рецепторы эпидермального фактора роста (EGFR) при раке, блокируя активность протеинтирозинкиназ (ПТК). Это показывает перспективу модуляции микроокружения опухоли, что приводит к регрессии рака. Понимание того, как ИТК модулируют микроокружение опухоли, может предложить другую форму лечения рака. [84] [85]
рецепторами антигенными Клеточная терапия химерными
с химерными антигенными рецепторами (CAR) Т-клеточная терапия — это иммунотерапевтический метод лечения, в котором используются генетически модифицированные Т-лимфоциты для эффективного воздействия на опухолевые клетки. CAR запрограммированы на нацеленность на опухолеассоциированные антигены , а также на быструю и гомогенную репликацию, что делает их потенциально очень эффективными в качестве лечения рака. [86] [87] Поскольку микроокружение опухоли имеет несколько барьеров, которые ограничивают способность CAR Т-клеток проникать в опухоль, было разработано несколько стратегий для решения этой проблемы. Локализованная доставка CAR T-клеток в глиобластому предполагает улучшение противоопухолевой активности, а разработка этих клеток для сверхэкспрессии хемокиновых рецепторов предполагает улучшение транспортировки CAR T-клеток. [88] По мере того как эта терапия распространяется на другие заболевания, управление ее уникальным профилем токсичности, включая синдром высвобождения цитокинов (CRS), синдром нейротоксичности, связанной с иммунными эффекторными клетками (ICANS) и цитопении , становится все более важным. [89]
См. также [ править ]
Ссылки [ править ]
- ^ Пиньейро Фернандес Дж., Лудди К.А., Хармон С., О'Фаррелли С. (2019). «Микроокружение опухоли печени и влияние на фенотип и функцию NK-клеток» . Международный журнал молекулярных наук . 20 (17): 4131. doi : 10.3390/ijms20174131 . ISSN 1422-0067 . ПМК 6747260 . ПМИД 31450598 .
- ↑ Перейти обратно: Перейти обратно: а б Альфарук КО, Муддатир АК, Шаюб МЭ (январь 2011 г.). «Кислотность опухоли как эволюционная злоба» . Раки . 3 (1): 408–414. дои : 10.3390/cancers3010408 . ПМЦ 3756368 . ПМИД 24310355 .
- ↑ Перейти обратно: Перейти обратно: а б с Джойс Дж. А., Фирон Д. Т. (апрель 2015 г.). «Исключение Т-клеток, иммунная привилегия и микроокружение опухоли» . Наука . 348 (6230): 74–80. Бибкод : 2015Sci...348...74J . дои : 10.1126/science.aaa6204 . ПМИД 25838376 .
- ↑ Перейти обратно: Перейти обратно: а б Спилл Ф, Рейнольдс Д.С., Камм Р.Д., Заман М.Х. (август 2016 г.). «Влияние физического микроокружения на прогрессирование и метастазирование опухоли» . Современное мнение в области биотехнологии . 40 : 41–48. дои : 10.1016/j.copbio.2016.02.007 . ПМЦ 4975620 . ПМИД 26938687 .
- ↑ Перейти обратно: Перейти обратно: а б с д Вебер CE, Куо ПК (сентябрь 2012 г.). «Микроокружение опухоли». Хирургическая онкология . 21 (3): 172–177. дои : 10.1016/j.suronc.2011.09.001 . ПМИД 21963199 .
- ^ Корнеев К.В., Атретханы К.Н., Друцкая М.С., Гривенников С.И., Купраш Д.В., Недоспасов С.А. (январь 2017). «Передача сигналов TLR и провоспалительные цитокины как движущие силы онкогенеза». Цитокин . 89 : 127–135. дои : 10.1016/j.cyto.2016.01.021 . ПМИД 26854213 .
- ^ Гошдастидер У., Рохатги Н., Моджтабави Наеини М., Баруа П., Ревков Е., Го Ю.А. и др. (апрель 2021 г.). «Панраковый анализ перекрестных помех лиганд-рецептор в микроокружении опухоли» . Исследования рака . 81 (7): 1802–1812. дои : 10.1158/0008-5472.CAN-20-2352 . ПМИД 33547160 . S2CID 232432582 .
- ^ Жавби Ю, Брезник Б (2021). «Моделирование микроокружения наиболее агрессивных опухолей головного мозга для доклинических исследований» . Достижения в области биологии рака: метастазы . 3 : 100017. doi : 10.1016/j.adcanc.2021.100017 . ISSN 2667-3940 . S2CID 244452599 .
- ^ Синьюань Т., Лэй Ю., Цзяньпин С., Жунвэй З., Жуйвэнь С., Йе З. и др. (01.10.2023). «Достижения в области роли микробиоты кишечника в регуляции микроокружения опухоли (обзор)» . Отчеты онкологии . 50 (4): 1–15. дои : 10.3892/или.2023.8618 . ISSN 1021-335X . ПМЦ 10485805 . ПМИД 37615187 .
- ↑ Перейти обратно: Перейти обратно: а б с Ахтар М., Хайдер А., Рашид С., Аль-Набет А.Д. (январь 2019 г.). «Теория метастазов рака «семена и почвы» Пэджета: идея, время которой пришло» . Достижения анатомической патологии . 26 (1): 69–74. дои : 10.1097/PAP.0000000000000219 . ISSN 1072-4109 . ПМИД 30339548 . S2CID 53010974 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Мао Ю., Келлер Э.Т., Гарфилд Д.Х., Шен К., Ван Дж. (01.06.2013). «Стромальные клетки в микроокружении опухоли и раке молочной железы» . Обзоры рака и метастазов . 32 (1): 303–315. дои : 10.1007/s10555-012-9415-3 . ISSN 1573-7233 . ПМК 4432936 . ПМИД 23114846 .
- ^ Лю Ц, Чжан Х, Цзян Икс, Цянь С, Лю Цз, Луо Д (02 декабря 2017 г.). «Факторы, участвующие в метастазировании рака: лучшее понимание гипотезы «сея и почвы» . Молекулярный рак . 16 (1): 176. дои : 10.1186/s12943-017-0742-4 . ISSN 1476-4598 . ПМК 5712107 . ПМИД 29197379 .
- ^ да Коста В.Р., Аральди Р.П., Вигерелли Х., Д'Амелио Ф., Мендес Т.Б., Гонзага В. и др. (октябрь 2021 г.). «Экзосомы в микроокружении опухоли: от биологии к клиническому применению» . Клетки . 10 (10): 2617. doi : 10.3390/cells10102617 . ISSN 2073-4409 . ПМЦ 8533895 . PMID 34685596 .
- ^ Маман С., Витц ИП (июнь 2018 г.). «История изучения рака в контексте» . Обзоры природы Рак . 18 (6): 359–376. дои : 10.1038/s41568-018-0006-7 . ISSN 1474-1768 . ПМИД 29700396 . S2CID 13777357 .
- ^ Аль-Остут Ф.Х., Салах С., Хамис Х.А., Ханум С.А. (01.01.2021). «Опухолевой ангиогенез: современные проблемы и терапевтические возможности» . Лечение рака и научные коммуникации . 28 : 100422. doi : 10.1016/j.ctarc.2021.100422 . ISSN 2468-2942 . ПМИД 34147821 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к Андерсон Н.М., Саймон MC (август 2020 г.). «Микроокружение опухоли» . Современная биология . 30 (16): Р921–Р925. Бибкод : 2020CBio...30.R921A . дои : 10.1016/j.cub.2020.06.081 . ISSN 0960-9822 . ПМК 8194051 . ПМИД 32810447 .
- ^ Цзян X, Ван Дж, Дэн X, Сюн Ф, Чжан С, Гун Z и др. (30 сентября 2020 г.). «Роль микроокружения в опухолевом ангиогенезе» . Журнал экспериментальных и клинических исследований рака . 39 (1): 204. doi : 10.1186/s13046-020-01709-5 . ISSN 1756-9966 . ПМЦ 7526376 . ПМИД 32993787 .
- ↑ Перейти обратно: Перейти обратно: а б с Ли Ю, Чжао Л, Ли С.Ф. (05 августа 2021 г.). «Гипоксия и микроокружение опухоли» . Технологии в исследовании и лечении рака . 20 : 15330338211036304. дои : 10.1177/15330338211036304 . ISSN 1533-0346 . ПМЦ 8358492 . ПМИД 34350796 .
- ^ Бхат С.М., Бадигер В.А., Васишта С., Чакраборти Дж., Прасад С., Гош С. и др. (01.12.2021). «3D-модели опухолевого ангиогенеза: последние достижения и проблемы» . Журнал исследований рака и клинической онкологии . 147 (12): 3477–3494. дои : 10.1007/s00432-021-03814-0 . ISSN 1432-1335 . ПМЦ 8557138 . ПМИД 34613483 .
- ^ Ханахан Д., Монже М. (13 марта 2023 г.). «Признаки рака пересекаются с исследованиями нейробиологии в микроокружении опухоли» . Раковая клетка . 41 (3): 573–580. doi : 10.1016/j.ccell.2023.02.012 . ISSN 1535-6108 . ПМЦ 10202656 . ПМИД 36917953 .
- ^ Аласванд Н., Урбанска А.М., Рахмати М., Саидифар М., Гунгор-Озкерим П.С., Сефат Ф. и др. (01.01.2017), Грумесеску А.М. (ред.), «Глава 13. Терапевтические наночастицы для адресной доставки противораковых препаратов» , «Многофункциональные системы для комбинированной доставки, биосенсорства и диагностики» , Elsevier, стр. 245–259, doi : 10.1016 /b978-0-323-52725-5.00013-7 , ISBN 978-0-323-52725-5 , получено 19 февраля 2024 г.
- ↑ Перейти обратно: Перейти обратно: а б с д Данье Ф., Ферон О., Преат В. (декабрь 2010 г.). «Использовать микроокружение опухоли: пассивное и активное нацеливание наноносителей на опухоль для доставки противораковых лекарств». Журнал контролируемого выпуска . 148 (2): 135–146. дои : 10.1016/j.jconrel.2010.08.027 . ПМИД 20797419 .
- ^ Тан М., Болдерсон Э., О'Бирн К.Дж., Ричард DJ (2021). «Гипоксия опухоли приводит к нестабильности генома» . Границы клеточной биологии и биологии развития . 9 . дои : 10.3389/fcell.2021.626229 . ISSN 2296-634X . ПМЦ 8007910 . ПМИД 33796526 .
- ^ Уикс Э.Э., Семенза Г.Л. (01.06.2022). «Факторы, индуцируемые гипоксией: прогрессирование рака и клинический перевод» . Журнал клинических исследований . 132 (11). дои : 10.1172/JCI159839 . ISSN 0021-9738 . ПМЦ 9151701 . ПМИД 35642641 .
- ↑ Перейти обратно: Перейти обратно: а б с д Чен Г, Ву К, Ли Х, Ся Д, Хэ Т (2022). «Роль гипоксии в микроокружении опухоли и таргетная терапия» . Границы онкологии . 12 . дои : 10.3389/fonc.2022.961637 . ISSN 2234-943X . ПМЦ 9545774 . ПМИД 36212414 .
- ^ Ли Ш., Гриффитс-младший (июнь 2020 г.). «Как и почему рак является кислым? Карбоангидраза IX и гомеостатический контроль внеклеточного pH опухоли» . Раки . 12 (6): 1616. doi : 10.3390/cancers12061616 . ПМЦ 7352839 . ПМИД 32570870 .
- ↑ Перейти обратно: Перейти обратно: а б Верб З, Лу П (июль – август 2015 г.). «Роль стромы в развитии опухоли» . Раковый журнал . 21 (4): 250–253. дои : 10.1097/PPO.0000000000000127 . ISSN 1540-336X . ПМЦ 4963227 . ПМИД 26222075 .
- ↑ Перейти обратно: Перейти обратно: а б с д Чжао Ю, Шен М, Ву Л, Ян Х, Яо Ю, Ян Ц и др. (04 сентября 2023 г.). «Стромальные клетки в микроокружении опухоли: соучастники опухолевой прогрессии?» . Смерть клеток и болезни . 14 (9): 587. doi : 10.1038/s41419-023-06110-6 . ISSN 2041-4889 . ПМЦ 10477351 . ПМИД 37666813 .
- ^ Белхабиб И, Загдуди С, Лак С, Буске С, Жан С (11 июля 2021 г.). «Внеклеточные матриксы и фибробласты, связанные с раком: мишени для диагностики и терапии рака?» . Раки . 13 (14): 3466. doi : 10.3390/cancers13143466 . ISSN 2072-6694 . ПМЦ 8303391 . ПМИД 34298680 .
- ^ Арора Л., Пал Д. (2021). «Ремоделирование стромальных клеток и иммунного ландшафта в микроокружении во время прогрессирования опухоли» . Границы онкологии . 11 . дои : 10.3389/fonc.2021.596798 . ISSN 2234-943X . ПМЦ 7982455 . ПМИД 33763348 .
- ↑ Перейти обратно: Перейти обратно: а б Глабман Р.А., Чойке П.Л., Сато Н. (январь 2022 г.). «Рак-ассоциированные фибробласты: туморогенность и нацеливание на терапию рака» . Раки . 14 (16): 3906. doi : 10.3390/cancers14163906 . ISSN 2072-6694 . ПМЦ 9405783 . ПМИД 36010899 .
- ^ Ян Д., Лю Дж., Цянь Х., Чжуан Ц. (июль 2023 г.). «Рак-ассоциированные фибробласты: от фундаментальной науки к противораковой терапии» . Экспериментальная и молекулярная медицина . 55 (7): 1322–1332. дои : 10.1038/s12276-023-01013-0 . ISSN 2092-6413 . ПМЦ 10394065 . ПМИД 37394578 .
- ↑ Перейти обратно: Перейти обратно: а б с Пин Q, Ян Р., Ченг Х, Ван В, Чжун Ю, Хоу З и др. (сентябрь 2021 г.). «Рак-ассоциированные фибробласты: обзор, прогресс, проблемы и направления» . Генная терапия рака . 28 (9): 984–999. дои : 10.1038/s41417-021-00318-4 . ISSN 1476-5500 . ПМИД 33712707 .
- ↑ Перейти обратно: Перейти обратно: а б Кордс Л., Титшер С., Анценедер Т., Лангвидер С., Рис М., де Соуза Н. и др. (18 июля 2023 г.). «Классификация фибробластов, связанных с раком, в данных одноклеточной и пространственной протеомики» . Природные коммуникации . 14 (1): 4294. Бибкод : 2023NatCo..14.4294C . дои : 10.1038/s41467-023-39762-1 . ISSN 2041-1723 . ПМЦ 10354071 . ПМИД 37463917 .
- ^ Сахай Э., Асцатуров И., Кукерман Э., ДеНардо Д.Г., Эгеблад М., Эванс Р.М. и др. (март 2020 г.). «Основы для углубления нашего понимания фибробластов, связанных с раком» . Обзоры природы Рак . 20 (3): 174–186. дои : 10.1038/s41568-019-0238-1 . ISSN 1474-1768 . ПМК 7046529 . ПМИД 31980749 .
- ^ Боннанс К., Чоу Дж., Верб З. (04 февраля 2015 г.). «Ремоделирование внеклеточного матрикса в развитии и заболеваниях» . Nature Reviews Молекулярно-клеточная биология . 15 (12): 786–801. дои : 10.1038/nrm3904 . ISSN 1471-0080 . ПМК 4316204 . ПМИД 25415508 .
- ^ Фромм Дж. Э., Зигрино П. (2022). «Роль ремоделирования внеклеточного матрикса в прогрессировании опухолей кожи и терапевтической резистентности» . Границы молекулярных биологических наук . 9 . дои : 10.3389/fmolb.2022.864302 . ISSN 2296-889X . ПМЦ 9086898 . ПМИД 35558554 .
- ^ Диллер РБ, Табор А.Дж. (01 июля 2022 г.). «Роль внеклеточного матрикса (ECM) в заживлении ран: обзор» . Биомиметика . 7 (3): 87. doi : 10.3390/biomimetics7030087 . ISSN 2313-7673 . ПМЦ 9326521 . ПМИД 35892357 .
- ^ Брассар-Паско С., Брезиллон С., Брассар Б., Рамон Л., Удар Ж.Б., Монбуас Ж.К. (2020). «Микроокружение опухоли: изменения внеклеточного матрикса влияют на прогрессирование опухоли» . Границы онкологии . 10 : 397. doi : 10.3389/fonc.2020.00397 . ISSN 2234-943X . ПМЦ 7174611 . ПМИД 32351878 .
- ↑ Перейти обратно: Перейти обратно: а б Мохан В., Дас А., Саги I (01.05.2020). «Новая роль процессов ремоделирования ЕСМ при раке». Семинары по биологии рака . Трансляция внеклеточного матрикса. 62 : 192–200. doi : 10.1016/j.semcancer.2019.09.004 . ISSN 1044-579X . ПМИД 31518697 . S2CID 202571768 .
- ^ Ларсен М., Артим В.В., Грин Дж.А., Ямада К.М. (01.10.2006). «Матрица реорганизовалась: ремоделирование внеклеточного матрикса и передача сигналов интегрина». Современное мнение в области клеточной биологии . Межклеточный контакт и внеклеточный матрикс. 18 (5): 463–471. дои : 10.1016/j.ceb.2006.08.009 . ISSN 0955-0674 . ПМИД 16919434 .
- ^ Кай Ф., Drain AP, Weaver VM (06 мая 2019 г.). «Внеклеточный матрикс модулирует метастатическое путешествие» . Развивающая клетка . 49 (3): 332–346. дои : 10.1016/j.devcel.2019.03.026 . ISSN 1878-1551 . ПМК 6527347 . ПМИД 31063753 .
- ↑ Перейти обратно: Перейти обратно: а б Дзобо К., Дандара К. (05.04.2023). «Внеклеточный матрикс: его состав, функции, ремоделирование и роль в опухолегенезе» . Биомиметика . 8 (2): 146. doi : 10.3390/biomimetics8020146 . ISSN 2313-7673 . ПМЦ 10123695 . ПМИД 37092398 .
- ^ Джуссани М, Триулзи Т, Соцци Г, Тальябуэ Э (23 января 2019 г.). «Ремоделирование опухолевого внеклеточного матрикса: новые перспективы как циркулирующего инструмента в диагностике и прогнозе солидных опухолей» . Клетки . 8 (2): 81. doi : 10.3390/cells8020081 . ISSN 2073-4409 . ПМК 6406979 . ПМИД 30678058 .
- ^ Вуллкопф Л., Вест А.К., Лейнсе Н., Кокс Т.Р., Мэдсен К.Д., Оддершеде Л.Б. и др. (октябрь 2018 г.). Дишер Д. (ред.). «Способность раковых клеток механически приспосабливаться к жесткости внеклеточного матрикса коррелирует с их инвазивным потенциалом» . Молекулярная биология клетки . 29 (20): 2378–2385. doi : 10.1091/mbc.E18-05-0319 . ISSN 1059-1524 . ПМК 6233061 . ПМИД 30091653 .
- ^ Попова Н.В., Юкер М. (январь 2022 г.). «Функциональная роль белков внеклеточного матрикса при раке» . Раки . 14 (1): 238. doi : 10.3390/cancers14010238 . ISSN 2072-6694 . ПМК 8750014 . ПМИД 35008401 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час Лей Икс, Лэй Ю, Ли Дж. К., Ду В. С., Ли Р. Г., Ян Дж. и др. (01.02.2020). «Иммунные клетки в микроокружении опухоли: биологические функции и роль в иммунотерапии рака». Письма о раке . 470 : 126–133. дои : 10.1016/j.canlet.2019.11.009 . ISSN 0304-3835 . ПМИД 31730903 . S2CID 208063582 .
- ^ Мантовани А., Аллавена П., Сика А., Балквилл Ф. (июль 2008 г.). «Раковое воспаление». Природа . 454 (7203): 436–444. Бибкод : 2008Natur.454..436M . дои : 10.1038/nature07205 . hdl : 2434/145688 . ПМИД 18650914 . S2CID 4429118 .
- ↑ Перейти обратно: Перейти обратно: а б Матиас Р.А., Гопал С.К., Симпсон Р.Дж. (январь 2013 г.). «Вклад клеток, претерпевающих эпителиально-мезенхимальный переход, в микроокружение опухоли». Журнал протеомики . 78 : 545–557. дои : 10.1016/j.jprot.2012.10.016 . ПМИД 23099347 .
- ^ Балквилл Ф., Чарльз К.А., Мантовани А. (март 2005 г.). «Тлеющее и поляризованное воспаление в инициировании и развитии злокачественных заболеваний» . Раковая клетка . 7 (3): 211–217. дои : 10.1016/j.ccr.2005.02.013 . ПМИД 15766659 .
- ^ Бисвас С.К., Ганги Л., Пол С., Скиоппа Т., Саккани А., Сирони М. и др. (март 2006 г.). «Отличная и уникальная программа транскрипции, экспрессируемая опухолеассоциированными макрофагами (дефектный NF-kappaB и повышенная активация IRF-3/STAT1)» . Кровь . 107 (5): 2112–2122. дои : 10.1182/кровь-2005-01-0428 . ПМИД 16269622 . S2CID 5884781 .
- ^ Цянь Б.З., Поллард Дж.В. (апрель 2010 г.). «Разнообразие макрофагов усиливает прогрессирование опухоли и метастазирование» . Клетка . 141 (1): 39–51. дои : 10.1016/j.cell.2010.03.014 . ПМЦ 4994190 . ПМИД 20371344 .
- ^ Чжан В, Ван Л, Чжоу Д, Цуй Ц, Чжао Д, Ву Ю (январь 2011 г.). «Экспрессия опухолеассоциированных макрофагов и фактора роста эндотелия сосудов коррелирует с плохим прогнозом периферической Т-клеточной лимфомы, не указано иное». Лейкемия и лимфома . 52 (1): 46–52. дои : 10.3109/10428194.2010.529204 . ПМИД 21077742 . S2CID 26116121 .
- ^ Чжан Б.С., Гао Дж., Ван Дж., Рао З.Г., Ван Б.С., Гао Дж.Ф. (декабрь 2011 г.). «Инфильтрация макрофагов, связанная с опухолью, связана с перитуморальным лимфангиогенезом и плохим прогнозом при аденокарциноме легких». Медицинская онкология . 28 (4): 1447–1452. дои : 10.1007/s12032-010-9638-5 . ПМИД 20676804 . S2CID 24840259 .
- ^ Ян М., Чен Дж., Су Ф., Ю Б., Су Ф., Лин Л. и др. (сентябрь 2011 г.). «Микровезикулы, секретируемые макрофагами, переносят микроРНК, усиливающие инвазию, в клетки рака молочной железы» . Молекулярный рак . 10 (117): 117. дои : 10.1186/1476-4598-10-117 . ПМК 3190352 . ПМИД 21939504 .
- ^ Коффелт С.Б., Велленштейн, доктор медицинских наук, де Виссер К.Е. (июль 2016 г.). «Нейтрофилы при раке: больше нет нейтральности» (PDF) . Обзоры природы. Рак . 16 (7): 431–446. дои : 10.1038/nrc.2016.52 . ПМИД 27282249 . S2CID 4393159 .
- ^ Джентлс А.Дж., Ньюман А.М., Лю К.Л., Брэтман С.В., Фенг В., Ким Д. и др. (август 2015 г.). «Прогностический ландшафт генов и проникновения иммунных клеток при раке человека» . Природная медицина . 21 (8): 938–945. дои : 10.1038/нм.3909 . ПМЦ 4852857 . ПМИД 26193342 .
- ^ Энгблом С., Пфиршке С., Питтет М.Дж. (июль 2016 г.). «Роль миелоидных клеток в терапии рака». Обзоры природы. Рак . 16 (7): 447–462. дои : 10.1038/nrc.2016.54 . ПМИД 27339708 . S2CID 21924175 .
- ^ Хуанг С.Х., Уолдрон Дж.Н., Милошевич М., Шен Х., Рингаш Дж., Су Дж. и др. (февраль 2015 г.). «Прогностическая ценность циркулирующих нейтрофилов, моноцитов и лимфоцитов перед лечением при раке ротоглотки, стратифицированная по статусу вируса папилломы человека» . Рак . 121 (4): 545–555. дои : 10.1002/cncr.29100 . ПМИД 25336438 . S2CID 926930 .
- ^ Цзян Л., Цзян С., Ситу Д., Линь Ю., Ян Х., Ли Ю. и др. (апрель 2015 г.). «Прогностическое значение соотношения моноцитов и нейтрофилов к лимфоцитам у больных метастатической саркомой мягких тканей» . Онкотаргет . 6 (11): 9542–9550. дои : 10.18632/oncotarget.3283 . ПМЦ 4496237 . ПМИД 25865224 .
- ^ Ву ВК, Сунь Х.В., Чен Х.Т., Лян Дж., Юй XJ, Ву С. и др. (март 2014 г.). «Циркулирующие гемопоэтические стволовые клетки и клетки-предшественники у онкологических больных имеют миелоидную предрасположенность» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (11): 4221–4226. Бибкод : 2014PNAS..111.4221W . дои : 10.1073/pnas.1320753111 . ПМЦ 3964061 . ПМИД 24591638 .
- ^ Коффелт С.Б., Керстен К., Дорнебал К.В., Вейден Дж., Врейланд К., Хау К.С. и др. (июнь 2015 г.). «IL-17-продуцирующие γδ Т-клетки и нейтрофилы способствуют метастазированию рака молочной железы» . Природа . 522 (7556): 345–348. Бибкод : 2015Natur.522..345C . дои : 10.1038/nature14282 . ПМЦ 4475637 . ПМИД 25822788 .
- ^ Энгблом С., Пфиршке С., Зилионис Р., Да Силва Мартинс Дж., Бос С.А., Кортис Г. и др. (декабрь 2017 г.). «Остеобласты удаленно снабжают опухоли легких способствующим развитию рака SiglecF. высокий нейтрофилы» . Science . 358 (6367): eaal5081. doi : 10.1126/ . PMC 6343476. . PMID 29191879 science.aal5081
- ^ Касбон А.Дж., Рейно Д., Парк С., Хук Э., Ган Д.Д., Шеперс К. и др. (февраль 2015 г.). «Инвазивный рак молочной железы перепрограммирует раннюю миелоидную дифференцировку в костном мозге для выработки иммуносупрессивных нейтрофилов» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (6): E566–E575. Бибкод : 2015PNAS..112E.566C . дои : 10.1073/pnas.1424927112 . ПМЦ 4330753 . ПМИД 25624500 .
- ^ Вцулек СК, Маланчи I (декабрь 2015 г.). «Нейтрофилы поддерживают колонизацию легких клетками рака молочной железы, инициирующими метастазирование» . Природа . 528 (7582): 413–417. Бибкод : 2015Natur.528..413W . дои : 10.1038/nature16140 . ПМК 4700594 . ПМИД 26649828 .
- ^ Финисгерра В., Ди Конза Г., Ди Маттео М., Сернилс Дж., Коста С., Томпсон А.А. и др. (июнь 2015 г.). «МЕТ необходим для привлечения противоопухолевых нейтрофилов» . Природа . 522 (7556): 349–353. Бибкод : 2015Natur.522..349F . дои : 10.1038/nature14407 . ПМЦ 4594765 . ПМИД 25985180 .
- ^ Гранот З., Хенке Э., Комен Э.А., Кинг Т.А., Нортон Л., Бенезра Р. (сентябрь 2011 г.). «Нейтрофилы, вовлеченные в опухоль, ингибируют посев в преметастатическое легкое» . Раковая клетка . 20 (3): 300–314. дои : 10.1016/j.ccr.2011.08.012 . ПМЦ 3172582 . ПМИД 21907922 .
- ^ «опухолеинфильтрирующий лимфоцит» . www.cancer.gov . 2 февраля 2011 г. Проверено 19 февраля 2024 г.
- ↑ Перейти обратно: Перейти обратно: а б с Уайтсайд ТЛ (2022). «Лимфоциты, инфильтрирующие опухоль, и их роль в прогрессировании солидной опухоли». Взаимодействие иммунных и раковых клеток . Дополнительный опыт. Том. 113. С. 89–106. дои : 10.1007/978-3-030-91311-3_3 . ISBN 978-3-030-91310-6 . ISSN 1664-431X . ПМК 9113058 . ПМИД 35165861 .
- ^ Тюркотт С., Розенберг С.А. (2011). «Иммунотерапия метастатического солидного рака» . Достижения хирургии . 45 : 341–360. дои : 10.1016/j.yasu.2011.04.003 . ПМЦ 3578602 . ПМИД 21954698 .
- ^ Валенти Р., Хубер В., Иеро М., Филипацци П., Пармиани Дж., Ривольтини Л. (апрель 2007 г.). «Высвобождаемые опухолью микровезикулы как средства иммуносупрессии» . Исследования рака . 67 (7): 2912–2915. дои : 10.1158/0008-5472.CAN-07-0520 . ПМИД 17409393 .
- ^ Клейтон А., Таби З. (май – июнь 2005 г.). «Экзосомы и система MICA-NKG2D при раке». Клетки крови, молекулы и болезни . 34 (3): 206–213. дои : 10.1016/j.bcmd.2005.03.003 . ПМИД 15885603 .
- ^ Фридман Л.П., Гибсон МС, Этье С.П., Соул Х.Р., Нив Р.М., Рид Ю.А. (июнь 2015 г.). «Воспроизводимость: изменение политики и культуры аутентификации клеточных линий». Природные методы . 12 (6): 493–497. дои : 10.1038/nmeth.3403 . ПМИД 26020501 . S2CID 20557369 .
- ^ Франки-Мендес Т., Эдуардо Р., Доменичи Дж., Брито К. (сентябрь 2021 г.). «3D-модели рака: изображение межклеточных перекрестных помех в микроокружении опухоли» . Раки . 13 (18): 4610. doi : 10.3390/cancers13184610 . ПМЦ 8468887 . ПМИД 34572836 .
- ^ Фэн Ю, Ляо З, Чжан Х, Се Икс, Ю Ф, Ляо Икс и др. (январь 2023 г.). «Новые стратегии наномедицины, ориентированные на микроокружение опухоли, предотвращающее рецидивы и метастазы рака». Химико-технологический журнал . 452 : 139506. Бибкод : 2023ChEnJ.45239506F . дои : 10.1016/j.cej.2022.139506 . S2CID 252676223 .
- ^ Раджу Г.С., Павитра Э., Варапрасад Г.Л., Бандару С.С., Нагараджу Г.П., Фарран Б. и др. (июнь 2022 г.). «Модуляция микроокружения опухоли, опосредованная наночастицами: текущие достижения и применения» . Журнал нанобиотехнологий . 20 (1): 274. дои : 10.1186/s12951-022-01476-9 . ПМЦ 9195263 . ПМИД 35701781 .
- ^ Унезаки С., Маруяма К., Хосода Дж.И., Нагаэ И., Коянаги Ю., Наката М. и др. (22 ноября 1996 г.). «Прямое измерение экстравазации липосом, покрытых полиэтиленгликолем, в ткань солидной опухоли с помощью флуоресцентной микроскопии in vivo». Международный фармацевтический журнал . 144 (1): 11–17. дои : 10.1016/S0378-5173(96)04674-1 .
- ^ Лилавиват С., Сардар Д., Яна С., Томас Г.К., Войцеховский К.Дж. (август 2012 г.). «Инкапсуляция нуклеиновых кислот in vivo с использованием сконструированного невирусного белкового капсида». Журнал Американского химического общества . 134 (32): 13152–13155. дои : 10.1021/ja302743g . ПМИД 22827162 .
- ^ Рамишетти С., Хуан Л. (декабрь 2012 г.). «Интеллектуальный дизайн многофункциональных платформ наночастиц с липидным покрытием для терапии рака» . Терапевтическая доставка . 3 (12): 1429–1445. дои : 10.4155/tde.12.127 . ПМЦ 3584330 . ПМИД 23323560 .
- ^ Джайн РК (июнь 1987 г.). «Транспорт молекул в интерстиции опухоли: обзор». Исследования рака . 47 (12): 3039–3051. ПМИД 3555767 .
- ^ Гарсия Дж., Гурвиц Х.И., Сэндлер А.Б., Майлз Д., Коулман Р.Л., Дерлоо Р. и др. (июнь 2020 г.). «Бевацизумаб (Авастин®) в лечении рака: обзор 15-летнего клинического опыта и перспективы на будущее» . Обзоры лечения рака . 86 : 102017. doi : 10.1016/j.ctrv.2020.102017 . ISSN 0305-7372 . ПМИД 32335505 .
- ^ Ли С, Цзян П, Вэй С, Сюй С, Ван Дж (июль 2020 г.). «Регуляторные Т-клетки в микроокружении опухоли: новые механизмы, потенциальные терапевтические стратегии и перспективы» . Молекулярный рак . 19 (1): 116. дои : 10.1186/s12943-020-01234-1 . ПМЦ 7367382 . ПМИД 32680511 .
- ^ «Ингибиторы протеинкиназы» , LiverTox: клиническая и исследовательская информация о лекарственном повреждении печени , Bethesda (MD): Национальный институт диабета, заболеваний органов пищеварения и почек, 2012 г., PMID 31643906 , получено 20 февраля 2024 г.
- ^ Тан ХЮ, Ван Н, Лам В, Го В, Фэн Ю, Ченг ЮК (19 февраля 2018 г.). «Нацеливание на микроокружение опухоли с помощью ингибитора тирозинкиназы» . Молекулярный рак . 17 (1): 43. дои : 10.1186/s12943-018-0800-6 . ISSN 1476-4598 . ПМЦ 5817793 . ПМИД 29455663 .
- ^ Мансур М.А., Капуто В.С., Алим Э (01.11.2021). «Основные сведения об избранных факторах роста и их рецепторах как перспективных мишенях для противораковых препаратов». Международный журнал биохимии и клеточной биологии . 140 : 106087. doi : 10.1016/j.biocel.2021.106087 . ISSN 1357-2725 . ПМИД 34563698 . S2CID 237943611 .
- ^ Канкеу Фонкуа Л.А., Сирпилла О, Сакемура Р., Зиглер Э.Л., Кендериан СС (16 июня 2022 г.). «CAR Т-клеточная терапия и микроокружение опухоли: текущие проблемы и возможности» . Молекулярная терапия – онколитики . 25 : 69–77. дои : 10.1016/j.omto.2022.03.009 . ISSN 2372-7705 . ПМЦ 8980704 . ПМИД 35434273 .
- ^ Чжан С., Дюрер С., Тандра К.С., Каси А. (2024), «Т-клеточная терапия химерными антигенными рецепторами» , StatPearls , Остров сокровищ (Флорида): StatPearls Publishing, PMID 30725979 , получено 20 февраля 2024 г.
- ^ Браун С.Э., Агилар Б., Старр Р., Ян Х, Чанг В.К., Венг Л. и др. (январь 2018 г.). «Оптимизация Т-клеток химерного антигенного рецептора, нацеленных на IL13Rα2, для повышения противоопухолевой эффективности против глиобластомы» . Молекулярная терапия . 26 (1): 31–44. дои : 10.1016/j.ymthe.2017.10.002 . ПМК 5763077 . ПМИД 29103912 .
- ^ Шуберт М.Л., Шмитт М., Ван Л., Рамос К.А., Джордан К., Мюллер-Тидоу С. и др. (01.01.2021). «Управление побочными эффектами Т-клеточной терапии химерными антигенными рецепторами (CAR)» . Анналы онкологии . 32 (1): 34–48. дои : 10.1016/j.annonc.2020.10.478 . ISSN 0923-7534 . ПМИД 33098993 .