Фосфат
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Фосфат [1] | |||
| Другие имена Ортофосфат Тетраоксофосфат(V) Тетраоксидофосфат(V) | |||
| Идентификаторы | |||
3D model ( JSmol ) |
| ||
| 3903772 | |||
| ЧЭБИ | |||
| ХимическийПаук | |||
| 1997 | |||
| МеШ | Фосфаты | ||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
| Характеристики | |||
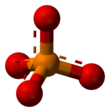
| PO 3− 4 | |||
| Молярная масса | 94.9714 g mol −1 | ||
| Конъюгатная кислота | Моногидрофосфат | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
В химии фосфат – это анион , соль , функциональная группа или сложный эфир, полученный из фосфорной кислоты . Чаще всего это означает ортофосфат , производное ортофосфорной кислоты, также известное как фосфорная кислота. Н 3 ПО 4 .
Фосфат ион или ортофосфат- [ PO
4 ] 3−
получается из фосфорной кислоты путем удаления трех протонов H +
. Удаление одного протона дает дигидрофосфата ион [ H
2 ПО
4 ] −
а удаление двух протонов дает гидрофосфата ион [HPO
4 ] 2−
. Эти названия также используются для солей этих анионов, таких как дигидрофосфат аммония и тринатрийфосфат .
- [PO
4 ] 3−
Фосфат или ортофосфат
В органической химии фосфат или ортофосфат — органофосфат , сложный эфир ортофосфорной кислоты формы PO.
4 RR'R″, где один или несколько атомов водорода заменены органическими группами. Примером является триметилфосфат CH (
3 )
33ПО
4 . Этот термин также относится к трехвалентной функциональной группе OP(O-)
3 в таких эфирах. Фосфаты могут содержать серу вместо одного или нескольких атомов кислорода ( тиофосфаты и органотиофосфаты ).
Ортофосфаты занимают особенно важное место среди различных фосфатов из-за их ключевой роли в биохимии , биогеохимии и экологии , а также их экономического значения для сельского хозяйства и промышленности. [2] Добавление и удаление фосфатных групп ( фосфорилирование и дефосфорилирование ) являются ключевыми этапами клеточного метаболизма .
Ортофосфаты могут конденсироваться с образованием пирофосфатов .
Химические свойства [ править ]
Фосфат-ион имеет молярную массу 94,97 г/моль и состоит из центрального атома фосфора, окруженного четырьмя атомами кислорода в тетраэдрическом расположении. Это сопряженное основание иона гидрофосфата H (PO
4 ) 2−
, который, в свою очередь, является сопряженным основанием иона дигидрофосфата H
2 (PO
4 ) −
, которое, в свою очередь, является сопряженным основанием ортофосфорной кислоты , H
33ПО
4 .
Многие фосфаты растворимы в воде при стандартной температуре и давлении . Фосфаты натрия, калия, рубидия , цезия и аммония растворимы в воде. Большинство других фосфатов мало растворимы или нерастворимы в воде. Как правило, водородные и дигидрофосфаты несколько более растворимы, чем соответствующие фосфаты.
Равновесия в растворе [ править ]

В водном растворе ортофосфорная кислота и три ее производных аниона сосуществуют в соответствии с приведенными ниже равновесиями диссоциации и рекомбинации. [3]
| Равновесие | Константа диссоциации K a [4] | п К а |
|---|---|---|
| Ч 3 ПО 4 ⇌ Ч 2 ПО − 4 + Ч + | р К а1 = 2,14 | |
| H 2 PO − 4 ⇌ HPO 2− 4 + H + | р К а2 = 7,20 | |
| ПО 2- 4 ⇌ ПО 3- 4 + Н + | р К а3 = 12,37 |
Значения указаны при температуре 25 °C и ионной силе 0.
Значения p K a представляют собой значения pH , при которых концентрация каждого вида равна концентрации его сопряженных оснований . При pH 1 или ниже фосфорная кислота практически не диссоциирует. При pH 4,7 (середина между первыми двумя значениями p K a ) ион дигидрофосфата [H
2 ПО
4 ] −
, практически единственный присутствующий вид. При pH 9,8 (середина между вторым и третьим значениями p K a ) ион моногидрофосфата [HPO
4 ] 2−
, единственный присутствующий вид. При pH 13 или выше кислота полностью диссоциирует в виде фосфат-иона (PO
4 ) 3−
.
Это означает, что соли моно- и дифосфат-ионов можно избирательно кристаллизовать из водного раствора, установив значение pH на уровне 4,7 или 9,8.
Фактически, Х
33ПО
4 , Ч
2 (PO
4 ) −
и H(PO
4 ) 2−
ведут себя как отдельные слабые кислоты , поскольку последовательные p K a различаются более чем в 4 раза.
Фосфат может образовывать множество полимерных таких как пирофосфат ионов , (P
22О
7 ) 4−
и трифосфат , (P
33О
10 ) 5−
. Различные ионы метафосфата (которые обычно представляют собой длинные линейные полимеры) имеют эмпирическую формулу (PO
3 ) −
и встречаются во многих соединениях.
Биохимия фосфатов [ править ]
В биологических системах фосфор может находиться в виде свободных фосфат-анионов в растворе ( неорганический фосфат ) или в виде связанных с органическими молекулами в виде различных органофосфатов .
Неорганический фосфат обычно обозначается и Pi при физиологическом ( гомеостатическом ) pH состоит в основном из смеси [HPO
4 ] 2−
и [Ч
2 ПО
4 ] −
ионы. При нейтральном pH, как и в цитозоле (pH = 7,0), концентрации ортофосфорной кислоты и трех ее анионов имеют соотношения
Таким образом, только [H
2 ПО
4 ] −
и [HPO
4 ] 2−
ионы присутствуют в цитозоле в значительных количествах (62% [H
2 ПО
4 ] −
, 38% [ГПО
4 ] 2−
). Во внеклеточной жидкости (рН = 7,4) эта пропорция обратная (61% [HPO
4 ] 2−
, 39% [Н
2 ПО
4 ] −
).
Неорганический фосфат также может присутствовать в виде пирофосфат- анионов [P
22О
7 ] 4−
, которые при гидролизе дают ортофосфат :
- [П
22О
7 ] 4−
+ Н 2 О ⇌ 2 [HPO
4 ] 2−
Органические фосфаты обычно встречаются в форме сложных эфиров в виде нуклеотидов (например, АМФ , АДФ и АТФ ), а также в ДНК и РНК . Свободные ортофосфат-анионы могут высвобождаться при гидролизе фосфоангидридных связей АТФ или АДФ. Эти реакции фосфорилирования и дефосфорилирования являются непосредственным хранилищем и источником энергии для многих метаболических процессов. АТФ и АДФ часто называют высокоэнергетическими фосфатами , как и фосфагены в мышечной ткани. Подобные реакции существуют и для других нуклеозиддифосфатов и трифосфатов .
Кости и зубы [ править ]
Важным явлением фосфатов в биологических системах является структурный материал костей и зубов. Эти структуры состоят из кристаллического фосфата кальция в форме гидроксиапатита . Твердая плотная эмаль зубов млекопитающих может содержать фторапатит , гидроксифосфат кальция , в котором некоторые гидроксильные группы заменены ионами фтора .
медицинских и биологических Использование в исследованиях
Фосфаты – это лекарственные соли фосфора. Некоторые фосфаты, которые помогают вылечить многие инфекции мочевыводящих путей , используются для повышения кислотности мочи. Чтобы избежать развития кальциевых камней в мочевыводящих путях, применяют некоторые фосфаты. [5] Пациентам, которые не могут получать достаточное количество фосфора с ежедневным рационом, фосфаты используются в качестве пищевых добавок, обычно из-за определенных нарушений или заболеваний. [5] С инъекционными фосфатами могут обращаться только квалифицированные медицинские работники. [5]
Метаболизм растений [ править ]
Растения поглощают фосфор несколькими путями: арбускулярным микоризным путем и путем прямого поглощения.
последствия Неблагоприятные для здоровья
Эта статья нуждается в дополнительных цитатах для проверки . ( июль 2022 г. ) |
Гиперфосфатемия , или высокий уровень фосфатов в крови, связана с повышенной смертностью среди населения в целом. Наиболее распространенной причиной гиперфосфатемии у людей, собак и кошек является почечная недостаточность. В случаях гиперфосфатемии ограничение потребления продуктов, богатых фосфатами, таких как некоторые мясные и молочные продукты, а также продуктов с высоким соотношением фосфатов к белкам, таких как безалкогольные напитки, фаст-фуд, обработанные пищевые продукты, приправы и другие продукты, содержащие фосфат. -рекомендуются солевые добавки. [6]
Фосфаты вызывают кальцификацию сосудов , а высокая концентрация фосфатов в крови оказалась предиктором сердечно-сосудистых событий . [7]
Производство [ править ]
Геологическое явление [ править ]


Фосфаты представляют собой природную форму элемента фосфора , который содержится во многих фосфатных минералах . В минералогии и геологии фосфатом называют горную породу или руду, содержащую ионы фосфата. Неорганические фосфаты добывают для получения фосфора для использования в сельском хозяйстве и промышленности. [2]
Крупнейшим мировым производителем и экспортером фосфатов является Марокко . В Северной Америке крупнейшие месторождения находятся в районе Bone Valley в центральной Флориде , в районе Сода-Спрингс на юго-востоке Айдахо и на побережье Северной Каролины . Меньшие месторождения расположены в Монтане , Теннесси , Джорджии и Южной Каролине . Небольшое островное государство Науру и его соседний остров Банаба , где раньше располагались огромные залежи фосфатов самого высокого качества, были добыты в чрезмерном количестве. Фосфат также можно найти в Египте, Израиле, Палестине, Западной Сахаре, на острове Навасса , Тунисе, Того и Иордании, странах с крупной промышленностью по добыче фосфатов.
Фосфоритовые рудники в основном находятся в:
- Северная Америка : Соединенные Штаты, особенно Флорида, с меньшими месторождениями в Северной Каролине , Айдахо и Теннесси.
- Африка : Марокко , Алжир , Египет , Нигер , Сенегал , Того , Тунис , Мавритания.
- Ближний Восток : Саудовская Аравия , Иордания , Израиль , Сирия , Иран и Ирак , в городе Акашат , недалеко от иорданской границы.
- Центральная Азия : Казахстан
- Океания : Австралия , Макатея , Науру и остров Банаба .
По оценкам, в 2007 году при нынешних темпах потребления запасы фосфора исчерпаются через 345 лет. [8] Однако некоторые ученые считали, что « пик фосфора » наступит через 30 лет, а Дана Корделл из Института устойчивого будущего заявила, что «при нынешних темпах запасы фосфора будут истощены в ближайшие 50–100 лет». [9] Под резервами понимается сумма, предположительно возмещаемая по текущим рыночным ценам. В 2012 году Геологическая служба США оценила мировые запасы в 71 миллиард тонн, тогда как в 2011 году во всем мире было добыто 0,19 миллиарда тонн. [10] Фосфор составляет 0,1% по массе средней породы. [11] (при этом его типичная концентрация в растительности составляет от 0,03% до 0,2%), [12] и, следовательно, в 3×10 Земли содержится квадриллионы тонн фосфора. 19 -тонная корочка, [13] хотя и преимущественно с более низкой концентрацией, чем месторождения, считающиеся запасами, которые инвентаризированы и их добыча дешевле. Если предположить, что фосфатные минералы в фосфоритной породе представляют собой в основном гидроксиапатит и фторапатит, фосфатные минералы содержат примерно 18,5% фосфора по массе. Если фосфоритная руда содержит около 20% этих минералов, то средняя фосфоритная руда содержит примерно 3,7% фосфора по весу.
Некоторые месторождения фосфоритов, такие как Малберри во Флориде, [14] примечательны наличием значительных количеств радиоактивных изотопов урана. Это вызывает беспокойство, поскольку радиоактивность может попасть в поверхностные воды. [15] от внесения полученного фосфорного удобрения .
В декабре 2012 года Cominco Resources объявила об обновленных соответствующих требованиям JORC ресурсах своего проекта Хинда в Конго-Браззавиле, , в размере 531 миллиона тонн, что делает его крупнейшим измеренным и выявленным месторождением фосфатов в мире. [16]
Примерно в 2018 году в Норвегии были обнаружены залежи фосфатов, почти равные запасам на всей остальной Земле вместе взятые. [17] [18]
В июле 2022 года Китай объявил о квотах на экспорт фосфатов. [19]
Крупнейшими импортерами фосфатов в миллионах тонн являются Бразилия (3,2), Индия (2,9) и США (1,6). [20]
Горное дело [ править ]
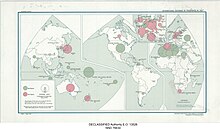
На три основные страны-производителя фосфатов (Китай, Марокко и США) приходится около 70% мирового производства.
| Страна | Производство (миллионы кг) | Доля глобальный производство (%) | Резервы (миллионы кг) |
|---|---|---|---|
| Алжир | 1,300 | 0.54 | 2,200,000 |
| Австралия | 2,700 | 1.17 | 1,100,000 |
| Бразилия | 4,700 | 3.00 | 1,600,000 |
| Китай | 95,000 | 44.83 | 3,200,000 |
| Египет | 5,000 | 2.47 | 2,800,000 |
| Финляндия | 995 | - | 1,000,000 |
| Индия | 1,480 | 0.49 | 46,000 |
| Ирак | 200 | 0.09 | 430,000 |
| Израиль | 2,810 | 1.48 | 57,000 |
| Иордания | 9,220 | 3.36 | 800,000 |
| Казахстан | 1,500 | 0.72 | 260,000 |
| Мексика | 558 | 0.76 | 30,000 |
| Марокко и Западная Сахара | 35,500 | 13.45 | 50,000,000 |
| Перу | 4,000 | 1.79 | 210,000 |
| Россия | 13,100 | 5.60 | 600,000 |
| Саудовская Аравия | 6,500 | 1.48 | 1,400,000 |
| Сенегал | 3,420 | 0.45 | 50,000 |
| ЮАР | 2,100 | 0.99 | 1,400,000 |
| Сирия | 2,000 | 0.34 | 1,800,000 |
| Togo | 800 | 0.45 | 30,000 |
| Тунис | 4,110 | 1.79 | 100,000 |
| Узбекистан | 900 | - | 100,000 |
| Соединенные Штаты | 23,300 | 12.37 | 1,000,000 |
| Вьетнам | 4,650 | 1.21 | 30,000 |
| Другие страны | 1,140 | 1.17 | 840,000 |
| Общий | 227,000 | 100 | 71,000,000 |
Экология [ править ]
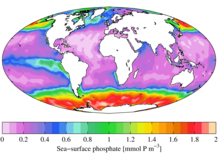

С экологической точки зрения, из-за своей важной роли в биологических системах фосфат является весьма востребованным ресурсом. После использования он часто становится лимитирующим питательным веществом в окружающей среде , и его доступность может определять скорость роста организмов. В целом это справедливо для пресноводной среды, тогда как азот чаще является лимитирующим питательным веществом в морской (морской) среде. Добавление высоких уровней фосфатов в окружающую среду и микросреду, где они обычно встречаются редко, может иметь серьезные экологические последствия. Например, может произойти цветение популяций одних организмов за счет других, а также коллапс популяций, лишенных таких ресурсов, как кислород (см. Эвтрофикация ). В контексте загрязнения фосфаты являются одним из компонентов общего количества растворенных твердых веществ , что является основным показателем качества воды, но не весь фосфор находится в молекулярной форме, которую водоросли могут расщеплять и потреблять. [22]
верхнем слое почвы можно обнаружить осадки гидроксиапатита кальция и кальцита Вокруг бактерий в аллювиальном . [23] Поскольку глинистые минералы способствуют биоминерализации, присутствие бактерий и глинистых минералов приводило к выпадению в осадок гидроксиапатита кальция и кальцита. [23]
Отложения фосфатов могут содержать значительные количества встречающихся в природе тяжелых металлов. При горнодобывающей деятельности по переработке фосфоритной руды могут образовываться отвалы отходов с повышенным содержанием кадмия , свинца , никеля , меди , хрома и урана . Без тщательного обращения эти отходы могут привести к выщелачиванию тяжелых металлов в грунтовые воды или близлежащие устья рек. Поглощение этих веществ растениями и морскими обитателями может привести к концентрации токсичных тяжелых металлов в пищевых продуктах. [24]
См. также [ править ]
- Диаммонийфосфат - (NH 4 ) 2 HPO 4
- Динатрийфосфат – Na 2 HPO 4
- Удобрения
- Гипофосфит – H
2 (PO
2 ) − - Метафосфат - (PO н
3) - Монофосфат натрия – NaH 2 PO 4
- Фосфорорганические соединения
- Бассейн Улед Абдун
- Фосфат – OP(OR) 3 , например трифенилфосфат.
- Фосфатное конверсионное покрытие
- Фосфатная сода , газированный напиток
- Фосфинат – OP(OR)R 2
- Фосфин – ПР 3
- Оксид фосфина – OPR 3
- Фосфинит – P(OR)R 2
- Фосфит – P(OR) 3
- фосфогипс
- Фосфонат – ОП(ОР) 2 Р
- Фосфонит – P(OR) 2 R
- фосфорилирование
- Полифосфат – (HPO
3 )
н - Пирофосфат - (P
22О
7 ) 4− - Триполифосфат натрия – Na 5 P 3 O 10
Ссылки [ править ]
- ^ «Фосфаты - Публичная химическая база данных PubChem» . Проект ПабХим . США: Национальный центр биотехнологической информации.
- ↑ Перейти обратно: Перейти обратно: а б «Фосфатный праймер» . Флоридский научно-исследовательский институт промышленности и фосфатов . Политехнический университет Флориды. Архивировано из оригинала 29 августа 2017 года . Проверено 30 марта 2018 г.
- ^ Кэмпбелл, Нил А .; Рис, Джейн Б. (2005). Биология (Седьмое изд.). Сан-Франциско, Калифорния: Бенджамин Каммингс . п. 65. ИСБН 0-8053-7171-0 .
- ^ Киптон Дж. Пауэлл, Пол Л. Браун, Роберт Х. Бирн, Тамаш Гайда, Гленн Хефтер, Стаффан Сьёберг, Ханс Ваннер (2005): «Химическое образование экологически значимых тяжелых металлов с неорганическими лигандами. Часть 1: Hg 2+
, кл − , ОЙ − , Колорадо 2−
3 , ТАК 2−
4 и ПО 3−
4 водные системы». Чистая и прикладная химия , том 77, выпуск 4, страницы 739–800. дои : 10.1351/pac200577040739 - ↑ Перейти обратно: Перейти обратно: а б с «Описание фосфатной добавки (пероральный, парентеральный) и торговые марки — клиника Майо» . www.mayoclinic.org . Проверено 20 ноября 2020 г.
- ^ Команда почечных диетологов, Снижение содержания фосфатов в рационе , Фонд NHS Foundation Hospital Оксфордского университета, обзор 2022 г.
- ^ Ритц, Эберхард; Хан, Кай; Кеттелер, Маркус; Кульманн, Мартин К.; Манн, Йоханнес (январь 2012 г.). «Фосфатные добавки в продуктах питания — риск для здоровья» . Немецкий международный медицинский журнал . 109 (4): 49–55. дои : 10.3238/arztebl.2012.0049 . ISSN 1866-0452 . ПМЦ 3278747 . ПМИД 22334826 .
- ^ Рейли, Майкл (26 мая 2007 г.). «Как долго это продлится?». Новый учёный . 194 (2605): 38–9. Бибкод : 2007NewSc.194...38R . дои : 10.1016/S0262-4079(07)61508-5 .
- ^ Лео Льюис (23 июня 2008 г.). «Ученые предупреждают о нехватке жизненно важного фосфора, поскольку биотопливо повышает спрос» . Таймс .
- ^ Геологическая служба США, фосфатная порода
- ^ Геологическая служба США «Образцы фосфорной почвы» (PDF) .
- ^ Этаж Антони. «Изобилие стихий» . Seafriends.org.nz . Проверено 10 января 2013 г.
- ^ Американский геофизический союз , осеннее собрание 2007 г., реферат № V33A-1161. Масса и состав континентальной коры
- ^ Фосфатная промышленность Центральной Флориды: Заявление о воздействии на окружающую среду . Том. 2. США. Агентство по охране окружающей среды. 1979.
- ^ К. Майкл Хоган (2010). «Загрязнение воды» . В Марке МакГинли и К. Кливленде (Вашингтон, округ Колумбия: Национальный совет по науке и окружающей среде ) (ред.). Энциклопедия Земли . Архивировано из оригинала 16 сентября 2010 г.
- ^ «Обновленное объявление о ресурсах Хинда: теперь это крупнейшее в мире месторождение фосфатов (12.04.2012)» . Ресурсы Коминко . Архивировано из оригинала 5 октября 2016 г. Проверено 3 мая 2013 г.
- ^ Бушуев Михаил (26 января 2021 г.). «ЕС возлагает надежды на норвежское сырье» . Проверено 2 июля 2023 г.
- ^ https://www.euractiv.com/section/energy-environment/news/great-news-eu-hails-discovery-of-massive-фосфат-rock-deposit-in-norway/
- ^ "Китай вводит квоты на фосфаты, чтобы обуздать экспорт удобрений - аналитики" . Рейтер . 15 июля 2022 г.
- ^ «Лучшие страны по импорту фосфорных удобрений» .
- ^ «ФОСФАТ, USGS» (PDF) .
- ^ Хочанадель, Дэйв (10 декабря 2010 г.). «Ограниченное количество общего фосфора на самом деле питает водоросли, как показало исследование» . Озерный учёный . Проверено 10 июня 2012 г.
По словам Майкла Бретта, профессора инженерии Университета Вашингтона, [B]ioдоступный фосфор – фосфор, который может быть использован растениями и бактериями – составляет лишь часть от общего количества…
- ↑ Перейти обратно: Перейти обратно: а б Шмиттнер К.Е., Жиресс П. (1999). «Микроэкологический контроль биоминерализации: поверхностные процессы осаждения апатита и кальцита в четвертичных почвах, Руссильон, Франция». Седиментология . 46 (3): 463–76. Бибкод : 1999Седим..46..463С . дои : 10.1046/j.1365-3091.1999.00224.x . S2CID 140680495 .
- ^ Гнанди, К.; Чангбеджил, Г.; Киллил, К.; Бабал, Г.; Аббель, Э. (март 2006 г.). «Влияние хвостов фосфатных шахт на биоаккумуляцию тяжелых металлов в морских рыбах и ракообразных прибрежной зоны Того». Шахтная вода и окружающая среда . 25 (1): 56–62. дои : 10.1007/s10230-006-0108-4 . S2CID 129497587 .
Внешние ссылки [ править ]
- Браузер данных о минералах США предоставляет графические данные о потреблении, производстве, импорте, экспорте и ценах на фосфаты и 86 других полезных ископаемых.
- Фосфат: монография по аналитам – Ассоциация клинической биохимии и лабораторной медицины


![[H 2PO 4]- Дигидрофосфат](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/2-dihydrogenphosphate-3D-balls.png/209px-2-dihydrogenphosphate-3D-balls.png)
![[HPO 4]2- Фосфат водорода](http://upload.wikimedia.org/wikipedia/commons/thumb/8/87/1-hydrogenphosphate-3D-balls.png/169px-1-hydrogenphosphate-3D-balls.png)
![[PO 4]3- Фосфат или ортофосфат](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b0/0-phosphate-3D-balls.png/165px-0-phosphate-3D-balls.png)
![{\displaystyle K_{a1}={\frac {[{\ce {H+}}][{\ce {H2PO4-}}]}{[{\ce {H3PO4}}]}}\около 7,5\times 10 ^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eed347325ee75e9e7cec75402ae9a0d68c5aca9a)
![{\displaystyle K_{a2}={\frac {[{\ce {H+}}][{\ce {HPO4^2-}}]}{[{\ce {H2PO4-}}]}}\приблизительно 6,2 \times 10^{-8}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3795cf914ff31fa4feb59c417cc8ae8da71ef519)
![{\displaystyle K_{a3}={\frac {[{\ce {H+}}][{\ce {PO4^3-}}]}{[{\ce {HPO4^2-}}]}}\ примерно 2,14\times 10^{-13}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90d1ae9985ce6207490cf9e7a6ab1f6d001a8a24)
![{\displaystyle {\begin{aligned}{\frac {[{\ce {H2PO4-}}]}{[{\ce {H3PO4}}]}}&\приблизительно 7,5\times 10^{4}\\[ 4pt]{\frac {[{\ce {HPO4^2-}}]}{[{\ce {H2PO4-}}]}}&\approx 0,62\\[4pt]{\frac {[{\ce { PO4^3-}}]}{[{\ce {HPO4^2-}}]}}&\approx 2,14\times 10^{-6}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7bfb55f5ed7d0ba3805ba68970255099eca8291)