Фосфат аммония
| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
фосфат аммония
| |
| Другие имена
триаммонийфосфат
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.709 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
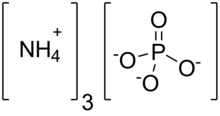
| (NH 4 ) 3 ПО 4 | |
| Молярная масса | 149.09 g/mol |
| Появление | Белые тетраэдрические кристаллы |
| 58,0 г/100 мл (25 °С) | |
| Растворимость | Нерастворим в ацетоне [ 2 ] |
| Опасности | |
| СГС Маркировка : | |

| |
| Предупреждение | |
| Х302 , Х319 | |
| P264 , P270 , P280 , P301+P312 , P305+P351+P338 , P330 , P337+P313 , P501 | |
| NFPA 704 (огненный алмаз) | |
| Термохимия | |
Стандартная энтальпия
образование (Δ f H ⦵ 298 ) |
−1671,9 кДж/моль |
| Родственные соединения | |
Другие катионы
|
Тринатрийфосфат Трикалия фосфат |
Родственные соединения
|
Диаммонийфосфат Моноаммонийфосфат |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Фосфат аммония представляет собой соединение формулы PO (NH 4 ) 3 4 неорганическое . Это аммониевая соль ортофосфорной кислоты. Родственная «двойная соль» (NH 4 ) 3 PO 4. . (NH 4 ) 2 HPO 4 также известен, но его непрактично использовать. Обе триаммониевые соли выделяют аммиак. В отличие от нестабильной природы триаммониевых солей, диаммонийфосфат (NH 4 ) 2 HPO 4 и моноаммонийная соль (NH 4 )H 2 PO 4 являются стабильными материалами, которые обычно используются в качестве удобрений для обеспечения растений фиксированным азотом и фосфором. [ 3 ]
Получение триаммонийфосфата
[ редактировать ]Триаммонийфосфат можно получить в лаборатории обработкой 85% фосфорной кислоты 30% раствором аммиака: [ нужна ссылка ]
- H 3 PO 4 + 3 NH 3 → (NH 4 ) 3 PO 4
(NH 4 ) 3 PO 4 представляет собой бесцветное кристаллическое твердое вещество. Твердое вещество, имеющее запах аммиака, легко растворяется в воде. Соль превращается в гидрофосфат диаммония (NH 4 ) 2 HPO 4 .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Лиде, Дэвид Р. (1998). Справочник по химии и физике (87 изд.). Бока-Ратон, Флорида: CRC Press. стр. 4–42, 5–19. ISBN 978-0-8493-0594-8 .
- ^ Джон Рамбл (18 июня 2018 г.). Справочник CRC по химии и физике (99-е изд.). ЦРК Пресс. стр. 4–41. ISBN 978-1138561632 .
- ^ Шрёдтер, Клаус; Беттерманн, Герхард; Стаффель, Томас; Валь, Фридрих; Кляйн, Томас; Хофманн, Томас (2008). «Фосфорная кислота и фосфаты». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a19_465.pub3 . ISBN 978-3527306732 .
