Ромбовидная протеаза
| Ромбовидный | |||
|---|---|---|---|
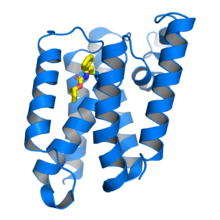 Escherichia coli Ромбоидная протеаза GlpG в комплексе с ингибитором бета-лактамов (желтый), связанным с каталитическим остатком серина . Из PDB : 3ZMH . [ 1 ] | |||
| Идентификаторы | |||
| Символ | Ромбовидный | ||
| Пфам | PF01694 | ||
| Пфам Клан | CL0207 | ||
| ИнтерПро | ИПР002610 | ||
| МЕРОПС | С54 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 144092 / SCOPe / СУПФАМ | ||
| Суперсемейство OPM | 165 | ||
| белок OPM | 2ic8 | ||
| |||
Ромбовидные протеазы представляют собой семейство ферментов , существующих почти у всех видов. Это протеазы : они разрезают полипептидную цепь других белков. Это протеолитическое расщепление необратимо в клетках и является важным типом клеточной регуляции. Хотя протеазы являются одним из самых ранних и наиболее изученных классов ферментов, ромбоиды принадлежат к гораздо более недавно открытому типу: внутримембранным протеазам . Уникальность внутримембранных протеаз заключается в том, что их активные центры скрыты в липидном бислое клеточных мембран и они расщепляют другие трансмембранные белки внутри своих трансмембранных доменов . [ 2 ] Около 30% всех белков имеют трансмембранные домены, и их регулируемый процессинг часто имеет серьезные биологические последствия. Соответственно, ромбовидные мышцы регулируют многие важные клеточные процессы и могут быть вовлечены в широкий спектр заболеваний человека.
Внутримембранные протеазы
[ редактировать ]Ромбоиды представляют собой внутримембранные сериновые протеазы . [ 3 ] [ 4 ] [ 5 ] [ 6 ] : Абстрактный Другими типами внутримембранных протеаз являются аспартил- и металлопротеазы соответственно. Пресенилины рецептор и семейство сигнальных пептидаз- подобных пептидаз, которые представляют собой внутримембранные аспартилпротеазы, расщепляют субстраты, которые включают Notch и белок-предшественник амилоида , который участвует в болезни Альцгеймера . Семейство протеаз сайта-2 , которые представляют собой внутримембранные металлопротеазы, регулируют, среди прочего, биосинтез холестерина и реакции на стресс у бактерий . Различные семейства внутримембранных протеаз эволюционно и механистически не связаны между собой, но существуют четкие общие функциональные особенности, которые их связывают. Ромбоиды, пожалуй, наиболее охарактеризованный класс.
История
[ редактировать ]Ромбоиды были впервые названы в честь мутации плодовой мухи Drosophila , обнаруженной в ходе знаменитого генетического скрининга, который привел к Нобелевской премии Кристиан Нюсляйн-Фольхард и Эрика Вишауса . [ 7 ] В ходе этого скрининга они обнаружили ряд мутантов со схожими фенотипами: «заостренными» эмбриональными скелетами головы. [ 6 ] : 192 Каждому из них они дали заостренное имя — одно было ромбовидным. Сначала это заметили, потому что мутация нарушила развитие, [ 8 ] : 237 генетический анализ позже доказал, что эта группа генов была членами сигнального пути рецептора эпидермального фактора роста (EGF) , [ 9 ] [ 10 ] [ 6 ] : 192 [ 8 ] : аннотация, 239 и этот ромбовидный отросток был необходим для генерации сигнала, который активирует рецептор EGF. [ 11 ] [ 12 ] [ 6 ] : 192 Чтобы разгадать молекулярную функцию ромбовидной кости, потребовалось немного больше времени, но сочетание генетики и молекулярных методов привело к открытию, что дрозофила ромбовидная [ 6 ] : 192, рис. 1 и другие члены семейства были первыми известными внутримембранными сериновыми протеазами. [ 3 ]
Функция
[ редактировать ]Ромбоиды были впервые обнаружены как протеазы, которые регулируют передачу сигналов рецептора EGF у дрозофилы . Высвобождая внеклеточный домен фактора роста Spitz из его трансмембранного предшественника, ромбовидная мышца запускает передачу сигналов. [ 3 ] С тех пор было предложено множество других важных биологических функций. [ 6 ] : 196 [ 13 ]
- Позже было показано, что Rhomboid-1 дрозофилы регулирует сон посредством новой функции уже открытого механизма. [ 6 ] : 201–2
- Хотя это и менее четко установлено, чем у дрозофилы , есть некоторые доказательства того, что ромбовидные кости могут участвовать в передаче сигналов факторов роста у млекопитающих, включая человека. [ 14 ] [ 8 ] : 240, Ромбовидные протеазы млекопитающих. Они также участвуют в передаче сигналов эфрина . [ 15 ] расщепление антикоагулянтного белка тромбомодулина [ 16 ] и заживление ран . [ 17 ]
- У всех эукариот есть митохондриальный ромб. Было показано, что у дрожжей это контролирует функцию и морфологию митохондрий, регулируя слияние мембран посредством расщепления динамин -подобной ГТФазы, называемой Mgm1p, ортолога человеческого OPA1 . [ 18 ] [ 19 ] У дрозофилы митохондриальный ромбовидный (Ромбоид-7) [ 8 ] : 240–1, Митохондриальные ромбоиды. также регулирует слияние митохондриальных мембран. [ 20 ] Drosophila Opa1 и Rhomboid-7, по-видимому, имеют те же взаимоотношения, что и у дрожжей. [ 6 ] : 201 У млекопитающих функция митохондрий также нарушена у мутантов PARL , митохондриального ромбоида, но диапазон функций более сложен. PARL регулирует ремоделирование митохондриальных крист . [ 21 ] участвует в гибели клеток [ 21 ] и обмен веществ , [ 22 ] и появляется все больше доказательств важной роли в болезни Паркинсона ; [ 23 ] [ 24 ] [ 25 ]
- Ромбовидные кости апикомплексных паразитов (включая Plasmodium , возбудитель малярии , и токсоплазму ) используются для перемещения между прикреплением к клетке-мишени и проникновением в нее. [ 26 ] : 582, Рисунок 1 и самая микронема [ 27 ] : 519 -продуцируемые адгезины высвобождаются из микронемы ромбовидными мышцами. [ 26 ] : 581 [ 28 ] [ 29 ] [ 30 ] [ 31 ] [ 32 ] [ 33 ] Ромбоиды также участвуют в патогенности других паразитов. [ 34 ] В частности, у токсоплазмы некоторые серпины ингибируют ромбоиды. [ 27 ] : 519
- Ромбоид у грамотрицательных бактерий Providencia stuartii необходим для функционирования механизма транслокации белка-близнеца аргинина (ТАТ). [ 35 ]
- Ромбоиды контролируют передачу сигналов рецептора EGF у Caenorhabditis elegans , как и у Drosophila . [ 6 ] : 201
Структура
[ редактировать ]Ромбоиды были первыми внутримембранными протеазами, для которых была решена кристаллическая структура с высоким разрешением . [ 36 ] [ 37 ] [ 38 ] [ 39 ] [ 40 ] Эти структуры подтвердили предсказания о том, что ромбоиды имеют ядро из шести трансмембранных доменов и что каталитический сайт зависит от каталитической диады серина и гистидина. Структуры также объяснили, как протеолитическая реакция, для которой необходимы молекулы воды, может происходить в гидрофобной среде липидного бислоя: одна из центральных загадок внутримембранных протеаз. [ 41 ] Активный центр ромбовидной протеазы находится в гидрофильном углублении, в принципе доступном для воды из основного раствора. [ 36 ] [ 37 ] [ 38 ] [ 39 ] [ 40 ] Однако было высказано предположение, что может существовать вспомогательный механизм, облегчающий доступ молекул воды к каталитической диаде в нижней части активного центра для обеспечения каталитической эффективности. [ 42 ]
Активный центр ромбовидной протеазы защищен латерально от липидного бислоя шестью составляющими его трансмембранными спиралями, что позволяет предположить, что доступ субстрата к ромбовидному активному сайту регулируется. Одной из областей неопределенности является путь доступа к субстрату . Первоначально предлагалось вводить субстраты между трансмембранными сегментами (ТМС) 1 и 3. [ 36 ] [ 39 ] но имеющиеся данные убедительно подтверждают наличие альтернативной точки доступа между TMS 2 и 5. [ 37 ] [ 38 ] [ 40 ] [ 43 ] [ 44 ] Это мнение также подтверждается тем фактом, что мутации в TMS 5 оказывают лишь незначительное влияние на термодинамическую стабильность ромбоида, в отличие от других участков молекулы. [ 45 ] Совсем недавно была создана первая сокристаллическая структура внутримембранной протеазы. [ 46 ] - Escherichia coli . Версия ромбовидной протеазы GlpG, принадлежащая [ 8 ] : 239 – и пептид, полученный из субстрата, связанный в активном центре [ 46 ] подтверждает и расширяет эту модель доступа к субстрату и дает представление о механизме действия других белков ромбовидного суперсемейства. [ нужна ссылка ] GlpG E. coli необычен своей низкой аффинностью связывания фермента/субстрата . [ 8 ] : 239 Однако детали того, как субстрат ТМС может быть распознан ромбовидным отростком, все еще неясны. Некоторые авторы предполагают, что доступ к субстрату включает в себя большое латеральное смещение TMS 5, чтобы открыть сердцевину ромбовидной кости. [ 37 ] [ 43 ] Другие отчеты вместо этого предполагают, что большое латеральное перемещение TMS 5 не требуется. [ 47 ] и предположили, что поверхность TMS 2 и 5 скорее служит «внутримембранным экзозитом», опосредующим узнавание субстрата TMS. [ 46 ] [ 48 ] Ромбовидный ортолог у D. suzukii — Dsuz\DS10_00004507. [ 49 ]
Ферментативная специфичность
[ редактировать ]Ромбоиды не расщепляют все трансмембранные домены. Фактически они высокоспецифичны и имеют ограниченное количество субстратов. Большинство известных на сегодняшний день природных ромбовидных субстратов представляют собой белки с одним трансмембранным доменом типа 1, аминоконцы которых находятся в люминальном/внеклеточном компартменте. Однако недавние исследования показали, что мембранный белок типа 2 (т.е. с противоположной топологией: аминоконец цитоплазматический), [ 50 ] или даже многопроходные мембранные белки могут действовать как ромбовидные субстраты. [ 51 ] Специфичность ромбовидных мышц лежит в основе их способности контролировать функции в широком диапазоне биологических процессов и, в свою очередь, понимание того, что превращает конкретный трансмембранный домен в ромбовидный субстрат, может пролить свет на функцию ромбовидных мышц в различных контекстах.
Первоначальная работа показала, что ромбоиды распознают нестабильность трансмембранной альфа-спирали в месте расщепления как основную детерминанту субстрата. [ 52 ] Совсем недавно было обнаружено, что ромбовидные субстраты определяются двумя разделяемыми элементами: трансмембранным доменом и мотивом первичной последовательности, находящимся в нем или непосредственно прилегающим к нему. [ 48 ] Этот мотив узнавания определяет, где расщепляется субстрат, что может происходить либо внутри, либо сразу за пределами трансмембранного домена, в околомембранной области. [ 48 ] В первом случае для эффективного расщепления также необходимы остатки, дестабилизирующие спираль, расположенные ниже по ходу субстрата ТМС. [ 48 ] Детальный анализ кинетики ферментов фактически показал, что взаимодействия мотива узнавания с ромбовидным активным центром определяют k cat расщепления субстрата. [ 53 ] Принципы распознавания субстрата TMS ромбовидными мышцами остаются плохо изученными, но многочисленные данные указывают на то, что ромбовидные кости (и, возможно, также другие внутримембранные протеазы ) каким-то образом распознают структурную гибкость или динамику трансмембранного домена своих субстратов. [ 42 ] [ 54 ] Полное понимание задействованных биофизических и структурных принципов потребует структурной характеристики комплекса ромбовидной кости с полным трансмембранным субстратом. [ 55 ] В качестве первого шага на пути к этой цели недавняя сокристаллическая структура фермента в комплексе с пептидом, полученным из субстрата, содержащим ингибитор на основе механизма, объясняет наблюдаемые предпочтения последовательностей мотивов узнавания в ромбовидных субстратах структурно и обеспечивает значительный прогресс в современной науке. понимание ромбовидной специфичности и механизма белков ромбовидного семейства. [ 46 ]
У некоторых грамотрицательных бактерий, включая Shewanella и Vibrio , обнаружено до тринадцати белков с GlyGly-CTERM, С-концевым гомологичным доменом, состоящим из богатого глицином мотива, высокогидрофобной трансмембранной спирали и кластера основных остатков. Этот домен, по-видимому, представляет собой последовательность узнавания ромбосортазы, ветви семейства ромбовидных протеаз, ограниченной только теми бактериями, у которых есть домен GlyGly-CTERM. [ 56 ]
Медицинское значение
[ редактировать ]Уже известно, что разнообразие биологических функций, зависящих от ромбовидных мышц, отражено в доказательствах того, что ромбовидные мышцы играют роль в различных заболеваниях, включая рак , [ нужна ссылка ] паразитарная инфекция, [ 13 ] и диабет . [ нужна ссылка ] Однако важно отметить, что еще не установлено ни одного случая, когда точное медицинское значение было бы полностью подтверждено. [ 6 ]
О препаратах, модулирующих активность ромбовидной мышцы, пока не сообщалось, хотя недавнее исследование выявило низкомолекулярные ингибиторы, основанные на механизме действия, которые могут стать основой для будущей разработки лекарств. [ 57 ]
Семейство ромбовидных
[ редактировать ]Ромбовидные протеазы, по-видимому, консервативны у всех эукариот и подавляющего большинства прокариот . Биоинформатический анализ показывает, что у некоторых членов семейства ромбовидных отсутствуют аминокислотные остатки, необходимые для протеолиза, а это означает, что они не могут расщеплять субстраты. Эти «псевдопротеазы» включают подсемейство, получившее название iRhoms. [ 58 ] (также известный как RHBDF1 и RHBDF2 ). iRhoms может способствовать ER-ассоциированной деградации (ERAD) лигандов рецепторов EGF у дрозофилы , обеспечивая тем самым механизм регуляции активности рецепторов EGF в головном мозге. [ 59 ] Это означает, что фундаментальный механизм контроля качества клеток используется многоклеточными организмами для регулирования передачи сигналов между клетками. У мышей iRhoms являются ключевыми шаперонами, необходимыми для экспорта ER ADAM17 /TACE и его созревания. Таким образом, iRhoms необходимы для передачи сигналов рецепторам TNF-альфа и EGF , что делает их очень привлекательными с медицинской точки зрения. [ 59 ] [ 60 ] [ 61 ] [ 62 ] [ 63 ]
Филогенетический анализ показывает, что ромбоиды на самом деле являются членами более крупного ромбовидного суперсемейства или клана, который включает белки дерлин , также участвующие в ERAD. [ 64 ]
Кинетопластиды имеют необычно небольшой набор ромбовидных семейств : у Trypanosoma brucei XP 001561764 и XP 001561544 , а также у T. cruzi XP 805971 , XP 802860 и XP 821055 . [ 65 ]
Различные белки семейства ромбовидных жизненно важны для Toxoplasma gondii вирулентности и подвижности , включая TgMIC2 , TgMIC6 , различные AMA1, варианты включая TgAMA1 , TgROM1 , TgROM4 и TgROM5 . [ 66 ]
Митохондрии трипаносом имеют TimRhom I и TimRhom II (два члена ромбовидного семейства с деактивированной протеолитической функцией) в своих транслоказах препоследовательности . Трудность в обнаружении большего сходства с эукариотическими или бактериальными родственниками может означать, что они произошли как часть исходного митохондриального предшественника. [ 67 ] Родственниками ромбовидной формы могут быть мембранные транспортные белки в системах ERAD и SELMA . [ 67 ] : 105
iRhoms
[ редактировать ]iRhoms представляют собой ромбовидные белки, но не являются протеазами. Как и ромбовидные кости, они были впервые обнаружены у дрозофил . Однако, в отличие от ромбоидов, iRhoms ингибируют передачу сигналов EGFr. Мыши, нокаутные по iRhom2, имеют серьезные нарушения иммунитета. [ 8 ] : 243, iРомс
Ссылки
[ редактировать ]- ^ Виноткумар К.Р., Пьеррат О.А., Лардж Дж.М., Фриман М. (июнь 2013 г.). «Структура ромбовидной протеазы в комплексе с ингибиторами β-лактамов определяет полость S2'» . Структура . 21 (6): 1051–8. дои : 10.1016/j.str.2013.03.013 . ПМЦ 3690538 . ПМИД 23665170 .
- ^ Браун М.С., Йе Дж., Роусон Р.Б., Гольдштейн Дж.Л. (февраль 2000 г.). «Регулируемый внутримембранный протеолиз: механизм контроля, сохраняющийся от бактерий до человека» . Клетка . 100 (4): 391–8. дои : 10.1016/S0092-8674(00)80675-3 . ПМИД 10693756 . S2CID 12194770 .
- ^ Jump up to: а б с Урбан С., Ли-младший, Фриман М. (октябрь 2001 г.). «Дрозофила ромбовидная-1 определяет семейство предполагаемых внутримембранных сериновых протеаз» . Клетка . 107 (2): 173–82. дои : 10.1016/s0092-8674(01)00525-6 . ПМИД 11672525 . S2CID 9026083 .
- ^ Лемберг М.К., Менендес Дж., Мисик А., Гарсия М., Кот К.М., Фриман М. (февраль 2005 г.). «Механизм внутримембранного протеолиза, исследованный с помощью очищенных ромбовидных протеаз» . Журнал ЭМБО . 24 (3): 464–72. дои : 10.1038/sj.emboj.7600537 . ПМЦ 548647 . ПМИД 15616571 .
- ^ Урбан С., Вулф М.С. (февраль 2005 г.). «Восстановление внутримембранного протеолиза in vitro показывает, что чистого ромбоида достаточно для катализа и специфичности» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (6): 1883–8. Бибкод : 2005ПНАС..102.1883У . дои : 10.1073/pnas.0408306102 . ПМК 548546 . ПМИД 15684070 .
- ^ Jump up to: а б с д и ж г час я дж Фриман М. (2008). «Ромбовидные протеазы и их биологические функции». Ежегодный обзор генетики . 42 : 191–210. дои : 10.1146/annurev.genet.42.110807.091628 . ПМИД 18605900 .
- ^ Юргенс Г., Вишаус Э., Нюссляйн-Фольхард С., Клудинг Х. (сентябрь 1984 г.). «Мутации, влияющие на рисунок личиночной кутикулы Drosophila melanogaster: II. Зиготические локусы на третьей хромосоме». Архив биологии развития Вильгельма Ру . 193 (5): 283–295. дои : 10.1007/BF00848157 . ПМИД 28305338 . S2CID 26608498 .
- ^ Jump up to: а б с д и ж г Фриман М (2014). «Ромбовидное суперсемейство: молекулярные механизмы и биологическая роль» . Ежегодный обзор клеточной биологии и биологии развития . 30 : 235–54. doi : 10.1146/annurev-cellbio-100913-012944 . ПМИД 25062361 . S2CID 31705365 .
- ^ Стертевант М.А., Роарк М., Бир Э. (июнь 1993 г.). «Ромбовидный ген дрозофилы опосредует локализованное образование жилок крыльев и генетически взаимодействует с компонентами сигнального пути EGF-R» . Гены и развитие . 7 (6): 961–73. дои : 10.1101/gad.7.6.961 . ПМИД 8504935 .
- ^ Фриман М. (октябрь 1994 г.). «Ген шпица необходим для определения фоторецепторов в глазу дрозофилы, где он взаимодействует с рецептором EGF». Механизмы развития . 48 (1): 25–33. дои : 10.1016/0925-4773(94)90003-5 . ПМИД 7833286 . S2CID 40396109 .
- ^ Вассерман Дж. Д., Урбан С., Фриман М. (июль 2000 г.). «Семейство ромбоподобных генов: ромбовидный-1 и рогоидный/ромбоидный-3 дрозофилы взаимодействуют, чтобы активировать передачу сигналов рецептора ЭФР» . Гены и развитие . 14 (13): 1651–63. дои : 10.1101/gad.14.13.1651 . ПМК 316740 . ПМИД 10887159 .
- ^ Банг А.Г., Кинтнер С. (январь 2000 г.). «Ромбовидная форма и звезда облегчают презентацию и обработку гомолога TGF-альфа шпица дрозофилы» . Гены и развитие . 14 (2): 177–86. дои : 10.1101/gad.14.2.177 . ПМК 316351 . ПМИД 10652272 .
- ^ Jump up to: а б Урбан С (июнь 2009 г.). «Делаем разрез: центральная роль внутримембранного протеолиза у патогенных микроорганизмов» . Обзоры природы. Микробиология . 7 (6): 411–23. дои : 10.1038/nrmicro2130 . ПМК 2818034 . ПМИД 19421188 .
- ^ Адрайн С., Срисовский К., Зеттл М., Ху Л., Лемберг М.К., Фриман М. (май 2011 г.). «Активация рецептора EGF млекопитающих ромбовидной протеазой RHBDL2» . Отчеты ЭМБО . 12 (5): 421–7. дои : 10.1038/embor.2011.50 . ПМК 3090019 . ПМИД 21494248 .
- ^ Паскаль Дж.К., Браун К.Д. (апрель 2004 г.). «Внутримембранное расщепление эфрина B3 протеазой ромбовидного семейства человека, RHBDL2». Связь с биохимическими и биофизическими исследованиями . 317 (1): 244–52. дои : 10.1016/j.bbrc.2004.03.039 . ПМИД 15047175 .
- ^ Лохи О., Урбан С., Фриман М. (февраль 2004 г.). «Различные механизмы распознавания субстратов ромбовидных мышц; тромбомодулин расщепляется ромбовидными мышцами млекопитающих» . Современная биология . 14 (3): 236–41. дои : 10.1016/j.cub.2004.01.025 . ПМИД 14761657 . S2CID 17760607 .
- ^ Ченг Т.Л., Ву Ю.Т., Линь Х.И., Сюй Ф.К., Лю С.К., Чанг Б.И. и др. (декабрь 2011 г.). «Функции протеазы ромбовидного семейства RHBDL2 и тромбомодулина в заживлении ран» . Журнал исследовательской дерматологии . 131 (12): 2486–94. дои : 10.1038/jid.2011.230 . ПМИД 21833011 .
- ^ Херлан М., Фогель Ф., Борнховд К., Нойперт В., Райхерт А.С. (июль 2003 г.). «Процессинг Mgm1 протеазой ромбовидного типа Pcp1 необходим для поддержания морфологии митохондрий и митохондриальной ДНК» . Журнал биологической химии . 278 (30): 27781–8. дои : 10.1074/jbc.m211311200 . ПМИД 12707284 .
- ^ МакКиббан Г.А., Саурья С., Фриман М. (май 2003 г.). «Ремоделирование митохондриальной мембраны, регулируемое консервативной ромбовидной протеазой» . Природа . 423 (6939): 537–41. Бибкод : 2003Natur.423..537M . дои : 10.1038/nature01633 . ПМИД 12774122 . S2CID 4398146 .
- ^ МакКиббан Г.А., Ли-младший, Чжэн Л., Юсола М., Фриман М. (май 2006 г.). «Нормальная динамика митохондрий требует ромбоида-7 и влияет на продолжительность жизни дрозофилы и функцию нейронов» . Современная биология . 16 (10): 982–9. дои : 10.1016/j.cub.2006.03.062 . ПМИД 16713954 . S2CID 18751418 .
- ^ Jump up to: а б Циполат С., Рудка Т., Хартманн Д., Коста В., Сернелс Л., Краессертс К. и др. (июль 2006 г.). «Митохондриальный ромбовидный PARL регулирует высвобождение цитохрома с во время апоптоза посредством OPA1-зависимого ремоделирования крист» . Клетка . 126 (1): 163–75. дои : 10.1016/j.cell.2006.06.021 . ПМИД 16839884 . S2CID 6396519 .
- ^ Чивитарезе А.Е., Маклин П.С., Карлинг С., Керр-Бейлс Л., Макмиллан Р.П., Пирс А. и др. (май 2010 г.). «Регуляция окислительной способности скелетных мышц и передачи сигналов инсулина с помощью митохондриальной ромбоидной протеазы PARL» . Клеточный метаболизм . 11 (5): 412–26. дои : 10.1016/j.cmet.2010.04.004 . ПМЦ 3835349 . ПМИД 20444421 .
- ^ Уитворт А.Дж., Ли-младший, Хо В.М., Флик Р., Чоудхури Р., МакКиббан Г.А. (2008). «Ромбоид-7 и HtrA2/Omi действуют по общему пути с факторами болезни Паркинсона Pink1 и Parkin» . Модели и механизмы заболеваний . 1 (2–3): 168–74, обсуждение 173. doi : 10.1242/dmm.000109 . ПМК 2562193 . ПМИД 19048081 .
- ^ Деас Э., План-Фавро Х., Ганди С., Десмонд Х., Кьер С., Ло Ш. и др. (март 2011 г.). «Расщепление PINK1 в положении A103 митохондриальной протеазой PARL» . Молекулярная генетика человека . 20 (5): 867–79. дои : 10.1093/hmg/ddq526 . ПМК 3033179 . ПМИД 21138942 .
- ^ Мейснер С., Лоренц Х., Вайхофен А., Селькое Д.Д., Лемберг М.К. (июнь 2011 г.). «Митохондриальная внутримембранная протеаза PARL расщепляет человеческий Pink1, чтобы регулировать трафик Pink1» . Журнал нейрохимии . 117 (5): 856–67. дои : 10.1111/j.1471-4159.2011.07253.x . ПМИД 21426348 .
- ^ Jump up to: а б Бисио Х., Солдати-Фавр Д. (сентябрь 2019 г.). «Сигнальные каскады, управляющие входом и выходом из клеток-хозяев Toxoplasma gondii » . Ежегодный обзор микробиологии . 73 (1). Годовые обзоры : 579–599. doi : 10.1146/annurev-micro-020518-120235 . ПМИД 31500539 . S2CID 202405949 .
- ^ Jump up to: а б МакКерроу Дж. Х., Кэффри С., Келли Б., Локи П., Саджид М. (2006). «Протеазы при паразитарных заболеваниях». Ежегодный обзор патологии . 1 (1). Годовые обзоры : 497–536. doi : 10.1146/annurev.pathol.1.110304.100151 . ПМИД 18039124 .
- ^ Урбан С., Фриман М. (июнь 2003 г.). «Субстратная специфичность ромбовидных внутримембранных протеаз регулируется остатками, разрывающими спираль, в трансмембранном домене субстрата» . Молекулярная клетка . 11 (6): 1425–34. дои : 10.1016/s1097-2765(03)00181-3 . ПМИД 12820957 .
- ^ Бейкер Р.П., Видетилака Р., Урбан С. (октябрь 2006 г.). «Две ромбовидные протеазы Plasmodium преимущественно расщепляют различные адгезины, участвующие во всех инвазивных стадиях малярии» . ПЛОС Патогены . 2 (10): е113. дои : 10.1371/journal.ppat.0020113 . ПМК 1599764 . ПМИД 17040128 .
- ^ О'Доннелл Р.А., Хакетт Ф., Хауэлл С.А., Трик М., Страк Н., Крнайски З. и др. (сентябрь 2006 г.). «Внутримембранный протеолиз опосредует отщепление ключевого адгезина во время инвазии эритроцитов малярийным паразитом» . Журнал клеточной биологии . 174 (7): 1023–33. дои : 10.1083/jcb.200604136 . ПМК 2064393 . ПМИД 17000879 .
- ^ Сантос Дж. М., Фергюсон Д. Д., Блэкман М. Дж., Солдати-Фавр Д. (январь 2011 г.). «Внутримембранное расщепление AMA1 заставляет токсоплазму переключаться с инвазивного на репликативный режим» . Наука . 331 (6016): 473–7. Бибкод : 2011Sci...331..473S . дои : 10.1126/science.1199284 . ПМИД 21205639 . S2CID 26806264 .
- ^ Шринивасан П., Коппенс И., Джейкобс-Лорена М. (январь 2009 г.). «Особая роль ромбовидного плазмодия 1 в развитии паразитов и патогенезе малярии» . ПЛОС Патогены . 5 (1): e1000262. дои : 10.1371/journal.ppat.1000262 . ПМК 2607553 . ПМИД 19148267 .
- ^ Лин Дж.В., Мейрелеш П., Пруденсио М., Энгельманн С., Анноура Т., Саджид М. и др. (апрель 2013 г.). «Анализ потери функции определяет жизненно важные и избыточные функции семейства ромбовидных протеаз Plasmodium» . Молекулярная микробиология . 88 (2): 318–38. дои : 10.1111/mmi.12187 . ПМИД 23490234 .
- ^ Бакст Л.А., Бейкер Р.П., Сингх У., Урбан С. (июнь 2008 г.). «Ромбовидная протеаза Entamoeba histolytica с атипичной специфичностью расщепляет поверхностный лектин, участвующий в фагоцитозе и уклонении от иммунитета» . Гены и развитие . 22 (12): 1636–46. дои : 10.1101/gad.1667708 . ПМК 2428061 . ПМИД 18559479 .
- ^ Стивенсон Л.Г., Срисовский К., Клеммер К.М., Бхатт С., Фриман М., Разер П.Н. (январь 2007 г.). «Ромбоидная протеаза AarA опосредует чувство кворума у Providencia stuartii путем активации TatA транслоказы-твинаргинина» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (3): 1003–8. Бибкод : 2007PNAS..104.1003S . дои : 10.1073/pnas.0608140104 . ПМЦ 1783354 . ПМИД 17215357 .
- ^ Jump up to: а б с Ван Ю, Чжан Ю, Ха Ю (ноябрь 2006 г.). «Кристаллическая структура внутримембранной протеазы ромбовидного семейства». Природа . 444 (7116): 179–80. Бибкод : 2006Natur.444..179W . дои : 10.1038/nature05255 . ПМИД 17051161 . S2CID 4350345 .
- ^ Jump up to: а б с д Ву З, Ян Н., Фэн Л., Оберштейн А., Ян Х., Бейкер Р.П. и др. (декабрь 2006 г.). «Структурный анализ внутримембранной протеазы ромбовидного семейства выявляет механизм пропускания субстрата». Структурная и молекулярная биология природы . 13 (12): 1084–91. дои : 10.1038/nsmb1179 . ПМИД 17099694 . S2CID 8308111 .
- ^ Jump up to: а б с Бен-Шем А., Фасс Д., Биби Э. (январь 2007 г.). «Структурные основы внутримембранного протеолиза ромбовидными сериновыми протеазами» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (2): 462–6. Бибкод : 2007PNAS..104..462B . дои : 10.1073/pnas.0609773104 . ПМК 1766407 . ПМИД 17190827 .
- ^ Jump up to: а б с Лемье М.Ю., Фишер С.Дж., Черный М.М., Бейтман К.С., Джеймс М.Н. (январь 2007 г.). «Кристаллическая структура ромбовидной пептидазы Haemophilus influenzae дает представление о внутримембранном протеолизе» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (3): 750–4. Бибкод : 2007PNAS..104..750L . дои : 10.1073/pnas.0609981104 . ПМЦ 1783385 . ПМИД 17210913 .
- ^ Jump up to: а б с Виноткумар КР (март 2011 г.). «Строение ромбовидной протеазы в липидном окружении» . Журнал молекулярной биологии . 407 (2): 232–47. дои : 10.1016/j.jmb.2011.01.029 . ПМЦ 3093617 . ПМИД 21256137 .
- ^ Лемберг М.К., Фриман М. (декабрь 2007 г.). «Разрезание белков внутри липидных бислоев: ромбовидная структура и механизм» . Молекулярная клетка . 28 (6): 930–40. doi : 10.1016/j.molcel.2007.12.003 . ПМИД 18158892 .
- ^ Jump up to: а б Мойн С.М., Урбан С. (ноябрь 2012 г.). «Погружение в мембрану позволяет ромбовидным протеазам достигать специфичности путем считывания динамики трансмембранных сегментов» . электронная жизнь . 1 : e00173. doi : 10.7554/eLife.00173 . ПМК 3494066 . ПМИД 23150798 .
- ^ Jump up to: а б Бейкер Р.П., Янг К., Фэн Л., Ши Ю, Урбан С. (май 2007 г.). «Ферментативный анализ ромбовидной внутримембранной протеазы предполагает, что трансмембранная спираль 5 выступает в качестве латеральных ворот субстрата» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (20): 8257–62. дои : 10.1073/pnas.0700814104 . ЧВК 1895938 . ПМИД 17463085 .
- ^ Ван Ю, Маэгава С, Акияма Ю, Ха Ю (декабрь 2007 г.). «Роль петли L1 в механизме действия ромбовидной внутримембранной протеазы GlpG» . Журнал молекулярной биологии . 374 (4): 1104–13. дои : 10.1016/j.jmb.2007.10.014 . ПМК 2128867 . ПМИД 17976648 .
- ^ Бейкер Р.П., Урбан С. (сентябрь 2012 г.). «Архитектурные и термодинамические принципы, лежащие в основе функции внутримембранной протеазы» . Химическая биология природы . 8 (9): 759–68. дои : 10.1038/nchembio.1021 . ПМК 4028635 . ПМИД 22797666 .
- ^ Jump up to: а б с д Золл С., Станчев С., Беган Дж., Скерле Дж., Лепшик М., Пеклиновска Л., Майер П., Срисовский К. (октябрь 2014 г.). «Связывание с субстратом и специфичность ромбовидной внутримембранной протеазы, выявляемая структурами комплекса субстрат-пептид» . Журнал ЭМБО . 33 (20): 2408–21. дои : 10.15252/embj.201489367 . ПМЦ 4253528 . ПМИД 25216680 .
- ^ Сюэ Ю, Ха Ю (июнь 2013 г.). «Большое латеральное перемещение трансмембранной спирали S5 не требуется для доступа субстрата к активному центру ромбовидной внутримембранной протеазы» . Журнал биологической химии . 288 (23): 16645–54. дои : 10.1074/jbc.M112.438127 . ПМЦ 3675599 . ПМИД 23609444 .
- ^ Jump up to: а б с д Срисовский К., Шарп Х.Дж., Фриман М. (декабрь 2009 г.). «Последовательность-специфичный внутримембранный протеолиз: идентификация мотива узнавания в ромбовидных субстратах» . Молекулярная клетка . 36 (6): 1048–59. doi : 10.1016/j.molcel.2009.11.006 . ПМК 2941825 . ПМИД 20064469 .
- ^ «Отчет о генах FlyBase: Dmel\rho» . ФлайБейс . 13 апреля 2021 г. Проверено 8 июня 2021 г. Ларкин А., Мэриголд С.Дж., Антонаццо Дж., Аттрилл Х., Дос Сантос Дж., Гарапати П.В. и др. (январь 2021 г.). «FlyBase: обновления базы знаний Drosophila melanogaster » Исследования нуклеиновых кислот . 49 (Д1):D899–D907. дои : 10.1093/nar/gkaa1026 . ПМЦ 7779046 . ПМИД 33219682 .
- ^ Цруя Р., Войталла А., Кармон С., Йогев С., Райх А., Биби Е. и др. (март 2007 г.). «Ромбовидная мышца расщепляет Звезду, чтобы регулировать уровень секретируемого шпица» . Журнал ЭМБО . 26 (5): 1211–20. дои : 10.1038/sj.emboj.7601581 . ПМК 1817629 . ПМИД 17304216 .
- ^ Флейг Л., Бергболд Н., Сахасрабуде П., Гейгер Б., Калтак Л., Лемберг М.К. (август 2012 г.). «Убиквитин-зависимая внутримембранная ромбовидная протеаза способствует ERAD мембранных белков» . Молекулярная клетка . 47 (4): 558–69. doi : 10.1016/j.molcel.2012.06.008 . ПМИД 22795130 .
- ^ Акияма Ю., Маэгава С. (май 2007 г.). «Особенности последовательности субстратов, необходимых для расщепления GlpG, ромбовидной протеазой Escherichia coli». Молекулярная микробиология . 64 (4): 1028–37. дои : 10.1111/j.1365-2958.2007.05715.x . ПМИД 17501925 . S2CID 33930463 .
- ^ Дики С.В., Бейкер Р.П., Чо С., Урбан С. (декабрь 2013 г.). «Протеолиз внутри мембраны — это реакция с регулируемой скоростью, не обусловленная сродством к субстрату» . Клетка . 155 (6): 1270–81. дои : 10.1016/j.cell.2013.10.053 . ПМЦ 3917317 . ПМИД 24315097 .
- ^ Лангош Д., Шарнагль К., Штайнер Х., Лемберг М.К. (июнь 2015 г.). «Понимание внутримембранного протеолиза: от динамики белков к кинетике реакции». Тенденции биохимических наук . 40 (6): 318–27. дои : 10.1016/j.tibs.2015.04.001 . ПМИД 25941170 .
- ^ Срисовский К. (апрель 2013 г.). «Структурные и механистические принципы внутримембранного протеолиза - уроки ромбовидных мышц». Журнал ФЭБС . 280 (7): 1579–603. дои : 10.1111/февраль 12199 . ПМИД 23432912 . S2CID 6316872 .
- ^ Хафт Д.Х., Варгезе Н. (2011). «GlyGly-CTERM и ромбосортаза: сигнал обработки C-концевого белка в паре «многие к одному» с внутримембранной сериновой протеазой ромбовидного семейства» . ПЛОС ОДИН . 6 (12): e28886. Бибкод : 2011PLoSO...628886H . дои : 10.1371/journal.pone.0028886 . ПМЦ 3237569 . ПМИД 22194940 .
- ^ Пьерра О.А., Срисовский К., Христова Ю., Лардж Дж., Анселл К., Булок Н., Смильянич Э., Фриман М. (апрель 2011 г.). «Моноциклические β-лактамы являются селективными ингибиторами ромбовидных внутримембранных протеаз по механизму действия» . АКС Химическая биология . 6 (4): 325–35. дои : 10.1021/cb100314y . ПМК 3077804 . ПМИД 21175222 .
- ^ Лемберг М.К., Фриман М. (ноябрь 2007 г.). «Функциональные и эволюционные последствия расширенного геномного анализа ромбовидных внутримембранных протеаз» . Геномные исследования . 17 (11): 1634–46. дои : 10.1101/гр.6425307 . ПМК 2045146 . ПМИД 17938163 .
- ^ Jump up to: а б Зеттл М., Адрайн С., Срисовский К., Ластун В., Фриман М. (апрель 2011 г.). «Псевдопротеазы ромбовидного семейства используют механизм контроля качества ER для регулирования межклеточной передачи сигналов» . Клетка . 145 (1): 79–91. дои : 10.1016/j.cell.2011.02.047 . ПМК 3149277 . ПМИД 21439629 .
- ^ Адрайн С., Зеттл М., Христова Ю., Тейлор Н., Фриман М. (январь 2012 г.). «Передача сигналов фактора некроза опухоли требует, чтобы iRhom2 способствовал транспортировке и активации TACE» . Наука . 335 (6065): 225–8. Бибкод : 2012Sci...335..225A . дои : 10.1126/science.1214400 . ПМЦ 3272371 . ПМИД 22246777 .
- ^ Макилвейн Д.Р., Ланг П.А., Марецки Т., Хамада К., Охиши К., Мани С.К. и др. (январь 2012 г.). «Регуляция iRhom2 ТАСЕ контролирует TNF-опосредованную защиту от листерий и реакцию на ЛПС» . Наука . 335 (6065): 229–32. Бибкод : 2012Sci...335..229M . дои : 10.1126/science.1214448 . ПМК 4250273 . ПМИД 22246778 .
- ^ Христова Ю., Адрен С., Бэмбро П., Ибрагим А., Фриман М. (октябрь 2013 г.). «iRhoms млекопитающих выполняют различные физиологические функции, включая важную роль в регуляции TACE» . Отчеты ЭМБО . 14 (10): 884–90. дои : 10.1038/embor.2013.128 . ПМК 3807218 . ПМИД 23969955 .
- ^ Ли X, Марецки Т., Вескамп Г., Монетт С., Цин Х, Иссури П.Д. и др. (май 2015 г.). «iRhoms 1 и 2 являются важными вышестоящими регуляторами ADAM17-зависимой передачи сигналов EGFR» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (19): 6080–5. Бибкод : 2015PNAS..112.6080L . дои : 10.1073/pnas.1505649112 . ПМЦ 4434755 . ПМИД 25918388 .
- ^ «Клан: Ромбовидные (CL0207)» . Пфам .
- ^ М. Сантос Дж., Грейндордж А., Солдати-Фавр Д. (2012). «Новый взгляд на ромбовидные протеазы паразитов» . Молекулярная и биохимическая паразитология . 182 (1–2). Эльзевир : 27–36. дои : 10.1016/j.molbiopara.2011.11.010 . ПМИД 22173057 .
- ^ Догга СК, Солдати-Фавр Д (декабрь 2016 г.). «Биология ромбовидных протеаз при инфекционных заболеваниях». Семинары по клеточной биологии и биологии развития . 60 . Эльзевир : 38–45. дои : 10.1016/j.semcdb.2016.08.020 . ПМИД 27567708 . S2CID 34820332 . п. 41:
2.3.1
- ^ Jump up to: а б Харсман А., Шнайдер А. (февраль 2017 г.). «Импорт митохондриального белка в трипаносомы: ждите неожиданностей» . Трафик . 18 (2). Уайли-Блэквелл : 96–109. дои : 10.1111/tra.12463 . ПМИД 27976830 . S2CID 206334512 . : 103
Дальнейшее чтение
[ редактировать ]Внешние ссылки
[ редактировать ]- «Сводка по семейству S54 (семейство Ромбовидные)» . МЕРОПС .
- «ЕС 3.4.21.105» . Экспаси . SIB Швейцарский институт биоинформатики.