Опсин


Опсины животных представляют собой рецепторы, связанные с G-белком , и группу белков, которые становятся светочувствительными с помощью хромофора , обычно сетчатки . При связывании с сетчаткой опсины становятся ретинилиденовыми белками , но обычно их все равно называют опсинами. они обнаружены в фоторецепторных клетках сетчатки Наиболее заметно . Пять классических групп опсинов участвуют в зрении , обеспечивая преобразование фотона света в электрохимический сигнал, первый этап каскада зрительной трансдукции . Другой опсин, обнаруженный в сетчатке млекопитающих, меланопсин , участвует в циркадных ритмах и зрачковом рефлексе , но не в зрении. Всего у человека девять опсинов. Помимо зрения и восприятия света, опсины могут также чувствовать температуру , звук или химические вещества .
Структура и функции
[ редактировать ]Опсины животных обнаруживают свет и являются молекулами, которые позволяют нам видеть. Опсины представляют собой рецепторы, связанные с G-белком (GPCR), [1] [2] которые являются хеморецепторами и имеют семь трансмембранных доменов, образующих карман связывания для лиганда. [3] [4] Лигандом опсинов является витамина А. на основе хромофор 11- цис -ретиналь [5] [6] [7] [8] [9] который ковалентно связан с лизина остатком [10] в седьмом трансмембранном домене [11] [12] [13] через Шиффову базу . [14] [15] Однако 11- цис -ретиналь только блокирует связывающий карман и не активирует опсин. Опсин активируется только тогда, когда 11- цис -ретиналь поглощает фотон света и изомеризуется в полностью транс -ретиналь. [16] [17] форма, активирующая рецептор, [18] [19] вызывая конформные изменения в опсине, [18] которые активируют каскад фототрансдукции . [20] Таким образом, хеморецептор преобразуется в световой или фото(n)рецептор . [21]
В фоторецепторных клетках позвоночных полностью транс -ретиналь высвобождается и заменяется вновь синтезированным 11- цис -ретиналем, поступающим из эпителиальных клеток сетчатки. Помимо 11- цис -ретиналя (А1), 11- цис -3,4-дидегидроретиналь (А2) также обнаружен у позвоночных в качестве лиганда, например, у пресноводных рыб. [19] Опсины, связанные с A2, имеют смещенный λ max и спектр поглощения по сравнению с опсинами, связанными с A1. [22]
Функционально консервативные остатки и мотивы
[ редактировать ]Семь трансмембранных α-спиральных доменов опсинов соединены тремя внеклеточными и тремя цитоплазматическими петлями. Вдоль α-спиралей и петель многие аминокислотные остатки высококонсервативны между всеми группами опсина, что указывает на то, что они выполняют важные функции и поэтому называются функционально консервативными остатками . На самом деле вставки и делеции в α-спиралях очень редки и преимущественно должны происходить в петлях. Следовательно, разные рецепторы, связанные с G-белком, имеют разную длину и гомологичные остатки могут находиться в разных положениях. Чтобы сделать такие позиции сопоставимыми между различными рецепторами, Баллестерос и Вайнштейн ввели общую схему нумерации рецепторов, связанных с G-белком. [23] Число перед точкой — это номер трансмембранного домена. Число после точки устанавливается произвольно равным 50 для наиболее консервативного остатка в этом трансмембранном домене среди GPCR, известных в 1995 году. Например, в седьмом трансмембранном домене пролин в высококонсервативном NPxxY 7.53 мотив Pro 7.50 , аспарагин перед этим будет Asp 7.49 , а тирозин, находящийся через три остатка после него, представляет собой Tyr 7.53 . [21] Другая схема нумерации основана на родопсине крупного рогатого скота . крупного рогатого скота Родопсин содержит 348 аминокислот и является первым опсином, аминокислотная последовательность которого [24] и чья 3D-структура была определена. [12] Схема нумерации родопсинов крупного рогатого скота широко распространена в литературе по опсинам. [21] Поэтому полезно использовать обе схемы.
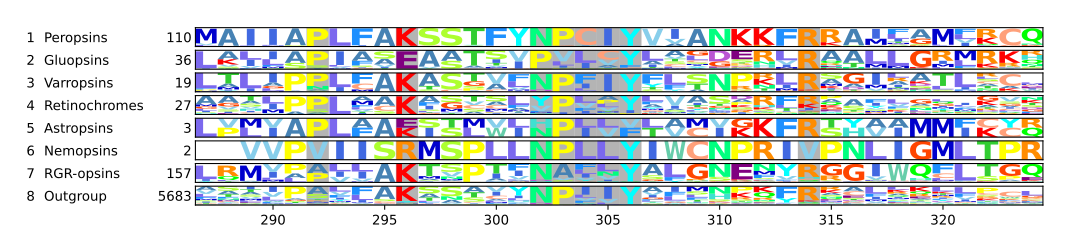
Связывание сетчатки с лизином
[ редактировать ]Опсины без лизина, связывающего сетчатку, не светочувствительны. [25] [26] В крупного рогатого скота родопсине этот лизин является 296-й аминокислотой. [12] [24] и таким образом согласно обеим схемам нумерации Lys296 7.43 . Он хорошо консервативен среди опсинов, настолько хорошо консервативен, что последовательности без него даже не считались опсинами и, таким образом, исключались из крупномасштабных филогенетических реконструкций . [27] [28] Несмотря на это, большинство опсинов содержат Lys296. 7.43 , некоторые утратили его в ходе эволюции: В немопсинах нематод Lys296 7.43 заменен аргинином . [29] [21] В астропсинах морских ежей [30] [21] а в глюопсинах Lys296 7.43 заменяется глутаминовой кислотой . [21] Немопсин экспрессируется в хемосенсорных клетках Caenorhabditis elegans . Поэтому немопсины считаются хеморецепторами . [29] Глюопсины обнаружены у таких насекомых, как жуки , скорпионы , стрекозы , бабочки и мотыльки , включая модельные организмы, такие как шелкопряд и табачный бражник . Однако глюопсины не имеют известной функции. [21]
Такой функцией не обязательно должно быть обнаружение света, поскольку некоторые опсины также участвуют в термочувствительности . [31] механорецепция, такая как слух [32] обнаружение фосфолипидов , хемосенсации и других функций. [33] [34] В частности, рабдомерные опсины дрозофилы (рабопсины, р-опсины) Rh1, Rh4 и Rh7 функционируют не только как фоторецепторы, но и как хеморецепторы аристолохиевой кислоты . Эти опсины все еще содержат Lys296. 7.43 как и другие опсины. Однако если этот лизин заменить в Rh1 аргинином, то Rh1 теряет светочувствительность, но все равно реагирует на аристолохиевую кислоту. Таким образом, Lys296 7.43 не требуется, чтобы Rh1 функционировал как хеморецептор. [26] Также в механорецепции участвуют рабопсины Rh1 и Rh6 дрозофилы, опять же для механорецепции Lys296. 7.43 не требуется, но необходим для правильного функционирования фоторецепторных клеток. [25]
Помимо этих функций, опсин без Lys296 7.43 , такие как глюопсин, все еще могут быть светочувствительными, поскольку в родопсине крупного рогатого скота лизин, связывающий сетчатку, может перемещаться из положения 296 в другие положения, даже в другие трансмембранные домены, без изменения светочувствительности. [35]
- Большинство известных опсинов содержат лизин, связывающий сетчатку, за исключением некоторых тетраопинов. Внешняя группа содержит другие рецепторы, связанные с G-белком .
- Большинство тетраопсинов также содержат лизин, связывающий сетчатку, за исключением некоторых хромопсинов, которые выделены рамкой и увеличены на следующем изображении. Внешняя группа содержит другие рецепторы, связанные с G-белком, включая другие опсины.
- Большинство хромопсинов также содержат лизин, связывающий сетчатку, за исключением немопсинов, где он заменен аргенином (R), и глюопсинов, где он заменен глутаминовой кислотой (E). Астропсины, немопсины и глюопсины выделены рамками. Внешняя группа содержит другие рецепторы, связанные с G-белком, включая другие опсины.
В приведенной выше филогении каждая клада содержит последовательности опсинов и других рецепторов, связанных с G-белком. Рядом с кладой показано количество последовательностей и две круговые диаграммы. Первая круговая диаграмма показывает процентное содержание определенной аминокислоты в положении последовательности, соответствующем Lys296. 7.43 у крупного рогатого скота родопсин. Аминокислоты имеют цветовую маркировку. Цвета: красный для лизина (K), фиолетовый для глутаминовой кислоты (E), оранжевый для аргенина (R), тёмный и средне-серый для других аминокислот и светло-серый для последовательностей, по которым нет данных в этом положении. На второй круговой диаграмме показан таксонный состав каждой клады: зеленый цвет обозначает краниаты , темно-зеленый цвет — головохордовых , средне-зеленый — иглокожих , коричневый — нематод , бледно-розовый — кольчатых червей , темно-синий — членистоногих , светло-синий — моллюсков и фиолетовый — книдарий. . Ветви клад имеют круговые диаграммы, на которых указаны значения поддержки для ветвей. Значения указаны справа налево SH-aLRT/aBayes/UFBoot. Ветви считаются поддерживаемыми, если SH-aLRT ≥ 80%, aBayes ≥ 0,95 и UFBoot ≥ 95%. Если значение поддержки превышает пороговое значение, круговая диаграмма отображается черным цветом, в противном случае — серым. [21]
Мотив NPxxY
[ редактировать ]NPxxY 7.53 мотив хорошо консервативен среди опсинов и рецепторов, связанных с G-белком. Этот мотив важен для связывания G-белка и активации рецептора. [21] Например, если он мутирован на DPxxY 7.53 ( Асн 7.49 → Асп 7.49 ) в человека мускариновом рецепторе m3 на активацию не влияет, но она отменяется, если он мутирует в APxxY 7.53 ( Асн 7.49 → Земля 7.49 ). [36] Такая мутация в APxxY 7.53 (Асн 7.49 → Земля 7.49 ) снижает активацию G-белка родопсина крупного рогатого скота до 45% по сравнению с диким типом. Также в родопсине крупного рогатого скота, если мотив мутирован на NPxxA. 7.53 ( Тир 7.53 → Земля 7.53 ), родопсин крупного рогатого скота не активирует G-белок. [37] Такая мутация также снижает активацию рецептора вазопрессина V2 . Фактически, в рецепторах, связанных с G-белком, потерю функции . для Tyr известны только мутации, вызывающие 7.53 . [38]
Также мутации Pro 7.50 влияют на активацию G-белка, если мотив мутирован на NAxxY 7.53 ( Про 7.50 → Земля 7.50 ) в крысы мускариновом рецепторе m3 рецептор все еще может активироваться, но менее эффективно, [39] отменяет активацию рецептора холецистокинина B. эта мутация даже полностью [40] Фактически, RGR-опсины имеют NAxxY 7.53 а ретинохромы в природе имеют VPxxY7.53 для кольчатых червей или YPxxY7.53 для моллюсков. И RGR-опсины, и ретинохромы относятся к хромопсинам. [21] RGR-опсины [41] и ретинохромы [42] также, в отличие от большинства опсинов, связывают полностью транс -ретиналь в темноте и превращают его в 11- цис -ретиналь при освещении. Таким образом, считается, что RGR-опсины и ретинохромы не сигнализируют и не активируют каскад фототрансдукции, а работают как фотоизомеразы, продуцируя 11- цис -ретиналь для других опсинов. [43] [44] Эта точка зрения считается устоявшейся в опсиновой литературе. [34] [45] [43] [46] [47] даже в этом случае это не было показано окончательно. [21] Фактически, человеческий рецептор мелатонина MT2 передает сигналы через G-белок и имеет NAxxY. 7.53 мотив родной. Если этот мотив мутирован на NPxxY 7.53 (Увы 7.50 → Про 7.50 ), рецептор не может быть активирован, но может быть частично восстановлен, если мотив мутирован на NVxxY 7.53 (Увы 7.50 → Вал 7.50 ). [48] Более того, когда мотив мутирует на NAxxY 7.53 (Про 7.50 → Земля 7.50 ) в родопсине крупного рогатого скота мутант имеет 141% активности дикого типа. [37] Эти данные показывают, что для GPCR не требуется стандартный NPxxY. 7.53 сигнальный мотив. [21]
Другие остатки и мотивы
[ редактировать ]Cys138 и Cys110 образуют высококонсервативный дисульфидный мостик . Glu113 служит противоионом, стабилизируя протонирование связи Шиффа между Lys296 и лигандом сетчатки. Glu134-Arg135-Tyr136 — еще один высококонсервативный мотив, участвующий в распространении сигнала трансдукции после поглощения фотона.
Сайты спектральной настройки
[ редактировать ]Определенные аминокислотные остатки, называемые сайтами спектральной настройки , оказывают сильное влияние на значения λ max . Используя сайт-направленный мутагенез , можно избирательно мутировать эти остатки и исследовать возникающие в результате изменения светопоглощающих свойств опсина. Важно отличать сайты спектральной настройки , остатки, влияющие на длину волны, на которой опсин поглощает свет, от функционально консервативных сайтов , остатков, важных для правильного функционирования опсина. Они не являются взаимоисключающими, но по практическим соображениям легче исследовать сайты спектральной настройки, которые не влияют на функциональность опсина. Подробный обзор сайтов спектральной настройки см. в Yokoyama. [49] и Диб. [50] Влияние участков спектральной настройки на λ max различается между разными группами опсинов и между группами опсинов разных видов.
Опсины в человеческом глазу, мозге и коже
[ редактировать ]| Сокр. | Имя | λλмакс | Цвет | Глаз | Мозг | Кожа | Хромосомное расположение [44] |
|---|---|---|---|---|---|---|---|
| ОПН1ЛВ | Опсин L-конуса (красного конуса) | 557 нм | Желтый | Конус | — | — | Xq28 [44] |
| ОПН1МВт | Опсин М-конуса (зеленого конуса) | 527 нм | Зеленый | Конус | — | — | Xq28 [44] |
| ОПН1SW | S-конус (синий конус) опсин | 420 нм | Фиолетовый | Конус | — | Меланоциты, кератиноциты [51] | 7q32.1 [44] |
| ОПН2 (РО) | Родопсин | 505 нм | Сине-зеленый | Стержень | — | Меланоциты, кератиноциты [51] | 3q22.1 [44] |
| ОПН3 | Энцефалопсин, панопсин | СМ | Сине-зеленый | Стержень, конус, OPL, IPL, GCL [52] | Кора головного мозга, мозжечок, полосатое тело, таламус, гипоталамус [53] [54] | Меланоциты, кератиноциты [51] | 1q43 [44] |
| ОПН4 | Меланопсин | 480 нм [55] | Небесно-голубой | ipRGC [55] | — | — | 10q23.2 [44] |
| ОПН5 | Нейропсин | 380 нм [56] | Ультрафиолетовый [56] | Нейронная сетчатка, РПЭ [57] | Передний гипоталамус [58] | Меланоциты, кератиноциты [51] | 6п12.3 [44] |
| HR | Перопсин | Клетки РПЭ – микроворсинки | — | — | 4q25 [44] | ||
| РГР | Рецептор, связанный с G-белком сетчатки | клетки РПЭ | — | — | 10q23.1 [44] |
РПЭ – пигментный эпителий сетчатки ; ipRGC, внутренне светочувствительные ганглиозные клетки сетчатки ; OPL — внешний плексиформный слой ; IPL, внутренний плексиформный слой ; GCL, слой ганглиозных клеток
Каракатица
[ редактировать ]Каракатицы и осьминоги содержат опсин в своей коже как часть хромофоров. Опсин является частью сенсорной сети, определяющей цвет и форму окружающей среды каракатицы. [59] [60] [61]
Филогения
[ редактировать ]Опсины животных (также известные как опсины типа 2) являются членами семитрансмембранных белков суперсемейства рецепторов, связанных с G-белком (GPCR). [1] [2]
Опсины животных филогенетически делятся на пять групп: ресничные опсины (цилопсины, к-опсины), рабдомерные опсины (р-опсины, рабопсины), ксенопсины, нессопсины и тетраопсины. Четыре из этих субкладов встречаются в Bilateria (все, кроме нессопсинов). [21] [28] Однако двулатеральные клады представляют собой парафилетический таксон без опсинов книдарий . [21] [28] [27] [62] Нессопсины также известны как антозойные опсины II. [63] или просто как книдарийные опсины. [64] Тетраопсины также известны как RGR/Go. [65] или опсины группы 4 [27] и содержат три подгруппы: нейропсины , Го-опсины и хромопсины. [21] [28] [64] Хромопсины имеют семь подгрупп: RGR-опсины , ретинохромы , перопсины , варропсины, астропсины, немопсины и глюопсины. [21]
Зрительные опсины животных традиционно классифицируются как цилиарные или рабдомерные. Цилиарные опсины, обнаруженные у позвоночных и книдарий , прикрепляются к цилиарным структурам, таким как палочки и колбочки . Рабдомерные опсины прикреплены к светособирающим органеллам, называемым рабдомерами. Эта классификация затрагивает филогенетические категории (клады), поэтому термины «реснитчатый» и «рабдомерный» могут быть неоднозначными. Здесь «C-опсины (ресничные)» относятся к кладе, обнаруженной исключительно у Bilateria , и исключают ресничные опсины книдарий, такие как те, которые обнаружены у коробчатых медуз . Аналогичным образом, «R-опсин (рабдомерный)» включает меланопсин, хотя он не встречается на рабдомерах у позвоночных. [27]
Цилиарные опсины
[ редактировать ]Цилиарные опсины (цилопсины, к-опсины) экспрессируются в цилиарных фоторецепторных клетках и включают зрительные опсины позвоночных и энцефалопсины. [66] Они преобразуют световые сигналы в нервные импульсы через ионные каналы, управляемые циклическими нуклеотидами, которые работают за счет увеличения разницы зарядов на клеточной мембране (т. е. гиперполяризации ). [67] )
Зрительные опсины позвоночных
[ редактировать ]Зрительные опсины позвоночных представляют собой подкласс цилиарных опсинов, которые экспрессируются в сетчатке позвоночных и опосредуют зрение. Далее они подразделяются на:
- Фотопсины – ответственные за фотопическое зрение (дневной свет), которые экспрессируются в колбочках; следовательно, также конусные опсины . Фотопсины далее подразделяются в зависимости от их спектральной чувствительности , а именно длины волны, при которой наблюдается наибольшее поглощение света ( λ max ). Позвоночные животные обычно имеют четыре класса фотопсинов (SWS1, SWS2, RH2, LWS). [68] [69] Млекопитающие потеряли классы Rh2 и SWS2 во время ночного «узкого места» , поэтому, как правило, они являются двухцветными . Предки приматов позже развили два различных опсина LWS (LWS и MWS), в результате чего у людей остались 3 фотопсина в 2 классах: SWS1 ( OPN1SW ) и две формы LWS ( OPN1LW , OPN1MW ).
- Скотопсины – ответственные за скотопическое зрение (тусклый свет), экспрессирующиеся в палочковидных клетках; следовательно, также палочковые опсины . [66] Наиболее распространенной формой скотопсина является родопсин , поэтому его обычно обозначают Rh1. [70]
Экстраретинальные (или экстраокулярные) родопсинподобные опсины (Exo-Rh)
[ редактировать ]Эти шишковидные опсины, обнаруженные у Actinopterygii (рыб с лучевыми плавниками), по-видимому, возникли в результате дупликации гена Rh1 (родопсина). Эти опсины, по-видимому, выполняют функции, аналогичные функциям пинопсина, обнаруженного у птиц и рептилий. [71] [72]
Пинопсины
[ редактировать ]Первый шишковидный опсин (пинопсин) был обнаружен в шишковидной железе курицы . Это опсин, чувствительный к синему цвету ( λ max = 470 нм). [73] [74]
Пинеальные опсины имеют широкий спектр экспрессии в мозге, особенно в шишковидной области .
Опсин древних позвоночных (ВА)
[ редактировать ]Опсин древних позвоночных (VA) имеет три изоформы VA короткая (VAS), VA средняя (VAM) и VA длинная (VAL). Он экспрессируется во внутренней сетчатке, в горизонтальных и амакриновых клетках , а также в шишковидном органе и хабенулярной области мозга. [75] Он чувствителен примерно к 500 нм [14] и встречается у большинства классов позвоночных, но не у млекопитающих. [76]
Парапинопсин
[ редактировать ]Первый парапинопсин (ПП) был обнаружен в органе сома парапинальном . [77] Парапинопсин миноги представляет собой опсин, чувствительный к УФ-излучению ( λ max = 370 нм). [78] У костистых рыб имеются две группы парапинопсинов: одна чувствительна к УФ ( λ max = 360-370 нм), другая - к синему ( λ max = 460-480 нм) свету. [79]
Париетопсины
[ редактировать ]Впервые париетопсин был обнаружен в фоторецепторных клетках теменного глаза ящерицы. Париетопсин ящерицы чувствителен к зеленому свету ( λ max = 522 нм), и, несмотря на то, что он является c-опсином, как и зрительные опсины позвоночных, он не вызывает гиперполяризацию через Gt-белок, но вызывает деполяризацию через Go-белок. [80] [81]
Энцефалопсин или Панопсин
[ редактировать ]Панопсины обнаруживаются во многих тканях (кожа, [51] мозг, [53] [82] яички, [53] сердце, печень, [82] почки, скелетные мышцы, легкие, поджелудочная железа и сетчатка [82] ). Первоначально они были обнаружены в мозге человека и мыши и поэтому названы энцефалопсинами. [53]
Первый панопсин беспозвоночных был обнаружен в цилиарных фоторецепторных клетках кольчатых червей Platynereis dumerilii и получил название с(илиарный)-опсин. [83] Этот c-опсин чувствителен к УФ-излучению ( λ max = 383 нм) и может быть настроен на длину волны 125 нм для одной аминокислоты (диапазон λ max = 377–502 нм). [84] Таким образом, неудивительно, что существует второй, но чувствительный к циану c-опсин ( λ max = 490 нм) у Platynereis dumerilii . [85] личинки, вызванную УФ-излучением Первый к-опсин опосредует гравитацию . Гравитаксис вместе с фототаксисом образует соотношение хроматической глубины . [86] На разных глубинах свет в воде состоит из разных длин волн : сначала исчезают красные (> 600 нм), а также ультрафиолетовые и фиолетовые (< 420 нм) длины волн. Чем выше глубина, тем уже спектр, так что только голубой свет (480 нм). остается [87] Таким образом, личинки могут определять свою глубину по цвету. Цвет, в отличие от яркости, остается практически постоянным независимо от времени суток и погоды, например, если пасмурно. [88] [89]
Панопсины также экспрессируются в мозге некоторых насекомых. [66] Панопсины комара и рыбы-фугу поглощают максимум при 500 и 460 нм соответственно. Оба активируют in vitro белки Gi и Go. [90]
Панопсины являются сестрами ТМТ-опсинов. [28] [91] [47] [92]
Опсин множественных тканей костной ткани (TMT)
[ редактировать ]Первый ТМТ-опсин был обнаружен во многих тканях костистых рыб, поэтому их называют опсинами множественных тканей костистых рыб (TMT). [93] ТМТ-опсины образуют три группы, которые наиболее тесно связаны с четвертой группой - панопсинами, которые, таким образом, являются паралогичными ТМТ-опсинам. [28] [47] [91] [92] ТМТ-опсины и панопсины также имеют одни и те же интроны , что подтверждает их принадлежность друг к другу. [93]
Опсины у книдарий
[ редактировать ]Книдарии , к которым относятся медузы, кораллы и морские анемоны , являются наиболее примитивными животными со сложными глазами. Опсины медуз в рупалии соединяются с Gs-белками, повышая внутриклеточный уровень цАМФ. [94] [62] Коралловые опсины могут соединяться с Gq-белками и Gc-белками. Gc-белки представляют собой подтип G-белков, специфичный для книдарий. [95] Опсины книдарий относятся к двум группам: ксенопсины и нессопсины. Ксенопсины содержат также билатеральные опсины, тогда как нессопсины свойственны только книдариям. [21] [28] Однако более ранние исследования показали, что некоторые опсины книдарий относятся к цилопсинам, рабопсинам и тетраопсинам билатерий . [65] [96] [97]
Рабдомерные опсины
[ редактировать ]Рабдомерные опсины (рабопсины, р-опсины) также известны как Gq-опсины, поскольку они соединяются с Gq-белком. Рабопсины используются моллюсками и членистоногими. Членистоногие, по-видимому, обретают цветовое зрение так же, как и позвоночные, за счет использования трех (или более) различных групп опсинов, различающихся как с точки зрения филогении, так и с точки зрения спектральной чувствительности. [66] Рабопсин меланопсин также экспрессируется у позвоночных, где он регулирует циркадные ритмы и опосредует зрачковый рефлекс. [66]
В отличие от цилопсинов, рабопсины связаны с каноническими ионными каналами переходного рецепторного потенциала; это приводит к устранению разницы электрических потенциалов на клеточной мембране (т.е. к деполяризации ). [67]
Идентификация кристаллической структуры родопсина кальмара [13] вероятно, будет способствовать нашему пониманию его функции в этой группе.
Членистоногие используют разные опсины в разных типах глаз, но, по крайней мере, у Limulus опсины, экспрессируемые в латеральных и сложных глазах, на 99% идентичны и, по-видимому, недавно разошлись. [98]
Меланопсин
[ редактировать ]Меланопсин (OPN4) участвует в циркадных ритмах , зрачковом рефлексе и цветокоррекции в условиях высокой яркости. Филогенетически он относится к рабдомерным опсинам (рабопсинам, р-опсинам) и функционально и структурно является рабопсином, но не встречается в рабдомерах.
Тетраопсины
[ редактировать ]К тетраопсинам относятся нейропсины , Go-опсины и хромопсины. [21] [28] [64] Хромопсины состоят из семи подгрупп: RGR-опсины , ретинохромы , перопсины , варропсины, астропсины, немопсины и глюопсины. [21]
Нейропсины
[ редактировать ]Нейропсины чувствительны к UVA, обычно при длине волны 380 нм. Они обнаружены в мозге, семенниках, коже и сетчатке человека и грызунов, а также в мозге и сетчатке птиц. У птиц и грызунов они обеспечивают ультрафиолетовое зрение. [51] [56] [99] Они соединяются с Gi-белками. [56] [99] У человека Нейропсин кодируется геном OPN5 . В сетчатке человека его функция неизвестна. У мышей он фотоэнтерирует сетчатку и роговицу, по крайней мере, ex vivo. [100]
Гоопсины
[ редактировать ]Гоопсины отсутствуют у высших позвоночных. [27] и экдизозойные . [101] Они обнаружены в цилиарных фоторецепторных клетках гребешкового глаза. [102] и базальный хордовый амфиоксус . [103] Однако у Platynereis dumerilii Go-опсин экспрессируется в рабдомерных фоторецепторных клетках глаз. [87]
RGR-опсины
[ редактировать ]RGR-опсины, также известные как рецепторы, связанные с G-белком сетчатки, экспрессируются в пигментном эпителии сетчатки (RPE) и клетках Мюллера . [104] В темноте они преимущественно связывают полностью транс-ретиналь, а не 11-цис-ретиналь. [41] Считалось, что RGR-опсины являются фотоизомеразами. [44] но вместо этого они регулируют транспорт и производство ретиноидов. [66] [105] В частности, они ускоряют независимое от света производство 11-цис-ретинола (предшественника 11-цис-ретиналя) из всех транс-ретиниловых эфиров. [106] Однако все транс-ретиниловые эфиры становятся доступными в зависимости от света благодаря RGR-опсинам. Неизвестно, регулируют ли RGR-опсины это через G-белок или другой сигнальный механизм. [107] RGR-опсин крупного рогатого скота максимально поглощает волны разной длины в зависимости от значения pH. При высоком pH он поглощает максимально синий (469 нм) свет, а при низком pH — максимально УФ-свет (370 нм). [108]
Перопсин
[ редактировать ]Перопсин , зрительный пигментоподобный рецептор, представляет собой белок , который у человека кодируется RRH геном . [109]
Другие белки, называемые опсинами
[ редактировать ]Фоторецепторы можно классифицировать по нескольким признакам, включая функцию (зрение, фототаксис, фотопериодизм и т. д.), тип хромофора ( ретиналь , флавин , билин ), молекулярную структуру ( третичная , четвертичная ), выход сигнала ( фосфорилирование , восстановление , окисление ) и т. д. . [110]
Помимо опсинов животных, которые представляют собой рецепторы, связанные с G-белком , существует еще одна группа фоторецепторных белков , называемых опсинами. [67] [111] Это микробный опсин , он используется прокариотами и некоторыми водорослями (как компонент канальных родопсинов ) и грибами . [112] тогда как животные используют исключительно животные опсины. За пределами этих групп опсины не обнаружены (например, у растений или плакозой ). [67]
Опсины микробов и животных также называются опсинами типа 1 и типа 2 соответственно. Оба типа называются опсинами, потому что одно время считалось, что они родственны: оба представляют собой семитрансмембранные рецепторы и ковалентно связывают ретиналь как хромофор, что превращает их в фоторецепторы, воспринимающие свет. Однако оба типа не связаны на уровне последовательности. [113]
Фактически, идентичность последовательностей между животными и миробиальными опсинами не превышает той, которую можно объяснить случайностью. Однако в последние годы были разработаны новые методы, специфичные для глубокой филогении . В результате несколько исследований обнаружили доказательства возможной филогенетической связи между ними. [114] [35] [115] Однако это не обязательно означает, что последний общий предок микробных и животных опсинов сам был светочувствительным: все опсины животных возникли (путем дупликации и дивергенции генов) на позднем этапе истории большого рецепторов, связанных с G-белком (GPCR). семейства генов , которая сама возникла после расхождения растений, грибов, хоанфлагеллят и губок от древнейших животных. Хромофор сетчатки обнаружен исключительно в опсиновой ветви этого большого семейства генов, а это означает, что его появление в других местах представляет собой конвергентную эволюцию , а не гомологию . Микробные родопсины по своей последовательности сильно отличаются от любого из семейств GPCR. [116] Согласно одной из гипотез, как микробные, так и животные опсины принадлежат к суперсемейству рецепторов, связанных с транспортером-опсином-G-белком (TOG) , предполагаемой кладе, которая включает рецептор, связанный с G-белком (GPCR), ион-транслоцирующий микробный родопсин (MR), и семь других. [117]
Большинство микробных опсинов представляют собой ионные каналы или насосы вместо собственных рецепторов и не связываются с G-белком . Микробные опсины встречаются во всех трех сферах жизни: археях , бактериях и эукариотах . У эукариот микробные опсины встречаются главным образом в одноклеточных организмах, таких как зеленые водоросли, и в грибах. У большинства сложных многоклеточных эукариот микробные опсины заменены другими светочувствительными молекулами, такими как криптохром и фитохром у растений и животные опсины у животных . [118]
Микробные опсины часто называют родопсиновой формой молекулы, т. е. родопсин (в широком смысле) = опсин + хромофор. Среди многих видов микробных опсинов выделяют протонные насосы бактериородопсин (BR) и ксанторородопсин (xR), хлоридной помпы галородопсин (HR), фотосенсоры сенсорный родопсин I (SRI) и сенсорный родопсин II (SRII), а также протеородопсин ( PR), опсин I Neurospora (NOPI), сенсорные родопсины A Chlamydomonas (CSRA), сенсорные родопсины B Chlamydomonas (CSRB), канальный родопсин (ChR) и археродопсин (Arch). [119]
Некоторые микробные опсины, такие как протео- и бактериородопсин , используются различными группами бактерий для сбора энергии света для осуществления метаболических процессов с использованием нехлорофилльного пути . Кроме того, галородопсины галобактерий фототаксических и каналородопсины некоторых водорослей, например вольвокса , служат им светозависимыми ионными каналами , в том числе и для целей . Сенсорные родопсины существуют у галобактерий, которые индуцируют фототаксическую реакцию путем взаимодействия с преобразователей , которые не имеют никакого отношения к G-белкам. белками, встроенными в мембраны [120]
Микробные опсины (такие как каналородопсин , галородопсин и археродопсин ) используются в оптогенетике для включения или выключения активности нейронов. Микробные опсины предпочтительнее, если нейрональную активность необходимо модулировать с более высокой частотой, поскольку они реагируют быстрее, чем опсины животных. Это связано с тем, что опсины микробов представляют собой ионные каналы или протонно- ионные насосы и, таким образом, активируются непосредственно светом, в то время как опсины животных активируют G-белки, которые затем активируют эффекторные ферменты, производящие метаболиты, для открытия ионных каналов. [121]
См. также
[ редактировать ]- Ретинилиденовый белок
- Визуальный цикл
- Визуальная фототрансдукция
- Микробный родопсин
- Канальные родопсины
Внешние ссылки
[ редактировать ]- Иллюстрация заархивирована 9 января 2020 г. в Wayback Machine в колледже Болдуин-Уоллес.
- Опсин в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Кейси П.Дж., Gilman AG (февраль 1988 г.). «Участие G-белка в соединении рецептор-эффектор» . Журнал биологической химии . 263 (6): 2577–2580. дои : 10.1016/s0021-9258(18)69103-3 . ПМИД 2830256 . S2CID 38970721 .
- ^ Перейти обратно: а б Эттвуд Т.К., Финдли Дж.Б. (февраль 1994 г.). «Отпечатки пальцев, связанные с G-белком рецепторы». Белковая инженерия . 7 (2): 195–203. дои : 10.1093/белок/7.2.195 . ПМИД 8170923 .
- ^ Диксон Р.А., Кобилка Б.К., Страдер Д.Д., Бенович Дж.Л., Долман Х.Г., Фрилль Т. и др. (май 1986 г.). «Клонирование гена и кДНК бета-адренергического рецептора млекопитающих и гомология с родопсином». Природа . 321 (6065): 75–79. Бибкод : 1986Natur.321...75D . дои : 10.1038/321075a0 . ПМИД 3010132 . S2CID 4324074 .
- ^ Диксон Р.А., Сигал И.С., Рэндс Э., Регистр РБ, Канделор М.Р., Блейк А.Д., Стрейдер CD (март 1987 г.). «Связывание лиганда с бета-адренергическим рецептором включает его родопсин-подобное ядро». Природа . 326 (6108): 73–77. Бибкод : 1987Natur.326...73D . дои : 10.1038/326073a0 . ПМИД 2881211 . S2CID 4352920 .
- ^ Вальд Г. (июль 1934 г.). «Каротиноиды и цикл витамина А в зрении» . Природа . 134 (3376): 65. Бибкод : 1934Natur.134...65W . дои : 10.1038/134065a0 . S2CID 4022911 .
- ^ Уолд Г., Браун П.К., Хаббард Р., Орошник В. (июль 1955 г.). «Затрудненные цис-изомеры витамина А и ретинена: структура изомера Neo-B» . Труды Национальной академии наук Соединенных Штатов Америки . 41 (7): 438–451. Бибкод : 1955PNAS...41..438W . дои : 10.1073/pnas.41.7.438 . ПМК 528115 . ПМИД 16589696 .
- ^ Браун П.К., Уолд Г. (октябрь 1956 г.). «Нео-b-изомер витамина А и ретинена» . Журнал биологической химии . 222 (2): 865–877. дои : 10.1016/S0021-9258(20)89944-X . ПМИД 13367054 .
- ^ Орошник В. (июнь 1956 г.). «Синтез и конфигурация нео-витамина А и неоретинина b». Журнал Американского химического общества . 78 (11): 2651–2652. дои : 10.1021/ja01592a095 .
- ^ Орошник В., Браун П.К., Хаббард Р., Уолд Г. (сентябрь 1956 г.). «ЗАПРЕЩЕННЫЕ ЦИСА-ИЗОМЕРЫ ВИТАМИНА А И РЕТИНЕНА: СТРУКТУРА ИЗОМЕРА NEO-b» . Труды Национальной академии наук Соединенных Штатов Америки . 42 (9): 578–580. Бибкод : 1956PNAS...42..578O . дои : 10.1073/pnas.42.9.578 . ПМК 534254 . ПМИД 16589909 .
- ^ Баундс Д. (декабрь 1967 г.). «Место прикрепления сетчатки к родопсину». Природа . 216 (5121): 1178–1181. Бибкод : 1967Natur.216.1178B . дои : 10.1038/2161178a0 . ПМИД 4294735 . S2CID 1657759 .
- ^ Харгрейв П.А., Макдауэлл Дж.Х., Кертис Д.Р., Ван Дж.К., Ющак Э., Фонг С.Л. и др. (1983). «Структура бычьего родопсина». Биофизика структуры и механизма . 9 (4): 235–244. дои : 10.1007/BF00535659 . ПМИД 6342691 . S2CID 20407577 .
- ^ Перейти обратно: а б с Пальчевски К., Кумасака Т., Хори Т., Бенке К.А., Мотошима Х., Фокс Б.А. и др. (август 2000 г.). «Кристаллическая структура родопсина: рецептор, связанный с белком AG». Наука . 289 (5480): 739–745. Бибкод : 2000Sci...289..739P . CiteSeerX 10.1.1.1012.2275 . дои : 10.1126/science.289.5480.739 . ПМИД 10926528 .
- ^ Перейти обратно: а б Мураками М., Кояма Т. (май 2008 г.). «Кристаллическая структура родопсина кальмара». Природа . 453 (7193): 363–367. Бибкод : 2008Natur.453..363M . дои : 10.1038/nature06925 . ПМИД 18480818 . S2CID 4339970 .
- ^ Коллинз Ф.Д. (март 1953 г.). «Родопсин и индикаторный желтый». Природа . 171 (4350): 469–471. Бибкод : 1953Natur.171..469C . дои : 10.1038/171469a0 . ПМИД 13046517 . S2CID 4152360 .
- ^ Питт Г.А., Коллинз Ф.Д., Мортон Р.А., Сток П. (январь 1955 г.). «Исследования родопсина. VIII. Ретинилиденметиламин, аналог индикаторного желтого» . Биохимический журнал . 59 (1): 122–128. дои : 10.1042/bj0590122 . ПМК 1216098 . ПМИД 14351151 .
- ^ Хаббард Р., Кропф А. (февраль 1958 г.). «Действие света на родопсин» . Труды Национальной академии наук Соединенных Штатов Америки . 44 (2): 130–139. Бибкод : 1958PNAS...44..130H . дои : 10.1073/pnas.44.2.130 . ПМК 335377 . ПМИД 16590155 .
- ^ Кропф А., Хаббард Р. (ноябрь 1959 г.). «Механизм обесцвечивания родопсина». Анналы Нью-Йоркской академии наук . 74 (2): 266–280. Бибкод : 1959NYASA..74..266K . дои : 10.1111/j.1749-6632.1958.tb39550.x . ПМИД 13627857 . S2CID 45830716 .
- ^ Перейти обратно: а б Чой Х.В., Ким Ю.Дж., Пак Дж.Х., Моризуми Т., Пай Э.Ф., Краусс Н. и др. (март 2011 г.). «Кристаллическая структура метародопсина II». Природа . 471 (7340): 651–655. Бибкод : 2011Natur.471..651C . дои : 10.1038/nature09789 . ПМИД 21389988 . S2CID 4302421 .
- ^ Перейти обратно: а б Уолд Дж. (октябрь 1968 г.). «Молекулярные основы зрительного возбуждения». Наука . 162 (3850): 230–239. Бибкод : 1968Sci...162..230W . дои : 10.1126/science.162.3850.230 . ПМИД 4877437 .
- ^ Теракита А., Кавано-Ямасита Э., Коянаги М. (январь 2012 г.). «Эволюция и разнообразие опсинов» . Междисциплинарные обзоры Wiley: мембранный транспорт и передача сигналов . 1 (1): 104–111. дои : 10.1002/wmts.6 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в Гюманн М., Портер М.Л., Бок М.Дж. (август 2022 г.). «Глюопсины: опсины без лизина, связывающего сетчатку» . Клетки . 11 (15): 2441. doi : 10.3390/cells11152441 . ПМЦ 9368030 . ПМИД 35954284 .
 Материал был скопирован и адаптирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Материал был скопирован и адаптирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 . - ^ Амора Т.Л., Рамос Л.С., Галан Дж.Ф., Бирге Р.Р. (апрель 2008 г.). «Спектральная настройка темно-красных колбочек» . Биохимия . 47 (16): 4614–4620. дои : 10.1021/bi702069d . ПМЦ 2492582 . ПМИД 18370404 .
- ^ Баллестерос Дж. А., Вайнштейн Х. (1995). «Комплексные методы построения трехмерных моделей и компьютерного исследования структурно-функциональных отношений в рецепторах, связанных с G-белками». Методы в нейронауках . 25 : 366–428. дои : 10.1016/S1043-9471(05)80049-7 . ISBN 978-0-12-185295-5 .
- ^ Перейти обратно: а б Овчинников, Ю.А. (ноябрь 1982 г.). «Родопсин и бактериородопсин: структурно-функциональные взаимоотношения» . Письма ФЭБС . 148 (2): 179–191. дои : 10.1016/0014-5793(82)80805-3 . ПМИД 6759163 . S2CID 85819100 .
- ^ Перейти обратно: а б Катана Р., Гуан С., Занини Д., Ларсен М.Е., Хиральдо Д., Гертен Б.Р. и др. (сентябрь 2019 г.). «Независимая от хромофора роль опсин-апопротеинов в механорецепторах дрозофилы» . Современная биология . 29 (17): 2961–2969.е4. Бибкод : 2019CBio...29E2961K . дои : 10.1016/j.cub.2019.07.036 . ПМИД 31447373 . S2CID 201420079 .
- ^ Перейти обратно: а б Люнг Нью-Йорк, Тхакур Д.П., Гурав А.С., Ким Ш., Ди Пицио А., Нив М.Ю., Монтелл С. (апрель 2020 г.). «Функции опсинов во вкусе дрозофилы» . Современная биология . 30 (8): 1367–1379.e6. Бибкод : 2020CBio...30E1367L . дои : 10.1016/j.cub.2020.01.068 . ПМЦ 7252503 . ПМИД 32243853 .
- ^ Перейти обратно: а б с д и Портер М.Л., Бласик Дж.Р., Бок М.Дж., Кэмерон Э.Г., Прингл Т., Кронин Т.В., Робинсон П.Р. (январь 2012 г.). «Проливая новый свет на эволюцию опсинов» . Слушания. Биологические науки . 279 (1726): 3–14. дои : 10.1098/rspb.2011.1819 . ПМЦ 3223661 . ПМИД 22012981 .
- ^ Перейти обратно: а б с д и ж г час Рамирес М.Д., Пайретт А.Н., Панки М.С., Серб Дж.М., Спейзер Д.И., Сваффорд А.Дж., Окли Т.Х. (декабрь 2016 г.). «Последний общий предок большинства двулатеральных животных, обладавший как минимум девятью опсинами» . Геномная биология и эволюция . 8 (12): 3640–3652. дои : 10.1093/gbe/evw248 . ПМЦ 5521729 . ПМИД 28172965 .
- ^ Перейти обратно: а б Тромель Э.Р., Чоу Дж.Х., Дуайер Н.Д., Колберт Х.А., Баргманн К.И. (октябрь 1995 г.). «Семь дивергентных трансмембранных рецепторов являются кандидатами в хемосенсорные рецепторы у C. elegans» . Клетка . 83 (2): 207–218. дои : 10.1016/0092-8674(95)90162-0 . ПМИД 7585938 . S2CID 17819587 .
- ^ Д'Аниелло С., Делруас Дж., Валеро-Грация А., Лоу Э.К., Бирн М., Кэннон Дж.Т. и др. (декабрь 2015 г.). «Эволюция опсина в амбулакрарии» . Морская геномика . 24 (Часть 2): 177–183. Бибкод : 2015MarGn..24..177D . дои : 10.1016/j.margen.2015.10.001 . ПМИД 26472700 .
- ^ Шен В.Л., Квон Ю., Адегбола А.А., Луо Дж., Чесс А., Монтелл С. (март 2011 г.). «Функция родопсина в распознавании температуры у дрозофилы». Наука . 331 (6022): 1333–1336. Бибкод : 2011Sci...331.1333S . дои : 10.1126/science.1198904 . ПМИД 21393546 . S2CID 206530389 .
- ^ Сентилан П.Р., Пипенброк Д., Овезмырадов Г., Надровски Б., Бехстедт С., Паулс С. и др. (август 2012 г.). «Гены органа слуха дрозофилы и генетические дефекты слуха» . Клетка . 150 (5): 1042–1054. дои : 10.1016/j.cell.2012.06.043 . ПМИД 22939627 . S2CID 1422764 .
- ^ Феуда Р., Менон А.К., Гёпферт М.К. (март 2022 г.). «Переосмысление опсинов» . Молекулярная биология и эволюция . 39 (3): msac033. дои : 10.1093/molbev/msac033 . ПМЦ 8892948 . ПМИД 35143663 .
- ^ Перейти обратно: а б Люнг, штат Нью-Йорк, Монтелл С. (октябрь 2017 г.). «Нетрадиционные роли опсинов» . Ежегодный обзор клеточной биологии и биологии развития . 33 (1): 241–264. doi : 10.1146/annurev-cellbio-100616-060432 . ПМЦ 5963513 . ПМИД 28598695 .
- ^ Перейти обратно: а б Дивайн Э.Л., Оприан Д.Д., Теобальд Д.Л. (август 2013 г.). «Перемещение лизина активного центра в родопсине и последствия для эволюции ретинилиденовых белков» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (33): 13351–13355. Бибкод : 2013PNAS..11013351D . дои : 10.1073/pnas.1306826110 . ПМЦ 3746867 . ПМИД 23904486 .
- ^ Боррото-Эскуэла Д.О., Ромеро-Фернандес В., Гарсия-Негредо Г., Коррейя П.А., Гаррига П., Фуксе К., Сируэла Ф (2011). «Раскрытие консервативного мотива NPxxY мускаринового ацетилхолинового рецептора M3: решающая роль Asp-7.49 в передаче сигналов рецептора и формировании мультибелкового комплекса». Клеточная физиология и биохимия . 28 (5): 1009–1022. дои : 10.1159/000335788 . hdl : 2445/126278 . ПМИД 22178951 . S2CID 14008354 .
- ^ Перейти обратно: а б Фрице О., Филипек С., Кукса В., Пальчевски К., Хофманн К.П., Эрнст О.П. (март 2003 г.). «Роль консервативного мотива NPxxY(x)5,6F в основном состоянии родопсина и во время активации» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (5): 2290–2295. Бибкод : 2003PNAS..100.2290F . дои : 10.1073/pnas.0435715100 . ПМК 151333 . ПМИД 12601165 .
- ^ Чжоу Ц, Ян Д., Ву М, Го Ю, Го В, Чжун Л и др. (декабрь 2019 г.). «Общий механизм активации GPCR класса А» . электронная жизнь . 8 : е50279. doi : 10.7554/eLife.50279 . ПМК 6954041 . ПМИД 31855179 .
- ^ Весс Дж., Нанавати С., Фогель З., Маджио Р. (январь 1993 г.). «Функциональная роль остатков пролина и триптофана, высококонсервативных среди рецепторов, связанных с G-белком, изучена с помощью мутационного анализа мускаринового рецептора m3» . Журнал ЭМБО . 12 (1): 331–338. дои : 10.1002/j.1460-2075.1993.tb05661.x . ПМК 413210 . ПМИД 7679072 .
- ^ Галес С., Ковальски-Шовель А., Дюфур М.Н., Сева С., Мородер Л., Прадайрол Л. и др. (июнь 2000 г.). «Мутация Asn-391 в консервативном мотиве NPXXY рецептора холецистокинина B отменяет активацию белка Gq, не влияя на его связь с рецептором» . Журнал биологической химии . 275 (23): 17321–17327. дои : 10.1074/jbc.M909801199 . ПМИД 10748160 .
- ^ Перейти обратно: а б Хао В., Фонг Гонконг (март 1999 г.). «Эндогенный хромофор рецептора опсина, связанного с G-белком сетчатки, из пигментного эпителия» . Журнал биологической химии . 274 (10): 6085–6090. дои : 10.1074/jbc.274.10.6085 . ПМИД 10037690 .
- ^ Хара Т., Хара Р. (май 1967 г.). «Родопсин и ретинохром в сетчатке кальмара». Природа . 214 (5088): 573–575. Бибкод : 1967Natur.214..573H . дои : 10.1038/214573a0 . ПМИД 6036171 . S2CID 4184319 .
- ^ Перейти обратно: а б Цукамото Х, Теракита А (ноябрь 2010 г.). «Разнообразие и функциональные свойства бистабильных пигментов» . Фотохимические и фотобиологические науки . 9 (11): 1435–1443. дои : 10.1039/c0pp00168f . ПМИД 20852774 .
- ^ Перейти обратно: а б с д и ж г час я дж к л Теракита А (1 марта 2005 г.). «Опсины» . Геномная биология . 6 (3): 213. doi : 10.1186/gb-2005-6-3-213 . ПМЦ 1088937 . ПМИД 15774036 .
- ^ Нагата Т., Коянаги М., Цукамото Х., Теракита А. (январь 2010 г.). «Идентификация и характеристика протостомного гомолога перопсина паука-прыгуна». Журнал сравнительной физиологии А. 196 (1): 51–59. дои : 10.1007/s00359-009-0493-9 . ПМИД 19960196 . S2CID 22879394 .
- ^ Геринг WJ (январь 2014 г.). «Эволюция зрения». Междисциплинарные обзоры Wiley. Биология развития . 3 (1): 1–40. дои : 10.1002/wdev.96 . ПМИД 24902832 . S2CID 36881435 .
- ^ Перейти обратно: а б с Като М., Сугияма Т., Сакаи К., Ямашита Т., Фудзита Х., Сато К. и др. (18 ноября 2016 г.). «Два белка, родственных опсину 3, в куриной сетчатке и мозге: опсин 3 типа ТМТ является датчиком синего света в горизонтальных клетках сетчатки, гипоталамусе и мозжечке» . ПЛОС ОДИН . 11 (11): e0163925. Бибкод : 2016PLoSO..1163925K . дои : 10.1371/journal.pone.0163925 . ПМЦ 5115664 . ПМИД 27861495 .
- ^ Мазна П., Грицова Л., Балик А., Земкова Х., Фридлова Е., Обсилова В. и др. (ноябрь 2008 г.). «Роль остатков пролина в структуре и функции человеческого рецептора мелатонина MT2». Журнал исследований шишковидной железы . 45 (4): 361–372. дои : 10.1111/j.1600-079X.2008.00598.x . ПМИД 18544139 . S2CID 6202186 .
- ^ Ёкояма С. (июль 2000 г.). «Молекулярная эволюция зрительных пигментов позвоночных». Прогресс в исследованиях сетчатки и глаз . 19 (4): 385–419. дои : 10.1016/S1350-9462(00)00002-1 . ПМИД 10785616 . S2CID 28746630 .
- ^ Диб СС (май 2005 г.). «Молекулярная основа изменения цветового зрения человека». Клиническая генетика . 67 (5): 369–377. дои : 10.1111/j.1399-0004.2004.00343.x . ПМИД 15811001 . S2CID 24105079 .
- ^ Перейти обратно: а б с д и ж Халтауфдерхайд К., Оздеслик Р.Н., Уикс Н.Л., Наджера Дж.А., Оанча Е (2015). «Экспрессия опсина в эпидермальной коже человека» . Фотохимия и фотобиология . 91 (1): 117–123. дои : 10.1111/php.12354 . ПМК 4303996 . ПМИД 25267311 .
- ^ Уайт Дж.Х., Чиано М., Вигглсворт М., Геске Р., Райли Дж., Уайт Н. и др. (июль 2008 г.). «Идентификация нового гена предрасположенности к астме на хромосоме 1qter и его функциональная оценка» . Молекулярная генетика человека . 17 (13): 1890–1903. дои : 10.1093/hmg/ddn087 . ПМИД 18344558 .
- ^ Перейти обратно: а б с д Блэкшоу С., Снайдер Ш. (май 1999 г.). «Энцефалопсин: новый экстраретинальный опсин млекопитающих, дискретно локализованный в мозге» . Журнал неврологии . 19 (10): 3681–3690. doi : 10.1523/JNEUROSCI.19-10-03681.1999 . ПМК 6782724 . ПМИД 10234000 .
- ^ Ниссила Ю, Мянттари С, Саркиоя Т, Туоминен Х, Такала Т, Тимонен М, Саарела С (ноябрь 2012 г.). «Обилие белка энцефалопсина (OPN3) в мозгу взрослой мыши» . Журнал сравнительной физиологии А. 198 (11): 833–839. дои : 10.1007/s00359-012-0754-x . ПМЦ 3478508 . ПМИД 22991144 .
- ^ Перейти обратно: а б Бэйлз Х.Дж., Лукас Р.Дж. (май 2013 г.). «Меланопсин человека образует пигмент, максимально чувствительный к синему свету (λmax ≈ 479 нм), поддерживающий активацию сигнальных каскадов G(q/11) и G(i/o)» . Слушания. Биологические науки . 280 (1759): 20122987. doi : 10.1098/rspb.2012.2987 . ПМК 3619500 . ПМИД 23554393 .
- ^ Перейти обратно: а б с д Кодзима Д., Мори С., Тории М., Вада А., Моришита Р., Фукада Ю. (17 октября 2011 г.). «УФ-чувствительный фоторецепторный белок OPN5 у человека и мышей» . ПЛОС ОДИН . 6 (10): e26388. Бибкод : 2011PLoSO...626388K . дои : 10.1371/journal.pone.0026388 . ПМК 3197025 . ПМИД 22043319 .
- ^ Тарттелин Э.Э., Беллингем Дж., Ханкинс М.В., Фостер Р.Г., Лукас Р.Дж. (ноябрь 2003 г.). «Нейропсин (Opn5): новый опсин, идентифицированный в нервной ткани млекопитающих» . Письма ФЭБС . 554 (3): 410–416. дои : 10.1016/S0014-5793(03)01212-2 . ПМИД 14623103 .
- ^ Ямашита Т., Оно К., Охучи Х., Юмото А., Гото Х., Томонари С. и др. (февраль 2014 г.). «Эволюция Opn5 млекопитающих как специализированного пигмента, поглощающего УФ-излучение, путем мутации одной аминокислоты» . Журнал биологической химии . 289 (7): 3991–4000. дои : 10.1074/jbc.M113.514075 . ПМЦ 3924266 . ПМИД 24403072 .
- ^ Мэтгер Л.М., Робертс С.Б., Хэнлон RT (октябрь 2010 г.). «Доказательства распределенного восприятия света в коже каракатицы Sepia officinalis» . Письма по биологии . 6 (5): 600–603. дои : 10.1098/rsbl.2010.0223 . ПМК 2936158 . ПМИД 20392722 .
- ^ Ён Э (20 мая 2015 г.). «Осьминоги и, возможно, кальмары способны чувствовать свет кожей» . Нэшнл Географик . Архивировано из оригинала 23 февраля 2021 года.
- ^ Ю С, Ли Ю, Чжан Х, Хуан Х, Малярчук В, Ван С и др. (сентябрь 2014 г.). «Адаптивные оптико-электронные системы камуфляжа с дизайном, вдохновленным шкурой головоногих моллюсков» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (36): 12998–13003. Бибкод : 2014PNAS..11112998Y . дои : 10.1073/pnas.1410494111 . ПМК 4246966 . ПМИД 25136094 .
- ^ Перейти обратно: а б Лигертова М., Пергнер Дж., Козьмикова И., Фабиан П., Помбиньо А.Р., Стрнад Х. и др. (июль 2015 г.). «Геном кубозоя проливает свет на функциональное разнообразие опсинов и эволюцию фоторецепторов» . Научные отчеты . 5 : 11885. Бибкод : 2015NatSR...511885L . дои : 10.1038/srep11885 . ПМК 5155618 . ПМИД 26154478 .
- ^ Кирога Артигас Дж., Лапеби П., Леклер Л., Такеда Н., Дегучи Р., Жекели Дж. и др. (январь 2018 г.). «Экспрессируемый гонадами опсин опосредует световое нерест у медузы Clytia » . электронная жизнь . 7 : е29555. дои : 10.7554/eLife.29555 . ПМК 5756024 . ПМИД 29303477 .
- ^ Перейти обратно: а б с Роулинсон К.А., Лапраз Ф., Баллистер Э.Р., Терасаки М., Роджерс Дж., Макдауэлл Р.Дж. и др. (октябрь 2019 г.). «Экстраокулярные палочковидные фоторецепторы плоского червя экспрессируют фотопигмент ксенопсин» . электронная жизнь . 8 : е45465. дои : 10.7554/eLife.45465 . ПМК 6805122 . ПМИД 31635694 .
- ^ Перейти обратно: а б Феуда Р., Хэмилтон СК, Макинерни Д.О., Пизани Д. (ноябрь 2012 г.). «Эволюция опсина многоклеточных животных открывает простой путь к зрению у животных» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (46): 18868–18872. Бибкод : 2012PNAS..10918868F . дои : 10.1073/pnas.1204609109 . ПМЦ 3503164 . ПМИД 23112152 .
- ^ Перейти обратно: а б с д и ж Ситида Ю., Мацуяма Т. (октябрь 2009 г.). «Эволюция опсинов и фототрансдукция» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 364 (1531): 2881–2895. дои : 10.1098/rstb.2009.0051 . ПМЦ 2781858 . ПМИД 19720651 .
- ^ Перейти обратно: а б с д Плачецки, округ Колумбия, Фонг Ч.Р., Окли, Т.Х. (июль 2010 г.). «Эволюция фототрансдукции на основе предкового пути, управляемого циклическими нуклеотидами» . Слушания. Биологические науки . 277 (1690): 1963–1969. дои : 10.1098/rspb.2009.1797 . ПМК 2880087 . ПМИД 20219739 .
- ^ Хант Д.М., Карвальо Л.С., Коуинг Дж.А., Дэвис В.Л. (октябрь 2009 г.). «Эволюция и спектральная настройка зрительных пигментов у птиц и млекопитающих» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 364 (1531): 2941–2955. дои : 10.1098/rstb.2009.0044 . ПМК 2781856 . ПМИД 19720655 .
- ^ Трезисе А.Е., Коллин С.П. (октябрь 2005 г.). «Опсины: эволюция в ожидании» . Современная биология . 15 (19): Р794–Р796. Бибкод : 2005CBio...15.R794T . дои : 10.1016/j.cub.2005.09.025 . ПМИД 16213808 .
- ^ Гулати С., Ястржебска Б., Банерджи С., Пласерес А.Л., Мишта П., Гао С. и др. (март 2017 г.). «Фотоциклическое поведение родопсина, вызванное атипичным механизмом изомеризации» . Труды Национальной академии наук Соединенных Штатов Америки . 114 (13): Е2608–Е2615. Бибкод : 2017PNAS..114E2608G . дои : 10.1073/pnas.1617446114 . ПМК 5380078 . ПМИД 28289214 .
- ^ Мано Х., Кодзима Д., Фукада Ю. (ноябрь 1999 г.). «Экзо-родопсин: новый родопсин, экспрессируемый в шишковидной железе рыбок данио». Исследования мозга. Молекулярные исследования мозга . 73 (1–2): 110–118. дои : 10.1016/S0169-328X(99)00242-9 . ПМИД 10581404 .
- ^ Тарттелин Э.Э., Франсен М.П., Эдвардс П.К., Ханкинс М.В., Шертлер Г.Ф., Фогель Р. и др. (ноябрь 2011 г.). «Адаптация шишковидной железы, экспрессирующей опсин экзостержня костной кости, к фоторецепции, не формирующей изображение, посредством усиленного распада Meta II» . Клеточные и молекулярные науки о жизни . 68 (22): 3713–3723. дои : 10.1007/s00018-011-0665-y . ПМК 3203999 . ПМИД 21416149 .
- ^ Окано Т., Ёсидзава Т., Фукада Ю. (ноябрь 1994 г.). «Пинопсин представляет собой фоторецепторную молекулу куриной шишковидной железы». Природа . 372 (6501): 94–97. Бибкод : 1994Natur.372...94O . дои : 10.1038/372094a0 . ПМИД 7969427 . S2CID 4301315 .
- ^ Накане Ю, Ёсимура Т (февраль 2019 г.). «Фотопериодическая регуляция размножения позвоночных». Ежегодный обзор биологических наук о животных . 7 (1). Годовые обзоры : 173–194. doi : 10.1146/annurev-animal-020518-115216 . ПМИД 30332291 . S2CID 52984435 .
- ^ Филп А.Р., Гарсия-Фернандес Дж.М., Сони Б.Г., Лукас Р.Дж., Беллингем Дж., Фостер Р.Г. (июнь 2000 г.). «Древний (VA) опсин позвоночных и экстраретинальная фоторецепция у атлантического лосося (Salmo salar)». Журнал экспериментальной биологии . 203 (Часть 12): 1925–1936. дои : 10.1242/jeb.203.12.1925 . ПМИД 10821749 .
- ^ Полетини М.О., Рамос Б.К., Мораес М.Н., Каструччи А.М. (2015). «Невизуальные опсины и регуляция периферических часов светом и гормонами» . Фотохимия и фотобиология . 91 (5): 1046–1055. дои : 10.1111/php.12494 . ПМИД 26174318 . S2CID 41895317 .
- ^ Блэкшоу С., Снайдер Ш. (ноябрь 1997 г.). «Парапинопсин, новый опсин сома, локализованный в парапинеальном органе, определяет новое семейство генов» . Журнал неврологии . 17 (21): 8083–8092. doi : 10.1523/JNEUROSCI.17-21-08083.1997 . ПМК 6573767 . ПМИД 9334384 .
- ^ Коянаги М., Кавано Э., Кинугава Ю., Оиси Т., Шичида Ю., Тамоцу С., Теракита А. (апрель 2004 г.). «Бистабильный УФ-пигмент в шишковидной железе миноги» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (17): 6687–6691. Бибкод : 2004PNAS..101.6687K . дои : 10.1073/pnas.0400819101 . ПМК 404106 . ПМИД 15096614 .
- ^ Коянаги М., Вада С., Кавано-Ямашита Е., Хара Ю., Кураку С., Косака С. и др. (сентябрь 2015 г.). «Диверсификация невизуального фотопигмента парапинопсина по спектральной чувствительности для различных функций шишковидной железы» . БМК Биология . 13 (1): 73. дои : 10.1186/s12915-015-0174-9 . ПМК 4570685 . ПМИД 26370232 .
- ^ Су С.И., Луо Д.Г., Теракита А., Шичида Ю., Ляо Х.В., Казми М.А. и др. (март 2006 г.). «Компоненты фототрансдукции теменного глаза и их потенциальные эволюционные последствия». Наука . 311 (5767): 1617–1621. Бибкод : 2006Sci...311.1617S . дои : 10.1126/science.1123802 . ПМИД 16543463 . S2CID 28604455 .
- ^ Коянаги М., Теракита А. (май 2014 г.). «Разнообразие пигментов на основе опсинов животных и их оптогенетический потенциал» . Biochimica et Biophysica Acta (BBA) – Биоэнергетика . 1837 (5): 710–716. дои : 10.1016/j.bbabio.2013.09.003 . ПМИД 24041647 .
- ^ Перейти обратно: а б с Хэлфорд С., Фридман М.С., Беллингем Дж., Инглис С.Л., Пупаласундарам С., Сони Б.Г. и др. (март 2001 г.). «Характеристика нового гена опсина человека с широкой тканевой экспрессией и идентификация встроенных и фланкирующих генов на хромосоме 1q43». Геномика . 72 (2): 203–208. дои : 10.1006/geno.2001.6469 . ПМИД 11401433 .
- ^ Арендт Д., Тессмар-Райбл К., Снайман Х., Доррестейн А.В., Виттбродт Дж. (октябрь 2004 г.). «Цилиарные фоторецепторы с опсином позвоночного типа в мозге беспозвоночных». Наука . 306 (5697): 869–871. Бибкод : 2004Sci...306..869A . дои : 10.1126/science.1099955 . ПМИД 15514158 . S2CID 2583520 .
- ^ Цукамото Х., Чен И.С., Кубо Ю., Фурутани Ю. (август 2017 г.). «Цилиарный опсин в мозгу морского кольчатого зоопланктона чувствителен к ультрафиолету, а чувствительность настраивается с помощью одного аминокислотного остатка» . Журнал биологической химии . 292 (31): 12971–12980. дои : 10.1074/jbc.M117.793539 . ПМК 5546036 . ПМИД 28623234 .
- ^ Айерс Т., Цукамото Х., Гуманн М., Видин Раджан В.Б., Тессмар-Райбл К. (апрель 2018 г.). «Опсин AG o -типа опосредует теневой рефлекс у кольчатых червей Platynereis dumerilii» . БМК Биология . 16 (1): 41. дои : 10.1186/s12915-018-0505-8 . ПМК 5904973 . ПМИД 29669554 .
- ^ Верасто С., Гуманн М., Цзя Х., Раджан В.Б., Безарес-Кальдерон Л.А., Пиньейро-Лопес С. и др. (май 2018 г.). «Цилиарные и рабдомерные фоторецепторные клетки образуют спектральный датчик глубины в морском зоопланктоне» . электронная жизнь . 7 . doi : 10.7554/eLife.36440 . ПМК 6019069 . ПМИД 29809157 .
- ^ Перейти обратно: а б Гуманн М., Цзя Х., Рандель Н., Верасто С., Безарес-Кальдерон Л.А., Михильс Н.К. и др. (август 2015 г.). «Спектральная настройка фототаксиса го-опсином в рабдомерных глазах Platynereis» . Современная биология . 25 (17): 2265–2271. Бибкод : 2015CBio...25.2265G . дои : 10.1016/j.cub.2015.07.017 . ПМИД 26255845 .
- ^ Нильссон Д.Е. (октябрь 2009 г.). «Эволюция глаз и зрительно-ориентированное поведение» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 364 (1531): 2833–2847. дои : 10.1098/rstb.2009.0083 . ПМК 2781862 . ПМИД 19720648 .
- ^ Нильссон Д.Е. (март 2013 г.). «Эволюция глаза и его функциональная основа» . Визуальная нейронаука . 30 (1–2): 5–20. дои : 10.1017/S0952523813000035 . ПМЦ 3632888 . ПМИД 23578808 .
- ^ Коянаги М., Такада Э., Нагата Т., Цукамото Х., Теракита А. (март 2013 г.). «Гомологи Opn3 позвоночных потенциально служат датчиком света в нефоторецепторной ткани» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (13): 4998–5003. Бибкод : 2013PNAS..110.4998K . дои : 10.1073/pnas.1219416110 . ПМЦ 3612648 . ПМИД 23479626 .
- ^ Перейти обратно: а б Сакаи К., Ямасита Т., Имамото Ю., Шичида Ю. (22 октября 2015 г.). «Многообразие активных состояний в опсинах ТМТ» . ПЛОС ОДИН . 10 (10): e0141238. Бибкод : 2015PLoSO..1041238S . дои : 10.1371/journal.pone.0141238 . ПМЦ 4619619 . ПМИД 26491964 .
- ^ Перейти обратно: а б Фишер Р.М., Фонтинья Б.М., Кирхмайер С., Стегер Дж., Блох С., Иноуэ Д. и др. (11 июня 2013 г.). «Совместная экспрессия VAL- и TMT-опсинов открывает древние фотосенсорные интернейроны и мотонейроны в мозге позвоночных» . ПЛОС Биология . 11 (6): e1001585. дои : 10.1371/journal.pbio.1001585 . ПМК 3679003 . ПМИД 23776409 .
- ^ Перейти обратно: а б Моутсаки П., Уитмор Д., Беллингем Дж., Сакамото К., Дэвид-Грей З.К., Фостер Р.Г. (апрель 2003 г.). «Опсин множественной ткани костной ткани (tmt): кандидат в фотопигмент, регулирующий периферические часы рыбок данио?». Исследования мозга. Молекулярные исследования мозга . 112 (1–2): 135–145. дои : 10.1016/S0169-328X(03)00059-7 . ПМИД 12670711 .
- ^ Коянаги М., Такано К., Цукамото Х., Оцу К., Токунага Ф., Теракита А. (октябрь 2008 г.). «Зрение медуз начинается с передачи сигналов цАМФ, опосредованной каскадом опсин-G(s)» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (40): 15576–15580. Бибкод : 2008PNAS..10515576K . дои : 10.1073/pnas.0806215105 . ПМК 2563118 . ПМИД 18832159 .
- ^ Мейсон Б., Шмале М., Гиббс П., Миллер М.В., Ван К., Левай К. и др. (5 декабря 2012 г.). «Доказательства существования множественных путей фототрансдукции в кораллах, строящих рифы» . ПЛОС ОДИН . 7 (12): e50371. Бибкод : 2012PLoSO...750371M . дои : 10.1371/journal.pone.0050371 . ПМЦ 3515558 . ПМИД 23227169 .
- ^ Шуга Х., Шмид В., Геринг В.Дж. (январь 2008 г.). «Эволюция и функциональное разнообразие опсинов медуз» . Современная биология . 18 (1): 51–55. Бибкод : 2008CBio...18...51S . дои : 10.1016/j.cub.2007.11.059 . ПМИД 18160295 .
- ^ Феуда Р., Рота-Стабелли О, Окли Т.Х., Пизани Д. (июль 2014 г.). «Гребенчатые опсины и происхождение фототрансдукции животных» . Геномная биология и эволюция . 6 (8): 1964–1971. дои : 10.1093/gbe/evu154 . ПМК 4159004 . ПМИД 25062921 .
- ^ Смит У.К., Прайс Д.А., Гринберг Р.М., Баттель Б.А. (июль 1993 г.). «Опсины из боковых глаз и глазков мечехвоста Limulus polyphemus» . Труды Национальной академии наук Соединенных Штатов Америки . 90 (13): 6150–6154. Бибкод : 1993PNAS...90.6150S . дои : 10.1073/pnas.90.13.6150 . ПМК 46885 . ПМИД 8327495 .
- ^ Перейти обратно: а б Ямасита Т., Охучи Х., Томонари С., Икеда К., Сакаи К., Шичида Ю. (декабрь 2010 г.). «Opn5 — это чувствительный к УФ-излучению бистабильный пигмент, который соединяется с подтипами G-белка Gi и Gq» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (51): 22084–22089. Бибкод : 2010PNAS..10722084Y . дои : 10.1073/pnas.1012498107 . ПМК 3009823 . ПМИД 21135214 .
- ^ Бур Э.Д., Юэ В.В., Рен X, Цзян З., Ляо Х.В., Мэй Икс и др. (октябрь 2015 г.). «Опосредованное нейропсином (OPN5) фотоувлечение местных циркадных осцилляторов в сетчатке и роговице млекопитающих» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (42): 13093–13098. Бибкод : 2015PNAS..11213093B . дои : 10.1073/pnas.1516259112 . ПМЦ 4620855 . ПМИД 26392540 .
- ^ Геринг Л., Майер Г. (сентябрь 2014 г.). «Анализ репертуара опсинов у тихоходок Hypsibius dujardini дает представление об эволюции генов опсинов у панартропод» . Геномная биология и эволюция . 6 (9): 2380–2391. дои : 10.1093/gbe/evu193 . ПМК 4202329 . ПМИД 25193307 .
- ^ Кодзима Д., Теракита А., Исикава Т., Цукахара Ю., Маэда А., Шичида Ю. (сентябрь 1997 г.). «Новый каскад фототрансдукции, опосредованный Go, в зрительных клетках гребешка» . Журнал биологической химии . 272 (37): 22979–22982. дои : 10.1074/jbc.272.37.22979 . ПМИД 9287291 .
- ^ Коянаги М., Теракита А., Кубокава К., Шичида Ю. (ноябрь 2002 г.). «Амфиоксусные гомологи Go-связанного родопсина и перопсина, имеющие 11-цис- и полностью транс-ретинали в качестве хромофоров» . Письма ФЭБС . 531 (3): 525–528. дои : 10.1016/s0014-5793(02)03616-5 . ПМИД 12435605 . S2CID 11669142 .
- ^ Цзян М., Панди С., Фонг Х.К. (декабрь 1993 г.). «Гомолог опсина в сетчатке и пигментном эпителии». Исследовательская офтальмология и визуальные науки . 34 (13): 3669–3678. ПМИД 8258527 .
- ^ Нагата Т., Коянаги М., Теракита А. (20 октября 2010 г.). «Молекулярная эволюция и функциональное разнообразие фотопигментов на основе опсина» . Проверено 7 мая 2018 г.
- ^ Венцель А., Оберхаузер В., Пью Э.Н., Лэмб Т.Д., Гримм С., Самардзия М. и др. (август 2005 г.). «Рецептор, связанный с G-белком сетчатки (RGR), усиливает активность изомерогидролазы независимо от света» . Журнал биологической химии . 280 (33): 29874–29884. дои : 10.1074/jbc.M503603200 . ПМИД 15961402 .
- ^ Раду Р.А., Ху Дж., Пэн Дж., Бок Д., Мата Н.Л., Трэвис Г.Х. (июль 2008 г.). «Пигментный эпителий сетчатки-рецептор G-белка сетчатки-опсин опосредует светозависимую транслокацию всех-транс-ретиниловых эфиров для синтеза зрительного хромофора в клетках пигментного эпителия сетчатки» . Журнал биологической химии . 283 (28): 19730–19738. дои : 10.1074/jbc.M801288200 . ПМЦ 2443657 . ПМИД 18474598 .
- ^ Хао В., Фонг Гонконг (май 1996 г.). «Синий и ультрафиолетовый светопоглощающий опсин из пигментного эпителия сетчатки». Биохимия . 35 (20): 6251–6256. дои : 10.1021/bi952420k . ПМИД 8639565 .
- ^ Сан Х., Гилберт Д.Д., Коупленд Н.Г., Дженкинс Н.А., Натанс Дж. (сентябрь 1997 г.). «Перопсин, новый зрительный пигментоподобный белок, расположенный в апикальных микроворсинках пигментного эпителия сетчатки» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (18): 9893–9898. Бибкод : 1997PNAS...94.9893S . дои : 10.1073/pnas.94.18.9893 . ПМК 23288 . ПМИД 9275222 .
- ^ Бьёрн ЛО (2 января 2015 г.). Фотобиология: наука о свете и жизни . Спрингер. п. 169. ИСБН 978-1-4939-1468-5 . Проверено 3 сентября 2015 г.
- ^ Фернальд Р.Д. (сентябрь 2006 г.). «Проливая генетический свет на эволюцию глаз». Наука . 313 (5795): 1914–1918. Бибкод : 2006Sci...313.1914F . дои : 10.1126/science.1127889 . ПМИД 17008522 . S2CID 84439732 .
- ^ Ващук С.А., Безерра А.Г., Ши Л., Браун Л.С. (май 2005 г.). «Родопсин Leptosphaeria: бактериородопсиноподобный протонный насос эукариот» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (19): 6879–6883. Бибкод : 2005PNAS..102.6879W . дои : 10.1073/pnas.0409659102 . ПМК 1100770 . ПМИД 15860584 .
- ^ Финдли Дж. Б., Паппин DJ (сентябрь 1986 г.). «Семейство белков опсинов» . Биохимический журнал . 238 (3): 625–642. дои : 10.1042/bj2380625 . ПМЦ 1147185 . ПМИД 2948499 .
- ^ Шен Л., Чэнь С., Чжэн Х., Цзинь Л. (2013). «Эволюционная связь между микробными родопсинами и многоклеточными родопсинами» . Научный мировой журнал . 2013 : 435651. doi : 10.1155/2013/435651 . ПМЦ 3583139 . ПМИД 23476135 .
- ^ Чжан Цз, Цзинь Цз, Чжао Ю, Чжан Цз, Ли Р, Сяо Дж, Ву Дж (август 2014 г.). «Систематическое исследование прототипов рецепторов пар G-белков: действительно ли они произошли от прокариотических генов?» . ИЭПП Системная биология . 8 (4): 154–161. дои : 10.1049/iet-syb.2013.0037 . ПМЦ 8687355 . ПМИД 25075528 .
- ^ Нордстрем К.Дж., Саллман Альмин М., Эдстам М.М., Фредрикссон Р., Шит Х.Б. (сентябрь 2011 г.). «Независимый поиск HH, анализ Нидлмана-Вунша и анализ мотивов выявляют общую иерархию для большинства семейств рецепторов, связанных с G-белком» . Молекулярная биология и эволюция . 28 (9): 2471–2480. дои : 10.1093/molbev/msr061 . ПМИД 21402729 .
- ^ Йи Д.С., Шлыков М.А., Вестермарк А., Редди В.С., Арора С., Сан Э.И., Сайер М.Х. (ноябрь 2013 г.). «Суперсемейство рецепторов, связанных с белком транспортер-опсин-G (TOG)» . Журнал ФЭБС . 280 (22): 5780–5800. дои : 10.1111/февраль 12499 . ПМЦ 3832197 . ПМИД 23981446 .
- ^ Ёсидзава С., Кумагай Ю., Ким Х., Огура Ю., Хаяши Т., Ивасаки В. и др. (май 2014 г.). «Функциональная характеристика родопсинов флавобактерий раскрывает уникальный класс светоуправляемых хлоридных насосов у бактерий» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (18): 6732–6737. Бибкод : 2014PNAS..111.6732Y . дои : 10.1073/pnas.1403051111 . ПМК 4020065 . ПМИД 24706784 .
- ^ Гроте М., Энгельхард М., Хегеманн П. (май 2014 г.). «Ионные насосы, датчики и каналы - взгляды на микробные родопсины между наукой и историей» . Biochimica et Biophysica Acta (BBA) – Биоэнергетика . 1837 (5): 533–545. дои : 10.1016/j.bbabio.2013.08.006 . ПМИД 23994288 .
- ^ Рёмплер Х., Штойберт С., Тор Д., Шульц А., Хофрайтер М., Шенеберг Т. (февраль 2007 г.). «Путешествие во времени, связанное с G-белком: эволюционные аспекты исследования GPCR». Молекулярные вмешательства . 7 (1): 17–25. дои : 10.1124/ми.7.1.5 . ПМИД 17339603 .
- ^ Чжан Ф., Виерок Дж., Ижар О., Фенно Л.Е., Цунода С., Кианианмомени А. и др. (декабрь 2011 г.). «Семейство оптогенетических инструментов микробного опсина» . Клетка . 147 (7): 1446–1457. дои : 10.1016/j.cell.2011.12.004 . ПМК 4166436 . ПМИД 22196724 .


