Группа Флавин
статьи первый раздел Возможно, придется переписать . Причина такова: Согласно MOS:INTRO , «избегайте трудной для понимания терминологии» в начале. ( сентябрь 2022 г. ) |
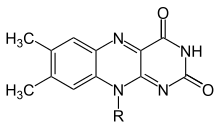

Флавины (от латинского flavus , «желтый») обычно относятся к классу органических соединений, содержащих трициклический гетероцикл изоаллоксазин или его изомер аллоксазин и его производные. Биохимическим источником флавина является желтый витамин В рибофлавин . Флавиновая часть часто присоединяется с аденозиндифосфатом с образованием флавинадениндинуклеотида ( FAD ), а в других обстоятельствах обнаруживается как флавинмононуклеотид (или FMN ), фосфорилированная форма рибофлавина . Именно в той или иной из этих форм флавин присутствует в качестве простетической группы во флавопротеинах . Несмотря на схожие названия, флавины (с «i») химически и биологически отличаются от флавоноидов (с «а») и флавонолов (с «о»).
Флавиновая группа способна вступать в окислительно-восстановительные реакции и может принимать либо один электрон в двухстадийном процессе, либо два электрона одновременно. Восстановление осуществляется путем присоединения атомов водорода к определенным атомам азота в кольцевой системе изоаллоксазина :

В водном растворе флавины при окислении окрашиваются в желтый цвет, приобретая красный цвет в полувосстановленном анионном состоянии или синий в нейтральном ( семихиноновом ) состоянии, и бесцветные при полном восстановлении. [1] Окисленная и восстановленная формы находятся в быстром равновесии с семихиноновой ( радикальной ) формой, сдвинутой против образования радикала: [2]
- Fl ox + Fl красный H 2 ⇌ FlH •
где Fl ox — окисленный флавин, Fl red H 2 — восстановленный флавин (при присоединении двух атомов водорода) и FlH • семихиноновая форма (присоединение одного атома водорода).
В форме FADH 2 это один из кофакторов, который может переносить электроны в цепь переноса электронов .
Фоторедукция
[ редактировать ]Как свободные, так и связанные с белком флавины фотовосстанавливаются , то есть способны восстанавливаться под действием света по механизму, опосредованному несколькими органическими соединениями, такими как некоторые аминокислоты , карбоновые кислоты и амины . [2] Это свойство флавинов используется различными светочувствительными белками. Например, домен LOV, обнаруженный у многих видов растений, грибов и бактерий, претерпевает обратимые светозависимые структурные изменения, которые включают образование связи между остатком цистеина в его пептидной последовательности и связанным FMN. [3]
ФАД
[ редактировать ]
Флавинадениндинуклеотид представляет собой группу, связанную со многими ферментами, включая ферредоксин-НАДФ+ редуктазу , моноаминоксидазу , оксидазу D-аминокислот , глюкозоксидазу , ксантиноксидазу и ацил-КоА-дегидрогеназу .
ДЛИННЫЙ/ДЛИННЫЙ 2
[ редактировать ]ФАДГ и ФАДГ 2 представляют собой восстановленные формы ФАД. FADH 2 вырабатывается как простетическая группа в сукцинатдегидрогеназе , ферменте, участвующем в цикле лимонной кислоты . При окислительном фосфорилировании две молекулы ФАДН 2 обычно дают 1,5 АТФ каждая или три АТФ вместе взятые.
ФМН
[ редактировать ]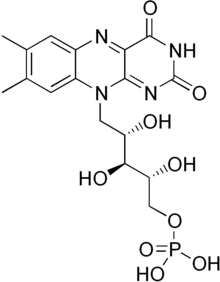
Флавинмононуклеотид представляет собой простетическую группу, обнаруженную, среди других белков, в НАДН-дегидрогеназе , E.coli нитроредуктазе и старом желтом ферменте .
См. также
[ редактировать ]- Птеридин
- Питера
- Деазафлавин (5-деазафлавин)
Ссылки
[ редактировать ]- ^ Михаэлис Л., Шуберт, член парламента, Смайт CV (1936). «Потенциометрическое исследование флавинов» . Журнал биологической химии . 116 (2): 587–607. дои : 10.1016/S0021-9258(18)74634-6 . Архивировано из оригинала 8 августа 2009 г. Проверено 25 апреля 2008 г.
- ^ Перейти обратно: а б Мэсси В., Станкович М., Хеммерих П. (январь 1978 г.). «Светоопосредованное восстановление флавопротеинов с использованием флавинов в качестве катализаторов». Биохимия . 17 (1): 1–8. дои : 10.1021/bi00594a001 . ПМИД 618535 .
- ^ Александр М.Т., Домрачева Т., Бонетти С., ван Вильдерен Л.Дж., ван Гронделл Р., Грут М.Л., Хеллингверф К.Дж., Кеннис Дж.Т. (июль 2009 г.). «Первичные реакции домена LOV2 фототропина, изученные с помощью сверхбыстрой спектроскопии среднего инфракрасного диапазона и квантовой химии» . Биофизический журнал . 97 (1): 227–37. Бибкод : 2009BpJ....97..227A . дои : 10.1016/j.bpj.2009.01.066 . ПМЦ 2711383 . ПМИД 19580760 .
Дальнейшее чтение
[ редактировать ]- Фут D, Фут JG (2004). Биохимия (3-е изд.). Джон Уайли и сыновья. ISBN 0-471-39223-5 .