Рецептор фолликулостимулирующего гормона
| ФШР | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | FSHR , FSHR1, FSHRO, LGR1, ODG1, рецептор фолликулостимулирующего гормона | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 136435 ; МГИ : 95583 ; Гомологен : 117 ; Генные карты : ФШР ; ОМА : ФШР - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Рецептор фолликулостимулирующего гормона или рецептор ФСГ ( FSHR ) представляет собой трансмембранный рецептор , который взаимодействует с фолликулостимулирующим гормоном (ФСГ) и представляет собой рецептор, связанный с G-белком (GPCR). Его активация необходима для гормонального функционирования ФСГ. FSHR обнаружены в яичниках , семенниках и матке .
ген ФШР
[ редактировать ]Ген FSHR находится на хромосоме 2 p21 у человека. Последовательность гена FSHR состоит примерно из 2080 нуклеотидов . [5]
Структура рецептора
[ редактировать ]
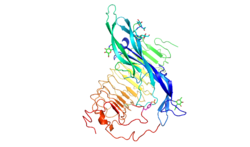
FSHR состоит из 695 аминокислот и имеет молекулярную массу около 76 кДа. [5] Как и другие GPCR, рецептор ФСГ обладает семью трансмембранными доменами или трансмембранными спиралями .
- Внеклеточный домен рецептора содержит 11 богатых лейцином повторов и гликозилирован . Он имеет два субдомена: субдомен, связывающий гормоны, за которым следует субдомен, специфичный для сигнала. [6] Гормонсвязывающий субдомен отвечает за связывание гормона с высоким сродством, а субдомен сигнальной специфичности, содержащий сульфатированный тирозин в положении 335 (sTyr) в шарнирной петле, необходим для активности гормона. [7]
- Трансмембранный домен содержит два высококонсервативных остатка цистеина , которые создают дисульфидные связи для стабилизации структуры рецептора. Высококонсервативный триплетный мотив Asp-Arg-Tyr присутствует у членов семейства GPCR в целом и может иметь значение для передачи сигнала. В FSHR и других близкородственных ему членах рецепторов гликопротеиновых гормонов (LHR и TSHR ) этот консервативный триплетный мотив представляет собой вариацию последовательности Glu-Arg-Trp. [8]
- является С-концевой домен внутриклеточным и коротким, богат остатками серина и треонина для возможного фосфорилирования .
Связывание лигандов и передача сигнала
[ редактировать ]После первоначального связывания с областью LRR FSHR ФСГ меняет свою конформацию, образуя новый карман. Затем FSHR вставляет свой сульфотирозин из шарнирной петли в карманы и активирует 7-спиральный трансмембранный домен. [6] Это событие приводит к передаче сигнала , который активирует белок Gs , который внутренне связан с рецептором. При присоединении ФСГ рецептор меняет конформацию и, таким образом, механически активирует G-белок, который отделяется от рецептора и активирует систему цАМФ . [9] [10]
Считается, что молекула рецептора существует в конформационном равновесии между активным и неактивным состояниями. Связывание ФСГ с рецептором сдвигает равновесие между активными и неактивными рецепторами. ФСГ и ФСГ-агонисты смещают равновесие в пользу активных состояний; Антагонисты ФСГ смещают равновесие в пользу неактивных состояний.
Фосфорилирование цАМФ-зависимыми протеинкиназами
[ редактировать ]Циклические АМФ-зависимые протеинкиназы ( протеинкиназа А ) активируются сигнальной цепью, идущей от белка Gs (который активируется рецептором ФСГ) через аденилатциклазу и циклический АМФ (цАМФ). [9] [10]
Эти протеинкиназы представлены в виде тетрамеров с двумя регуляторными единицами и двумя каталитическими единицами. При связывании цАМФ с регуляторными единицами каталитические единицы высвобождаются и инициируют фосфорилирование белков, что приводит к физиологическому действию. Димеры, регулирующие циклический АМФ, разрушаются фосфодиэстеразой и высвобождают 5'АМФ. ДНК в клеточном ядре связывается с фосфорилированными белками через элемент ответа циклического АМФ (CRE), что приводит к активации генов . [5]
Сигнал усиливается за счет участия цАМФ и последующего фосфорилирования. Процесс модифицируется простагландинами . Другими клеточными регуляторами являются внутриклеточная концентрация кальция, модифицированная фосфолипазой , азотной кислотой и другими факторами роста.
Рецептор ФСГ также может активировать киназы, регулируемые внеклеточными сигналами (ERK). [11] По механизму обратной связи эти активированные киназы фосфорилируют рецептор.
Действие
[ редактировать ]В яичнике рецептор ФСГ необходим для развития фолликулов и экспрессируется на гранулезных клетках . [5]
У мужчин рецептор ФСГ был идентифицирован на клетках Сертоли , которые имеют решающее значение для сперматогенеза . [12]
FSHR экспрессируется во время лютеиновой фазы в секреторном эндометрии матки. [13]
Рецептор ФСГ избирательно экспрессируется на поверхности кровеносных сосудов широкого спектра канцерогенных опухолей. [14]
Регуляция рецепторов
[ редактировать ]Повышение регуляции
[ редактировать ]Положительная регуляция означает увеличение количества рецепторных участков на мембране. Эстроген активирует рецепторы ФСГ. В свою очередь, ФСГ стимулирует гранулезные клетки к выработке эстрогенов . Эта синергетическая активность эстрогена и ФСГ способствует росту и развитию фолликулов в яичниках. [ нужна ссылка ]
Десенсибилизация
[ редактировать ]ФСГР теряет чувствительность при воздействии ФСГ в течение некоторого времени. Ключевой реакцией этого подавления является фосфорилирование внутриклеточного (или цитоплазматического ) домена рецептора протеинкиназами . [15] Этот процесс отсоединяет белок Gs от FSHR. Другой способ десенсибилизации — разъединить регуляторные и каталитические единицы системы цАМФ. [ нужна ссылка ]
Даунрегуляция
[ редактировать ]Понижение регуляции означает уменьшение количества рецепторных участков. Этого можно достичь путем метаболизма связанных сайтов FSHR. Связанный комплекс ФСГ-рецептор переносится путем латеральной миграции в «покрытую ямку», где такие единицы концентрируются, а затем стабилизируются каркасом из клатринов . Отщипнутая покрытая оболочкой ямка интернализируется и разрушается лизосомами . Белки могут метаболизироваться или рецептор может быть переработан.
Модуляторы
[ редактировать ]Антитела к FSHR могут мешать активности FSHR.
Нарушения ФСГ
[ редактировать ]У некоторых пациенток с синдромом гиперстимуляции яичников могут быть мутации в гене FSHR, что делает их более чувствительными к стимуляции гонадотропинами. [16]
У женщин с дисгенезией гонад 46 XX наблюдается первичная аменорея с гипергонадотропным гипогонадизмом . Существуют формы дисгенезии гонад 46 xx, при которых наблюдаются нарушения рецептора ФСГ, которые считаются причиной гипогонадизма. [17]
Полиморфизм может повлиять на популяцию рецепторов ФСГ и привести к ухудшению реакции у бесплодных женщин, получающих препараты ФСГ для ЭКО . [18]
Альтернативный сплайсинг гена FSHR может быть связан с бесплодием у мужчин [19]
Лиганды
[ редактировать ]Фолликулостимулирующий гормон (ФСГ) является агонистом ФСГР.
низкомолекулярные положительные аллостерические модуляторы ФСГР. Разработаны [20]
История
[ редактировать ]Альфред Гилман и Мартин Родбелл получили Нобелевскую премию по медицине и физиологии 1994 года за «открытие G-белков и роли этих белков в передаче сигналов в клетках». [21] [22]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Ensembl, выпуск 89: ENSG00000170820 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000032937 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б с д Симони М., Громолл Дж., Нишлаг Э. (декабрь 1997 г.). «Рецептор фолликулостимулирующего гормона: биохимия, молекулярная биология, физиология и патофизиология» . Эндокринные обзоры . 18 (6): 739–73. дои : 10.1210/edrv.18.6.0320 . ПМИД 9408742 .
- ^ Jump up to: а б Цзян X, Лю Х, Чен X, Чен П.Х., Фишер Д., Шрираман В. и др. (июль 2012 г.). «Структура фолликулостимулирующего гормона в комплексе со всем эктодоменом его рецептора» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (31): 12491–6. Бибкод : 2012PNAS..10912491J . дои : 10.1073/pnas.1206643109 . ПМК 3411987 . ПМИД 22802634 .
- ^ Костальола С., Паннелс В., Бономи М., Кох Дж., Мани МС, Смитс Г. и др. (февраль 2002 г.). «Сульфатирование тирозина необходимо для распознавания агониста рецепторами гликопротеиновых гормонов» . Журнал ЭМБО . 21 (4): 504–13. дои : 10.1093/emboj/21.4.504 . ПМЦ 125869 . ПМИД 11847099 .
- ^ Цзян X, Диас Дж.А., Хэ X (январь 2014 г.). «Структурная биология гликопротеиновых гормонов и их рецепторов: понимание передачи сигналов» . Молекулярная и клеточная эндокринология . 382 (1): 424–51. дои : 10.1016/j.mce.2013.08.021 . ПМИД 24001578 .
- ^ Jump up to: а б Де Паскали Ф., Трефье А., Ландомиэль Ф., Бозон В., Брюно Дж., Ивинец Р. и др. (2018). «Рецептор фолликулостимулирующего гормона: достижения и оставшиеся проблемы». Международное обозрение клеточной и молекулярной биологии . 338 : 1–58. arXiv : 1808.01965 . дои : 10.1016/bs.ircmb.2018.02.001 . ISBN 978-0-12-813772-7 . ПМИД 29699689 .
- ^ Jump up to: а б Казарини Л., Крепье П. (2019). «Молекулярные механизмы действия ФСГ» . Границы эндокринологии . 10 :305. дои : 10.3389/fendo.2019.00305 . hdl : 11380/1181065 . ПМИД 31139153 .
- ^ Пикетти В., Кара Э., Гийу Ф., Рейтер Э., Крепье П. (2006). «Фолликулостимулирующий гормон (ФСГ) активирует фосфорилирование киназы, регулируемое внеклеточными сигналами, независимо от интернализации рецептора ФСГ, опосредованной бета-аррестином и динамином» . Репродуктивная биология и эндокринология . 4:33 . дои : 10.1186/1477-7827-4-33 . ПМЦ 1524777 . ПМИД 16787538 .
- ^ Асатиани К., Громолл Дж., Экардштейн С.В., Зицманн М., Нишлаг Э., Симони М. (июнь 2002 г.). «Распределение и функция генетических вариантов рецептора ФСГ у нормальных мужчин» . Андрология . 34 (3): 172–6. дои : 10.1046/j.1439-0272.2002.00493.x . ПМИД 12059813 . S2CID 21090038 .
- ^ Ла Марка А, Кардуччи Артенисио А, Стабиле Г, Риваси Ф, Вольпе А (декабрь 2005 г.). «Доказательства циклозависимой экспрессии рецептора фолликулостимулирующего гормона в эндометрии человека». Гинекологическая эндокринология . 21 (6): 303–6. дои : 10.1080/09513590500402756 . ПМИД 16390776 . S2CID 24690912 .
- ^ Раду А., Пишон С., Кампаро П., Антуан М., Аллори Ю., Кувелард А. и др. (октябрь 2010 г.). «Экспрессия рецептора фолликулостимулирующего гормона в кровеносных сосудах опухоли» . Медицинский журнал Новой Англии . 363 (17): 1621–30. дои : 10.1056/NEJMoa1001283 . ПМИД 20961245 .
- ^ Манна П.Р., Пакарайнен П., Ранникко А.С., Хухтаниеми И.Т. (ноябрь 1998 г.). «Механизмы десенсибилизации действия фолликулостимулирующего гормона (ФСГ) в клеточной линии мышиной гранулезы, стабильно трансфицированной дезоксирибонуклеиновой кислотой, комплементарной рецептору ФСГ человека». Молекулярная и клеточная эндокринология . 146 (1–2): 163–176. дои : 10.1016/S0303-7207(98)00156-7 . ПМИД 10022774 .
- ^ Дельбар А., Смитс Г., Де Леенер А., Костальола С., Вассарт Г. (апрель 2005 г.). «Понимание синдрома гиперстимуляции яичников». Эндокринный . 26 (3): 285–90. дои : 10.1385/ЭНДО:26:3:285 . ПМИД 16034183 . S2CID 7607365 .
- ^ Айттомяки К., Лусена Дж.Л., Пакаринен П., Систонен П., Тапанайнен Дж., Громолл Дж. и др. (сентябрь 1995 г.). «Мутация в гене рецептора фолликулостимулирующего гормона вызывает наследственную гипергонадотропную недостаточность яичников» . Клетка . 82 (6): 959–68. дои : 10.1016/0092-8674(95)90275-9 . ПМИД 7553856 . S2CID 14748261 .
- ^ Лутрадис Д., Патсула Е., Минас В., Кусидис Г.А., Анцаклис А., Михалас С. и др. (апрель 2006 г.). «Полиморфизм гена рецептора ФСГ играет роль в различной реакции яичников на стимуляцию у пациенток, вступающих в программы ЭКО/ИКСИ-ЭТ» . Журнал вспомогательной репродукции и генетики . 23 (4): 177–84. дои : 10.1007/s10815-005-9015-z . ПМЦ 3454958 . ПМИД 16758348 .
- ^ Сон GJ, Пак Ю.С., Ли Ю.С., Ли CC, Кан И.С. (март 2002 г.). «Альтернативно сплайсированные варианты гена рецептора фолликулостимулирующего гормона в яичках бесплодных мужчин» . Фертильность и бесплодие . 77 (3): 499–504. дои : 10.1016/s0015-0282(01)03221-6 . ПМИД 11872202 .
- ^ Натараджа С., Ю Х., Гунер Дж., Палмер С. (2020). «Открытие и доклиническая разработка перорально активных малых молекул, которые проявляют высокоселективный агонизм рецепторов фолликулостимулирующих гормонов» . Фронт Фармакол . 11 : 602593. дои : 10.3389/fphar.2020.602593 . ПМЦ 7845544 . ПМИД 33519465 .
- ^ Гилман А.Г. (1994). «G-белки и регуляция аденилатциклазы» . Нобелевская лекция .
- ^ Родбелл М. (1994). «Передача сигналов: эволюция идеи» . Нобелевская лекция .