Домен гомологии плекстрина
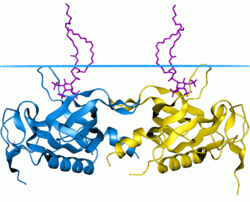 PH-домен тирозин-протеинкиназы BTK | |||
| Идентификаторы | |||
|---|---|---|---|
| Символ | PH | ||
| Пфам | PF00169 | ||
| Пфам Клан | CL0266 | ||
| ИнтерПро | ИПР001849 | ||
| УМНЫЙ | PH | ||
| PROSITE | PDOC50003 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1дин / СКОПе / СУПФАМ | ||
| Суперсемейство OPM | 49 | ||
| белок OPM | 1пожалуйста | ||
| CDD | cd00821 | ||
| |||
Домен гомологии плекстрина ( домен PH ) или ( PHIP ) представляет собой белковый домен , состоящий примерно из 120 аминокислот , который встречается в широком спектре белков, участвующих во внутриклеточной передаче сигналов или в составе цитоскелета . [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ]
Этот домен может связывать липиды фосфатидилинозитола внутри биологических мембран (такие как фосфатидилинозитол (3,4,5)-трифосфат и фосфатидилинозитол (4,5)-бисфосфат ), [ 8 ] и белки, такие как βγ-субъединицы гетеротримерных G-белков , [ 9 ] и протеинкиназа С. [ 10 ] Посредством этих взаимодействий домены PH играют роль в привлечении белков к различным мембранам , направляя их таким образом в соответствующие клеточные компартменты или позволяя им взаимодействовать с другими компонентами путей передачи сигнала .
Специфичность связывания липидов
[ редактировать ]Отдельные домены PH обладают специфичностью в отношении фосфоинозитидов, фосфорилированных в разных сайтах внутри инозитолового кольца, например, некоторые из них связывают фосфатидилинозитол(4,5)-бисфосфат , но не фосфатидилинозитол(3,4,5)-трифосфат или фосфатидилинозитол(3,4)-бисфосфат . в то время как другие могут обладать необходимой близостью. Это важно, поскольку это делает рекрутирование различных белков, содержащих домен PH, чувствительным к активности ферментов, которые либо фосфорилируют, либо дефосфорилируют эти сайты на инозитольном кольце, таких как фосфоинозитид-3-киназа или PTEN соответственно. Таким образом, такие ферменты частично оказывают свое влияние на функцию клеток, модулируя локализацию нижестоящих сигнальных белков, которые обладают доменами PH, способными связывать свои фосфолипидные продукты.
Структура
[ редактировать ]Определена трехмерная структура нескольких доменов PH. [ 11 ] Все известные случаи имеют общую структуру, состоящую из двух перпендикулярных антипараллельных бета-листов , за которыми следует С-концевая амфипатическая спираль. Петли, соединяющие бета-цепи, сильно различаются по длине, что делает домен PH относительно трудным для обнаружения, но при этом является источником специфичности домена. Единственным консервативным остатком среди доменов PH является один триптофан, расположенный внутри альфа-спирали , который служит для зарождения ядра домена.
Белки, содержащие домен PH
[ редактировать ]Домены PH можно найти во многих различных белках, таких как OSBP или ARF . Рекрутирование аппарата Гольджи в этом случае зависит как от PtdIns, так и от ARF. Большое количество доменов PH имеют плохое сродство к фосфоинозитидам и, как предполагается, функционируют как домены, связывающие белки. Полногеномный анализ Saccharomyces cerevisiae показал, что большинство из 33 доменов PH дрожжей действительно беспорядочно связываются с фосфоинозитидами, в то время как только один (Num1-PH) вел себя высокоспецифично. [ 12 ] Сообщается, что белки содержат домены PH принадлежат к следующим семействам:
- Плекстрин , белок, в котором этот домен был впервые обнаружен, является основным субстратом протеинкиназы С в тромбоцитах. Плекстрин содержит два домена PH. Белки ARAP содержат пять доменов PH.
- Серин/треонин-специфичные протеинкиназы, такие как семейство Akt/Rac, протеинкиназа D1 и семейство трипаносомальных NrkA.
- Нерецепторные тирозинкиназы, принадлежащие к подсемейству Btk/Itk/Tec.
- Субстрат 1 инсулинового рецептора ( IRS-1 ).
- Регуляторы малых G-белков : 64 RhoGEF семейства Dbl-подобных. [ 13 ] и несколько белков, активирующих ГТФазу, таких как белки ABR, BCR или ARAP.
- Цитоскелетные белки, такие как динамин (см. InterPro : IPR001401 ), Caenorhabditis elegans кинезинподобный белок unc-104 (см. InterPro : IPR001752 ), бета-цепь спектрина, синтрофин (2 домена PH) и S. cerevisiae . белок ядерной миграции NUM1
- Оксистеролсвязывающие белки OSBP, S. cerevisiae OSH1 и YHR073w.
- Церамидкиназа — липидкиназа, которая фосфорилирует церамиды до церамид-1-фосфата. [ 14 ]
- Киназы G-протеиновых рецепторов (GRK) подсемейства GRK2 (бета-адренергические рецепторные киназы): GRK2 и GRK3 . [ 15 ]
Подсемейства
[ редактировать ]Примеры
[ редактировать ]Гены человека, кодирующие белки, содержащие этот домен, включают:
- ABR , ADRBK1 , ADRBK2 , AFAP , AFAP1 , AFAP1L1 , AFAP1L2 , AKAP13 , AKT1 , AKT2 , AKT3 , ANLN , APBB1IP , APPL1 , APPL2 , ARHGAP10 , ARHGAP12 , ARHGAP15 , , ARH ARH GAP21 GAP22 , ARHGAP23 , ARHGAP24 , ARHGAP25 , ARHGAP26 , ARHGAP27 , ARHGAP9 , ARHGEF16 , ARHGEF18 , ARHGEF19 , ARHGEF2 , ARHGEF3 , ARHGEF4 , ARHGEF5 , ARHGEF6 , ARHGEF7 , ARHGEF9 , ASEF2 ,
- БМХ , БТК ,
- C20orf42 , C9orf100 , CADPS , CADPS2 , CDC42BPA , CDC42BPB , CDC42BPG , CENTA1 , CENTA2 , CENTB1 , CENTB2 , CENTB5 , CENTD1 , CENTD2 , CENTD3 , CENTG1 , CENTG2 , CENTG3 , CERK , CIT , CNKSR1 , CNKSR2 , COL4A3BP , CTGLF1 , CTGLF2 , CTGLF3 , * CTGLF4 , CTGLF5 , CTGLF6 ,
- DAB2IP , DAPP1 , DDEF1 , DDEF2 , DDEFL1 , DEF6 , DEPDC2 , DGKD , DGKH , DGKK , DNM1 , DNM2 , DNM3 , DOCK10 , DOCK11 , DOCK9 , DOK1 , DOK2 , DOK3 , DOK4 , DOK5 , D ОК6 , ДТГКУ2 ,
- EXOC8 ,
- FAM109A , FAM109B , FARP1 , FARP2 , FGD1 , FGD2 , FGD3 , FGD4 , FGD5 , FGD6 ,
- ГАБ1 , ГАБ2 , ГАБ3 , ГАБ4 , GRB10 , GRB14 , GRB7 ,
- ИРС1 , ИРС2 , ИРС4 , ИТК , ИТСН1 , ИТСН2 ,
- КАЛРН , КИФ1А , КИФ1Б , КИФ1Ббета ,
- MCF2 , MCF2L , MCF2L2 , МРИП , МИО10 ,
- НЕТ1 , НЭФ ,
- ОБПХ1 , ОБСКН , ОПХН1 , ОСБП , ОСБП2 , ОСБПЛ10 , ОСБПЛ11 , ОСБПЛ3 , ОСБПЛ5 , ОСБПЛ6 , ОСБПЛ7 , ОСБПЛ8 , ОСБПЛ9 ,
- PHLDA2 , PHLDA3 , PHLDB1 , PHLDB2 , PHLPP , - , PLCD1 , PLCD4 , PLCG1 , PLCG2 , PLCH1 , PLCH2 , PLCL1 , PLCL2 , PLD1 , PLD2 , PLEK , PLEK2 , PLEKHA1 , PLEKHA2 , ПЛЕХА4 , ПЛЕХА5 , PIP3 3 , E ПЛЕХА7 , ПЛЕХА8 , ПЛЕХБ1 , ПЛЕХБ2 , ПЛЕХХ1 , ПЛЕХФ1 , ПЛЕХФ2 , ПЛЕХГ1 , ПЛЕХГ2 , ПЛЕХГ3 , ПЛЕХГ4 , ПЛЕХГ5 , ПЛЕХГ6 , ПЛЕХХ1 , ПЛЕХJ1 , ПЛЕХК1 , ПРКД1 , ПЛЕХМ1 , ПЛЕКХQ1 , ПЛЕХМ2 , PREX1 , , PREX1 1 ПРКЦН , PRKD1, PRKD2 , PRKD3 , PSCD1 , PSCD2 , PSCD3 , PSCD4 , PSD , PSD2 , PSD3 , PSD4 , RALGPS1 , RALGPS2 , RAPH1 ,
- RASA1 , RASA2 , RASA3 , RASA4 , RASAL1 , RASGRF1 , RGNEF , ROCK1 , ROCK2 , RTKN ,
- СБФ1 , СБФ2 , СКАП2 , СГЭФ , Ш2Б , Ш2Б1 , Ш2Б2 , Ш3БП2 , Ш2Б3 , СНТА1 , СНТБ2 , СНТБ1 , СОС1 , СОС2 , СПАТА13 , СПНБ4 , СПТБН1 , СПТБН2 , СПТБН5 , 4 , , , СВАП70 , СТАП1 , СИНГАП1 , СКАП1 СКАП2
- TBC1D2 , TEC , ТИАМ1 , ТРИО , ТРИОБП , ТИЛ ,
- УРП1 , УРП2 ,
- ВАВ1 , ВАВ2 , ВАВ3 , ВЕПХ1
См. также
[ редактировать ]- Плекстрин
- Неродственный домен FYVE связывает фосфатидилинозитол-3-фосфат и обнаружен более чем в 60 белках.
- Домен GRAM представляет собой структурно родственный белковый домен.
Ссылки
[ редактировать ]- ^ Майер Б.Дж., Рен Р., Кларк К.Л., Балтимор Д. (май 1993 г.). «Предполагаемый модульный домен присутствует в различных сигнальных белках». Клетка . 73 (4): 629–30. дои : 10.1016/0092-8674(93)90244-К . ПМИД 8500161 . S2CID 44282241 .
- ^ Хаслам Р.Дж., Койде Х.Б., Хеммингс Б.А. (май 1993 г.). «Гомология домена плекстрина». Природа . 363 (6427): 309–10. Бибкод : 1993Natur.363..309H . дои : 10.1038/363309b0 . ПМИД 8497315 . S2CID 4334376 .
- ^ Мусаккио А., Гибсон Т., Райс П., Томпсон Дж., Сарасте М. (сентябрь 1993 г.). «Домен PH: общий фрагмент структурной мозаики сигнальных белков». Тенденции биохимических наук . 18 (9): 343–8. дои : 10.1016/0968-0004(93)90071-T . ПМИД 8236453 .
- ^ Гибсон Т.Дж., Хивонен М., Мусаккио А., Сарасте М., Бирни Э. (сентябрь 1994 г.). «Домен PH: первый юбилей» . Тенденции биохимических наук . 19 (9): 349–53. дои : 10.1016/0968-0004(94)90108-2 . ПМИД 7985225 .
- ^ Поусон Т. (февраль 1995 г.). «Белковые модули и сигнальные сети». Природа . 373 (6515): 573–80. Бибкод : 1995Natur.373..573P . дои : 10.1038/373573a0 . ПМИД 7531822 . S2CID 4324726 .
- ^ Ингли Э., Хеммингс Б.А. (декабрь 1994 г.). «Домены гомологии плекстрина (PH) в передаче сигнала». Журнал клеточной биохимии . 56 (4): 436–43. дои : 10.1002/jcb.240560403 . ПМИД 7890802 . S2CID 23154429 .
- ^ Сарасте М., Хивонен М. (июнь 1995 г.). «Домены гомологии плекстрина: файл фактов». Современное мнение в области структурной биологии . 5 (3): 403–8. дои : 10.1016/0959-440X(95)80104-9 . ПМИД 7583640 .
- ^ Ван Д.С., Шоу Дж. (декабрь 1995 г.). «Ассоциация С-концевой области бета-I-сигма-II-спектрина с мембранами головного мозга опосредована доменом PH, не требует мембранных белков и совпадает с сайтом связывания инозитол-1,4,5-трифосфата». Связь с биохимическими и биофизическими исследованиями . 217 (2): 608–15. дои : 10.1006/bbrc.1995.2818 . ПМИД 7503742 .
- ^ Ван Д.С., Шоу Р., Винкельманн Дж.К., Шоу Дж. (август 1994 г.). «Связывание PH-доменов киназы бета-адренергического рецептора и бета-спектрина с областями, содержащими повтор WD40 / бета-трансдуцин, бета-субъединицы тримерных G-белков». Связь с биохимическими и биофизическими исследованиями . 203 (1): 29–35. дои : 10.1006/bbrc.1994.2144 . ПМИД 8074669 .
- ^ Яо Л., Каваками Ю., Каваками Т. (сентябрь 1994 г.). «Домен гомологии плекстрина тирозинкиназы Брутона взаимодействует с протеинкиназой C» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (19): 9175–9. Бибкод : 1994PNAS...91.9175Y . дои : 10.1073/pnas.91.19.9175 . ПМК 44770 . ПМИД 7522330 .
- ^ Риддихау Дж. (ноябрь 1994 г.). «Больше меандров и бутербродов». Структурная биология природы . 1 (11): 755–7. дои : 10.1038/nsb1194-755 . ПМИД 7634082 . S2CID 5410578 .
- ^ Ю Дж.В., Мендрола Дж.М., Аудхья А., Сингх С., Келети Д., ДеВальд Д.Б., Мюррей Д., Эмр С.Д., Леммон М.А. (март 2004 г.). «Полногеномный анализ нацеливания на мембрану доменов гомологии плекстрина S. cerevisiae» . Молекулярная клетка . 13 (5): 677–88. дои : 10.1016/S1097-2765(04)00083-8 . ПМИД 15023338 .
- ^ Форт П, Бланжи А (июнь 2017 г.). «Эволюционный ландшафт Dbl-подобных семейств RhoGEF: адаптация эукариотических клеток к сигналам окружающей среды» . Геном Биол Эвол . 9 (6): 1471–1486. дои : 10.1093/gbe/evx100 . ПМЦ 5499878 . ПМИД 28541439 .
- ^ Сугиура М., Коно К., Лю Х., Симидзугава Т., Минекура Х., Шпигель С., Кохама Т. (июнь 2002 г.). «Церамидкиназа, новая липидкиназа. Молекулярное клонирование и функциональная характеристика» . Журнал биологической химии . 277 (26): 23294–300. дои : 10.1074/jbc.M201535200 . ПМИД 11956206 .
- ^ Комолов К.Е., Бенович Ю.Л. (январь 2018 г.). «Киназы рецепторов, связанных с G-белком: прошлое, настоящее и будущее» . Сотовая сигнализация . 41 : 17–24. doi : 10.1016/j.cellsig.2017.07.004 . ПМЦ 5722692 . ПМИД 28711719 .
Внешние ссылки
[ редактировать ]- Домены взаимодействия белков Nash Lab — описание домена PH [ постоянная мертвая ссылка ]
- UMich Orientation of Proteins in Membranes семейства/суперсемейства-51 - Расчетные ориентации доменов PH в мембранах