Эффекторный домен смерти
| Эффекторный домен смерти | |||
|---|---|---|---|
 структура эффекторного домена смерти FADD (Mort1). [ 1 ] | |||
| Идентификаторы | |||
| Символ | DED | ||
| Пфам | PF01335 | ||
| ИнтерПро | ИПР001875 | ||
| УМНЫЙ | DED | ||
| PROSITE | ПС50168 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1а1з / СКОПе / СУПФАМ | ||
| CDD | cd00045 | ||
| |||
Домен эффектора смерти ( DED ) представляет собой домен взаимодействия белков, обнаруженный только у эукариот и регулирующий различные клеточные сигнальные пути. [ 2 ] Домен DED обнаружен в неактивных прокаспазах ( цистеиновых протеазах ) и белках, которые регулируют активацию каспаз в каскаде апоптоза, таких как белок, содержащий домен смерти, ассоциированный с FAS ( FADD ). FADD вовлекает прокаспазу 8 и прокаспазу 10 в сигнальный комплекс, индуцирующий смерть (DISC). Это рекрутирование опосредовано гомотипическим взаимодействием между прокаспазой DED и вторым DED, который является доменом эффектора смерти в адаптерном белке , который непосредственно связан с активированными рецепторами TNF. Образование комплекса позволяет протеолитическую активацию прокаспазы в активную форму каспазы, что приводит к инициации апоптоза (гибель клеток). Структурно домен DED представляет собой подкласс белкового мотива, известного как складка смерти , и содержит 6 альфа-спиралей, которые очень напоминают структуру домена смерти (DD).
Структура
[ редактировать ]
DED является подсемейством суперсемейства DD (другими узнаваемыми доменами этого суперсемейства являются: домен рекрутирования каспазы (CARD) , пириновый домен (PYD) и домен смерти (DD)). Подсемейства структурно сходны друг с другом, все они (и DED в частности) состоят из пучка из 6 альфа-спиралей, но расходятся по особенностям поверхности.
Полная первичная структура этого белкового домена не была согласованно определена. В некоторых исследованиях описаны остатки 2–184, но остатки С-конца и N-конца еще не идентифицированы. Наличие аминокислот, определяющих растворимость и агрегацию DED, позволило идентифицировать DED в различных белках, таких как каспаза-8 и MC159. Вторичная . структура домена, как сказано, построена из 6 альфа-спиралей
Третичная структура домена была описана на основе кристаллизации каспазы 8 у человека. Для описания структуры использовался метод рентгеновской дифракции, полученное разрешение составило 2,2 Å. [ 3 ] DED в этом белке представляют собой асимметричный димер , интерфейс которого содержит две сети водородных связей, которые выглядят как нитевидная структура. Функция DED определяется его структурой. Насколько известно, гомотипические взаимодействия, которые активируют каспазу и запускают апоптоз, опосредуются асимметричными поверхностными контактами между партнерами (например, DED1 и DED2 в случае каспазы-8). [ 4 ] Остатки, образующие поверхности, обычно представляют собой заряженные аминокислоты, но на интерактивной поверхности домена также можно наблюдать короткий гидрофобный участок.
Функция
[ редактировать ]Домен DED наиболее известен своей ролью в апоптозе. Однако белки, содержащие DED, также участвуют в других клеточных процессах, контролируя решения как о жизни, так и о смерти клеток.
Внешний апоптоз
[ редактировать ][ 5 ] Апоптоз — это контролируемая и запрограммированная гибель клеток, дающая преимущества в течение жизненного цикла организма. Внешний путь управляется семейством протеаз, которые становятся активными в ответ на стимулы смерти. Чтобы узнать роль DED в этом процессе, важно наблюдать за формированием мультибелкового сигнального комплекса, включающего смерть (DISC).
DR4 , TRAIL-R2 и CD95 представляют собой рецепторы смерти (члены суперсемейства рецепторов TNF ), которые взаимодействуют друг с другом, используя свои внутриклеточные домены смерти (DD). DD FADD, белка, содержащего DED, может затем взаимодействовать с этими описанными DD. Здесь функция FADD DED заключается в создании стабилизированной структуры путем самоассоциации FADD.

[ 6 ] Эти взаимодействия определяются спиралями α1/α4 и α2/α3: остатки Ser1, Val6, His9, Leu43, Asp44 и Glu51 из α1/α4 контактируют с Thr21, Phe25, Lys33, Arg34, Glu37 и Glu51 из α2/α3 вторая молекула. Каждое взаимодействие занимает площадь 1062 Å. 2 и вклад гидрофобных боковых цепей, водородных связей и солевых мостиков. Конечный гомодимер имеет структуру, ориентированную таким образом, что каждая субъединица имеет два сайта взаимодействия.
Прокаспаза-8, также содержащий DED белок, имеет сродство к FADD DED. Именно по этой причине они рекрутируются в FADD как мономеры через свои DED. Это взаимодействие определяется α1/α4 прокапазы-8 DED-A и FADD DED α2/α3 или α1/α4 FADD DED и α2/α5 прокапазы-8 DED-B. Прокаспаза-8 DED-B взаимодействует с FADD, а DED-A опосредует образование цепи капазы-8 или наоборот. Однако в обоих случаях взаимодействие приводит к созданию димера между прокаспазами, что приводит к конформационным изменениям. Эта димеризация необходима для создания активного сайта; субъединица р12 высвобождается и впоследствии преобразуется в малую субъединицу р10. Две молекулы прокапазы-8 связаны с этими субъединицами р10, вызывая активную гибель клеток протеазы-8. [ 7 ] [ 8 ]
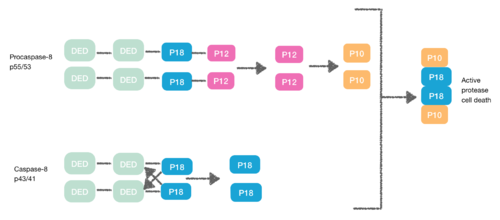
Некроптоз
[ редактировать ][ 9 ] Во время создания DISC прокаспаза-8 также может гетеродимеризоваться с другим DED-содержащим белком, известным как L. FLIP FLIP L Псевдокаспаза имеет два тандемных DED, которые очень похожи на N-конец капазы-8, но в которых имеется важная мутация в активном сайте (цистеин на тирозин).
Эта гетеродимерация, осуществляемая между их DED, предотвращает нормальную гомодимерацию, так что псевдокаспаза не может активировать апоптотический каскад. FLIP L Псевдокаспаза более эффективно вызывает конформационные изменения. Однако FLIP L не обладает достаточной ферментативной активностью, поэтому расщепление между DED и p18 невозможно. В результате невозможно вызвать активную протеазу гибели клеток. [ 10 ]
Прокаспаза-8 также может гетеродимеризоваться с FLIP S , также белком, содержащим DED. В этом случае гетеродимеризация не может напрямую активировать прокаспазу-8, поскольку начальное конформационное изменение не может произойти в каспазном домене прокаспазы-8. [ 10 ]

Таким образом, DED также может ингибировать каскад апоптоза, что приводит к некроптозу .
Семейство белков DED
[ редактировать ]DED-содержащие белки
[ редактировать ]Каспаза-8 и каспаза-10
[ редактировать ][ 11 ] Каспазы – это цистеиновые протеазы, ответственные за разрушение клетки во время апоптоза .
Эти белки являются зимогенами и становятся активными после расщепления в определенных участках молекулы.
Структура:
- Домен эффектора смерти (DED) и домен рекрутирования каспазы (CARD), которые заключены в структуру, называемую продоменом, которая расположена на N-конце.
- Каталитический протеазный домен на С-конце.
Выделяют две группы протеаз :
- Эффекторные каспазы: вызывают большую часть морфологических изменений, возникающих во время апоптоза.
- Инициаторные каспазы: отвечают за активацию эффекторных каспаз. Эти каспазы активируются посредством олигомеризации и расщепления, что делает белок функциональным.
Два тандемных DED в продомене каспазы индуцируют белок-белковые взаимодействия с другими белками, такими как FADD .
Изучение каспаз важно, поскольку они не только контролируют апоптоз, но и ингибируют его, в зависимости от необходимости клетки. Ученые обнаружили, что они представляют собой механизм, который может регулировать жизнь клеток и важен для лечения рака.
FLICE-подобные ингибирующие белки (FLIP)
[ редактировать ]FLICE-подобные ингибирующие белки (FLIP) представляют собой клеточные ингибиторы, способные останавливать сигнал рецепторов смерти, которые вызывают апоптоз клеток.
Первые идентифицированные FLIP были экспрессированы вирусами γ-герпеса, поэтому их назвали v-FLIP. Эти v-FLIP были способны связываться с рецептором сигнального комплекса, индуцирующего смерть (DISC) , блокируя таким образом CD95-опосредованный апоптоз.
[ 12 ] vFLIP преимущественно содержат два последовательных DED, которые в высокой степени гомологичны N-концу каспазы-8.
[ 10 ] Клеточные обычно гомологи v-FLIP экспрессируются в двух формах:
- c-FLIP S (короткий): он содержит только тандемные DED с аминоконцевыми концами, за которыми следует короткий карбоксиконцевой участок. Его структура аналогична вирусным FLIP.
- c-FLIP L (длинный): он состоит не только из тандемных DED, но и из протеазоподобного домена (гомологичного каспазе-8), в котором мутированы различные важные для активности протеазы аминокислоты, включая цистеин активного центра.
[ 12 ] Обе формы c-FLIP переносятся на CD95 DISC, где гетеродимеризуются с каспазой-8. c-FLIP участвует в альтернативных путях передачи сигналов, соединяя рецептор CD95 с путями NF-κB , JNK и MAPK .
ГОЛОВКА-15/ПЕД
[ редактировать ]PEA-15 (фосфопротеин, обогащенный астроцитами, массой 15 кДа), также известный как PED (фосфопротеин, обогащенный при диабете), представляет собой DED-содержащий белок с плейотропными эффектами .
PED представляет собой небольшой некаталитический белок, состоящий из N-концевого эффекторного домена смерти (DED) и C-концевого хвоста с неправильной структурой. [ 13 ] PED/PEA-15 взаимодействует с различными типами белков с DED и без них, и его специфичность присоединения к этим белкам опосредована фосфорилированием двух сериновых остатков на C-концевом хвосте:
- Ser104 : фосфорилируется протеинкиназой C (PKC) .
- Ser116 : субстрат кальций/кальмодулинзависимой протеинкиназы II (CamKII) .
[ 13 ] PEA-15 действует как антиапоптотический белок DED в нескольких сигнальных каскадах . В путях, опосредованных TNF α, CD95 и TRAIL, PEA-15 действует, связывая и разрушая взаимодействия FADD и каспазы-8.
[ 10 ] Помимо апоптоза, ПЭА-15 ингибирует опосредованный инсулином транспорт глюкозы в мышечных клетках, поэтому высокий уровень экспрессии мРНК ПЭА-15 связан с сахарным диабетом II типа .
ЗАКОН/ЗАКОН2
[ редактировать ]Эффекторный домен смерти, содержащий связывание ДНК (DEDD). Обладает способностью связывания ДНК, при сверхэкспрессии локализуется в ядрышках, где он связывается с молекулой под названием DEDAF (DED-ассоциированный фактор), которая усиливает апоптоз. Кроме того, он блокирует РНК-полимеразы I, транскрипцию связываясь с ДНК.
DEDD2 (FLAME-3) представляет собой гомолог DEDD, который имеет 48,5% общей аминокислотной последовательности. Отмечено, что он взаимодействует с c-FLIP и DEDD и играет важную роль в зависимой от полимеразы II репрессии транскрипции.
Белки с доменом, связанным с DED
[ редактировать ]ХИП-1 и ХИППИ
[ редактировать ]Белок-1, взаимодействующий с хантингтином (HIP-1), представляет собой белок, который взаимодействует с хантингтином (Htt) , другим белком, который при мутации (с расширенными полиглутаминовыми повторами) образует белковые агрегаты в мозге пациентов с болезнью Хантингтона (БГ) .
[ 14 ] HIP-1 содержит эффекторный домен псевдосмерти (pDED) , поэтому сверхэкспрессия HIP-1 индуцирует апоптоз в некоторых клетках, как это делают белки DED. Этот тип апоптоза зависит от pDED HIP-1 и заключается в активации каспазы-3, фермента, уровень которого снижается при экспрессии Htt дикого типа, что позволяет предположить, что HIP-1 взаимодействует с Htt в Патомеханизм болезни Гентингтона.
[ 10 ] дрожжей С помощью двухгибридного скрининга было показано, что HIP-1 взаимодействует с белком из 419 аминокислот, называемым HIPPI (белковый интерактор HIP-1). Последующие эксперименты показали, что присутствие HIPPI определяет апоптоз, индуцированный HIP-1 .
ВСПЫШКА
[ редактировать ]Огромный белок, связанный с FLICE. Содержит домен, аналогичный DED, но гомология очень слабая, и его функция до сих пор неясна.
Терапевтическое использование DED
[ редактировать ][ 7 ] Было показано, что комплексы DED функционируют на важнейших этапах, контролируя процессы жизни и смерти клеток. Эти знания особенно полезны в терапии, поскольку существует множество патологий, связанных с ненормальным контролем жизни клеток.
Отсутствие апоптоза является особенностью рака. В некоторых случаях ген, кодирующий прокаспазу-8, подавляется в результате метилирования, поэтому необходимо активировать ген с помощью эпигенетического лечения, чтобы иметь активную протеазу. В других случаях наблюдается сверхэкспрессия FLIP, антиапоптотической молекулы, которая предотвращает образование активной каспазы. В этом случае существуют некоторые противораковые агенты, которые подавляют экспрессию FLIP.
Однако аномальный апоптоз не является исключением только из рака, существуют и другие патологии, такие как воспаления и нейродегенеративные заболевания, которые также можно лечить с помощью такого рода терапии.
Ссылки
[ редактировать ]- ^ Эберштадт М., Хуан Б., Чен З. и др. (апрель 1998 г.). «Структура ЯМР и мутагенез эффекторного домена смерти FADD (Mort1)». Природа . 392 (6679): 941–5. Бибкод : 1998Natur.392..941E . дои : 10.1038/31972 . ПМИД 9582077 . S2CID 4370202 .
- ^ Валмики М.Г., Рамос Дж.В. (март 2009 г.). «Белки, содержащие эффекторный домен смерти» . Клетка. Мол. Наука о жизни . 66 (5): 814–30. дои : 10.1007/s00018-008-8489-0 . ПМЦ 11131443 . ПМИД 18989622 . S2CID 13117680 .
- ^ Шен, Чен; Юэ, Хун; Пей, Цзяньвэнь; Го, Сяоминь; Ван, Тао; Цюань, Цзюнь-Мин (2015). «Кристаллическая структура эффекторных доменов смерти каспазы-8». Связь с биохимическими и биофизическими исследованиями . 463 (3): 297–302. дои : 10.1016/j.bbrc.2015.05.054 . ISSN 0006-291X . ПМИД 26003730 .
- ^ «Структуры, домены и функции при гибели клеток» .
- ^ Элмор, Сьюзен (2007). «Апоптоз: обзор запрограммированной гибели клеток» . Токсикологическая патология . 35 (4): 495–516. дои : 10.1080/01926230701320337 . ISSN 1533-1601 . ПМК 2117903 . ПМИД 17562483 .
- ^ Сингх, Ниту; Хасан, Али; Бозе, Каколи (2015). «Молекулярные основы сборки цепи эффекторного домена смерти и ее роль в активации каспазы-8» . Журнал ФАСЭБ . 30 (1): 186–200. дои : 10.1096/fj.15-272997 . ISSN 1530-6860 . ПМИД 26370846 .
- ^ Jump up to: а б Райли, Дж.С.; Малик, А; Холохан, К; Лонгли, Д.Б. (2015). «DED или жив: сборка и регуляция комплексов доменов эффектора смерти» . Смерть клеток и болезни . 6 (8): e1866. дои : 10.1038/cddis.2015.213 . ISSN 2041-4889 . ПМЦ 4558505 . ПМИД 26313917 .
- ^ Яо, Чжан; Дуань, Шаньшань; Хоу, Дэжи; Хиз, Клаус; Ву, Миан (2007). «Домен эффектора смерти DEDa, саморасщепляющийся продукт каспазы-8/Mch5, транслоцируется в ядро путем связывания с ERK1/2 и усиливает экспрессию прокаспазы-8 посредством p53-зависимого механизма» . Журнал ЭМБО . 26 (4): 1068–1080. дои : 10.1038/sj.emboj.7601571 . ISSN 1460-2075 . ПМЦ 1852837 . ПМИД 17290218 .
- ^ Ли, Ын-Ву; Со, Джинхо; Чон, Манхён; Ли, Сангсик; Сон, Джеван (2012). «Роль FADD во внешнем апоптозе и некроптозе» . Отчеты БМБ . 45 (9): 496–508. дои : 10.5483/BMBRep.2012.45.9.186 . ISSN 1976-670X . ПМИД 23010170 .
- ^ Jump up to: а б с д и Барнхарт, Брайан С; Ли, Жюстин С; Алаппат, Элизабет С; Питер, Маркус Э (2003). «Семейство белков эффекторного домена смерти». Онкоген . 22 (53): 8634–8644. дои : 10.1038/sj.onc.1207103 . ISSN 0950-9232 . ПМИД 14634625 .
- ^ Шляйх, К.; Бухбиндер, Дж. Х.; Пьеткевич, С.; Кане, Т.; Варнкен, Ю.; Озтюрк, С.; Шнольцер, М.; Науманн, М.; Краммер, PH (1 апреля 2016 г.). «Молекулярная архитектура цепей DED на DISC: регуляция активации прокаспазы-8 короткими белками DED c-FLIP и продоменом прокаспазы-8» . Смерть клеток и дифференциация . 23 (4): 681–694. дои : 10.1038/cdd.2015.137 . ISSN 1350-9047 . ПМЦ 4986640 . ПМИД 26494467 .
- ^ Jump up to: а б Ю, Дж.В.; Ши, Ю (2008). «FLIP и семейство доменов эффектора смерти» . Онкоген . 27 (48): 6216–6227. дои : 10.1038/onc.2008.299 . ISSN 0950-9232 . ПМИД 18931689 .
- ^ Jump up to: а б Туми, Эдвард С; Кордаско, Дана Ф; Вэй, Юфэн (2012). «Глубокие конформационные изменения PED/PEA-15 в комплексе ERK2, выявленные с помощью динамики основной цепи ЯМР». Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1824 (12): 1382–1393. дои : 10.1016/j.bbapap.2012.07.001 . ISSN 1570-9639 . ПМИД 22820249 .
- ^ Бхаттачарья, Нитай П; Банерджи, Маниша; Маджумдер, Прита (2008). «Болезнь Хантингтона: роль взаимодействующего с хантингтином белка 1 (HIP-1) и его молекулярного партнера HIPPI в регуляции апоптоза и транскрипции» . Журнал ФЭБС . 275 (17): 4271–4279. дои : 10.1111/j.1742-4658.2008.06563.x . ISSN 1742-464X . ПМИД 18637945 .