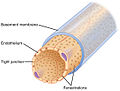
Коллаген IV типа
Коллаген IV (ColIV или Col4) — это тип коллагена, обнаруженный преимущественно в базальной пластинке . Домен C4 коллагена IV на С-конце не удаляется при посттрансляционном процессинге, и волокна соединяются друг с другом, а не параллельно. Кроме того, в коллагене IV отсутствует обычный глицин в каждом третьем остатке, необходимый для плотной коллагеновой спирали . Это делает общую компоновку более небрежной и изломной. Эти две особенности заставляют коллаген формироваться в виде листа, напоминающего базальную пластинку. Коллаген IV является более распространенным, в отличие от старой терминологии «коллаген типа IV». [ нужна ссылка ] Коллаген IV существует во всех типах многоклеточных животных, для которых он послужил эволюционной ступенькой к многоклеточности . [1]
С ним связаны шесть человеческих генов: [2]
Функция
[ редактировать ]Коллаген типа IV — это тип коллагена, который отвечает за обеспечение устойчивости и сборки каркаса. Он также преимущественно обнаруживается во внеклеточных базальных мембранах. [3] Он способствует клеточной адгезии , миграции , выживанию , расширению и дифференцировке . [4]
Синтез
[ редактировать ]Начнем с того, что этот тип коллагена синтезируется путем сборки определенного тримера, когда три домена NC1 инициируют молекулярные взаимодействия между тремя α-цепями. Затем тримеризация протомера происходит от карбокси-конца с образованием полностью собранного протомера . Следующим шагом сборки является димеризация коллагена IV. Два протомера коллагена IV связываются через карбокси-концевой тример NC1 с образованием гексамера NC1. Эти взаимодействия составляют основу каркаса коллагена IV типа. Каркас превращается в суперструктуру коллагена IV за счет «сквозных» и латеральных связей между протомерами коллагена IV. Затем образуется молекула коллагена. Наконец, молекулы коллагена IV типа связываются вместе, образуя сложную белковую сеть. [3]
Подводя итог, можно сказать, что процесс синтеза коллагена происходит преимущественно в клетках фибробластов, которые являются специализированными клетками, основной функцией которых является синтез коллагена. Синтез коллагена происходит как внутриклеточно, так и внеклеточно. [5] Однако, если рассматривать конкретно коллаген типа IV, то он в основном синтезируется внеклеточно.
Структура
[ редактировать ]Домен C4 на С-конце не удаляется в посттрансляционном процессе, и в результате структуры волокон соединяются в формате «голова к голове», а не параллельно. [3] В нем также отсутствует глицин в каждом третьем аминокислотном остатке, который отвечает за плотную спираль коллагена, в результате он будет более гибким и изогнутым, чем другие типы коллагена. [3]
- Плотная спираль коллагена
Чем коллаген типа IV отличается от коллагена типа I?
[ редактировать ]Наиболее распространенным коллагеном является коллаген I типа, который составляет 90% всего коллагена. Он обнаруживается во всех слоях дермы в больших количествах, тогда как коллаген типа IV обнаруживается только в базальной мембране эпидермального соединения. [6] Несмотря на различия в общности, они оба сильно изменяются во время старения или прогрессирования рака. [ нужна ссылка ]
- Параллельное направление волокон в типе I
Клиническое значение
[ редактировать ]В зависимости от генетических и негенетических факторов, включая изменения в экспрессии генов, вариации сплайсинга, посттрансляционные модификации и специфическую сборку определенных α-цепей, различные органы могут быть затронуты во время их развития и в течение взрослой жизни. [2]
Коллаген IV был в центре обширных исследований, начиная от биохимии и заканчивая патологией и генетическими нарушениями. Это единственный тип коллагена, который кодируется шестью разными генами. Шесть α-цепей коллагена IV могут распознавать друг друга с невероятной специфичностью и объединяться в уникальные гетеротримеры . После секреции во внеклеточную мембрану эти молекулы в дальнейшем будут взаимодействовать с образованием более высокомолекулярных организаций. Они, наряду с другими белками, будут формировать уникальные базальные мембраны тканеспецифичным образом. Благодаря взаимодействиям со специфическими клеточными рецепторами, такими как интегрины , сети коллагена IV базальной мембраны не только обеспечивают структурную поддержку клеткам и тканям, но также влияют на биологическую скорость во время и после развития. Новые открытия продолжают раскрывать информацию о генетических мутациях, биосинтезе, молекулярной сборке и формировании сети коллагена типа IV, и это улучшает понимание критической роли этого коллагена в здоровье и болезнях. [2]
Синдром хорошего пастбища
[ редактировать ]Субъединица альфа-3 (COL4A3) коллагена IV считается антигеном, участвующим в синдроме Гудпасчера , при котором иммунная система атакует базальные мембраны клубочков поскольку и альвеол, антигенный сайт на субъединице альфа-3 становится несеквестрированным из-за воздействия окружающей среды.
Синдром Гудпасчера проявляется нефритическим синдромом и кровохарканьем . Микроскопическая оценка биопсии почечной ткани выявит линейные отложения иммуноглобулина G методом иммунофлуоресценции . Это классически у молодых взрослых мужчин.
Синдром Альпорта
[ редактировать ]Мутации гена [COL4A5], кодирующего коллаген IV, приводят к синдрому Альпорта . Это приведет к истончению и расщеплению клубочковой базальной мембраны . Он проявляется в виде изолированной гематурии , нейросенсорной тугоухости и глазных нарушений и передается генетически, обычно Х-сцепленно , хотя встречаются и более редкие аутосомные формы.
Болезнь печени
[ редактировать ]Фиброз и цирроз печени связаны с отложением коллагена IV в печени. Концентрации коллагена IV в сыворотке коррелируют с уровнями коллагена IV в печеночной ткани у пациентов с алкогольной болезнью печени и гепатитом С и снижаются после успешной терапии. [7] [8]
HANAC-синдром
[ редактировать ]Мутации в 24 и 25 экзонах COL4A1 связаны с HANAC ( аутосомно-доминантной наследственной ангиопатией с нефропатией , аневризмами и мышечными судорогами ). [9] Также подтверждено, что мутации гена COL4A1 возникают у некоторых пациентов с порэнцефалией и шизэнцефалией . [10] [11]
Врожденная катаракта
[ редактировать ]Было обнаружено, что у людей новая мутация гена COL4A1, кодирующего коллаген IV типа, связана с аутосомно-доминантной врожденной катарактой в китайской семье. Эта мутация не была обнаружена ни у незатронутых членов семьи, ни у 200 несвязанных контрольных групп. В этом исследовании анализ последовательности подтвердил, что аминокислотный остаток Gly782 является высококонсервативным. [12] Это сообщение о новой мутации в гене COL4A1 является первым сообщением о несиндромальной аутосомно-доминантной врожденной катаракте, которое подчеркивает важную роль коллагена типа IV в физиологических и оптических свойствах хрусталика. [12]
Сердечно-сосудистые заболевания
[ редактировать ]Коллаген IV типа является основным компонентом базальных мембран в различных тканях (включая артерии). [13]
За последнее десятилетие исследования неоднократно обнаруживали, что однонуклеотидные полиморфизмы, расположенные в генах коллагена (COL) 4A1 и COL4A2, связаны с сердечно-сосудистыми заболеваниями , а локус 13q34, содержащий эти гены, является одним из 160 полногеномных локусов значимого риска сердечно-сосудистых заболеваний. ишемическая болезнь сердца. COL4A1 и COL4A2 кодируют α1- и α2-цепи коллагена IV типа. Это основной компонент базальных мембран в различных тканях, включая артерии. Имеются клинические сообщения о связи 13q34 с ишемической болезнью сердца , атеросклерозом и уплотнением артерий в результате экспериментальных исследований, основанных на сосудистых клетках и тканях. [13]
Кроме того, в области сердечно-сосудистой системы области COL4A1 и COL4A2 на хромосоме 13q34 являются высокореплицируемым локусом ишемической болезни сердца. В нормальной стенке артерий коллаген IV типа подавляет пролиферацию гладкомышечных клеток. Соответственно, было продемонстрировано, что экспрессия белка коллагена типа IV в гладкомышечных клетках сосудов человека регулируется как белком SMAD3, так и опосредованной TGFβ стимуляцией мРНК. [14] В целом был сделан вывод, что патогенез ишемической болезни сердца может регулироваться генами COL4A1 и COL4A2. [14]
- Жировые отложения, вызывающие бляшки в коронарных артериях
Раковые клетки поджелудочной железы
[ редактировать ]Этот тип коллагена может вызывать увеличение количества раковых клеток поджелудочной железы и способен ингибировать апоптоз через аутокринную петлю . [4]
Эта аутокринная петля обеспечивает важные сигналы выживания клеток рака поджелудочной железы. [4]
Коллаген типа IV экспрессируется вблизи раковых клеток in vivo , образуя на поверхности раковых клеток структуры, подобные базальной мембране, которые колокализуются с рецепторами интегрина . Взаимодействие между коллагеном IV типа, продуцируемым раковой клеткой, и интегринами на поверхности раковых клеток важно для непрерывного роста раковых клеток, поддержания миграционного фенотипа и предотвращения апоптоза. [4]
- Раковая клетка поджелудочной железы в большом увеличении
Цинга
[ редактировать ]Цинга – это дефицит водорастворимого витамина С или аскорбиновой кислоты. В развивающихся странах оно встречается редко и чаще всего наблюдается у младенцев, пожилых людей и алкоголиков, у всех которых может быть недостаточное питание и недоедание. [5]
У пациентов могут отмечаться общая усталость, слабость, плохое заживление ран, анемия и заболевания десен. Клинически один из первых признаков цинги возникает на коже и проявляется перифолликулярными кровоизлияниями, при которых фолликулы кожи закупориваются кератином . Эти области выглядят как синяки вокруг волосяных фолликулов. Также могут быть хрупкие волоски, уложенные в виде штопора. [5]
Недостаток аскорбиновой кислоты приводит к гиперметилированию эпигенетической ДНК и ингибирует транскрипцию различных типов коллагена, обнаруженного в коже, кровеносных сосудах и тканях. [15]
- Кальцифицированный хрящ, кровоизлияние в фиброзный костный мозг и аномально тонкая корковая ткань вследствие цинги.
Коллаген-гибридизирующие пептиды
[ редактировать ]Коллаген , основной структурный компонент почти всех тканей млекопитающих, подвергается обширному протеолитическому ремоделированию на этапах развития и при различных опасных для жизни заболеваниях, таких как рак, инфаркт миокарда и фиброз. Хотя деградированный коллаген может быть важным маркером повреждения тканей, его трудно обнаружить и нацелить с помощью обычных инструментов. В результате пептид, гибридизующий коллаген, специфически гибридизуется с деградировавшими, развернутыми цепями коллагена и может использоваться для визуализации деградированного коллагена и информирования об активности ремоделирования тканей в различных тканях. [16]
Помеченный 5-карбоксифлуоресцеином и биотином, гибридизирующий коллаген пептид может обеспечить прямую локализацию и количественную оценку деградации коллагена в изолированных тканях при патологических состояниях, начиная от остеоартрита и инфаркта миокарда до гломерулонефрита и легочного фиброза , а также в нормальных тканях во время программ развития, связанных с с эмбриональным костеобразованием и старением кожи. [16]
Общая корреляция между уровнем ремоделирования коллагена и количеством денатурированного коллагена в ткани показывает, что пептидные зонды, гибридизирующие коллаген, можно использовать для разных видов и типов коллагена (включая коллаген типа IV), предоставляя универсальный инструмент не только для изучения патологии и развития. биологические исследования, а также диагностика заболеваний с помощью гистологии. [16]
- Коллаген-гибридизирующие пептиды
Сообщалось также об аутосомно-рецессивной энцефалопатии, связанной с мутациями в этом гене. [17]
Повышенное клубочковое и мезангиальное отложение коллагена IV наблюдается при диабетической нефропатии , а повышение его уровня в моче связано со степенью поражения почек. [18]
См. также
[ редактировать ]- Спонгин , вариант этого типа коллагена, обнаруженный у некоторых животных.
Ссылки
[ редактировать ]- ^ Буте Н., Экспозито Дж. Я., Бури-Эсно Н., Васелет Дж., Норо Н., Миядзаки К. и др. (1996). «Коллаген типа IV в губках, недостающее звено в повсеместном распространении базальной мембраны». Биология клетки . 88 (1–2): 37–44. дои : 10.1016/S0248-4900(97)86829-3 . ПМИД 9175266 . S2CID 32293092 .
- ^ Jump up to: а б с Хошнуди Дж., Педченко В., Хадсон Б.Г. (май 2008 г.). «Коллаген млекопитающих IV» . Микроскопические исследования и техника . 71 (5): 357–370. дои : 10.1002/jemt.20564 . ПМЦ 4788096 . ПМИД 18219669 .
- ^ Jump up to: а б с д Абреу-Велес А.М., Ховард М.С. (январь 2012 г.). «Коллаген IV в нормальной коже и при патологических процессах» . Североамериканский журнал медицинских наук . 4 (1): 1–8. дои : 10.4103/1947-2714.92892 . ПМЦ 3289483 . ПМИД 22393540 .
- ^ Jump up to: а б с д Олунд Д., Франклин О., Лундберг Э., Лундин С., Сунд М. (март 2013 г.). «Коллаген типа IV стимулирует пролиферацию, миграцию раковых клеток поджелудочной железы и ингибирует апоптоз посредством аутокринной петли» . БМК Рак . 13 :154. дои : 10.1186/1471-2407-13-154 . ПМК 3618250 . ПМИД 23530721 .
- ^ Jump up to: а б с Ву М., Кронин К., Крейн Дж.С. (сентябрь 2022 г.). «Биохимия, синтез коллагена» . StatPearls [Интернет] . Остров сокровищ (Флорида): StatPearls Publishing. ПМИД 29939531 .
- ^ Нгуен Т.Т., Гобинет С., Феру Дж., Паско С.Б., Манфаит М., Пиот О. (октябрь 2012 г.). «Характеристика коллагенов типов I и IV с помощью рамановской микроспектроскопии: идентификация спектральных маркеров дермо-эпидермального соединения» . Спектроскопия . 27 (5–6): 421–427. дои : 10.1155/2012/686183 .
- ^ Цуцуми М., Такасэ С., Урасима С., Уэсима Ю., Кавахара Х., Такада А. (декабрь 1996 г.). «Сывороточные маркеры фиброза печени при алкогольной болезни печени: какой маркер лучший: проколлаген III типа, коллаген IV типа, ламинин, тканевой ингибитор металлопротеиназы или пролилгидроксилазы?». Алкоголизм: клинические и экспериментальные исследования . 20 (9): 1512–1517. дои : 10.1111/j.1530-0277.1996.tb01692.x . ПМИД 8986196 .
- ^ Ябу К., Кийосава К., Мори Х., Мацумото А., Ёсидзава К., Танака Э., Фурута С. (май 1994 г.). «Сывороточный коллаген IV типа для оценки фиброза и резистентности к терапии интерфероном при хроническом гепатите С». Скандинавский журнал гастроэнтерологии . 29 (5): 474–479. дои : 10.3109/00365529409096841 . ПМИД 7518613 .
- ^ Плезье Э., Грибуваль О., Аламович С., Мужено Б., Прост С., Верпон М.С. и др. (декабрь 2007 г.). «Мутации COL4A1 и наследственная ангиопатия, нефропатия, аневризмы и мышечные судороги» . Медицинский журнал Новой Англии . 357 (26): 2687–2695. дои : 10.1056/NEJMoa071906 . ПМИД 18160688 .
- ^ Йонеда Ю., Хагиноя К., Като М., Осака Х., Ёкочи К., Араи Х. и др. (январь 2013 г.). «Фенотипический спектр мутаций COL4A1: от порэнцефалии до шизэнцефалии». Анналы неврологии . 73 (1): 48–57. дои : 10.1002/ana.23736 . ПМИД 23225343 . S2CID 3218598 .
- ^ Смигель Р., Кабала М., Якубиак А., Кодера Х., Сасиадек М.Дж., Мацумото Н. и др. (апрель 2016 г.). «Новая мутация COL4A1 у младенца с тяжелым дисморфическим синдромом с шизэнцефалией, перивентрикулярными кальцификациями и катарактой, напоминающей врожденную инфекцию». Исследование врожденных дефектов. Часть A. Клиническая и молекулярная тератология . 106 (4): 304–307. дои : 10.1002/bdra.23488 . ПМИД 26879631 .
- ^ Jump up to: а б Ся XY, Ли Н, Цао X, Ву QY, Ли ТФ, Чжан С и др. (август 2014 г.). «Новая мутация гена COL4A1 приводит к аутосомно-доминантной несиндромальной врожденной катаракте в китайской семье» . BMC Медицинская генетика . 15:97 . дои : 10.1186/s12881-014-0097-2 . ПМК 4236509 . ПМИД 25124159 .
- ^ Jump up to: а б Стеффенсен Л.Б., Расмуссен Л.М. (сентябрь 2018 г.). «Роль коллагена IV типа в сердечно-сосудистых заболеваниях?» . Американский журнал физиологии. Физиология сердца и кровообращения . 315 (3): H610–H625. дои : 10.1152/ajpheart.00070.2018 . ПМИД 29677463 . S2CID 5018123 .
- ^ Jump up to: а б Тернер А.В., Никпай М., Сильва А., Лау П., Мартинюк А., Линсеман Т.А. и др. (октябрь 2015 г.). «Функциональное взаимодействие между локусами риска COL4A1/COL4A2 и SMAD3 ишемической болезни сердца». Атеросклероз . 242 (2): 543–552. doi : 10.1016/j.atherosclerosis.2015.08.008 . ПМИД 26310581 .
- ^ Максфилд Л., Крейн Дж.С. (октябрь 2022 г.). «Дефицит витамина С». . StatPearls [Интернет] . Остров сокровищ (Флорида): StatPearls Publishing. ПМИД 29630239 .
- ^ Jump up to: а б с Хван Дж., Хуан Ю., Беруэлл Т.Дж., Петерсон Н.К., Коннор Дж., Вайс С.Дж. и др. (октябрь 2017 г.). «Визуализация ремоделирования тканей in situ с помощью пептидов, гибридизующих коллаген» . АСУ Нано . 11 (10): 9825–9835. дои : 10.1021/acsnano.7b03150 . ПМЦ 5656977 . ПМИД 28877431 .
- ^ Ярамис А., Лохмюллер Х., Тёпф А., Сонмезлер Э., Йилмаз Э., Хиз С. и др. (февраль 2020 г.). « Аутосомно-рецессивная энцефалопатия, связанная с COL4A1 , у 2 турецких детей» . Неврология. Генетика . 6 (1): e392. дои : 10.1212/NXG.0000000000000392 . ПМК 6975172 . ПМИД 32042920 .
- ^ Оконоги Х., Нишимура М., Уцуномия Ю., Хамагути К., Цучида Х., Миура Ю. и др. (май 2001 г.). «Экскреция коллагена IV типа с мочой отражает морфологические изменения почек и экспрессию коллагена IV типа у пациентов с сахарным диабетом 2 типа». Клиническая нефрология . 55 (5): 357–364. ПМИД 11393380 . ИНИСТ 985198 .
Внешние ссылки
[ редактировать ]- Коллаген + тип + IV в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)