Костный морфогенетический белок 4
| БМП4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | BMP4 , BMP2B, BMP2B1, MCOPS6, OFC11, ZYME, костный морфогенетический белок 4 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 112262 ; МГИ : 88180 ; Гомологен : 7247 ; Генные карты : BMP4 ; ОМА : BMP4 — ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Костный морфогенетический белок 4 — это белок , который у человека кодируется BMP4 геном . [4] [5] BMP4 находится на хромосоме 14q22-q23.
BMP4 является членом семейства костных морфогенетических белков , которое является частью суперсемейства трансформирующего фактора роста-бета . Надсемейство включает большие семейства факторов роста и дифференцировки. BMP4 высоко консервативен в эволюционном отношении. BMP4 обнаруживается на ранних стадиях эмбрионального развития в вентральной маргинальной зоне, а также в глазах, сердечной крови и слуховых пузырьках. [6]
Открытие
[ редактировать ]Костные морфогенетические белки первоначально были идентифицированы по способности деминерализованного костного экстракта индуцировать эндохондральный остеогенез in vivo во внескелетных участках.
Функция
[ редактировать ]BMP4 представляет собой полипептид , принадлежащий к TGF-β суперсемейству белков . Он, как и другие костные морфогенетические белки , участвует в развитии костей и хрящей, в частности, в развитии зубов и конечностей, а также в восстановлении переломов. Этот конкретный член семейства играет важную роль в начале формирования эндохондральной кости у человека. Было показано, что он участвует в развитии мышц, минерализации костей и развитии зачатков мочеточников . [7]
BMP4 стимулирует дифференцировку вышележащей эктодермальной ткани. [8]
Известно, что костные морфогенетические белки стимулируют костеобразование у взрослых животных. Считается, что это индуцирует остеобластную коммитацию и дифференцировку стволовых клеток, таких как мезенхимальные стволовые клетки . [ нужна ссылка ] Известно, что BMP играют большую роль в эмбриональном развитии. В эмбрионе BMP4 помогает установить формирование дорсально-вентральной оси у лягушки Xenopus путем индукции вентральной мезодермы. У мышей целенаправленная инактивация BMP4 нарушает мезодермы . формирование [9] Также с помощью BMP7 устанавливается дорсально-вентральный паттерн развивающейся нервной трубки и индуцируются дорсальные признаки. [ нужна ссылка ]
BMP4 также ограничивает степень, в которой происходит нервная дифференцировка у эмбрионов Xenopus , индуцируя образование эпидермиса, а не нервной ткани. Они могут помочь в индукции латеральных характеристик сомитов. Сомиты необходимы для развития хрящей, костей, дермы на дорсальной стороне тела, грудных мышц и мышц конечностей. [10] BMP4 помогает в формировании паттерна развивающейся головки, вызывая апоптоз клеток нервного гребня ; это делается в заднем мозге. [11]
т.е. генерации новых нейронов), который происходит на протяжении всей жизни в двух нейрогенных нишах мозга: зубчатой извилине гиппокампа У взрослых BMP4 важен для нейрогенеза ( и субвентрикулярной зоне (СВЗ), прилегающей к боковым желудочкам. В этих нишах из стволовых клеток постоянно генерируются новые нейроны. Фактически было показано, что в зубчатой извилине BMP4 поддерживает нервные стволовые клетки в состоянии покоя, предотвращая тем самым истощение пула стволовых клеток. [12] В SVZ BMP-опосредованная передача сигналов через Smad4 необходима для инициации нейрогенеза из взрослых нейральных стволовых клеток и подавления альтернативной судьбы олигодендроглиогенеза. [13] Более того, было показано, что в СВЗ BMP4 оказывает продифференциативный эффект, поскольку устраняет дефект терминальной дифференцировки в нейросферах СВЗ, где ген Tis21 / BTG2 , необходимый для терминальной дифференцировки, был удален. [14] Tis21 является положительным регулятором экспрессии BMP4 в СВЗ. [14]
BMP4 важен для метаболизма костей и хрящей . Передача сигналов BMP4 была обнаружена при формировании ранней мезодермы и зародышевых клеток. Регуляция зачатков конечностей и развитие легких, печени, зубов и клеток мезенхимы лица являются другими важными функциями, приписываемыми передаче сигналов BMP4. [15] На формирование цифр влияет BMP4, а также другие сигналы BMP. Межпальцевая мезенхима содержит BMP4, который предотвращает апоптоз этой области. [16] Формирование зубов зависит от экспрессии BMP4, которая индуцирует Msx 1 и 2. Эти факторы транскрипции превращают формирующийся зуб в резец.
BMP4 также играет важную роль в жировой ткани: он необходим для белого адипогенеза и способствует адипоцитов . дифференцировке [17] Кроме того, это также важно для бурого жира , где он индуцирует UCP1 , связанный с несократительным термогенезом . [17]
Секреция BMP4 помогает вызвать дифференцировку зачатка мочеточника в мочеточник. [18]
BMP4 противодействует ткани-организатору и экспрессируется на ранних стадиях развития в тканях эктодермы и мезодермы. После гаструляции транскрипция BMP4 ограничивается вентролатеральной маргинальной зоной из-за ингибирования со стороны дорсальной стороны развивающегося эмбриона. BMP4 способствует вентрализации мезодермы, которая направляет формирование дорсально-вентральной оси. Было обнаружено, что у Xenopus BMP4 способствует образованию крови и кровяных островков. [19]
BMP4, первоначально экспрессируемый в эпидермисе, обнаруживается в пластинке крыши во время формирования нервной трубки. Градиент передачи сигналов BMP обнаружен в отличие от градиента Sonic hedgehog Shh. Эта экспрессия BMP4 паттернает дорсальные нейроны. [20]
BMP4 в сочетании с FGF2 способствуют дифференцировке стволовых клеток в мезодермальные линии. После дифференцировки клетки, обработанные BMP4 и FGF2, обычно производят более высокий уровень остеогенной и хондрогенной дифференцировки, чем необработанные стволовые клетки. [21] Также в сочетании с FGF2 он может производить клетки-предшественники щитовидной железы из плюрипотентных стволовых клеток у мышей и людей. [22]
Было показано, что BMP4 индуцирует экспрессию генов семейства Msx, которые, как полагают, являются частью формирования хряща из соматической мезодермы. [23]
BMP4, паракринный фактор роста , был обнаружен в яичниках крыс . BMP4 в сочетании с BMP7 регулируют раннее развитие фолликула яичника и переход от примордиального к первичному фолликулу. Кроме того, было показано, что ингибирование BMP4 антителами уменьшает общий размер яичников. Эти результаты показывают, что BMP4 может способствовать выживанию и предотвращению апоптоза ооцитов . [15]
Было показано, что у птиц BMP4 влияет на размер клюва дарвиновских вьюрков . Низкое количество BMP4 коррелирует с небольшой глубиной и шириной клюва. И наоборот, высокая экспрессия BMP4 приводит к большей глубине и ширине клюва. Генетическая регуляция BMP4 обеспечивает основу для естественного отбора в клюве птиц. [24]
Структура белка
[ редактировать ]Образуя активный карбокси-концевой пептид из 116 остатков, человеческий bmp4 первоначально синтезируется в виде препропротеина, состоящего из сорока процентов остатков, который расщепляется посттрансляционно. BMP4 имеет семь консервативных и гликозилированных остатков. [25] Мономеры удерживаются дисульфидными мостиками и 3 парами аминокислот цистеина. Эта конформация называется «цистиновым узлом». BMP4 может образовывать гомодимеры или гетеродимеры со сходными BMPS. Одним из примеров этого является BMP7. Эта способность образовывать гомодимеры или гетеродимеры дает возможность обладать большей остеоиндуктивной активностью, чем только bmp4. [26] Пока мало что известно о том, как BMPS взаимодействует с внеклеточным матриксом. Также мало известно о путях, которые затем разрушают BMP4.
Торможение
[ редактировать ]Подавление сигнала BMP4 (хордином , ноггином или фоллистатином ) заставляет эктодерму дифференцироваться в нервную пластинку . Если эти клетки также получат сигналы от FGF , они дифференцируются в спинной мозг; в отсутствие FGF клетки становятся тканью мозга.
В то время как сверхэкспрессия экспрессии BMP4 может приводить к вентрализации, ингибирование с доминантным негативом может приводить к полной дорсализации эмбриона или образованию двух осей. [27]
Важно отметить, что мыши, у которых BMP4 был полностью инактивирован, обычно погибали во время гаструляции . Считается, что инактивация человеческого BMP4, вероятно, будет иметь тот же эффект. Однако мутации, которые не полностью инактивируют BMP4 у людей, также могут иметь незначительные фенотипические эффекты и участвуют в агенезии зубов, а также в остеопорозе. [28]
Изоформы
[ редактировать ]Описан альтернативный сплайсинг в 5'-нетранслируемой области этого гена и описаны три варианта, все кодирующие идентичный белок. [29]
Молекулярные механизмы
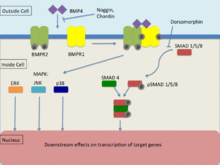
[ редактировать ]BMP4, как член семейства трансформирующего фактора роста-β (TGF-β), связывается с двумя различными типами рецепторов серин-треониновой киназы, известных как BMPR1 и BMPR2. [30] Передача сигнала через эти рецепторы происходит через Smad и картирует киназные пути, вызывая транскрипцию его генов-мишеней. Для того чтобы произошла передача сигнала, оба рецептора должны быть функциональными. BMP способен связываться с BMPR2 без BMPR1, однако сродство значительно увеличивается в присутствии обоих рецепторов. BMPR1 трансфосфорилируется через BMPR2, который индуцирует передачу сигналов внутри клетки, влияя на транскрипцию. [30]
Сигнальный путь Smad
[ редактировать ]Рецепторы семейства TGF-β чаще всего используют сигнальный путь Smad для передачи сигналов. [30] Рецепторы типа 2 отвечают за активацию рецепторов типа 1 , функция которых включает фосфорилирование R-Smads (Smad-1, Smad-5, Smad-8). При фосфорилировании происходит образование комплекса R-SMAD вместе с общим партнером Smad (co-Smad), где он мигрирует в ядро. Этот сигнальный путь регулируется низкомолекулярным ингибитором, известным как дорсоморфин, который предотвращает последующие эффекты R-smads. [30]
Сигнальные пути карт-киназы (MAPK)
[ редактировать ]Митоген- активируемые протеинкиназы (МАРК) подвергаются фосфорилированию через сигнальный каскад, где МАРКК фосфорилирует и активирует МАРКК, а МАПКК фосфорилирует и активирует МАРК , что затем индуцирует внутриклеточный ответ. [31] Активация MAPKKK происходит посредством взаимодействия преимущественно ГТФаз или другой группы протеинкиназ. Рецепторы TGF-β индуцируют сигнальные пути MAPK ERK, JNK и p38. [31] Также известно, что BMP4 активирует сигнальные пути ERK, JNK и p38 MAPK, хотя было обнаружено, что он действует независимо от сигнальных путей Smad, но в основном активен в сочетании с Smad. [32] Активация путей ERK и JNK фосфорилирует Smad и, следовательно, регулирует его активацию. В дополнение к этому пути MAPK могут быть способны напрямую влиять на Smad-взаимодействующие факторы транскрипции через субстрат JNK или p38, который индуцирует конвергенцию двух сигнальных путей. Отмечается, что эта конвергенция состоит в основном из кооперативного поведения, однако есть основания полагать, что иногда они могут противодействовать друг другу. Более того, баланс, который существует между прямой активацией этих сигнальных путей, оказывает значительное влияние на клеточные реакции, индуцированные TGF-β. [32]
Клиническое значение
[ редактировать ]Увеличение экспрессии BMP4 связано с различными заболеваниями костей, включая наследственное заболевание Fibrodysplasia Ossificans Progressiva . [33]
В результате исследований секвенирования генов-кандидатов, участвующих в расщелине, получены убедительные доказательства того, что мутации в гене костного морфогенетического белка 4 (BMP4) могут быть связаны с патогенезом расщелины губы и неба . [34]
Развитие глаз
[ редактировать ]Глаза необходимы организмам, особенно наземным позвоночным, для наблюдения за добычей и препятствиями; это имеет решающее значение для их выживания. Формирование глаз начинается с оптических пузырьков и хрусталика, происходящих из нейроэктодермы . Известно, что костные морфогенные белки стимулируют образование хрусталика глаза.Во время раннего развития глаз образование зрительного пузырька существенно у Мышей, и BMP4 сильно экспрессируется в зрительном пузырьке и слабо в окружающей мезенхиме и поверхностной эктодерме. Этот градиент концентрации BMP4 в зрительном пузырьке имеет решающее значение для индукции хрусталика. Исследователь доктор Фурута и доктор Хоган обнаружили, что если они произведут лазерную мутацию на эмбрионах мышей и вызовут гомозиготную нулевую мутацию BMP4 , у этого эмбриона не разовьется хрусталик. Они также провели in situ гибридизацию BMP4 гена , показывающего зеленый цвет, и гена Sox2 красного цвета, который, по их мнению, также участвует в формировании хрусталика. После того, как они провели эти две гибридизации in situ на эмбрионах мышей, они обнаружили, что в оптической системе обнаруживаются как зеленый, так и красный цвета. пузырь эмбрионов мышей. Это указывает на то, что BMP4 и Sox2 экспрессируются в нужном месте и в нужное время зрительного пузырька и доказывают, что они выполняют некоторые важные функции для индукции хрусталика. Более того, они провели дополнительный эксперимент, в ходе которого инъекция BMP4 в гомозиготные мутантные эмбрионы BMP4 спасла образование хрусталика (12). Это указывало на то, что BMP4 определенно необходим для формирования хрусталика. Однако исследователи также обнаружили, что некоторых мутировавших мышей спасти невозможно. Позже они обнаружили, что у этих мутантов отсутствовал Msx 2 , который активируется BMP4. Механизм, который они предсказали, заключался в том, что BMP4 активирует Msx 2 в зрительном пузырьке, и комбинация концентраций BMP4 и Msx2 вместе с активным Sox2 и Sox2 необходима для дифференцировки хрусталика. [35]
Инъекция Noggin в клетки волокон хрусталика мышей значительно снижает количество белков BMP4 в клетках. Это указывает на то, что Noggin достаточен для ингибирования выработки BMP4. Более того, был обнаружен другой белок-ингибитор , Alk6, который блокировал активацию BMP4 Msx2, что останавливало дифференцировку хрусталика. [36] Однако до сих пор многое неизвестно о механизме ингибирования BMP4 и последующей регуляции Sox2. В будущем исследователи стремятся выяснить более полный путь развития всего глаза и надеются, что однажды они смогут найти способ вылечить некоторые генетически обусловленные глазные заболевания.
Выпадение волос
[ редактировать ]Выпадение волос или известное как алопеция вызвано изменением морфологии волосяного фолликула и ненормальным циклическим циклом волосяного фолликула. [37] Циклы волосяных фолликулов делятся на циклы роста ( анагена ), регрессии ( катагена ) и покоя ( телогена) . [38] У млекопитающих реципрокные эпителиальные и мезенхимальные взаимодействия контролируют развитие волос. Такие гены, как BMP4 и BMP2, активны в предшественниках стержня волоса. В частности, BMP4 обнаруживается в дермальном сосочке . BMP4 является частью сигнальной сети, контролирующей развитие волос. Он необходим для индукции биохимических путей и передачи сигналов для регуляции дифференцировки стержня волоса в анагенном волосяном фолликуле. Это достигается путем контроля экспрессии факторов транскрипции , которые регулируют дифференцировку волос. Однако до сих пор неясно, где BMP действуют внутри генетической сети. Передача сигналов bmp4 потенциально может контролировать экспрессию молекул терминальной дифференцировки, таких как кератины. Было показано, что другие регуляторы также контролируют развитие волосяных фолликулов. HOXC13 и FOXN1 считаются важными регуляторами, поскольку эксперименты по потере функции показывают нарушение дифференцировки стержня волоса, которое не влияет на образование волосяного фолликула. [39]
Когда BMP4 экспрессируется эктопически, у трансгенных мышей во внешней корневой оболочке волосяного фолликула (ORS) ингибируется пролиферация клеточного матрикса. BMP4 также активирует экспрессию гена кератина волос , отмечая, что BMP4 важен для дифференцировки стержня волоса. Noggin , известный ингибитор BMP4, находится в матриксных клетках волосяной луковицы. Другими важными факторами, которые следует учитывать при развитии волос, являются экспрессия Shh ( sonic hedgehog ), BMP7 , BMP2, WNT и β-catenin , поскольку они необходимы на ранней стадии морфогенеза . [40]
Другими генами, которые могут ингибировать или взаимодействовать с BMP4, являются noggin, фоллистатин , гремлин , которые экспрессируются в развивающихся волосяных фолликулах. [41] У мышей, у которых отсутствует голова, волосяных фолликулов меньше, чем у здоровых мышей, и развитие фолликулов тормозится . На куриных эмбрионах показано, что эктопически экспрессируемый noggin производит увеличенные фолликулы, а передача сигналов BMP4 показывает репрессированную судьбу плакод в близлежащих клетках. [26] В ходе экспериментов in vivo также было показано, что Noggin вызывает рост волос на послеродовой коже. [42]
BMP4 является важным компонентом биологических путей, которые участвуют в регуляции дифференцировки волосяного стержня внутри анагенного волосяного фолликула. Самые сильные уровни экспрессии BMP4 обнаруживаются в мозговом веществе , клетках стержня волоса, дистальном матриксе волоса и потенциальных предшественниках кутикулы . Два основных метода, с помощью которых BMP4 ингибирует экспрессию волос, заключаются в ограничении экспрессии факторов роста в матрице волос и антагонизме между передачей сигналов роста и дифференцировки. [40]
Пути, регулирующие образование волосяных фолликулов и рост волос, являются ключевыми в разработке методов лечения заболеваний, связанных с выпадением волос. Такие состояния включают развитие новых фолликулов, изменение формы характеристик существующих фолликулов и изменение роста волос в существующих волосяных фолликулах. Более того, BMP4 и механизм его действия могут стать терапевтическими целями для предотвращения выпадения волос. [38]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000021835 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ ван ден Вейнгаард А., Вегуис Д.О., Боерсма С.Дж., ван Зелен Э.Дж., Гертс ван Кессель А., Олийве В. (ноябрь 1995 г.). «Точное картирование гена морфогенетического белка-4 кости человека (BMP4) с хромосомой 14q22-q23 методом гибридизации in situ» (PDF) . Геномика . 27 (3): 559–60. дои : 10.1006/geno.1995.1096 . hdl : 2066/22049 . ПМИД 7558046 .
- ^ Оида С., Иимура Т., Маруока Ю., Такеда К., Сасаки С. (ноябрь 1995 г.). «Клонирование и последовательность костного морфогенетического белка 4 (BMP-4) из библиотеки кДНК плаценты человека». Секв. ДНК . 5 (5): 273–5. дои : 10.3109/10425179509030980 . ПМИД 7579580 .
- ^ Кнехель С., Диллинджер К., Кестер М., Кнехель В. (ноябрь 2001 г.). «Структура и экспрессия генов Xenopus тропического BMP-2 и BMP-4» . Мех. Дев . 109 (1): 79–82. дои : 10.1016/S0925-4773(01)00506-8 . ПМИД 11677055 . S2CID 792305 .
- ^ Миядзаки Ю., Осима К., Фого А., Хоган Б.Л., Итикава И. (апрель 2000 г.). «Костный морфогенетический белок 4 регулирует место отпочкования и удлинение мочеточника мыши» . Журнал клинических исследований . 105 (7): 863–873. дои : 10.1172/JCI8256 . ПМК 377476 . ПМИД 10749566 .
- ^ Биниазан Ф, Манзари-Таваколи А, Сафаинежад Ф, Могими А, Раджаи Ф, Никнеджад Х (февраль 2021 г.). «Дифференцировочный эффект костного морфогенетического белка (BMP) на амниотические эпителиальные стволовые клетки человека для экспрессии маркеров эктодермального происхождения». Исследования клеток и тканей . 383 (2): 751–763. дои : 10.1007/s00441-020-03280-z . ПМИД 32960356 . S2CID 221843254 .
- ^ Винньер Дж., Блессинг М., Лабоски П.А., Хоган Б.Л. (сентябрь 1995 г.). «Костный морфогенетический белок-4 необходим для формирования и формирования паттерна мезодермы у мышей» . Гены и развитие . 9 (17): 2105–2116. дои : 10.1101/gad.17.9.2105 . ПМИД 7657163 .
- ^ Вулперт Л., Тикл С., Ариас А.М., Лоуренс П., Ламсден А., Робертсон Э., Мейеровиц Э., Смит Дж. (2015). «Развитие позвоночных III: Цыпленок и мышь - завершение плана тела». Принципы развития (Пятое изд.). Оксфорд, Великобритания. п. 207. ИСБН 978-0-19-870988-6 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Грэм и др. , 1994 г.
- ^ Мира Х, Андреу З., Су Х., Ли Д.С., Джессбергер С., Консильо А., Сан Эметерио Дж., Хортигуэла Р., Маркес-Торрехон М.А., Накашима К., Колак Д., Гетц М., Фариньяс I, Гейдж Ф.Х. (2010). «Передача сигналов через BMPR-IA регулирует состояние покоя и долговременную активность нервных стволовых клеток во взрослом гиппокампе» . Клеточная стволовая клетка . 7 (1): 78–89. дои : 10.1016/j.stem.2010.04.016 . ПМИД 20621052 .
- ^ Колак Д., Мори Т., Брилл М.С., Пфайфер А., Фальк С., Денг С., Монтейро Р., Маммери С., Соммер Л., Гётц М. (2008). «Взрослый нейрогенез требует Smad4-опосредованной передачи сигналов костного морфогенного белка в стволовых клетках» . Журнал неврологии . 28 (2): 434–446. doi : 10.1523/JNEUROSCI.4374-07.2008 . ПМК 6670509 . ПМИД 18184786 .
- ^ Перейти обратно: а б Фариоли-Веккьоли С., Чеккарелли М., Сараулли Д., Микели Л., Каннас С., Д'Алессандро Ф., Скардигли Р., Леонарди Л., Чина I, Костанци М., Маттера А., Честари В., Тироне Ф. (2014). «Tis21 необходим для нейрогенеза у взрослых в субвентрикулярной зоне и для обонятельного поведения, регулирующего циклины, BMP4, Hes1/5 и Ids» . Переднеклеточные нейроны . 8 : 98. дои : 10.3389/fncel.2014.00098 . ПМЦ 3977348 . ПМИД 24744701 .
- ^ Перейти обратно: а б Нильссон Э.Э., Скиннер М.К. (октябрь 2003 г.). «Костный морфогенетический белок-4 действует как фактор выживания фолликула яичника и способствует развитию примордиального фолликула». Биол. Репродукция . 69 (4): 1265–72. дои : 10.1095/biolreprod.103.018671 . ПМИД 12801979 . S2CID 2141586 .
- ^ Артеага-Солис Э., Гайро Б., Ли С.Ю., Шум Л., Сакаи Л., Рамирес Ф. (июль 2001 г.). «Регуляция формирования рисунка конечностей с помощью внеклеточных микрофибрилл» . Дж. Клеточная Биол . 154 (2): 275–81. дои : 10.1083/jcb.200105046 . ПМК 2150751 . ПМИД 11470817 .
- ^ Перейти обратно: а б Бласкес-Медела А.М., Джумабай М., Бострем К.И. (май 2019 г.). «За пределами кости: передача сигналов костного морфогенетического белка в жировой ткани» . Обзоры ожирения . 20 (5): 648–658. дои : 10.1111/обр.12822 . ПМК 6447448 . ПМИД 30609449 .
- ^ Миядзаки Ю., Осима К., Фого А. , Итикава И. (март 2003 г.). «Доказательства того, что костный морфогенетический белок 4 выполняет множество биологических функций во время развития почек и мочевыводящих путей» . Почки Int . 63 (3): 835–44. дои : 10.1046/j.1523-1755.2003.00834.x . ПМИД 12631064 .
- ^ Хеммати-Бриванлу А., Томсен Г.Х. (1995). «Построение вентрального мезодермального паттерна у эмбрионов Xenopus: закономерности экспрессии и активность BMP-2 и BMP-4». Дев. Жене . 17 (1): 78–89. дои : 10.1002/dvg.1020170109 . ПМИД 7554498 .
- ^ Селлек М.А., Гарсиа-Кастро М.И., Артингер К.Б., Броннер-Фрейзер М. (декабрь 1998 г.). «Влияние Shh и Noggin на формирование нервного гребня демонстрирует, что BMP необходим в нервной трубке, но не в эктодерме» . Разработка . 125 (24): 4919–30. дои : 10.1242/dev.125.24.4919 . ПМИД 9811576 . Архивировано из оригинала 20 мая 2022 года . Проверено 22 августа 2021 г.
- ^ Ли Т.Дж., Чан Дж., Кан С., Джин М., Шин Х., Ким Д.В., Ким Б.С. (январь 2013 г.). «Усиление остеогенной и хондрогенной дифференцировки эмбриональных стволовых клеток человека путем индукции мезодермального клона с помощью обработки BMP-4 и FGF2». Биохим. Биофиз. Рез. Коммун . 430 (2): 793–7. дои : 10.1016/j.bbrc.2012.11.067 . ПМИД 23206696 .
- ^ Курманн А.А., Серра М., Хокинс Ф., Рэнкин С.А., Мори М., Астапова И., Уллас С., Лин С., Билодо М., Россант Дж., Жан Дж.К., Иконому Л., Детердинг Р.Р., Шеннон Дж.М., Зорн А.М., Холленберг А.Н., Коттон Д.Н. (ноябрь 2015 г.). «Восстановление функции щитовидной железы путем трансплантации дифференцированных плюрипотентных стволовых клеток» . Клеточная стволовая клетка . 17 (5): 527–42. дои : 10.1016/j.stem.2015.09.004 . ПМК 4666682 . ПМИД 26593959 .
- ^ Ватанабэ Ю., Ле Дуарен, Н.М. (июнь 1996 г.). «Роль БМП-4 в развитии подкожного хряща» . Мех. Дев . 57 (1): 69–78. дои : 10.1016/0925-4773(96)00534-5 . ПМИД 8817454 . S2CID 16858412 .
- ^ Абжанов А, Протас М, Грант Б.Р., Грант PR, Табин С.Дж. (сентябрь 2004 г.). «Bmp4 и морфологическая изменчивость клювов дарвиновских вьюрков». Наука . 305 (5689): 1462–5. Бибкод : 2004Sci...305.1462A . дои : 10.1126/science.1098095 . ПМИД 15353802 . S2CID 17226774 .
- ^ Аоно А., Хазама М., Нотоя К., Такэтоми С., Ямасаки Х., Цукуда Р., Сасаки С., Фудзисава Ю. (май 1995 г.). «Мощная эктопическая индуцирующая кость активность гетеродимера костного морфогенетического белка-4/7». Биохим. Биофиз. Рез. Коммун . 210 (3): 670–7. дои : 10.1006/bbrc.1995.1712 . ПМИД 7763240 .
- ^ Перейти обратно: а б Бочкарев В.А., Бочкарева Н.В., Рот В., Накамура М., Чен Л.Х., Херцог В., Линднер Г., МакМахон Дж.А., Питерс С., Лаустер Р., МакМахон А.П., Паус Р. (июль 1999 г.). «Noggin - это стимулятор индукции волосяных фолликулов мезенхимального происхождения». Нат. Клеточная Биол . 1 (3): 158–64. дои : 10.1038/11078 . ПМИД 10559902 . S2CID 8777441 .
- ^ Мец А., Кнехель С., Бюхлер П., Кестер М., Кнехель В. (июнь 1998 г.). «Структурный и функциональный анализ промотора BMP-4 ранних эмбрионов Xenopus laevis» . Мех. Дев . 74 (1–2): 29–39. дои : 10.1016/S0925-4773(98)00059-8 . ПМИД 9651472 . S2CID 14496024 .
- ^ Ю М, Ван Х, Фань З, Се С, Лю Х, Лю Ю, Хан Д, Вонг СВ, Фэн Х (июль 2019 г.). «Мутации BMP4 при агенезии зубов и низкой костной массе» . Архивы оральной биологии . 103 : 40–46. doi : 10.1016/j.archorlbio.2019.05.012 . ПМК 6639811 . ПМИД 31128441 .
- ^ «Ген Энтрез: костный морфогенетический белок 4 BMP4» .
- ^ Перейти обратно: а б с д Миядзоно К., Камия Ю., Морикава М. (январь 2010 г.). «Костные морфогенетические белковые рецепторы и сигнальная трансдукция» . Дж. Биохим . 147 (1): 35–51. дои : 10.1093/jb/mvp148 . ПМИД 19762341 .
- ^ Перейти обратно: а б Cell Signaling Technology, Inc. «Митоген-активируемые протеинкиназные каскады» . Проверено 17 ноября 2012 г.
- ^ Перейти обратно: а б Деринк Р., Чжан Й.Е. (октябрь 2003 г.). «Smad-зависимые и Smad-независимые пути передачи сигналов семейства TGF-бета». Природа . 425 (6958): 577–84. Бибкод : 2003Natur.425..577D . дои : 10.1038/nature02006 . ПМИД 14534577 . S2CID 4419607 .
- ^ Кан Л., Ху М., Гомес В.А., Кесслер Дж.А. (октябрь 2004 г.). «Трансгенные мыши, сверхэкспрессирующие BMP4, развивают фенотип, подобный фибродисплазии оссифицирующей прогрессивной (FOP)» . Являюсь. Дж. Патол . 165 (4): 1107–15. дои : 10.1016/S0002-9440(10)63372-X . ПМК 1618644 . ПМИД 15466378 .
- ^ Диксон М.Дж., Маразита М.Л., Бити Т.Х., Мюррей Дж.К. (март 2011 г.). «Расщелина губы и неба: понимание генетических и экологических влияний» . Нат. Преподобный Жене . 12 (3): 167–78. дои : 10.1038/nrg2933 . ПМК 3086810 . ПМИД 21331089 .
- ^ Фурута Ю., Хоган Б.Л. (декабрь 1998 г.). «BMP4 необходим для индукции хрусталика у эмбриона мыши» . Генс Дев . 12 (23): 3764–75. дои : 10.1101/gad.12.23.3764 . ПМК 317259 . ПМИД 9851982 .
- ^ Фабер С.С., Робинсон М.Л., Макаренкова Х.П., Ланг Р.А. (август 2002 г.). «Передача сигналов Bmp необходима для развития клеток первичных волокон хрусталика». Разработка . 129 (15): 3727–37. дои : 10.1242/dev.129.15.3727 . ПМИД 12117821 .
- ^ Котсарелис Г., Миллар С.Е. (июль 2001 г.). «К молекулярному пониманию выпадения волос и его лечения». Тенденции Мол Мед . 7 (7): 293–301. дои : 10.1016/S1471-4914(01)02027-5 . ПМИД 11425637 .
- ^ Перейти обратно: а б Миллар С.Э. (февраль 2002 г.). «Молекулярные механизмы, регулирующие развитие волосяных фолликулов» . Дж. Инвест. Дерматол . 118 (2): 216–25. дои : 10.1046/j.0022-202x.2001.01670.x . ПМИД 11841536 .
- ^ Кулесса Х., Терк Г., Хоган Б.Л. (декабрь 2000 г.). «Ингибирование передачи сигналов Bmp влияет на рост и дифференцировку анагенного волосяного фолликула» . ЭМБО Дж . 19 (24): 6664–74. дои : 10.1093/emboj/19.24.6664 . ПМК 305899 . ПМИД 11118201 .
- ^ Перейти обратно: а б Хюльскен Дж., Фогель Р., Эрдманн Б., Котсарелис Г., Бирчмайер В. (май 2001 г.). «Бета-катенин контролирует морфогенез волосяных фолликулов и дифференцировку стволовых клеток в коже» . Клетка . 105 (4): 533–45. дои : 10.1016/S0092-8674(01)00336-1 . ПМИД 11371349 . S2CID 16775006 .
- ^ Фейен А., Гуманс М.Ю., ван ден Эйнден-ван Раай А.Дж. (декабрь 1994 г.). «Экспрессия субъединиц активина, рецепторов активина и фоллистатина в постимплантационных эмбрионах мышей предполагает специфические функции развития различных активинов». Разработка . 120 (12): 3621–37. дои : 10.1242/dev.120.12.3621 . ПМИД 7821227 .
- ^ Бочкарев В.А., Бочкарева Н.В., Накамура М., Хубер О., Фуна К., Лаустер Р., Паус Р., Гилкрест Б.А. (октябрь 2001 г.). «Ноггин необходим для индукции фазы роста волосяных фолликулов в послеродовой коже» . ФАСЕБ Дж . 15 (12): 2205–14. дои : 10.1096/fj.01-0207com . ПМИД 11641247 . S2CID 10236217 .
Дальнейшее чтение
[ редактировать ]- Возни Дж. М., Розен В., Селеста А. Дж., Митсок Л. М., Уиттерс М. Дж., Криз Р. В., Хьюик Р. М., Ван Э. А. (1989). «Новые регуляторы костеобразования: молекулярные клоны и активность». Наука . 242 (4885): 1528–34. Бибкод : 1988Sci...242.1528W . дои : 10.1126/science.3201241 . ПМИД 3201241 .
- Розенцвейг Б.Л., Имамура Т., Окадоме Т., Кокс Г.Н., Ямашита Х., тен Дейке П., Хелдин Ч., Миязоно К. (1995). «Клонирование и характеристика человеческого рецептора типа II для костных морфогенетических белков» . Учеб. Натл. акад. наук. США . 92 (17): 7632–6. Бибкод : 1995PNAS...92.7632R . дои : 10.1073/pnas.92.17.7632 . ПМЦ 41199 . ПМИД 7644468 .
- Ноно Т., Исикава Т., Сайто Т., Хосокава К., Ноджи С., Уолсинг Д.Х., Розенбаум Дж.С. (1995). «Идентификация человеческого рецептора типа II для костного морфогенетического белка-4, который образует дифференциальные гетеромерные комплексы с рецепторами костного морфогенетического белка типа I» . Ж. Биол. Хим . 270 (38): 22522–6. дои : 10.1074/jbc.270.38.22522 . ПМИД 7673243 .
- Ямаджи Н., Селеста А.Дж., Тис Р.С., Сонг Дж.Дж., Бернье С.М., Гольцман Д., Лайонс К.М., Нове Дж., Розен В., Возни Дж.М. (1995). «Рецептор серин/треонинкиназы млекопитающих специфически связывает BMP-2 и BMP-4». Биохим. Биофиз. Рез. Коммун . 205 (3): 1944–51. дои : 10.1006/bbrc.1994.2898 . ПМИД 7811286 .
- Харрис С.Э., Харрис М.А., Махи П., Возни Дж., Фэн Дж.К., Манди Г.Р. (1994). «Экспрессия информационных РНК костных морфогенетических белков нормальными клетками простаты и рака простаты крысы и человека». Простата . 24 (4): 204–11. дои : 10.1002/pros.2990240406 . ПМИД 8146069 . S2CID 21276656 .
- ван ден Вейнгаард А., ван Краай М., ван Зелен Э.Дж., Оливе В., Боерсма С.Дж. (1996). «Геномная организация гена морфогенетического белка-4 кости человека: молекулярная основа для множественных транскриптов» (PDF) . Биохим. Биофиз. Рез. Коммун . 219 (3): 789–94. дои : 10.1006/bbrc.1996.0312 . hdl : 2066/23948 . ПМИД 8645259 .
- Нисито Х., Итидзё Х., Кимура М., Мацумото Т., Макисима Ф., Ямагути А., Ямасита Х., Эномото С., Миядзоно К. (1996). «Идентификация серин/треонин-киназных рецепторов типа I и типа II для фактора роста/дифференциации-5» . Ж. Биол. Хим . 271 (35): 21345–52. дои : 10.1074/jbc.271.35.21345 . ПМИД 8702914 .
- Бональдо М.Ф., Леннон Дж., Соарес М.Б. (1997). «Нормализация и вычитание: два подхода к открытию генов» . Геном Рез . 6 (9): 791–806. дои : 10.1101/гр.6.9.791 . ПМИД 8889548 .
- Шор Э.М., Сюй М., Шах П.Б., Янофф Х.Б., Хан Г.В., Дирдорф М.А., Совинский Л., Спиннер Н.Б., Заслофф М.А., Возни Дж.М., Каплан Ф.С. (1998). «Ген морфогенетического белка 4 кости человека (BMP-4): молекулярная структура и регуляция транскрипции». Кальциф. Ткань Int . 63 (3): 221–9. дои : 10.1007/s002239900518 . ПМИД 9701626 . S2CID 8339465 .
- Такер А.С., Мэтьюз К.Л., Шарп П.Т. (1998). «Трансформация типа зубов, вызванная ингибированием передачи сигналов BMP». Наука . 282 (5391): 1136–8. Бибкод : 1998Sci...282.1136T . дои : 10.1126/science.282.5391.1136 . ПМИД 9804553 .
- Ван ден Вейнгаард А., Пайперс М.А., Йоостен П.Х., Рулофс Дж.М., Ван Зоелен Э.Дж., Олийве В. (1999). «Функциональная характеристика двух промоторов гена морфогенетического белка-4 кости человека» . Дж. Боун Майнер. Рез . 14 (8): 1432–41. дои : 10.1359/jbmr.1999.14.8.1432 . ПМИД 10457277 .
- Ли В, ЛоТурко Джей Джей (2000). «Ноггин является негативным регулятором дифференцировки нейронов в развивающемся неокортексе». Дев. Нейроски . 22 (1–2): 68–73. дои : 10.1159/000017428 . ПМИД 10657699 . S2CID 35547875 .
- Раатикайнен-Ахокас А., Хитонен М., Тенхунен А., Сайнио К., Сариола Х. (2000). «BMP-4 влияет на дифференцировку метанефрической мезенхимы и выявляет раннюю передне-заднюю ось эмбриональной почки». Дев. Дин . 217 (2): 146–58. doi : 10.1002/(SICI)1097-0177(200002)217:2<146::AID-DVDY2>3.0.CO;2-I . ПМИД 10706139 . S2CID 11672134 .
- ван ден Вейнгаард А., Малдер В.Р., Дейкема Р., Боерсма С.Дж., Моссельман С., ван Зоелен Э.Дж., Олийве В. (2000). «Антиэстрогены специфически усиливают активность промотора костного морфогенетического белка-4 в остеобластных клетках человека» . Мол. Эндокринол . 14 (5): 623–33. дои : 10.1210/mend.14.5.0463 . ПМИД 10809227 .
- Ин Ю, Лю XM, Марбл А, Лоусон К.А., Чжао GQ (2000). «Требование Bmp8b для образования первичных зародышевых клеток у мышей» . Мол. Эндокринол . 14 (7): 1053–63. дои : 10.1210/mend.14.7.0479 . ПМИД 10894154 .
- Накаде О, Такахаши К, Такума Т, Аоки Т, Каку Т (2001). «Влияние внеклеточного кальция на экспрессию генов костных морфогенетических белков-2 и -4 нормальных костных клеток человека». Дж. Боун Майнер. Метаб . 19 (1): 13–9. дои : 10.1007/s007740170055 . ПМИД 11156467 . S2CID 23873280 .
- Хатта Т., Кониси Х., Като Э., Нацуме Т., Уэно Н., Кобаяши Ю., Ямазаки Т. (2001). «Идентификация лиганд-связывающего сайта рецептора BMP типа IA для BMP-4». Биополимеры . 55 (5): 399–406. doi : 10.1002/1097-0282(2000)55:5<399::AID-BIP1014>3.0.CO;2-9 . ПМИД 11241215 .
- Аоки Х, Фуджи М, Имамура Т, Яги К, Такехара К, Като М, Миязоно К (2001). «Синергетическое воздействие различных рецепторов костных морфогенетических белков типа I на индукцию щелочной фосфатазы». Дж. Клеточная наука . 114 (Часть 8): 1483–9. дои : 10.1242/jcs.114.8.1483 . ПМИД 11282024 .
- Калиновский А., Бухтуш Ф., Блазески Р., Борнманн С., Сузуки Н., Мейсон К.А., Шайффеле П. (2011). Поллё Ф. (ред.). «Развитие аксон-мишеневой специфичности понто-мозжечковых афферентов» . ПЛОС Биология . 9 (2): e1001013. дои : 10.1371/journal.pbio.1001013 . ПМК 3035609 . ПМИД 21346800 .
- Котсарелис Г., Миллар С.Е. (июль 2001 г.). «К молекулярному пониманию выпадения волос и его лечения». Тенденции Мол Мед . 7 (7): 293–301. дои : 10.1016/S1471-4914(01)02027-5 . ПМИД 11425637 .
- Фейен А., Гуманс М.Ю., ван ден Эйнден-ван Раай А.Дж. (декабрь 1994 г.). «Экспрессия субъединиц активина, рецепторов активина и фоллистатина в постимплантационных эмбрионах мышей предполагает специфические функции развития различных активинов». Разработка . 120 (12): 3621–37. дои : 10.1242/dev.120.12.3621 . ПМИД 7821227 .
- Грэм А., Фрэнсис-Уэст П., Брикелл П., Ламсден А. (декабрь 1994 г.). «Сигнальная молекула BMP4 опосредует апоптоз в ромбенцефалическом нервном гребне». Природа . 372 (6507): 684–6. Бибкод : 1994Natur.372..684G . дои : 10.1038/372684a0 . ПМИД 7990961 . S2CID 4361935 .
- Хюльскен Дж., Фогель Р., Эрдманн Б., Котсарелис Г., Бирчмайер В. (май 2001 г.). «Бета-катенин контролирует морфогенез волосяных фолликулов и дифференцировку стволовых клеток в коже» . Клетка . 105 (4): 533–45. дои : 10.1016/S0092-8674(01)00336-1 . ПМИД 11371349 . S2CID 16775006 .
- Кулесса Х., Терк Г., Хоган Б.Л. (декабрь 2000 г.). «Ингибирование передачи сигналов Bmp влияет на рост и дифференцировку анагенного волосяного фолликула» . ЭМБО Дж . 19 (24): 6664–74. дои : 10.1093/emboj/19.24.6664 . ПМК 305899 . ПМИД 11118201 .
- Леонг Л.М., Брикелл, премьер-министр (декабрь 1996 г.). «Костный морфогенный белок-4». Межд. Дж. Биохим. Клеточная Биол . 28 (12): 1293–6. дои : 10.1016/S1357-2725(96)00075-1 . ПМИД 9022288 .
- Лием К.Ф., Треммл Г., Ролинк Х., Джесселл Т.М. (сентябрь 1995 г.). «Дорсальная дифференцировка клеток нервной пластинки, индуцированная BMP-опосредованными сигналами от эпидермальной эктодермы» . Клетка . 82 (6): 969–79. дои : 10.1016/0092-8674(95)90276-7 . ПМИД 7553857 . S2CID 17106597 .
- Миллар С.Э. (февраль 2002 г.). «Молекулярные механизмы, регулирующие развитие волосяных фолликулов» . Дж. Инвест. Дерматол . 118 (2): 216–25. дои : 10.1046/j.0022-202x.2001.01670.x . ПМИД 11841536 .
- Пурке О, Фан С.М., Колти М., Хирсингер Э., Ватанабэ Ю., Бреан С., Фрэнсис-Уэст П., Брикелл П., Тессье-Лавин М., Ле Дуарен Н.М. (февраль 1996 г.). «Боковые и аксиальные сигналы, участвующие в формировании паттерна сомитов птиц: роль BMP4» . Клетка . 84 (3): 461–71. doi : 10.1016/S0092-8674(00)81291-X . ПМИД 8608600 . S2CID 15824329 .
- Ван Э.А., Израиль Д.И., Келли С., Люксенберг Д.П. (1993). «Костный морфогенетический белок-2 вызывает коммитацию и дифференцировку в клетках C3H10T1/2 и 3T3». Факторы роста . 9 (1): 57–71. дои : 10.3109/08977199308991582 . ПМИД 8347351 .
- Винньер Дж., Блессинг М., Лабоски П.А., Хоган Б.Л. (сентябрь 1995 г.). «Костный морфогенетический белок-4 необходим для формирования и формирования паттерна мезодермы у мышей» . Генс Дев . 9 (17): 2105–16. дои : 10.1101/gad.17.9.2105 . ПМИД 7657163 .
Внешние ссылки
[ редактировать ]- BMPedia — Вики по костным морфогенетическим белкам [ постоянная мертвая ссылка ]
- BMP4 Расположение гена человека в браузере генома UCSC .
- Подробности о гене человека BMP4 в браузере генома UCSC .