Рак
| Рак | |
|---|---|
| Другие имена | Злокачественная опухоль , злокачественное новообразование |
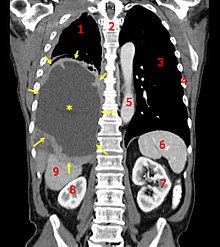 | |
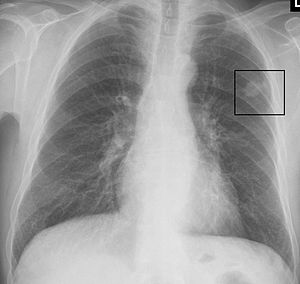
| Корональная КТ, показывающая злокачественную мезотелиому. Условные обозначения: → опухоль ←, ✱ центральный плевральный выпот , 1 и 3 легкие , 2 позвоночника , 4 ребра , 5 аорта , 6 селезенка , 7 и 8 почки , 9 печень | |
| Pronunciation | |
| Specialty | Oncology |
| Symptoms | Lump, abnormal bleeding, prolonged cough, unexplained weight loss, change in bowel movements[1] |
| Risk factors | Exposure to carcinogens, tobacco, obesity, poor diet, lack of physical activity, excessive alcohol, certain infections[2][3] |
| Treatment | Radiation therapy, surgery, chemotherapy, targeted therapy[2][4] |
| Prognosis | Average five-year survival 66% (USA)[5] |
| Frequency | 24 million annually (2019)[6] |
| Deaths | 10 million annually (2019)[6] |
Рак — это группа заболеваний, сопровождающихся аномальным ростом клеток с возможностью проникновения или распространения на другие части тела. [2] [7] Они контрастируют с доброкачественными опухолями , которые не распространяются. [7] Возможные признаки и симптомы включают шишку, аномальное кровотечение, продолжительный кашель, необъяснимую потерю веса и изменение стула . [1] Хотя эти симптомы могут указывать на рак, они также могут иметь и другие причины. [1] У человека более 100 видов рака. [7]
Употребление табака является причиной около 22% случаев смерти от рака. [2] Еще 10% связаны с ожирением , неправильным питанием , недостатком физической активности или чрезмерным употреблением алкоголя . [2] [8] [9] Другие факторы включают определенные инфекции, воздействие ионизирующей радиации и загрязнителей окружающей среды. [3] Инфекция специфическими вирусами, бактериями и паразитами является фактором окружающей среды, вызывающим примерно 16-18% случаев рака во всем мире. [10] Эти инфекционные агенты включают Helicobacter pylori , гепатит B , гепатит C , папилломавирусную инфекцию человека , вирус Эпштейна-Барра , Т-лимфотропный вирус человека 1 , герпесвирус, ассоциированный с саркомой Капоши, и полиомавирус клеток Меркеля . Вирус иммунодефицита человека (ВИЧ) не вызывает непосредственно рак, но вызывает иммунодефицит, который может увеличить риск, связанный с другими инфекциями, иногда в несколько тысяч раз (в случае саркомы Капоши ). Важно отметить, что вакцинация против гепатита В и вируса папилломы человека практически устраняет риск развития рака, вызываемого этими вирусами, у лиц, успешно вакцинированных до заражения.
These environmental factors act, at least partly, by changing the genes of a cell.[11] Typically, many genetic changes are required before cancer develops.[11] Approximately 5–10% of cancers are due to inherited genetic defects.[12] Cancer can be detected by certain signs and symptoms or screening tests.[2] It is then typically further investigated by medical imaging and confirmed by biopsy.[13]
The risk of developing certain cancers can be reduced by not smoking, maintaining a healthy weight, limiting alcohol intake, eating plenty of vegetables, fruits, and whole grains, vaccination against certain infectious diseases, limiting consumption of processed meat and red meat, and limiting exposure to direct sunlight.[14][15] Early detection through screening is useful for cervical and colorectal cancer.[16] The benefits of screening for breast cancer are controversial.[16][17] Cancer is often treated with some combination of radiation therapy, surgery, chemotherapy and targeted therapy.[2][4] Pain and symptom management are an important part of care.[2] Palliative care is particularly important in people with advanced disease.[2] The chance of survival depends on the type of cancer and extent of disease at the start of treatment.[11] In children under 15 at diagnosis, the five-year survival rate in the developed world is on average 80%.[18] For cancer in the United States, the average five-year survival rate is 66% for all ages.[5]
In 2015, about 90.5 million people worldwide had cancer.[19] In 2019, annual cancer cases grew by 23.6 million people, and there were 10 million deaths worldwide, representing over the previous decade increases of 26% and 21%, respectively.[6][20]
The most common types of cancer in males are lung cancer, prostate cancer, colorectal cancer, and stomach cancer.[21][22] In females, the most common types are breast cancer, colorectal cancer, lung cancer, and cervical cancer.[11][22] If skin cancer other than melanoma were included in total new cancer cases each year, it would account for around 40% of cases.[23][24] In children, acute lymphoblastic leukemia and brain tumors are most common, except in Africa, where non-Hodgkin lymphoma occurs more often.[18] In 2012, about 165,000 children under 15 years of age were diagnosed with cancer.[21] The risk of cancer increases significantly with age, and many cancers occur more commonly in developed countries.[11] Rates are increasing as more people live to an old age and as lifestyle changes occur in the developing world.[25] The global total economic costs of cancer were estimated at US$1.16 trillion (equivalent to $1.62 trillion in 2023) per year as of 2010[update].[26]
Etymology and definitions
The word comes from the ancient Greek καρκίνος, meaning 'crab' and 'tumor'. Greek physicians Hippocrates and Galen, among others, noted the similarity of crabs to some tumors with swollen veins. The word was introduced in English in the modern medical sense around 1600.[27]
Cancers comprise a large family of diseases that involve abnormal cell growth with the potential to invade or spread to other parts of the body.[2][7] They form a subset of neoplasms. A neoplasm or tumor is a group of cells that have undergone unregulated growth and will often form a mass or lump, but may be distributed diffusely.[28][29]
All tumor cells show the six hallmarks of cancer. These characteristics are required to produce a malignant tumor. They include:[30]
- Cell growth and division absent the proper signals
- Continuous growth and division even given contrary signals
- Avoidance of programmed cell death
- Limitless number of cell divisions
- Promoting blood vessel construction
- Invasion of tissue and formation of metastases[30]
The progression from normal cells to cells that can form a detectable mass to cancer involves multiple steps known as malignant progression.[30][31]
Signs and symptoms
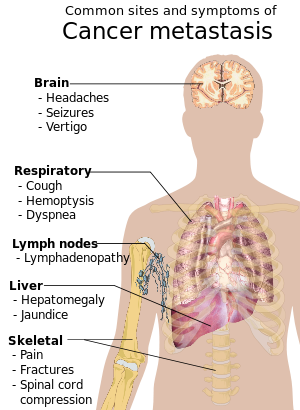
When cancer begins, it produces no symptoms. Signs and symptoms appear as the mass grows or ulcerates. The findings that result depend on cancer's type and location. Few symptoms are specific. Many frequently occur in individuals who have other conditions. Cancer can be difficult to diagnose and can be considered a "great imitator".[32]
People may become anxious or depressed post-diagnosis. The risk of suicide in people with cancer is approximately double.[33]
Local symptoms
Local symptoms may occur due to the mass of the tumor or its ulceration. For example, mass effects from lung cancer can block the bronchus resulting in cough or pneumonia; esophageal cancer can cause narrowing of the esophagus, making it difficult or painful to swallow; and colorectal cancer may lead to narrowing or blockages in the bowel, affecting bowel habits. Masses in breasts or testicles may produce observable lumps. Ulceration can cause bleeding that can lead to symptoms such as coughing up blood (lung cancer), anemia or rectal bleeding (colon cancer), blood in the urine (bladder cancer), or abnormal vaginal bleeding (endometrial or cervical cancer). Although localized pain may occur in advanced cancer, the initial tumor is usually painless. Some cancers can cause a buildup of fluid within the chest or abdomen.[32]
Systemic symptoms
Systemic symptoms may occur due to the body's response to the cancer. This may include fatigue, unintentional weight loss, or skin changes.[34] Some cancers can cause a systemic inflammatory state that leads to ongoing muscle loss and weakness, known as cachexia.[35]
Some cancers, such as Hodgkin's disease, leukemias, and liver or kidney cancers, can cause a persistent fever.[32]
Shortness of breath, called dyspnea, is a common symptom of cancer and its treatment. The causes of cancer-related dyspnea can include tumors in or around the lung, blocked airways, fluid in the lungs, pneumonia, or treatment reactions including an allergic response.[36] Treatment for dyspnea in patients with advanced cancer can include fans, bilevel ventilation, acupressure/reflexology and multicomponent nonpharmacological interventions.[37]
Some systemic symptoms of cancer are caused by hormones or other molecules produced by the tumor, known as paraneoplastic syndromes. Common paraneoplastic syndromes include hypercalcemia, which can cause altered mental state, constipation and dehydration, or hyponatremia, which can also cause altered mental status, vomiting, headaches, or seizures.[38]
Metastasis
Metastasis is the spread of cancer to other locations in the body. The dispersed tumors are called metastatic tumors, while the original is called the primary tumor. Almost all cancers can metastasize.[39] Most cancer deaths are due to cancer that has metastasized.[40]
Metastasis is common in the late stages of cancer and it can occur via the blood or the lymphatic system or both. The typical steps in metastasis are local invasion, intravasation into the blood or lymph, circulation through the body, extravasation into the new tissue, proliferation and angiogenesis. Different types of cancers tend to metastasize to particular organs, but overall the most common places for metastases to occur are the lungs, liver, brain, and the bones.[39]
While some cancers can be cured if detected early, metastatic cancer is more difficult to treat and control. Nevertheless, some recent treatments are demonstrating encouraging results.[41]
Causes


The majority of cancers, some 90–95% of cases, are due to genetic mutations from environmental and lifestyle factors.[3] The remaining 5–10% are due to inherited genetics.[3] Environmental refers to any cause that is not inherited, such as lifestyle, economic, and behavioral factors and not merely pollution.[43] Common environmental factors that contribute to cancer death include tobacco use (25–30%), diet and obesity (30–35%), infections (15–20%), radiation (both ionizing and non-ionizing, up to 10%), lack of physical activity, and pollution.[3][44] Psychological stress does not appear to be a risk factor for the onset of cancer,[45][46] though it may worsen outcomes in those who already have cancer.[45]
Environmental or lifestyle factors that caused cancer to develop in an individual can be identified by analyzing mutational signatures from genomic sequencing of tumor DNA. For example, this can reveal if lung cancer was caused by tobacco smoke, if skin cancer was caused by UV radiation, or if secondary cancers were caused by previous chemotherapy treatment.[47]
Cancer is generally not a transmissible disease.[48] Exceptions include rare transmissions that occur with pregnancies and occasional organ donors. However, transmissible infectious diseases such as hepatitis B, Epstein-Barr virus, Human Papilloma Virus and HIV, can contribute to the development of cancer.[citation needed]
Chemicals

Exposure to particular substances have been linked to specific types of cancer. These substances are called carcinogens.
Tobacco smoke, for example, causes 90% of lung cancer.[49] Tobacco use can cause cancer throughout the body including in the mouth and throat, larynx, esophagus, stomach, bladder, kidney, cervix, colon/rectum, liver and pancreas.[50][51] Tobacco smoke contains over fifty known carcinogens, including nitrosamines and polycyclic aromatic hydrocarbons.[52]
Tobacco is responsible for about one in five cancer deaths worldwide[52] and about one in three in the developed world.[53] Lung cancer death rates in the United States have mirrored smoking patterns, with increases in smoking followed by dramatic increases in lung cancer death rates and, more recently, decreases in smoking rates since the 1950s followed by decreases in lung cancer death rates in men since 1990.[54][55]
In Western Europe, 10% of cancers in males and 3% of cancers in females are attributed to alcohol exposure, especially liver and digestive tract cancers.[56] Cancer from work-related substance exposures may cause between 2 and 20% of cases,[57] causing at least 200,000 deaths.[58] Cancers such as lung cancer and mesothelioma can come from inhaling tobacco smoke or asbestos fibers, or leukemia from exposure to benzene.[58]
Exposure to perfluorooctanoic acid (PFOA), which is predominantly used in the production of Teflon, is known to cause two kinds of cancer.[59][60]
Chemotherapy drugs such as platinum-based compounds are carcinogens that increase the risk of secondary cancers[47]
Azathioprine, an immunosuppressive medication, is a carcinogen that can cause primary tumors to develop.[47]
Diet and exercise
Diet, physical inactivity, and obesity are related to up to 30–35% of cancer deaths.[3][61] In the United States, excess body weight is associated with the development of many types of cancer and is a factor in 14–20% of cancer deaths.[61] A UK study including data on over 5 million people showed higher body mass index to be related to at least 10 types of cancer and responsible for around 12,000 cases each year in that country.[62] Physical inactivity is believed to contribute to cancer risk, not only through its effect on body weight but also through negative effects on the immune system and endocrine system.[61] More than half of the effect from the diet is due to overnutrition (eating too much), rather than from eating too few vegetables or other healthful foods.[citation needed]
Some specific foods are linked to specific cancers. A high-salt diet is linked to gastric cancer.[63] Aflatoxin B1, a frequent food contaminant, causes liver cancer.[63] Betel nut chewing can cause oral cancer.[63] National differences in dietary practices may partly explain differences in cancer incidence. For example, gastric cancer is more common in Japan due to its high-salt diet[64] while colon cancer is more common in the United States. Immigrant cancer profiles mirror those of their new country, often within one generation.[65]
Infection
Worldwide, approximately 18% of cancer deaths are related to infectious diseases.[3] This proportion ranges from a high of 25% in Africa to less than 10% in the developed world.[3] Viruses[66] are the usual infectious agents that cause cancer but bacteria and parasites may also play a role. Oncoviruses (viruses that can cause human cancer) include:
- Human papillomavirus (cervical cancer),
- Epstein–Barr virus (B-cell lymphoproliferative disease and nasopharyngeal carcinoma),
- Kaposi's sarcoma herpesvirus (Kaposi's sarcoma and primary effusion lymphomas),
- Hepatitis B and hepatitis C viruses (hepatocellular carcinoma)
- Human T-cell leukemia virus-1 (T-cell leukemias).
- Merkel cell polyomavirus (Merkel cell carcinoma)
Bacterial infection may also increase the risk of cancer, as seen in
- Helicobacter pylori-induced gastric carcinoma.[67][68]
- Colibactin, a genotoxin associated with Escherichia coli infection (colorectal cancer)[47]
Parasitic infections associated with cancer include:
- Schistosoma haematobium (squamous cell carcinoma of the bladder)
- The liver flukes, Opisthorchis viverrini and Clonorchis sinensis (cholangiocarcinoma).[69]
Radiation
Radiation exposure such as ultraviolet radiation and radioactive material is a risk factor for cancer.[70][71][72] Many non-melanoma skin cancers are due to ultraviolet radiation, mostly from sunlight.[71] Sources of ionizing radiation include medical imaging and radon gas.[71]
Ionizing radiation is not a particularly strong mutagen.[73] Residential exposure to radon gas, for example, has similar cancer risks as passive smoking.[73] Radiation is a more potent source of cancer when combined with other cancer-causing agents, such as radon plus tobacco smoke.[73] Radiation can cause cancer in most parts of the body, in all animals and at any age. Children are twice as likely to develop radiation-induced leukemia as adults; radiation exposure before birth has ten times the effect.[73]
Medical use of ionizing radiation is a small but growing source of radiation-induced cancers. Ionizing radiation may be used to treat other cancers, but this may, in some cases, induce a second form of cancer.[73] It is also used in some kinds of medical imaging.[74]
Prolonged exposure to ultraviolet radiation from the sun can lead to melanoma and other skin malignancies.[75] Clear evidence establishes ultraviolet radiation, especially the non-ionizing medium wave UVB, as the cause of most non-melanoma skin cancers, which are the most common forms of cancer in the world.[75]
Non-ionizing radio frequency radiation from mobile phones, electric power transmission and other similar sources has been described as a possible carcinogen by the World Health Organization's International Agency for Research on Cancer.[76] Evidence, however, has not supported a concern.[77][70] This includes that studies have not found a consistent link between mobile phone radiation and cancer risk.[78]
Heredity
The vast majority of cancers are non-hereditary (sporadic). Hereditary cancers are primarily caused by an inherited genetic defect. Less than 0.3% of the population are carriers of a genetic mutation that has a large effect on cancer risk and these cause less than 3–10% of cancer.[79] Some of these syndromes include: certain inherited mutations in the genes BRCA1 and BRCA2 with a more than 75% risk of breast cancer and ovarian cancer,[79] and hereditary nonpolyposis colorectal cancer (HNPCC or Lynch syndrome), which is present in about 3% of people with colorectal cancer,[80] among others.
Statistically for cancers causing most mortality, the relative risk of developing colorectal cancer when a first-degree relative (parent, sibling or child) has been diagnosed with it is about 2.[81] The corresponding relative risk is 1.5 for lung cancer,[82] and 1.9 for prostate cancer.[83] For breast cancer, the relative risk is 1.8 with a first-degree relative having developed it at 50 years of age or older, and 3.3 when the relative developed it when being younger than 50 years of age.[84]
Taller people have an increased risk of cancer because they have more cells than shorter people. Since height is genetically determined to a large extent, taller people have a heritable increase of cancer risk.[85]
Physical agents
Some substances cause cancer primarily through their physical, rather than chemical, effects.[86] A prominent example of this is prolonged exposure to asbestos, naturally occurring mineral fibers that are a major cause of mesothelioma (cancer of the serous membrane) usually the serous membrane surrounding the lungs.[86] Other substances in this category, including both naturally occurring and synthetic asbestos-like fibers, such as wollastonite, attapulgite, glass wool and rock wool, are believed to have similar effects.[86] Non-fibrous particulate materials that cause cancer include powdered metallic cobalt and nickel and crystalline silica (quartz, cristobalite and tridymite).[86] Usually, physical carcinogens must get inside the body (such as through inhalation) and require years of exposure to produce cancer.[86]
Physical trauma resulting in cancer is relatively rare.[87] Claims that breaking bones resulted in bone cancer, for example, have not been proven.[87] Similarly, physical trauma is not accepted as a cause for cervical cancer, breast cancer or brain cancer.[87] One accepted source is frequent, long-term application of hot objects to the body. It is possible that repeated burns on the same part of the body, such as those produced by kanger and kairo heaters (charcoal hand warmers), may produce skin cancer, especially if carcinogenic chemicals are also present.[87] Frequent consumption of scalding hot tea may produce esophageal cancer.[87] Generally, it is believed that cancer arises, or a pre-existing cancer is encouraged, during the process of healing, rather than directly by the trauma.[87] However, repeated injuries to the same tissues might promote excessive cell proliferation, which could then increase the odds of a cancerous mutation.[citation needed]
Chronic inflammation has been hypothesized to directly cause mutation.[87][88] Inflammation can contribute to proliferation, survival, angiogenesis and migration of cancer cells by influencing the tumor microenvironment.[89][90] Oncogenes build up an inflammatory pro-tumorigenic microenvironment.[91]
Hormones
Hormones also play a role in the development of cancer by promoting cell proliferation.[92] Insulin-like growth factors and their binding proteins play a key role in cancer cell proliferation, differentiation and apoptosis, suggesting possible involvement in carcinogenesis.[93]
Hormones are important agents in sex-related cancers, such as cancer of the breast, endometrium, prostate, ovary and testis and also of thyroid cancer and bone cancer.[92] For example, the daughters of women who have breast cancer have significantly higher levels of estrogen and progesterone than the daughters of women without breast cancer. These higher hormone levels may explain their higher risk of breast cancer, even in the absence of a breast-cancer gene.[92] Similarly, men of African ancestry have significantly higher levels of testosterone than men of European ancestry and have a correspondingly higher level of prostate cancer.[92] Men of Asian ancestry, with the lowest levels of testosterone-activating androstanediol glucuronide, have the lowest levels of prostate cancer.[92]
Other factors are relevant: obese people have higher levels of some hormones associated with cancer and a higher rate of those cancers.[92] Women who take hormone replacement therapy have a higher risk of developing cancers associated with those hormones.[92] On the other hand, people who exercise far more than average have lower levels of these hormones and lower risk of cancer.[92] Osteosarcoma may be promoted by growth hormones.[92] Some treatments and prevention approaches leverage this cause by artificially reducing hormone levels and thus discouraging hormone-sensitive cancers.[92]
Autoimmune diseases
There is an association between celiac disease and an increased risk of all cancers. People with untreated celiac disease have a higher risk, but this risk decreases with time after diagnosis and strict treatment. This may be due to the adoption of a gluten-free diet, which seems to have a protective role against development of malignancy in people with celiac disease. However, the delay in diagnosis and initiation of a gluten-free diet seems to increase the risk of malignancies.[94] Rates of gastrointestinal cancers are increased in people with Crohn's disease and ulcerative colitis, due to chronic inflammation. Immunomodulators and biologic agents used to treat these diseases may promote developing extra-intestinal malignancies.[95]
Pathophysiology
Genetics
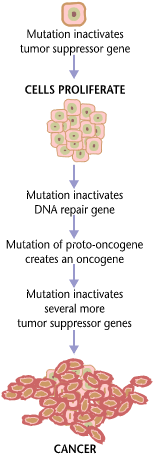
Cancer is fundamentally a disease of tissue growth regulation. For a normal cell to transform into a cancer cell, the genes that regulate cell growth and differentiation must be altered.[96]
The affected genes are divided into two broad categories. Oncogenes are genes that promote cell growth and reproduction. Tumor suppressor genes are genes that inhibit cell division and survival. Malignant transformation can occur through the formation of novel oncogenes, the inappropriate over-expression of normal oncogenes, or by the under-expression or disabling of tumor suppressor genes. Typically, changes in multiple genes are required to transform a normal cell into a cancer cell.[97]
Genetic changes can occur at different levels and by different mechanisms. The gain or loss of an entire chromosome can occur through errors in mitosis. More common are mutations, which are changes in the nucleotide sequence of genomic DNA.
Large-scale mutations involve the deletion or gain of a portion of a chromosome. Genomic amplification occurs when a cell gains copies (often 20 or more) of a small chromosomal locus, usually containing one or more oncogenes and adjacent genetic material. Translocation occurs when two separate chromosomal regions become abnormally fused, often at a characteristic location. A well-known example of this is the Philadelphia chromosome, or translocation of chromosomes 9 and 22, which occurs in chronic myelogenous leukemia and results in production of the BCR-abl fusion protein, an oncogenic tyrosine kinase.
Small-scale mutations include point mutations, deletions, and insertions, which may occur in the promoter region of a gene and affect its expression, or may occur in the gene's coding sequence and alter the function or stability of its protein product. Disruption of a single gene may also result from integration of genomic material from a DNA virus or retrovirus, leading to the expression of viral oncogenes in the affected cell and its descendants.
Replication of the data contained within the DNA of living cells will probabilistically result in some errors (mutations). Complex error correction and prevention are built into the process and safeguard the cell against cancer. If a significant error occurs, the damaged cell can self-destruct through programmed cell death, termed apoptosis. If the error control processes fail, then the mutations will survive and be passed along to daughter cells.
Some environments make errors more likely to arise and propagate. Such environments can include the presence of disruptive substances called carcinogens, repeated physical injury, heat, ionising radiation, or hypoxia.[98]
The errors that cause cancer are self-amplifying and compounding, for example:
- A mutation in the error-correcting machinery of a cell might cause that cell and its children to accumulate errors more rapidly.
- A further mutation in an oncogene might cause the cell to reproduce more rapidly and more frequently than its normal counterparts.
- A further mutation may cause loss of a tumor suppressor gene, disrupting the apoptosis signaling pathway and immortalizing the cell.
- A further mutation in the signaling machinery of the cell might send error-causing signals to nearby cells.
The transformation of a normal cell into cancer is akin to a chain reaction caused by initial errors, which compound into more severe errors, each progressively allowing the cell to escape more controls that limit normal tissue growth. This rebellion-like scenario is an undesirable survival of the fittest, where the driving forces of evolution work against the body's design and enforcement of order. Once cancer has begun to develop, this ongoing process, termed clonal evolution, drives progression towards more invasive stages.[99] Clonal evolution leads to intra-tumour heterogeneity (cancer cells with heterogeneous mutations) that complicates designing effective treatment strategies and requires an evolutionary approach to designing treatment.
Characteristic abilities developed by cancers are divided into categories, specifically evasion of apoptosis, self-sufficiency in growth signals, insensitivity to anti-growth signals, sustained angiogenesis, limitless replicative potential, metastasis, reprogramming of energy metabolism and evasion of immune destruction.[30][31]
Epigenetics
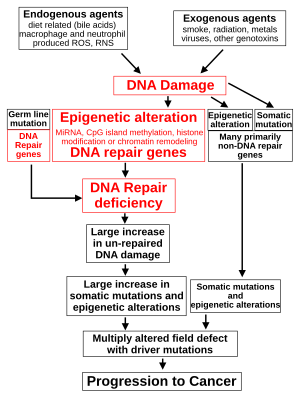
The classical view of cancer is a set of diseases driven by progressive genetic abnormalities that include mutations in tumor-suppressor genes and oncogenes, and in chromosomal abnormalities. A role for epigenetic alterations was identified in the early 21st century.[100]
Epigenetic alterations are functionally relevant modifications to the genome that do not change the nucleotide sequence. Examples of such modifications are changes in DNA methylation (hypermethylation and hypomethylation), histone modification[101] and changes in chromosomal architecture (caused by inappropriate expression of proteins such as HMGA2 or HMGA1).[102] Each of these alterations regulates gene expression without altering the underlying DNA sequence. These changes may remain through cell divisions, endure for multiple generations, and can be considered as equivalent to mutations.
Epigenetic alterations occur frequently in cancers. As an example, one study listed protein coding genes that were frequently altered in their methylation in association with colon cancer. These included 147 hypermethylated and 27 hypomethylated genes. Of the hypermethylated genes, 10 were hypermethylated in 100% of colon cancers and many others were hypermethylated in more than 50% of colon cancers.[103]
While epigenetic alterations are found in cancers, the epigenetic alterations in DNA repair genes, causing reduced expression of DNA repair proteins, may be of particular importance. Such alterations may occur early in progression to cancer and are a possible cause of the genetic instability characteristic of cancers.[104][105][106]
Reduced expression of DNA repair genes disrupts DNA repair. This is shown in the figure at the 4th level from the top. (In the figure, red wording indicates the central role of DNA damage and defects in DNA repair in progression to cancer.) When DNA repair is deficient DNA damage remains in cells at a higher than usual level (5th level) and causes increased frequencies of mutation and/or epimutation (6th level). Mutation rates increase substantially in cells defective in DNA mismatch repair[107][108] or in homologous recombinational repair (HRR).[109] Chromosomal rearrangements and aneuploidy also increase in HRR defective cells.[110]
Higher levels of DNA damage cause increased mutation (right side of figure) and increased epimutation. During repair of DNA double strand breaks, or repair of other DNA damage, incompletely cleared repair sites can cause epigenetic gene silencing.[111][112]
Deficient expression of DNA repair proteins due to an inherited mutation can increase cancer risks. Individuals with an inherited impairment in any of 34 DNA repair genes (see article DNA repair-deficiency disorder) have increased cancer risk, with some defects ensuring a 100% lifetime chance of cancer (e.g. p53 mutations).[113] Germ line DNA repair mutations are noted on the figure's left side. However, such germline mutations (which cause highly penetrant cancer syndromes) are the cause of only about 1 percent of cancers.[114]
In sporadic cancers, deficiencies in DNA repair are occasionally caused by a mutation in a DNA repair gene but are much more frequently caused by epigenetic alterations that reduce or silence expression of DNA repair genes. This is indicated in the figure at the 3rd level. Many studies of heavy metal-induced carcinogenesis show that such heavy metals cause a reduction in expression of DNA repair enzymes, some through epigenetic mechanisms. DNA repair inhibition is proposed to be a predominant mechanism in heavy metal-induced carcinogenicity. In addition, frequent epigenetic alterations of the DNA sequences code for small RNAs called microRNAs (or miRNAs). miRNAs do not code for proteins, but can "target" protein-coding genes and reduce their expression.
Cancers usually arise from an assemblage of mutations and epimutations that confer a selective advantage leading to clonal expansion (see Field defects in progression to cancer). Mutations, however, may not be as frequent in cancers as epigenetic alterations. An average cancer of the breast or colon can have about 60 to 70 protein-altering mutations, of which about three or four may be "driver" mutations and the remaining ones may be "passenger" mutations.[115]
Metastasis
Metastasis is the spread of cancer to other locations in the body. The dispersed tumors are called metastatic tumors, while the original is called the primary tumor. Almost all cancers can metastasize.[39] Most cancer deaths are due to cancer that has metastasized.[40]
Metastasis is common in the late stages of cancer and it can occur via the blood or the lymphatic system or both. The typical steps in metastasis are local invasion, intravasation into the blood or lymph, circulation through the body, extravasation into the new tissue, proliferation and angiogenesis. Different types of cancers tend to metastasize to particular organs, but overall the most common places for metastases to occur are the lungs, liver, brain and the bones.[39]
Metabolism
Normal cells typically generate only about 30% of energy from glycolysis,[116] whereas most cancers rely on glycolysis for energy production (Warburg effect).[117][118] But a minority of cancer types rely on oxidative phosphorylation as the primary energy source, including lymphoma, leukemia, and endometrial cancer.[119] Even in these cases, however, the use of glycolysis as an energy source rarely exceeds 60%.[116] A few cancers use glutamine as the major energy source, partly because it provides nitrogen required for nucleotide (DNA, RNA) synthesis.[120] Cancer stem cells often use oxidative phosphorylation or glutamine as a primary energy source.[121]
Diagnosis
Most cancers are initially recognized either because of the appearance of signs or symptoms or through screening.[122] Neither of these leads to a definitive diagnosis, which requires the examination of a tissue sample by a pathologist.[123] People with suspected cancer are investigated with medical tests. These commonly include blood tests, X-rays, (contrast) CT scans and endoscopy.
The tissue diagnosis from the biopsy indicates the type of cell that is proliferating, its histological grade, genetic abnormalities and other features. Together, this information is useful to evaluate the prognosis and to choose the best treatment.
Cytogenetics and immunohistochemistry are other types of tissue tests. These tests provide information about molecular changes (such as mutations, fusion genes and numerical chromosome changes) and may thus also indicate the prognosis and best treatment.
Cancer diagnosis can cause psychological distress and psychosocial interventions, such as talking therapy, may help people with this.[124] Some people choose to disclose the diagnosis widely; others prefer to keep the information private, especially shortly after the diagnosis, or to disclose it only partially or to selected people.[125]
Classification

Cancers are classified by the type of cell that the tumor cells resemble and is therefore presumed to be the origin of the tumor. These types include:
- Carcinoma: Cancers derived from epithelial cells. This group includes many of the most common cancers and include nearly all those in the breast, prostate, lung, pancreas and colon. Most of these are of the adenocarcinoma type, which means that the cancer has gland-like differentiation.
- Sarcoma: Cancers arising from connective tissue (i.e. bone, cartilage, fat, nerve), each of which develops from cells originating in mesenchymal cells outside the bone marrow.
- Lymphoma and leukemia: These two classes arise from hematopoietic (blood-forming) cells that leave the marrow and tend to mature in the lymph nodes and blood, respectively.[126]
- Germ cell tumor: Cancers derived from pluripotent cells, most often presenting in the testicle or the ovary (seminoma and dysgerminoma, respectively).
- Blastoma: Cancers derived from immature "precursor" cells or embryonic tissue.
Cancers are usually named using -carcinoma, -sarcoma or -blastoma as a suffix, with the Latin or Greek word for the organ or tissue of origin as the root. For example, cancers of the liver parenchyma arising from malignant epithelial cells is called hepatocarcinoma, while a malignancy arising from primitive liver precursor cells is called a hepatoblastoma and a cancer arising from fat cells is called a liposarcoma. For some common cancers, the English organ name is used. For example, the most common type of breast cancer is called ductal carcinoma of the breast. Here, the adjective ductal refers to the appearance of cancer under the microscope, which suggests that it has originated in the milk ducts.
Benign tumors (which are not cancers) are named using -oma as a suffix with the organ name as the root. For example, a benign tumor of smooth muscle cells is called a leiomyoma (the common name of this frequently occurring benign tumor in the uterus is fibroid). Confusingly, some types of cancer use the -noma suffix, examples including melanoma and seminoma.
Some types of cancer are named for the size and shape of the cells under a microscope, such as giant cell carcinoma, spindle cell carcinoma and small-cell carcinoma.
- An invasive ductal carcinoma of the breast (pale area at the center) surrounded by spikes of whitish scar tissue and yellow fatty tissue
- An invasive colorectal carcinoma (top center) in a colectomy specimen
- A squamous-cell carcinoma (the whitish tumor) near the bronchi in a lung specimen
- A large invasive ductal carcinoma in a mastectomy specimen
- Squamous cell carcinoma with typical histopathology features.
- Histopathology of small-cell carcinoma, with typical findings.[127]
Prevention


Cancer prevention is defined as active measures to decrease cancer risk.[129] The vast majority of cancer cases are due to environmental risk factors. Many of these environmental factors are controllable lifestyle choices. Thus, cancer is generally preventable.[130] Between 70% and 90% of common cancers are due to environmental factors and therefore potentially preventable.[131]
Greater than 30% of cancer deaths could be prevented by avoiding risk factors including: tobacco, excess weight/obesity, poor diet, physical inactivity, alcohol, sexually transmitted infections and air pollution.[132] Further, poverty could be considered as an indirect risk factor in human cancers.[133] Not all environmental causes are controllable, such as naturally occurring background radiation and cancers caused through hereditary genetic disorders and thus are not preventable via personal behavior.
In 2019, ~44% of all cancer deaths – or ~4.5 M deaths or ~105 million lost disability-adjusted life years – were due to known clearly preventable risk factors, led by smoking, alcohol use and high BMI, according to a GBD systematic analysis.[128]
Dietary
While many dietary recommendations have been proposed to reduce cancer risks, the evidence to support them is not definitive.[14][134] The primary dietary factors that increase risk are obesity and alcohol consumption. Diets low in fruits and vegetables and high in red meat have been implicated but reviews and meta-analyses do not come to a consistent conclusion.[135][136] A 2014 meta-analysis found no relationship between fruits and vegetables and cancer.[137] Coffee is associated with a reduced risk of liver cancer.[138] Studies have linked excessive consumption of red or processed meat to an increased risk of breast cancer, colon cancer and pancreatic cancer, a phenomenon that could be due to the presence of carcinogens in meats cooked at high temperatures.[139][140] In 2015 the IARC reported that eating processed meat (e.g., bacon, ham, hot dogs, sausages) and, to a lesser degree, red meat was linked to some cancers.[141][142]
Dietary recommendations for cancer prevention typically include an emphasis on vegetables, fruit, whole grains and fish and an avoidance of processed and red meat (beef, pork, lamb), animal fats, pickled foods and refined carbohydrates.[14][134]
Medication
Medications can be used to prevent cancer in a few circumstances.[143] In the general population, NSAIDs reduce the risk of colorectal cancer; however, due to cardiovascular and gastrointestinal side effects, they cause overall harm when used for prevention.[144] Aspirin has been found to reduce the risk of death from cancer by about 7%.[145] COX-2 inhibitors may decrease the rate of polyp formation in people with familial adenomatous polyposis; however, it is associated with the same adverse effects as NSAIDs.[146] Daily use of tamoxifen or raloxifene reduce the risk of breast cancer in high-risk women.[147] The benefit versus harm for 5-alpha-reductase inhibitor such as finasteride is not clear.[148]
Vitamin supplementation does not appear to be effective at preventing cancer.[149] While low blood levels of vitamin D are correlated with increased cancer risk,[150][151][152] whether this relationship is causal and vitamin D supplementation is protective is not determined.[153][154] One 2014 review found that supplements had no significant effect on cancer risk.[154] Another 2014 review concluded that vitamin D3 may decrease the risk of death from cancer (one fewer death in 150 people treated over 5 years), but concerns with the quality of the data were noted.[155]
Beta-Carotene supplementation increases lung cancer rates in those who are high risk.[156] Folic acid supplementation is not effective in preventing colon cancer and may increase colon polyps.[157] Selenium supplementation has not been shown to reduce the risk of cancer.[158]
Vaccination
Vaccines have been developed that prevent infection by some carcinogenic viruses.[159] Human papillomavirus vaccine (Gardasil and Cervarix) decrease the risk of developing cervical cancer.[159] The hepatitis B vaccine prevents infection with hepatitis B virus and thus decreases the risk of liver cancer.[159] The administration of human papillomavirus and hepatitis B vaccinations is recommended where resources allow.[160]
Скрининг
В отличие от диагностических усилий, основанных на симптомах и медицинских признаках , скрининг рака предполагает усилия по обнаружению рака после его формирования, но до появления каких-либо заметных симптомов. [161] Это может включать медицинский осмотр , крови или анализы мочи или медицинскую визуализацию . [161]
Скрининг рака недоступен для многих видов рака. Даже если тесты доступны, их можно рекомендовать не всем. Всеобщий скрининг или массовый скрининг предполагает проверку всех. [162] Выборочный скрининг выявляет людей, которые подвергаются более высокому риску, например, людей с семейным анамнезом. [162] При определении того, перевешивают ли преимущества скрининга риски и затраты на скрининг, учитывается несколько факторов. [161] Эти факторы включают в себя:
- Возможный вред от скринингового теста: например, рентгеновские снимки связаны с воздействием потенциально вредного ионизирующего излучения.
- Вероятность того, что тест правильно определит рак
- Вероятность наличия рака: скрининг обычно бесполезен при редких видах рака.
- Возможный вред от последующих процедур
- Доступно ли подходящее лечение
- Улучшает ли раннее выявление результаты лечения?
- Потребуется ли когда-нибудь раку лечение
- Приемлем ли тест для людей: Если скрининговый тест слишком обременителен (например, крайне болезненный), люди откажутся от него. [162]
- Расходы
Рекомендации
Целевая группа США по профилактическим услугам
( Рабочая группа по профилактическим услугам США USPSTF) выпускает рекомендации по различным видам рака:
- Настоятельно рекомендует проводить скрининг рака шейки матки у женщин, ведущих половую жизнь и имеющих шейку матки , по крайней мере, до 65 лет. [163]
- Рекомендуют американцам проходить обследование на колоректальный рак с помощью анализа кала на скрытую кровь , ректороманоскопию или колоноскопию , начиная с 50 до 75 лет. [164]
- Доказательств недостаточно, чтобы рекомендовать или не рекомендовать скрининг на рак кожи . [165] рак полости рта , [166] рак легких, [167] или рак простаты у мужчин до 75 лет. [168]
- не рекомендуется Рутинный скрининг на рак мочевого пузыря . [169] рак яичка , [170] рак яичников , [171] рак поджелудочной железы , [172] или рак простаты . [173]
- Рекомендует маммографию для скрининга рака молочной железы каждые два года в возрасте 50–74 лет, но не рекомендует ни самообследование молочных желез , ни клиническое обследование молочных желез . [174] 2013 года Кокрейновский обзор пришел к выводу, что скрининг рака молочной железы с помощью маммографии не оказал влияния на снижение смертности из-за гипердиагностики и чрезмерного лечения. [175]
Япония
Скрининг рака желудка проводится с помощью флюорографии из-за высокой заболеваемости там. [25]
Генетическое тестирование
| Ген | Типы рака |
|---|---|
| БРЦА1 , БРЦА2 | Грудь, яичники, поджелудочная железа |
| HNPCC , MLH1 , MSH2 , MSH6 , PMS1 , PMS2 | Толстая кишка, матка, тонкая кишка, желудок, мочевыводящие пути |
генетическое тестирование лицам с высоким риском развития некоторых видов рака. Неофициальные группы рекомендуют [160] [176] Носители этих мутаций могут затем подвергнуться усиленному надзору, химиопрофилактике или профилактическому хирургическому вмешательству, чтобы снизить последующий риск. [176]
Управление
Существует множество вариантов лечения рака. К первичным из них относятся хирургическое вмешательство, химиотерапия , лучевая терапия , гормональная терапия , таргетная терапия и паллиативная помощь . Выбор метода лечения зависит от типа, местоположения и степени рака, а также от состояния здоровья и предпочтений пациента. Цель лечения может быть лечебной, а может и не быть. [ нужна ссылка ]
Химиотерапия
Химиотерапия – это лечение рака одним или несколькими цитотоксическими противоопухолевыми препаратами ( химиотерапевтическими агентами ) в рамках стандартизированного режима . Этот термин охватывает множество лекарств, которые разделены на широкие категории, такие как алкилирующие агенты и антиметаболиты . [177] Традиционные химиотерапевтические агенты действуют, убивая клетки, которые быстро делятся, что является критическим свойством большинства раковых клеток.
Было обнаружено, что использование комбинированных цитостатических препаратов лучше, чем использование одного препарата, процесс, называемый комбинированной терапией , который имеет преимущество в статистике выживаемости и реакции на опухоль, а также в прогрессировании заболевания. [178] Кокрейновский обзор пришел к выводу, что комбинированная терапия более эффективна для лечения метастазирующего рака молочной железы. Однако в целом неясно, приводит ли комбинированная химиотерапия к лучшим результатам для здоровья, если учитывать как выживаемость, так и токсичность. [179]
Таргетная терапия — это форма химиотерапии, направленная на специфические молекулярные различия между раковыми и нормальными клетками. Первые таргетные методы лечения блокировали молекулу рецептора эстрогена , подавляя рост рака молочной железы. Другим распространенным примером является класс ингибиторов Bcr-Abl , которые используются для лечения хронического миелогенного лейкоза (ХМЛ). [4] В настоящее время существуют таргетные методы лечения многих наиболее распространенных типов рака, включая рак мочевого пузыря , рак молочной железы, колоректальный рак , рак почки , лейкемию , рак печени , рак легких, лимфому , рак поджелудочной железы , рак простаты , рак кожи и рак щитовидной железы . а также другие виды рака. [180]
Эффективность химиотерапии зависит от типа рака и стадии. В сочетании с хирургическим вмешательством химиотерапия оказалась полезной при таких типах рака, как рак молочной железы, колоректальный рак, рак поджелудочной железы , остеогенная саркома , рак яичек , рак яичников и некоторые виды рака легких. [181] Химиотерапия излечивает некоторые виды рака, например, некоторые лейкемии . [182] [183] неэффективен при некоторых опухолях головного мозга , [184] и ненужно в других случаях, например, при большинстве немеланомных видов рака кожи . [185] Эффективность химиотерапии часто ограничивается ее токсичностью для других тканей организма. Даже если химиотерапия не обеспечивает окончательного излечения, может быть полезно уменьшить такие симптомы, как боль, или уменьшить размер неоперабельной опухоли в надежде, что операция станет возможной в будущем.
Радиация
Лучевая терапия предполагает использование ионизирующего излучения в попытке вылечить или улучшить симптомы. Он действует путем повреждения ДНК раковой ткани, вызывая митотическую катастрофу, приводящую к гибели раковых клеток. [186] Чтобы сохранить нормальные ткани (например, кожу или органы, через которые радиация должна пройти для лечения опухоли), лучи определенной формы направляются под разными углами воздействия и пересекаются с опухолью, обеспечивая там гораздо большую дозу, чем в окружающей здоровой ткани. . Как и в случае с химиотерапией, раковые заболевания по-разному реагируют на лучевую терапию. [187] [188] [189]
Лучевая терапия применяется примерно в половине случаев. Излучение может быть как от внутренних источников ( брахитерапия ), так и от внешних источников. Излучение чаще всего представляет собой рентгеновские лучи низкой энергии для лечения рака кожи, тогда как рентгеновские лучи более высокой энергии используются для лечения рака в организме. [190] Лучевая терапия обычно используется в дополнение к хирургическому вмешательству и/или химиотерапии. При некоторых типах рака, таких как ранний рак головы и шеи , его можно использовать отдельно. [191] Было показано, что лучевая терапия после операции по поводу метастазов в головной мозг не улучшает общую выживаемость пациентов по сравнению с только хирургическим вмешательством. [192] Было обнаружено, что при болезненных метастазах в кости лучевая терапия эффективна примерно у 70% пациентов. [191]
Операция
Хирургическое вмешательство является основным методом лечения большинства изолированных солидных раковых заболеваний и может играть роль в паллиативном лечении и продлении выживаемости. Обычно это важная часть окончательного диагноза и определения стадии опухолей, поскольку обычно требуется биопсия. При локализованном раке хирургическим путем обычно пытаются удалить всю массу вместе, в некоторых случаях, с лимфатическими узлами в этой области. Для некоторых видов рака этого достаточно, чтобы устранить рак. [181]
Паллиативная помощь
Паллиативная помощь – это лечение, целью которого является улучшение самочувствия пациента и которое может сочетаться с попыткой лечения рака. Паллиативная помощь включает в себя действия по уменьшению физических, эмоциональных, духовных и психосоциальных страданий. В отличие от лечения, направленного на непосредственное уничтожение раковых клеток, основной целью паллиативной помощи является улучшение качества жизни .
Люди на всех стадиях лечения рака обычно получают паллиативную помощь. В некоторых случаях медицинских специальностей профессиональные организации рекомендуют пациентам и врачам лечить рак только паллиативной помощью. [193] Это касается пациентов, которые: [194]
- отображать низкий статус работоспособности , подразумевающий ограниченную способность заботиться о себе [193]
- не получил никакой пользы от предшествующего лечения, основанного на фактических данных [193]
- не имеют права участвовать в каком-либо соответствующем клиническом исследовании [193]
- нет убедительных доказательств того, что лечение будет эффективным [193]
Паллиативную помощь можно спутать с хосписом , и поэтому она показана только тогда, когда люди приближаются к концу жизни . Как и хосписная помощь, паллиативная помощь направлена на то, чтобы помочь пациенту справиться с его неотложными потребностями и повысить комфорт. В отличие от хосписной помощи, паллиативная помощь не требует от людей прекращения лечения, направленного на рак.
Во многих национальных медицинских руководствах рекомендуется ранняя паллиативная помощь пациентам, у которых рак вызвал тревожные симптомы или которым нужна помощь в борьбе с болезнью. Пациентам, у которых впервые диагностировано метастатическое заболевание, может быть немедленно показана паллиативная помощь. Паллиативная помощь показана пациентам с прогнозом менее 12 месяцев жизни даже при агрессивном лечении. [195] [196] [197]
Иммунотерапия
различные методы лечения с использованием иммунотерапии или помогающие ей , стимулирующие иммунную систему С 1997 года стали использоваться бороться с раком. Подходы включают антитела , терапию контрольных точек и перенос адоптивных клеток . [198]
Лазерная терапия
Лазерная терапия использует свет высокой интенсивности для лечения рака путем уменьшения или разрушения опухолей или предраковых новообразований. Лазеры чаще всего используются для лечения поверхностных раковых опухолей, расположенных на поверхности тела или на слизистой оболочке внутренних органов. Он используется для лечения базальноклеточного рака кожи и самых ранних стадий других заболеваний, таких как рак шейки матки, полового члена, влагалища, вульвы и немелкоклеточный рак легких. Его часто комбинируют с другими методами лечения, такими как хирургия, химиотерапия или лучевая терапия. Лазерно-индуцированная интерстициальная термотерапия (ЛИТТ), или интерстициальная лазерная фотокоагуляция , использует лазеры для лечения некоторых видов рака с помощью гипертермии, которая использует тепло для уменьшения опухолей путем повреждения или уничтожения раковых клеток. Лазер более точен, чем хирургическое вмешательство, и вызывает меньше повреждений, боли, кровотечений, отеков и рубцов. Недостатком является то, что хирурги должны иметь специальную подготовку. Это может быть дороже, чем другие методы лечения. [199]
Альтернативная медицина
Дополнительные и альтернативные методы лечения рака представляют собой разнообразную группу методов лечения, методов и продуктов, которые не являются частью традиционной медицины. [200] «Дополнительная медицина» относится к методам и веществам, используемым наряду с традиционной медициной, а «альтернативная медицина» относится к соединениям, используемым вместо традиционной медицины. [201] Большинство дополнительных и альтернативных лекарств от рака не изучались и не тестировались с использованием традиционных методов, таких как клинические испытания. Некоторые альтернативные методы лечения были исследованы и оказались неэффективными, но все еще продолжают продаваться и продвигаться. Исследователь рака Эндрю Дж. Викерс заявил: «Ярлык «недоказанный» не подходит для таких методов лечения; настало время заявить, что многие альтернативные методы лечения рака были «опровергнуты». [202]
Прогноз

Показатели выживаемости варьируются в зависимости от типа рака и стадии, на которой он диагностирован: от выживаемости большинства до полной смертности через пять лет после постановки диагноза. После метастазирования рака прогноз обычно становится намного хуже. Около половины пациентов, получающих лечение от инвазивного рака (за исключением рака in situ и немеланомного рака кожи), умирают от этого рака или от его лечения. [25] Большинство смертей от рака происходит из-за метастазов первичной опухоли. [204]
выживаемость хуже В развивающихся странах , [25] отчасти потому, что наиболее распространенные там виды рака труднее поддаются лечению, чем те, которые наблюдаются в развитых странах . [205]
У тех, кто выжил после рака, развивается второй первичный рак примерно в два раза чаще, чем у тех, кто никогда не диагностировался. [206] Считается, что повышенный риск обусловлен случайной вероятностью развития любого рака, вероятностью выживания при первом раке, теми же факторами риска, которые вызвали первый рак, нежелательными побочными эффектами лечения первого рака (особенно лучевой терапии) и лучшее соблюдение скрининга. [206]
Прогнозирование краткосрочной или долгосрочной выживаемости зависит от многих факторов. Наиболее важными являются тип рака, возраст пациента и общее состояние здоровья. Те, кто слаб и имеет другие проблемы со здоровьем, имеют более низкие показатели выживаемости, чем здоровые люди. Долгожители вряд ли проживут пять лет, даже если лечение окажется успешным. Люди, которые сообщают о более высоком качестве жизни, как правило, выживают дольше. [207] Люди с более низким качеством жизни могут страдать от депрессии и других осложнений и/или прогрессирования заболевания, что ухудшает как качество, так и количество жизни. Кроме того, пациенты с худшим прогнозом могут страдать депрессией или сообщать о более низком качестве жизни, поскольку они считают, что их состояние может быть фатальным.
У больных раком повышен риск образования тромбов в венах , что может быть опасным для жизни. [208] Использование препаратов, разжижающих кровь , таких как гепарин, снижает риск образования тромбов, но не доказано, что оно увеличивает выживаемость у людей, больных раком. [208] Люди, которые принимают препараты, разжижающие кровь, также имеют повышенный риск кровотечений. [208]
Хотя некоторые формы рака, даже на поздних стадиях, встречаются крайне редко, они могут излечиться спонтанно. Это явление известно как спонтанная ремиссия . [209]
Эпидемиология
Графики недоступны по техническим причинам. Дополнительную информацию можно найти на Phabricator и на MediaWiki.org . |
По оценкам, в 2018 году во всем мире произойдет 18,1 миллиона новых случаев рака и 9,6 миллиона смертей. [211] Около 20% мужчин и 17% женщин в какой-то момент заболеют раком, а 13% мужчин и 9% женщин умрут от него. [211]
около 12,7 миллионов случаев рака В 2008 году было диагностировано (исключая немеланомный рак кожи и другие неинвазивные виды рака). [25] а в 2010 году умерло почти 7,98 миллиона человек. [212] Рак является причиной примерно 16% смертей. Самый распространенный по состоянию на 2018 год. [update] Это рак легких (1,76 миллиона смертей), колоректальный рак (860 000), рак желудка (780 000), рак печени (780 000) и рак молочной железы (620 000). [2] Это делает инвазивный рак ведущей причиной смертности в развитых странах и второй в развивающихся странах . [25] Более половины случаев приходится на развивающиеся страны. [25]
В 1990 году число смертей от рака составило 5,8 миллиона человек. [212] Смертность растет, главным образом, из-за увеличения продолжительности жизни и изменения образа жизни в развивающихся странах. [25] Наиболее значимым фактором риска развития рака является возраст. [213] Хотя рак может возникнуть в любом возрасте, большинство пациентов с инвазивным раком старше 65 лет. [213] По словам исследователя рака Роберта А. Вайнберга : «Если бы мы жили достаточно долго, рано или поздно мы все заболели бы раком». [214] В некоторой степени связь между старением и раком связана с иммуностарением . [215] ошибки, накопленные в ДНК за всю жизнь [216] и возрастные изменения эндокринной системы . [217] Влияние старения на рак осложняется такими факторами, как повреждение ДНК и воспаление, способствующими развитию рака, а также такими факторами, как старение сосудов и эндокринные изменения, тормозящие его. [218]
Некоторые медленно растущие виды рака особенно распространены, но часто не смертельны. Аутопсийные исследования в Европе и Азии показали, что до 36% людей имеют невыявленный и очевидно безобидный рак щитовидной железы на момент смерти развивается рак простаты . и что у 80% мужчин к 80 годам [219] [220] Поскольку эти виды рака не приводят к смерти пациента, их выявление было бы скорее гипердиагностикой, чем полезной медицинской помощью.
Тремя наиболее распространенными видами рака у детей являются лейкемия (34%), опухоли головного мозга (23%) и лимфомы (12%). [221] В США рак поражает примерно 1 из 285 детей. [222] Уровень заболеваемости раком у детей увеличивался на 0,6% в год в период с 1975 по 2002 год в США. [223] и на 1,1% в год в период с 1978 по 1997 год в Европе. [221] Смертность от детского рака в США снизилась вдвое в период с 1975 по 2010 год. [222]
История

Рак существовал на протяжении всей истории человечества. [224] Самое раннее письменное упоминание о раке датируется ок. 1600 г. до н.э. в египетском папирусе Эдвина Смита и описывает рак молочной железы. [224] Гиппократ ( ок. 460 г. до н. э. — ок. 370 г. до н. э. ) описал несколько видов рака, назвав их греческим словом καρκίνος karkinos (краб или рак ). [224] Это название происходит от внешнего вида поверхности среза твердой злокачественной опухоли с «венами, растянутыми во все стороны, как у животного, краба, с ногами, откуда оно и получило свое название». [225] Гален заявил, что «рак груди назван так из-за воображаемого сходства с крабом, обусловленного боковыми расширениями опухоли и прилегающими расширенными венами». [226] : 738 Цельс ( ок. 25 г. до н. э. – 50 г. н. э.) перевел «каркинос» на латинский «рак» , что также означает «краб», и рекомендовал хирургическое вмешательство в качестве лечения. [224] Гален (2 век нашей эры) не соглашался с хирургическим вмешательством и рекомендовал вместо этого слабительные средства . [224] Эти рекомендации в основном сохранялись на протяжении 1000 лет. [224]
В 15, 16 и 17 веках врачам стало приемлемо препарировать тела, чтобы установить причину смерти. [227] Немецкий профессор Вильгельм Фабри считал, что рак молочной железы вызван сгустком молока в молочных протоках. Голландский профессор Франсуа де ла Бо Сильвиус , последователь Декарта , считал, что все болезни являются результатом химических процессов и что кислая лимфатическая причиной рака является жидкость. Его современник Николаес Тульп считал, что рак — это медленно распространяющийся яд, и пришел к выводу, что он заразен . [228]
В 1761 году врач Джон Хилл описал нюхание табака как причину рака носа. [227] За этим последовало сообщение в 1775 году британского хирурга Персивалла Потта о том, что карцинома трубочистов , рак мошонки , является распространенным заболеванием среди трубочистов . [229] С широким распространением микроскопа в 18 веке было обнаружено, что «раковый яд» распространяется от первичной опухоли через лимфатические узлы к другим участкам (« метастазирование »). Этот взгляд на заболевание впервые сформулировал английский хирург Кэмпбелл Де Морган между 1871 и 1874 годами. [230]
Общество и культура
Хотя многие заболевания (например, сердечная недостаточность) могут иметь худший прогноз, чем большинство случаев рака, рак является предметом широко распространенного страха и табу. Эвфемизм «длительная болезнь» для описания рака , приводящего к смерти, до сих пор широко используется в некрологах, вместо того, чтобы прямо называть болезнь, отражая очевидную стигму . [231] Рак также называют «словом на букву C»; [232] [233] [234] Служба поддержки рака Macmillan использует этот термин, чтобы попытаться уменьшить страх, связанный с этой болезнью. [235] В Нигерии одно местное название рака переводится на английский как «болезнь, которую невозможно вылечить». [236] Это глубокое убеждение в том, что рак обязательно является тяжелым и обычно смертельным заболеванием, отражено в системах, выбранных обществом для сбора статистики рака: наиболее распространенная форма рака — немеланомный рак кожи , на долю которого приходится около трети случаев рака во всем мире, но очень мало смертей [237] [238] — исключены из статистики рака именно потому, что они легко поддаются лечению и почти всегда излечиваются, часто за одну короткую амбулаторную процедуру. [239]
Западные концепции прав пациентов для людей, больных раком, включают обязанность полностью раскрывать медицинскую ситуацию человеку и право участвовать в совместном принятии решений таким образом, чтобы уважать собственные ценности человека. В других культурах предпочтение отдается другим правам и ценностям. Например, в большинстве африканских культур ценятся целые семьи, а не индивидуализм . В некоторых частях Африки диагноз обычно ставится настолько поздно, что излечение становится невозможным, а лечение, если оно вообще доступно, быстро разорит семью. В результате этих факторов африканские поставщики медицинских услуг, как правило, позволяют членам семьи решать, стоит ли, когда и как раскрывать диагноз, и они, как правило, делают это медленно и окольно, поскольку человек проявляет интерес и способность справиться с мрачными новостями. . [236] Люди из стран Азии и Южной Америки также склонны предпочитать более медленный и менее откровенный подход к раскрытию информации, чем это идеализируется в Соединенных Штатах и Западной Европе, и они считают, что иногда было бы предпочтительнее не сообщать им о диагнозе рака. [236] В целом раскрытие диагноза встречается чаще, чем в ХХ веке, но полное раскрытие прогноза не предлагается многим пациентам во всем мире. [236]
В Соединенных Штатах и некоторых других культурах рак рассматривается как болезнь, с которой необходимо «бороться», чтобы положить конец «гражданскому восстанию»; война раку В США была объявлена . Военные метафоры особенно распространены в описаниях последствий рака для человека, и они подчеркивают как состояние здоровья пациента, так и необходимость самому предпринять немедленные, решительные действия, а не откладывать, игнорировать или полностью полагаться на других. Военные метафоры также помогают рационализировать радикальные, деструктивные методы лечения. [240] [241] В 1970-х годах относительно популярным альтернативным методом лечения рака в США была специализированная форма разговорной терапии , основанная на идее, что рак вызывается плохим отношением. [242] Считалось, что люди с «раковой личностью» — депрессивные, подавленные, ненавидящие себя и боящиеся выражать свои эмоции — считали, что рак проявился через подсознательное желание. Некоторые психотерапевты утверждали, что лечение, направленное на изменение взглядов пациента на жизнь, излечит рак. [242] Помимо прочего, эта вера позволяла обществу обвинять жертву в том, что она вызвала рак («желая» его) или помешала его излечению (не став достаточно счастливым, бесстрашным и любящим человеком). [243] Это также увеличивало тревожность пациентов, поскольку они ошибочно полагали, что естественные эмоции печали, гнева или страха сокращают их жизнь. [243] Идея была высмеяна Сьюзан Зонтаг , которая опубликовала «Болезнь как метафора» во время выздоровления от рака молочной железы в 1978 году. [242] Хотя первоначальная идея в настоящее время обычно рассматривается как абсурд, она частично сохраняется в сокращенной форме с широко распространенным, но неверным убеждением, что сознательное развитие привычки позитивного мышления увеличит выживаемость. [243] Эта идея особенно сильна в культуре рака молочной железы . [243]
Одна из идей о том, почему людей, больных раком, обвиняют или стигматизируют, называемая заблуждением справедливого мира , заключается в том, что возложение вины за рак на действия или отношения пациента позволяет обвиняющим восстановить чувство контроля. Это основано на убеждении обвинителей в том, что мир по своей сути справедлив и поэтому любая опасная болезнь, такая как рак, должна быть своего рода наказанием за неправильный выбор, потому что в справедливом мире с хорошими людьми не случается ничего плохого. [244]
Экономический эффект
Общие расходы на здравоохранение при раке в США в 2015 году оценивались в 80,2 миллиарда долларов. [245] Несмотря на то, что расходы на здравоохранение, связанные с раком, увеличились в абсолютном выражении за последние десятилетия, доля расходов на лечение рака в период с 1960-х по 2004 год оставалась близкой к 5%. [246] [247] Аналогичная картина наблюдается в Европе, где около 6% всех расходов на здравоохранение тратится на лечение рака. [248] [249] Помимо расходов на здравоохранение и финансовой токсичности , рак вызывает косвенные затраты в виде потерь производительности из-за больничных, постоянной нетрудоспособности и инвалидности, а также преждевременной смерти в трудоспособном возрасте. Рак также приводит к расходам на неформальный уход. Косвенные затраты и затраты на неофициальную помощь обычно оцениваются как превышающие или равные затратам на здравоохранение при раке. [250] [249]
Рабочее место
(EEOC) включила рак в список защищенных состояний В Соединенных Штатах Комиссия по равным возможностям трудоустройства , главным образом из-за того, что рак может оказывать дискриминационное воздействие на работников. [251] Дискриминация на рабочем месте может возникнуть, если работодатель ошибочно полагает, что человек, больной раком, не способен выполнять работу должным образом, и может попросить больше отпуска по болезни, чем другие сотрудники. Работодатели также могут принимать решения о приеме на работу или увольнении на основании неправильных представлений о раковых заболеваниях, если таковые имеются. EEOC предоставляет работодателям рекомендации по проведению собеседований, а также списки возможных решений для оценки и адаптации сотрудников, больных раком. [251]
Влияние на развод
Исследование показало, что женщины примерно в шесть раз чаще разводятся вскоре после того, как у них диагностирован рак, по сравнению с мужчинами. [252] уровень разделения среди людей, переживших рак, показал корреляцию с расой, возрастом, доходом и сопутствующими заболеваниями . В исследовании [253] Обзор выявил несколько сниженный уровень разводов для большинства типов рака, а также отметил неоднородность исследований и методологические недостатки многих исследований влияния рака на развод. [254]
Исследовать

Поскольку рак – это класс болезней, [255] [256] маловероятно, что когда-либо будет создано единое « лекарство от рака », так же как не будет единого лечения от всех инфекционных заболеваний . [257] ингибиторы ангиогенеза Когда-то ошибочно считалось, что могут стать « серебряной пулей », применимой ко многим типам рака. [258] Ингибиторы ангиогенеза и другие противораковые средства используются в сочетании для снижения заболеваемости и смертности от рака. [259]
Экспериментальные методы лечения рака изучаются в клинических испытаниях для сравнения предлагаемого лечения с лучшими существующими методами лечения. Методы лечения, оказавшиеся успешными при одном типе рака, могут быть протестированы на других типах. [260] Диагностические тесты находятся в стадии разработки, чтобы лучше нацеливать правильное лечение на нужных пациентов, исходя из их индивидуальной биологии. [261]
Исследования рака фокусируются на следующих вопросах:
- Агенты (например, вирусы) и события (например, мутации), которые вызывают или способствуют генетическим изменениям в клетках, которым суждено стать раковыми.
- Точная природа генетического повреждения и гены, на которые оно влияет.
- Последствия этих генетических изменений для биологии клетки, как в формировании определяющих свойств раковой клетки, так и в содействии дополнительным генетическим событиям, которые приводят к дальнейшему прогрессированию рака.
Улучшение понимания молекулярной биологии и клеточной биологии благодаря исследованиям рака привело к появлению новых методов лечения рака с тех пор, как президент США Ричард Никсон объявил « войну раку » в 1971 году. С тех пор страна потратила более 200 миллиардов долларов на исследования рака, в том числе ресурсы государственного и частного секторов. [262] Уровень смертности от рака (с поправкой на численность и возраст населения) снизился на пять процентов в период с 1950 по 2005 год. [263]
Конкуренция за финансовые ресурсы, по-видимому, подавляет творчество, сотрудничество, принятие риска и оригинальное мышление, необходимые для фундаментальных открытий, неоправданно отдавая предпочтение исследованиям с низким уровнем риска, направленным на небольшие постепенные достижения, по сравнению с более рискованными и инновационными исследованиями. Другими последствиями конкуренции, по-видимому, являются многочисленные исследования с впечатляющими заявлениями, результаты которых невозможно воспроизвести, а также порочные стимулы, которые побуждают институты-получатели грантов расти без достаточных инвестиций в свои собственные преподаватели и оборудование. [264] [263] [265] [266]
Виротерапия , в которой используются конвертированные вирусы, изучается.
После пандемии COVID-19 возникли опасения, что исследования и лечение рака замедляются. [267] [268]
2 декабря 2023 года компания Nano Today опубликовала революционное открытие, касающееся «нанодронов, взаимодействующих с NK-клетками», для таргетного лечения рака. Разработка «нанодронов, взаимодействующих с NK-клетками», представляет собой значительный шаг вперед в лечении рака, демонстрируя, как передовые нанотехнологии и иммунотерапию можно объединить для нацеливания и уничтожения раковых клеток с беспрецедентной точностью. Эти нанодроны предназначены для использования силы естественных клеток-киллеров (NK), которые играют решающую роль в иммунном ответе организма против опухолей. Направляя эти NK-клетки конкретно на места опухолей, нанодроны могут эффективно концентрировать атаку иммунной системы на раковые клетки, что потенциально приводит к лучшим результатам для пациентов. [269]
Ключевая инновация здесь заключается в использовании систем на основе наночастиц белковых клеток. Эти системы спроектированы так, чтобы передавать сигналы, которые привлекают NK-клетки непосредственно к опухоли, преодолевая одну из основных проблем иммунотерапии рака: гарантировать, что иммунные клетки находят и атакуют только раковые клетки, не повреждая здоровые ткани. Такой целенаправленный подход не только повышает эффективность лечения, но и сводит к минимуму побочные эффекты, что является общей проблемой при лечении рака более широкого действия. [269]
Беременность
Рак поражает примерно 1 из 1000 беременных женщин. Наиболее распространенные виды рака, обнаруживаемые во время беременности, такие же, как и наиболее распространенные виды рака, встречающиеся у небеременных женщин в детородном возрасте: рак молочной железы, рак шейки матки, лейкемия, лимфома, меланома, рак яичников и колоректальный рак. [270]
Диагностировать новый рак у беременной женщины сложно, отчасти потому, что любые симптомы обычно считаются обычным дискомфортом, связанным с беременностью. В результате рак обычно обнаруживается на несколько более поздней стадии, чем в среднем. Некоторые процедуры визуализации, такие как МРТ (магнитно-резонансная томография), компьютерная томография , ультразвуковое исследование и маммография с защитой плода, считаются безопасными во время беременности; некоторые другие, такие как ПЭТ-сканирование , нет. [270]
Лечение в целом такое же, как и для небеременных женщин. Однако во время беременности обычно избегают облучения и радиоактивных препаратов, особенно если доза для плода может превышать 100 сГр. В некоторых случаях некоторые или все методы лечения откладываются до рождения, если рак диагностируется на поздних сроках беременности. Ранние роды часто используются для ускорения начала лечения. Хирургическое вмешательство в целом безопасно, но операции на органах малого таза в первом триместре могут привести к выкидышу. Некоторые методы лечения, особенно некоторые химиотерапевтические препараты, назначаемые в первом триместре , повышают риск врожденных дефектов и потери беременности (самопроизвольные аборты и мертворождения). [270]
Плановые аборты не требуются и при наиболее распространенных формах и стадиях рака не улучшают выживаемость матери. В некоторых случаях, например, при запущенном раке матки, беременность не может быть продолжена, а в других пациентка может прервать беременность, чтобы начать агрессивную химиотерапию. [270]
Некоторые методы лечения могут повлиять на способность матери рожать естественным путем или кормить грудью. [270] Рак шейки матки может потребовать родов путем кесарева сечения . Облучение груди снижает способность молочной железы вырабатывать молоко и увеличивает риск мастита . Кроме того, когда химиотерапия проводится после рождения, многие препараты попадают в грудное молоко, что может нанести вред ребенку. [270]
Другие животные
Ветеринарная онкология , специализирующаяся в основном на кошках и собаках, становится растущей специальностью в богатых странах, и здесь могут быть предложены основные формы лечения людей, такие как хирургия и лучевая терапия. Наиболее распространенные типы рака различаются, но бремя рака у домашних животных кажется таким же высоким, как и у людей. Животные, обычно грызуны, часто используются в исследованиях рака, а исследования естественных видов рака у более крупных животных могут принести пользу исследованиям рака у человека. [271]
Данные о диких животных по-прежнему ограничены. Тем не менее, исследование, опубликованное в 2022 году и изучавшее риск рака у (неодомашненных) млекопитающих в зоопарках, принадлежащих к 191 виду, 110 148 особям, продемонстрировало, что рак является повсеместным заболеванием млекопитающих и может возникнуть в любом месте филогении млекопитающих. [272] Это исследование также показало, что риск рака неравномерно распределен среди млекопитающих. Например, виды отряда Carnivora особенно склонны к заболеванию раком (например, более 25% дымчатых леопардов , ушастых лисиц и рыжих волков умирают от рака), в то время как копытные (особенно парнокопытные ), похоже, постоянно сталкиваются с раком. низкие риски рака.
У людей, не являющихся людьми, также было описано несколько типов трансмиссивного рака , при котором рак распространяется между животными путем передачи самих опухолевых клеток. Это явление наблюдается у собак с саркомой Стикера (также известной как трансмиссивная венерическая опухоль собак) и у тасманских дьяволов с опухолевой болезнью лица дьявола (DFTD). [273]
Ссылки
- ^ Перейти обратно: а б с «Рак – признаки и симптомы» . Выбор Национальной службы здравоохранения . Архивировано из оригинала 8 июня 2014 года . Проверено 10 июня 2014 г.
- ^ Перейти обратно: а б с д и ж г час я дж к "Рак" . Всемирная организация здравоохранения . 12 сентября 2018 года . Проверено 19 декабря 2018 г.
- ^ Перейти обратно: а б с д и ж г час Ананд П., Куннумаккара А.Б., Сундарам С., Харикумар К.Б., Таракан С.Т., Лай ОС и др. (сентябрь 2008 г.). «Рак — это предотвратимое заболевание, которое требует серьезных изменений образа жизни» . Фармацевтические исследования . 25 (9): 2097–116. дои : 10.1007/s11095-008-9661-9 . ПМЦ 2515569 . ПМИД 18626751 . (Ошибка: два : 10.1007/s11095-008-9690-4 , ПМИД 18626751 )
- ^ Перейти обратно: а б с «Таргетная терапия рака» . сайт рака . Национальный институт рака. 26 февраля 2018 года . Проверено 28 марта 2018 г.
- ^ Перейти обратно: а б «Информационные бюллетени SEER: все онкологические центры» . Национальный институт рака. Архивировано из оригинала 26 сентября 2010 года . Проверено 18 июня 2014 г.
- ^ Перейти обратно: а б с Кочарник Дж.М., Комптон К., Дин Ф.Е., Фу В., Гау Б.Л., Харви Дж.Д. и др. (март 2022 г.). «Заболеваемость раком, смертность, потерянные годы жизни, годы, прожитые с инвалидностью, и годы жизни с поправкой на инвалидность для 29 групп рака с 2010 по 2019 год: систематический анализ исследования глобального бремени болезней, 2019 год» . JAMA Онкология . 8 (3): 420–444. дои : 10.1001/jamaoncol.2021.6987 . ISSN 2374-2437 . ПМЦ 8719276 . ПМИД 34967848 .
- ^ Перейти обратно: а б с д «Определение рака» . Национальный институт рака. 17 сентября 2007 года . Проверено 28 марта 2018 г.
- ^ «Ожирение и риск рака» . Национальный институт рака. 3 января 2012 года. Архивировано из оригинала 4 июля 2015 года . Проверено 4 июля 2015 г.
- ^ Джаясекара Х., Макиннис Р.Дж., Комната R, Английский DR (май 2016 г.). «Длительное употребление алкоголя и риск рака молочной железы, верхних отделов пищеварительного тракта и колоректального рака: систематический обзор и метаанализ» . Алкоголь и алкоголизм . 51 (3): 315–30. дои : 10.1093/alcalc/agv110 . ПМИД 26400678 .
- ^ «Глобальное бремя рака, связанное с инфекциями, в 2018 году: анализ заболеваемости во всем мире – The Lancet Global Health» .
- ^ Перейти обратно: а б с д и Всемирный доклад о раке, 2014 год . Всемирная организация здравоохранения. 2014. стр. Глава 1.1. ISBN 978-92-832-0429-9 . Архивировано из оригинала 12 июля 2017 года.
- ^ «Наследственность и рак» . Американское онкологическое общество . Архивировано из оригинала 2 августа 2013 года . Проверено 22 июля 2013 г.
- ^ «Как диагностируется рак?» . Американское онкологическое общество . 29 января 2013 года. Архивировано из оригинала 14 июля 2014 года . Проверено 10 июня 2014 г.
- ^ Перейти обратно: а б с Куши Л.Х., Дойл С., Маккалоу М., Рок К.Л., Демарк-Ваннефрид В., Бандера Е.В. и др. (2012). «Руководство Американского онкологического общества по питанию и физической активности для профилактики рака: снижение риска развития рака с помощью здорового питания и физической активности» . CA: Журнал рака для врачей . 62 (1): 30–67. дои : 10.3322/caac.20140 . ПМИД 22237782 . S2CID 2067308 .
- ^ Паркин Д.М., Бойд Л., Уокер Л.С. (декабрь 2011 г.). «16. Доля рака, обусловленная образом жизни и факторами окружающей среды в Великобритании в 2010 году» . Британский журнал рака . 105 (Приложение 2): S77–81. дои : 10.1038/bjc.2011.489 . ПМК 3252065 . ПМИД 22158327 .
- ^ Перейти обратно: а б Всемирный доклад о раке, 2014 год . Всемирная организация здравоохранения. 2014. С. Глава 4.7. ISBN 978-92-832-0429-9 . Архивировано из оригинала 12 июля 2017 года.
- ^ Гётше ПК, Йоргенсен К.Дж. (июнь 2013 г.). «Скрининг рака молочной железы с помощью маммографии» . Кокрановская база данных систематических обзоров . 2013 (6): CD001877. дои : 10.1002/14651858.CD001877.pub5 . ПМК 6464778 . ПМИД 23737396 .
- ^ Перейти обратно: а б Всемирный доклад о раке, 2014 год . Всемирная организация здравоохранения. 2014. С. Глава 1.3. ISBN 978-92-832-0429-9 . Архивировано из оригинала 12 июля 2017 года.
- ^ ГБД и др. (Соавторы по вопросам заболеваемости и травматизма и распространенности) (8 октября 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и количество лет жизни с инвалидностью по 310 заболеваниям и травмам, 1990–2015 гг.: систематический анализ для исследования глобального бремени болезней 2015 г.» . Ланцет . 388 (10053): 1545–1602. дои : 10.1016/S0140-6736(16)31678-6 . ПМК 5055577 . ПМИД 27733282 .
- ^ Скиаковелли М., Шмидт С., Махер Э.Р., Фрецца С. (2020). «Метаболические факторы при наследственных раковых синдромах» . Ежегодный обзор биологии рака . 4 : 77–97. doi : 10.1146/annurev-cancerbio-030419-033612 .
- ^ Перейти обратно: а б Всемирный доклад о раке, 2014 год . Всемирная организация здравоохранения. 2014. стр. Глава 1.1. ISBN 978-92-832-0429-9 .
- ^ Перейти обратно: а б Сигел Р.Л., Миллер К.Д., Вагл Н.С., Джемал А. (январь 2023 г.). «Статистика рака, 2023» . КА . 73 (1): 17–48. дои : 10.3322/caac.21763 . ПМИД 36633525 .
- ^ Дубас Л.Е., Ingraffea A (февраль 2013 г.). «Немеланомный рак кожи». Клиники пластической хирургии лица Северной Америки . 21 (1): 43–53. дои : 10.1016/j.fsc.2012.10.003 . ПМИД 23369588 .
- ^ Чакир БЁ, Адамсон П., Чинги С. (ноябрь 2012 г.). «Эпидемиология и экономическое бремя немеланомного рака кожи». Клиники пластической хирургии лица Северной Америки . 20 (4): 419–422. дои : 10.1016/j.fsc.2012.07.004 . ПМИД 23084294 .
- ^ Перейти обратно: а б с д и ж г час Джемал А., Брей Ф., Центр ММ, Ферлей Дж., Уорд Э., Форман Д. (февраль 2011 г.). «Глобальная статистика рака» . КА . 61 (2): 69–90. дои : 10.3322/caac.20107 . ПМИД 21296855 . S2CID 30500384 .
- ^ Всемирный доклад 2014 . Всемирная организация здравоохранения. 2014. С. Глава 6.7. ISBN 978-92-832-0429-9 . Архивировано из оригинала 12 июля 2017 года.
- ^ "рак" . www.etymonline.com . Архивировано из оригинала 7 ноября 2022 года.
- ^ «Раковый словарь» . сайт рака . Американское онкологическое общество. Архивировано из оригинала 1 сентября 2013 года . Проверено 11 сентября 2013 г.
- ^ «Что такое рак?» . сайт рака . Национальный институт рака. 17 сентября 2007 года . Проверено 28 марта 2018 г.
- ^ Перейти обратно: а б с д Ханахан Д. , Вайнберг Р.А. (январь 2000 г.). «Признаки рака» . Клетка . 100 (1): 57–70. дои : 10.1016/S0092-8674(00)81683-9 . ПМИД 10647931 . S2CID 1478778 .
- ^ Перейти обратно: а б Ханахан Д., Вайнберг Р.А. (март 2011 г.). «Признаки рака: следующее поколение» . Клетка . 144 (5): 646–74. дои : 10.1016/j.cell.2011.02.013 . ПМИД 21376230 .
- ^ Перейти обратно: а б с Голландия Чп. 1
- ^ Ангиано Л., Майер Д.К., Пивен М.Л., Розенштейн Д. (июль – август 2012 г.). «Обзор литературы о самоубийствах у онкологических больных» . Уход за раком . 35 (4): Е14–26. дои : 10.1097/NCC.0b013e31822fc76c . ПМИД 21946906 . S2CID 45874503 .
- ^ О'Делл М., Стабблфилд М. (2009). Принципы и практика реабилитации рака . Нью-Йорк: Демос Медикал. п. 983. ИСБН 978-1-933864-33-4 .
- ^ Фирон К., Штрассер Ф., Анкер С.Д., Босеус И., Брюэра Е., Файнзингер Р.Л. и др. (май 2011 г.). «Определение и классификация раковой кахексии: международный консенсус». «Ланцет». Онкология . 12 (5): 489–95. дои : 10.1016/S1470-2045(10)70218-7 . ПМИД 21296615 .
- ^ «Одышка | Побочные эффекты, связанные с раком» . www.cancer.org . Проверено 10 октября 2023 г.
- ^ Дай С.М., Гупта А., Вальдфогель Дж.М., Шарма Р., Чжан А., Фелисиано Дж.Л. и др. (2020). Вмешательства при одышке у пациентов с поздними стадиями рака . Сравнительные обзоры эффективности AHRQ. Роквилл (Мэриленд): Агентство исследований и качества здравоохранения (США). ПМИД 33289989 .
- ^ Димитриадис Г.К., Ангелуси А., Вейкерт М.О., Рандева Х.С., Кальцас Г., Гроссман А. (июнь 2017 г.). «Паранеопластические эндокринные синдромы» . Эндокринный рак . 24 (6): 173–190 Р. дои : 10.1530/ERC-17-0036 . ПМИД 28341725 .
- ^ Перейти обратно: а б с д «Метастатический рак: вопросы и ответы» . Национальный институт рака. 12 мая 2015 года . Проверено 28 марта 2018 г.
- ^ Перейти обратно: а б «Что такое метастазирующий рак?» . Национальная комплексная онкологическая сеть . Архивировано из оригинала 7 июля 2013 года . Проверено 18 июля 2013 г.
- ^ «Почему рак так трудно вылечить?» . Возраст . 15 июля 2023 г. Проверено 17 июля 2023 г.
- ^ «Доля смертей от рака, связанных с табакокурением» . Наш мир в данных . Проверено 5 марта 2020 г.
- ^ Мантон К., Акушевич И., Кравченко Ю. (28 декабря 2008 г.). Структура смертности и заболеваемости раком среди населения США: междисциплинарный подход . Springer Science & Business Media. ISBN 978-0-387-78193-8 .
Термин «окружающая среда» относится не только к воздуху, воде и почве, но также к веществам и условиям дома и на рабочем месте, включая диету, курение, алкоголь, наркотики, воздействие химических веществ, солнечный свет, ионизирующее излучение, электромагнитные поля, инфекционные агенты, и т. д. Образ жизни, экономические и поведенческие факторы – все это аспекты нашей окружающей среды.
- ^ Ислами Ф., Годинг Зауэр А., Миллер К.Д., Сигел Р.Л., Федева С.А., Джейкобс Э.Дж. и др. (январь 2018 г.). «Доля и количество случаев рака и смертей, связанных с потенциально модифицируемыми факторами риска в Соединенных Штатах» . CA: Журнал рака для врачей . 68 (1): 31–54. дои : 10.3322/caac.21440 . ПМИД 29160902 .
- ^ Перейти обратно: а б Коэн С., Мерфи М.Л., Пратер А.А. (январь 2019 г.). «Десять удивительных фактов о стрессовых жизненных событиях и риске заболеваний» . Ежегодный обзор психологии . 70 : 577–597. doi : 10.1146/annurev-psych-010418-102857 . ПМК 6996482 . ПМИД 29949726 .
Самый убедительный вывод, полученный в результате десятилетий исследований стрессоров и рака, заключается в том, что стрессовые события могут быть связаны со снижением выживаемости при раке, но, вероятно, не связаны с заболеваемостью (Chida et al. 2008).
- ^ Хейккиля К., Нюберг С.Т., Теорелл Т., Франссон Э.И., Альфредссон Л., Бьорнер Дж.Б. и др. (февраль 2013 г.). «Рабочий стресс и риск рака: метаанализ 5700 случаев рака у 116 000 европейских мужчин и женщин» . БМЖ . 346 : ф165. дои : 10.1136/bmj.f165 . ПМК 3567204 . ПМИД 23393080 .
- ^ Перейти обратно: а б с д Стил С.Д., Пиллэй Н., Александров Л.Б. (июль 2022 г.). «Обзор мутационных и копийных сигнатур при раке человека» . Журнал патологии . 257 (4): 454–465. дои : 10.1002/путь.5912 . ПМЦ 9324981 . ПМИД 35420163 .
- ^ Толар Дж., Нелья Дж. П. (июнь 2003 г.). «Трансплацентарный и другие пути передачи рака между людьми». Журнал детской гематологии/онкологии . 25 (6): 430–4. дои : 10.1097/00043426-200306000-00002 . ПМИД 12794519 . S2CID 34197973 .
- ^ Бисальски Х.К., Буэно де Мескита Б., Чессон А., Хитил Ф., Гримбл Р., Хермус Р.Дж. и др. (1998). «Заявление Европейского консенсуса по раку легких: факторы риска и профилактика. Группа по раку легких» . CA: Журнал рака для врачей . 48 (3): 167–76, обсуждение 164–66. дои : 10.3322/canjclin.48.3.167 . ПМИД 9594919 . S2CID 20891885 .
- ^ Купер Х., Боффетта П., Адами Х.О. (сентябрь 2002 г.). «Употребление табака и причина рака: связь по типу опухоли» . Журнал внутренней медицины . 252 (3): 206–24. дои : 10.1046/j.1365-2796.2002.01022.x . ПМИД 12270001 . S2CID 6132726 .
- ^ «Рак и употребление табака» . Центры по контролю и профилактике заболеваний . 27 августа 2019 года . Проверено 25 октября 2023 г.
- ^ Перейти обратно: а б Купер Х., Адами Х.О., Боффетта П. (июнь 2002 г.). «Употребление табака, причины рака и влияние на общественное здравоохранение» . Журнал внутренней медицины . 251 (6): 455–66. дои : 10.1046/j.1365-2796.2002.00993.x . ПМИД 12028500 . S2CID 9172672 .
- ^ Саско А.Дж., Секретан М.Б., Страйф К. (август 2004 г.). «Табакокурение и рак: краткий обзор последних эпидемиологических данных». Рак легких . 45 (Приложение 2): С3–9. дои : 10.1016/j.lungcan.2004.07.998 . ПМИД 15552776 .
- ^ Тун М.Дж., Джемаль А. (октябрь 2006 г.). «В какой степени снижение смертности от рака в Соединенных Штатах связано с сокращением курения табака?» . Контроль над табаком . 15 (5): 345–47. дои : 10.1136/tc.2006.017749 . ПМК 2563648 . ПМИД 16998161 .
- ^ Дубей С., Пауэлл, Калифорния (май 2008 г.). «Обновленная информация о раке легких, 2007 г.» . Американский журнал респираторной медицины и интенсивной терапии . 177 (9): 941–46. дои : 10.1164/rccm.200801-107UP . ПМК 2720127 . ПМИД 18434333 .
- ^ Шютце М., Боинг Х., Пишон Т., Рем Дж., Кехо Т., Гмель Г. и др. (апрель 2011 г.). «Атрибутивное бремя заболеваемости раком, связанное с алкоголем, в восьми европейских странах на основе результатов проспективного когортного исследования» . БМЖ . 342 : d1584. дои : 10.1136/bmj.d1584 . ПМК 3072472 . ПМИД 21474525 .
- ^ Иригарей П., Ньюби Дж.А., Клэпп Р., Харделл Л., Ховард В., Монтанье Л. и др. (декабрь 2007 г.). «Факторы, связанные с образом жизни, и агенты окружающей среды, вызывающие рак: обзор». Биомедицина и фармакотерапия . 61 (10): 640–58. дои : 10.1016/j.biopha.2007.10.006 . ПМИД 18055160 .
- ^ Перейти обратно: а б «ВОЗ призывает к профилактике рака посредством здоровых рабочих мест» (Пресс-релиз). Всемирная организация здравоохранения. 27 апреля 2007 г. Архивировано из оригинала 12 октября 2007 г. Проверено 13 октября 2007 г.
- ^ «Эрин Брокович критикует регулирование токсичных химикатов в США» . Scientificamerican.com . Научный американец. 28 декабря 2020 г.
- ^ «Загрязнитель окружающей среды, ПФОК, связан с повышенным риском рака почки» . Национальный институт рака . 24 сентября 2020 г.
- ^ Перейти обратно: а б с Куши Л.Х., Байерс Т., Дойл С., Бандера Е.В., Маккалоу М., Мактирнан А. и др. (2006). «Руководство Американского онкологического общества по питанию и физической активности для профилактики рака: снижение риска рака с помощью здорового питания и физической активности» . CA: Журнал рака для врачей . 56 (5): 254–81, викторина 313–14. дои : 10.3322/canjclin.56.5.254 . ПМИД 17005596 . S2CID 19823935 .
- ^ Бхаскаран К., Дуглас И., Форбс Х., Дос-Сантос-Сильва И., Леон Д.А., Смит Л. (август 2014 г.). «Индекс массы тела и риск развития 22 конкретных видов рака: популяционное когортное исследование с участием 5,24 миллионов взрослых в Великобритании» . Ланцет . 384 (9945): 755–65. дои : 10.1016/S0140-6736(14)60892-8 . ПМЦ 4151483 . ПМИД 25129328 .
- ^ Перейти обратно: а б с Пак С., Бэ Дж., Нам Б.Х., Ю Ки (2008). «Этиология рака в Азии» . Азиатско-Тихоокеанский журнал профилактики рака . 9 (3): 371–80. ПМИД 18990005 . Архивировано из оригинала 4 сентября 2011 года.
- ^ Бреннер Х., Ротенбахер Д., Арндт В. (2009). «Эпидемиология рака желудка» . Эпидемиология рака . Методы молекулярной биологии. Том. 472. стр. 467–77. дои : 10.1007/978-1-60327-492-0_23 . ISBN 978-1-60327-491-3 . ПМК 2166976 . ПМИД 19107449 .
- ^ Бьюэлл П., Данн Дж. Э. (май 1965 г.). «Смертность от рака среди японских иссеев и нисей из Калифорнии» . Рак . 18 (5): 656–64. doi : 10.1002/1097-0142(196505)18:5<656::AID-CNCR2820180515>3.0.CO;2-3 . PMID 14278899 .
- ^ Мур П.С., Чанг И (декабрь 2010 г.). «Почему вирусы вызывают рак? Основные события первого века вирусологии опухолей человека» . Обзоры природы. Рак . 10 (12). ООО «Спрингер Сайенс энд Бизнес Медиа»: 878–889. дои : 10.1038/nrc2961 . ПМК 3718018 . ПМИД 21102637 .
- ^ Пагано Дж.С., Блазер М., Буэндиа М.А., Дамания Б., Халили К., Рааб-Трауб Н. и др. (декабрь 2004 г.). «Инфекционные агенты и рак: критерии причинно-следственной связи». Семинары по биологии рака . 14 (6): 453–71. дои : 10.1016/j.semcancer.2004.06.009 . ПМИД 15489139 .
- ^ Любоевич С, Скерлев М (2014). «Заболевания, связанные с ВПЧ». Клиники по дерматологии . 32 (2): 227–34. doi : 10.1016/j.clindermatol.2013.08.007 . ПМИД 24559558 .
- ^ Самарас В., Рафаилидис П.И., Мурцуку Э.Г., Пеппас Г., Фалагас М.Е. (июнь 2010 г.). «Хронические бактериальные и паразитарные инфекции и рак: обзор» . Журнал инфекции в развивающихся странах . 4 (5): 267–81. дои : 10.3855/jidc.819 . ПМИД 20539059 . Архивировано из оригинала 4 октября 2011 года.
- ^ Перейти обратно: а б «Радиация» . Национальный институт рака. 29 апреля 2015 года . Проверено 8 июня 2019 г.
- ^ Перейти обратно: а б с «Солнечный свет» . Национальный институт рака. 29 апреля 2015 года . Проверено 8 июня 2019 г.
- ^ «Профилактика рака» . ВОЗ . Проверено 8 июня 2019 г.
- ^ Перейти обратно: а б с д и Маленький Джей Би (2000). «Глава 14: Ионизирующее излучение» . В Куфе Д.В., Поллок Р.Э., Вайхзельбаум Р.Р., Баст Р.К., Ганслер Т.С., Холланд Дж.Ф., Фрей Э. (ред.). Лекарство от рака (6-е изд.). Гамильтон, Онтарио: BC Декер. ISBN 978-1-55009-113-7 . Архивировано из оригинала 2 января 2016 года.
- ^ Бреннер DJ, Холл EJ (ноябрь 2007 г.). «Компьютерная томография — растущий источник радиационного облучения» . Медицинский журнал Новой Англии . 357 (22): 2277–84. дои : 10.1056/NEJMra072149 . ПМИД 18046031 . S2CID 2760372 .
- ^ Перейти обратно: а б Кливер Дж. Э., Митчелл Д. Л. (2000). «15. Канцерогенез ультрафиолетового излучения» . В Bast RC, Kufe DW, Pollock RE и др. (ред.). Медицина рака Холланд-Фрай (5-е изд.). Гамильтон, Онтарио: BC Декер. ISBN 978-1-55009-113-7 . Архивировано из оригинала 4 сентября 2015 года . Проверено 31 января 2011 г.
- ^ «МАИР классифицирует радиочастотные электромагнитные поля как потенциально канцерогенные для человека» (PDF) . Всемирная организация здравоохранения . Архивировано (PDF) из оригинала 1 июня 2011 года.
- ^ «Электромагнитные поля и рак» . Национальный институт рака. 7 января 2019 года . Проверено 8 июня 2019 г.
- ^ «Сотовые телефоны и риск рака – Национальный институт рака» . Cancer.gov. 8 мая 2013 года . Проверено 28 марта 2018 г.
- ^ Перейти обратно: а б Рукос Д.Х. (апрель 2009 г.). «Полногеномные ассоциативные исследования: насколько предсказуем риск рака у человека?» . Экспертный обзор противораковой терапии . 9 (4): 389–92. дои : 10.1586/эра.09.12 . ПМИД 19374592 . S2CID 24746283 .
- ^ Каннингем Д., Аткин В., Ленц Х.Дж., Линч Х.Т., Мински Б., Нордлингер Б. и др. (март 2010 г.). «Колоректальный рак». Ланцет . 375 (9719): 1030–47. дои : 10.1016/S0140-6736(10)60353-4 . ПМИД 20304247 . S2CID 25299272 .
- ^ Кампман Э. (январь 2007 г.). «Родственник первой линии, больной колоректальным раком: чего нам не хватает?» . Эпидемиология рака, биомаркеры и профилактика . 16 (1): 1–3. doi : 10.1158/1055-9965.EPI-06-0984 . ПМИД 17220324 .
- ^ Коте М.Л., Лю М., Бонасси С., Нери М., Шварц А.Г., Кристиани Д.С. и др. (сентябрь 2012 г.). «Повышенный риск рака легких у людей с семейным анамнезом этого заболевания: объединенный анализ Международного консорциума по раку легких» . Европейский журнал рака . 48 (13): 1957–68. дои : 10.1016/j.ejca.2012.01.038 . ПМЦ 3445438 . ПМИД 22436981 .
- ^ Брунер Д.В., Мур Д., Парланти А., Дорган Дж., Энгстрем П. (декабрь 2003 г.). «Относительный риск рака простаты у мужчин, у которых есть пораженные родственники: систематический обзор и метаанализ». Международный журнал рака . 107 (5): 797–803. дои : 10.1002/ijc.11466 . PMID 14566830 . S2CID 25591527 .
- ^ Синглетарный SE (апрель 2003 г.). «Рейтинг факторов риска рака молочной железы» . Анналы хирургии . 237 (4): 474–482. дои : 10.1097/01.SLA.0000059969.64262.87 . ПМЦ 1514477 . ПМИД 12677142 .
- ^ Грин Дж., Кэрнс Б.Дж., Касабонн Д., Райт Ф.Л., Ривз Дж., Берал В. (август 2011 г.). «Рост и заболеваемость раком в исследовании миллиона женщин: проспективная когорта и метаанализ проспективных исследований роста и общего риска рака» . «Ланцет». Онкология . 12 (8): 785–94. дои : 10.1016/S1470-2045(11)70154-1 . ПМК 3148429 . ПМИД 21782509 .
- ^ Перейти обратно: а б с д и Мальтони, Голландия Дж.Ф. (2000). «Глава 16: Физические канцерогены» . В Bast RC, Kufe DW, Pollock RE и др. (ред.). Медицина рака Холланд-Фрай (5-е изд.). Гамильтон, Онтарио: BC Декер. ISBN 978-1-55009-113-7 . Архивировано из оригинала 4 сентября 2015 года . Проверено 31 января 2011 г.
- ^ Перейти обратно: а б с д и ж г Гаэта Дж. Ф. (2000). «Глава 17: Травма и воспаление» . В Bast RC, Kufe DW, Pollock RE и др. (ред.). Медицина рака Холланд-Фрай (5-е изд.). Гамильтон, Онтарио: BC Декер. ISBN 978-1-55009-113-7 . Архивировано из оригинала 4 сентября 2015 года . Проверено 27 января 2011 г.
- ^ Колотта Ф, Аллавена П, Сика А, Гарланда С, Мантовани А (июль 2009 г.). «Воспаление, связанное с раком, седьмой признак рака: связь с генетической нестабильностью» . Канцерогенез (обзор). 30 (7): 1073–81. дои : 10.1093/carcin/bgp127 . ПМИД 19468060 .
- ^ Унгефрорен Х., Себенс С., Зайдль Д., Ленерт Х., Хасс Р. (сентябрь 2011 г.). «Взаимодействие опухолевых клеток с микроокружением» . Сотовая связь и сигнализация . 9 (18): 18. дои : 10.1186/1478-811X-9-18 . ПМК 3180438 . ПМИД 21914164 .
- ^ Мантовани А (июнь 2010 г.). «Молекулярные пути, связывающие воспаление и рак». Современная молекулярная медицина (обзор). 10 (4): 369–73. дои : 10.2174/156652410791316968 . ПМИД 20455855 .
- ^ Боррелло М.Г., Дегль'Инноченти Д., Пьеротти М.А. (август 2008 г.). «Воспаление и рак: связь, управляемая онкогенами». Раковые письма (обзор). 267 (2): 262–70. дои : 10.1016/j.canlet.2008.03.060 . ПМИД 18502035 .
- ^ Перейти обратно: а б с д и ж г час я дж Хендерсон Б.Е., Бернштейн Л., Росс Р.К. (2000). «Глава 13: Гормоны и этиология рака» . В Bast RC, Kufe DW, Pollock RE и др. (ред.). Медицина рака Холланд-Фрай (5-е изд.). Гамильтон, Онтарио: BC Декер. ISBN 978-1-55009-113-7 . Архивировано из оригинала 10 сентября 2017 года . Проверено 27 января 2011 г.
- ^ Роулендс М.А., Ганнелл Д., Харрис Р., Ваттен Л.Дж., Холли Дж.М., Мартин Р.М. (май 2009 г.). «Циркулирующие пептиды инсулиноподобного фактора роста и риск рака простаты: систематический обзор и метаанализ» . Международный журнал рака . 124 (10): 2416–29. дои : 10.1002/ijc.24202 . ПМК 2743036 . ПМИД 19142965 .
- ^ Хан Ю, Чен В, Ли П, Е Дж (сентябрь 2015 г.). «Связь между целиакией и риском любого злокачественного новообразования и злокачественного новообразования желудочно-кишечного тракта: метаанализ» . Лекарство . 94 (38): e1612. дои : 10.1097/MD.0000000000001612 . ПМЦ 4635766 . ПМИД 26402826 .
- ^ Аксельрад Дж. Э., Лихтигер С., Яйник В. (май 2016 г.). «Воспалительные заболевания кишечника и рак: роль воспаления, иммуносупрессии и лечения рака» . Всемирный журнал гастроэнтерологии . 22 (20): 4794–801. дои : 10.3748/wjg.v22.i20.4794 . ПМЦ 4873872 . ПМИД 27239106 .
- ^ Кроче CM (январь 2008 г.). «Онкогены и рак». Медицинский журнал Новой Англии . 358 (5): 502–11. дои : 10.1056/NEJMra072367 . ПМИД 18234754 . S2CID 8813076 .
- ^ Кнудсон АГ (ноябрь 2001 г.). «Два генетических удара (более или менее) к раку». Обзоры природы. Рак . 1 (2): 157–62. дои : 10.1038/35101031 . ПМИД 11905807 . S2CID 20201610 .
- ^ Нельсон Д.А., Тан Т.Т., Рабсон А.Б., Андерсон Д., Дегенхардт К., Уайт Э. (сентябрь 2004 г.). «Гипоксия и дефектный апоптоз приводят к геномной нестабильности и онкогенезу» . Гены и развитие . 18 (17): 2095–107. дои : 10.1101/gad.1204904 . ПМК 515288 . ПМИД 15314031 .
- ^ Мерло Л.М., Пеппер Дж.В., Рид Б.Дж., Мэйли CC (декабрь 2006 г.). «Рак как эволюционный и экологический процесс». Обзоры природы. Рак . 6 (12): 924–35. дои : 10.1038/nrc2013 . ПМИД 17109012 . S2CID 8040576 .
- ^ Байлин С.Б., Ом Дж.Э. (февраль 2006 г.). «Эпигенетическое молчание генов при раке - механизм ранней зависимости от онкогенного пути?». Обзоры природы. Рак . 6 (2): 107–16. дои : 10.1038/nrc1799 . ПМИД 16491070 . S2CID 2514545 .
- ^ Канвал Р., Гупта С. (апрель 2012 г.). «Эпигенетические модификации рака» . Клиническая генетика . 81 (4): 303–11. дои : 10.1111/j.1399-0004.2011.01809.x . ПМК 3590802 . ПМИД 22082348 .
- ^ Бальдасарре Дж., Баттиста С., Беллетти Б., Такур С., Пентималли Ф., Трапассо Ф. и др. (апрель 2003 г.). «Негативная регуляция экспрессии гена BRCA1 белками HMGA1 объясняет снижение уровня белка BRCA1 при спорадической карциноме молочной железы» . Молекулярная и клеточная биология . 23 (7): 2225–38. дои : 10.1128/MCB.23.7.2225-2238.2003 . ПМК 150734 . ПМИД 12640109 . /
- ^ Шнекенбургер М., Дидерих М. (март 2012 г.). «Эпигенетика открывает новые горизонты в профилактике колоректального рака» . Текущие отчеты о колоректальном раке . 8 (1): 66–81. дои : 10.1007/s11888-011-0116-z . ПМК 3277709 . ПМИД 22389639 .
- ^ Хасинто Ф.В., Эстеллер М. (июль 2007 г.). «Мутаторные пути, вызванные эпигенетическим молчанием при раке человека» . Мутагенез . 22 (4): 247–53. дои : 10.1093/mutage/gem009 . ПМИД 17412712 .
- ^ Латц К., Пфайфер GP (февраль 2011 г.). «Эпигенетические изменения генов репарации ДНК при раке» . Журнал молекулярно-клеточной биологии . 3 (1): 51–8. дои : 10.1093/jmcb/mjq053 . ПМК 3030973 . ПМИД 21278452 .
- ^ Бернштейн С., Нфонсам В., Прасад А.Р., Бернштейн Х. (март 2013 г.). «Дефекты эпигенетического поля при прогрессировании рака» . Всемирный журнал желудочно-кишечной онкологии . 5 (3): 43–49. дои : 10.4251/wjgo.v5.i3.43 . ПМЦ 3648662 . ПМИД 23671730 .
- ^ Нарайанан Л., Фритцелл Дж.А., Бейкер С.М., Лискай Р.М., Глейзер П.М. (апрель 1997 г.). «Повышенные уровни мутаций во многих тканях мышей с дефицитом гена репарации несоответствия ДНК Pms2» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (7): 3122–27. Бибкод : 1997PNAS...94.3122N . дои : 10.1073/pnas.94.7.3122 . ЧВК 20332 . ПМИД 9096356 .
- ^ Хеган Д.С., Нараянан Л., Жирик Ф.Р., Эдельманн В., Лискай Р.М., Глейзер П.М. (декабрь 2006 г.). «Различные модели генетической нестабильности у мышей с дефицитом генов репарации ошибочного спаривания Pms2, Mlh1, Msh2, Msh3 и Msh6» . Канцерогенез . 27 (12): 2402–08. doi : 10.1093/carcin/bgl079 . ПМК 2612936 . ПМИД 16728433 .
- ^ Тутт А.Н., ван Остром КТ, Росс ГМ, ван Стиг Х., Эшворт А. (март 2002 г.). «Нарушение Brca2 увеличивает частоту спонтанных мутаций in vivo: синергизм с ионизирующим излучением» . Отчеты ЭМБО . 3 (3): 255–60. дои : 10.1093/embo-reports/kvf037 . ПМК 1084010 . ПМИД 11850397 .
- ^ Герман Дж (март 1969 г.). «Синдром Блума. I. Генетические и клинические наблюдения у первых двадцати семи больных» . Американский журнал генетики человека . 21 (2): 196–227. ПМК 1706430 . ПМИД 5770175 .
- ^ О'Хаган Х.М., Мохаммад Х.П., Бэйлин С.Б. (август 2008 г.). Ли Джей Ти (ред.). «Двухнитевые разрывы могут инициировать молчание генов и SIRT1-зависимое начало метилирования ДНК на экзогенном промоторном острове CpG» . ПЛОС Генетика . 4 (8): е1000155. дои : 10.1371/journal.pgen.1000155 . ПМЦ 2491723 . ПМИД 18704159 .
- ^ Куоццо С., Порчеллини А., Ангризано Т., Морано А., Ли Б., Ди Пардо А. и др. (июль 2007 г.). «Повреждение ДНК, репарация, направленная на гомологию, и метилирование ДНК» . ПЛОС Генетика . 3 (7): е110. дои : 10.1371/journal.pgen.0030110 . ЧВК 1913100 . ПМИД 17616978 .
- ^ Малкин Д. (апрель 2011 г.). «Синдром Ли-фраумени» . Гены и рак . 2 (4): 475–84. дои : 10.1177/1947601911413466 . ПМЦ 3135649 . ПМИД 21779515 .
- ^ Фирон Э.Р. (ноябрь 1997 г.). «Синдромы рака человека: ключ к разгадке происхождения и природы рака». Наука . 278 (5340): 1043–50. Бибкод : 1997Sci...278.1043F . дои : 10.1126/science.278.5340.1043 . ПМИД 9353177 .
- ^ Фогельштейн Б., Пападопулос Н., Велкулеску В.Е., Чжоу С., Диас Л.А., Кинцлер К.В. (март 2013 г.). «Пейзажи генома рака» . Наука . 339 (6127): 1546–58. Бибкод : 2013Sci...339.1546V . дои : 10.1126/science.1235122 . ПМК 3749880 . ПМИД 23539594 .
- ^ Перейти обратно: а б Чжэн Дж (2012). «Энергетический метаболизм рака: гликолиз против окислительного фосфорилирования (обзор)» . Письма об онкологии . 4 (6): 1151–1157. дои : 10.3892/ол.2012.928 . ПМК 3506713 . ПМИД 23226794 .
- ^ Сейфрид Т.Н., Шелтон Л.М. (2010). «Рак как метаболическое заболевание» . Питание и обмен веществ . 7 :7. дои : 10.1186/1743-7075-7-7 . ПМЦ 2845135 . ПМИД 20181022 .
- ^ Вайс Дж. М. (2020). «Перспективы и опасности воздействия на клеточный метаболизм для терапии рака» . Иммунология рака, иммунотерапия . 69 (2): 255–261. дои : 10.1007/s00262-019-02432-7 . ПМЦ 7004869 . ПМИД 31781842 .
- ^ Фархади П., Ярани Р., Доканехейфард С., Мансури К. (2020). «Новая роль нацеливания на метаболизм рака в терапии рака» . Биология опухолей . 42 (10): 1010428320965284. дои : 10.1177/1010428320965284 . ПМИД 33028168 . S2CID 222214285 .
- ^ Павлова Н.Н., Томпсон CB (2016). «Новые признаки метаболизма рака» . Клеточный метаболизм . 23 (1): 27–47. дои : 10.1016/j.cmet.2015.12.006 . ПМЦ 4715268 . ПМИД 26771115 .
- ^ Ядав УП, Сингх Т, Кумар П, Мехта К (2020). «Метаболические адаптации раковых стволовых клеток» . Границы онкологии . 10 :1010. doi : 10.3389/fonc.2020.01010 . ПМК 7330710 . ПМИД 32670883 .
- ^ «Руководство по скринингу рака | Раннее выявление рака» . Американское онкологическое общество. 14 марта 2022 г. Проверено 24 мая 2022 г.
- ^ Коннолли Дж.Л., Шнитт С.Дж., Ван Х.Х., Лонгтайн Дж.А., Дворжак А., Дворжак Х.Ф. (2003). «Роль хирурга-патологоанатома в диагностике и лечении онкологических больных» . В Голландии Дж. Ф. , Фрей Э. , Куфе Д. В. (ред.). Медицина рака Холланд-Фрай (6-е изд.). Гамильтон (Онтарио): BC Декер. ISBN 978-1-55009-213-4 .
- ^ Голуэй К., Блэк А., Кэнтуэлл М., Кардвелл С.Р., Миллс М., Доннелли М. (ноябрь 2012 г.). «Психосоциальные вмешательства для улучшения качества жизни и эмоционального благополучия больных недавно диагностированным раком» . Кокрановская база данных систематических обзоров . 11 (11): CD007064. дои : 10.1002/14651858.cd007064.pub2 . ПМК 6457819 . ПМИД 23152241 .
- ^ Пирсон С. (10 января 2024 г.). «Почему некоторые люди держат в тайне свои серьезные заболевания» . Нью-Йорк Таймс .
- ^ Варриккио С (2004). Справочник по раку для медсестер . Бостон: Издательство Jones and Bartlett. п. 229. ИСБН 978-0-7637-3276-9 .
- ^ Изображение Микаэля Хэггстрема, доктора медицинских наук. Источник выводов: Андервуд К.И., Гласс К. «Легкие – мелкоклеточная карцинома» . Очертания патологии . Последнее обновление автора: 20 сентября 2022 г.
- ^ Перейти обратно: а б с Тран К.Б., Ланг Дж.Дж., Комптон К., Сюй Р., Ачесон А.Р., Хенриксон Х.Дж. и др. (август 2022 г.). «Глобальное бремя рака, связанное с факторами риска, 2010–2019 годы: систематический анализ для исследования глобального бремени болезней 2019 года» . Ланцет . 400 (10352): 563–591. дои : 10.1016/S0140-6736(22)01438-6 . ПМЦ 9395583 . ПМИД 35988567 .
- ^ «Профилактика рака: 7 шагов, чтобы снизить риск» . Клиника Мэйо . 27 сентября 2008 г. Архивировано из оригинала 8 февраля 2010 г. Проверено 30 января 2010 г.
- ^ Даная Дж., Вандер Хорн С., Лопес А.Д., Мюррей С.Дж., Эззати М. (ноябрь 2005 г.). «Причины рака в мире: сравнительная оценка риска девяти поведенческих и экологических факторов риска» . Ланцет . 366 (9499): 1784–93. дои : 10.1016/S0140-6736(05)67725-2 . ПМИД 16298215 . S2CID 17354479 .
- ^ Ву С., Пауэрс С., Чжу В., Ханнун Ю.А. (январь 2016 г.). «Существенный вклад внешних факторов риска в развитие рака» . Природа . 529 (7584): 43–7. Бибкод : 2016Natur.529...43W . дои : 10.1038/nature16166 . ПМЦ 4836858 . ПМИД 26675728 .
- ^ "Рак" . Всемирная организация здравоохранения . Архивировано из оригинала 29 декабря 2010 года . Проверено 9 января 2011 г.
- ^ Хейдари Ф., Рахими А., Гаребаги Р. (2013). «Бедность как фактор риска развития рака у человека» . Иранский журнал общественного здравоохранения . 42 (3): 341–343. ПМЦ 3633807 . ПМИД 23641414 .
- ^ Перейти обратно: а б Вики А., Хагманн Дж. (сентябрь 2011 г.). «Диета и рак» . Швейцарский медицинский еженедельник . 141 : w13250. дои : 10.4414/smw.2011.13250 . ПМИД 21904992 .
- ^ Каппеллани А., Ди Вита М., Занги А., Кавалларо А., Пикколо Г., Веру М. и др. (январь 2012 г.). «Диета, ожирение и рак молочной железы: обновленная информация». Границы бионауки . 4 (1): 90–108. дои : 10.2741/253 . ПМИД 22202045 .
- ^ Ки ТиДжей (январь 2011 г.). «Фрукты и овощи и риск рака» . Британский журнал рака . 104 (1): 6–11. дои : 10.1038/sj.bjc.6606032 . ПМК 3039795 . ПМИД 21119663 .
- ^ Ван X, Оуян Ю, Лю Дж, Чжу М, Чжао Г, Бао В и др. (июль 2014 г.). «Потребление фруктов и овощей и смертность от всех причин, сердечно-сосудистых заболеваний и рака: систематический обзор и метаанализ зависимости реакции от дозы проспективных когортных исследований» . БМЖ . 349 : г4490. дои : 10.1136/bmj.g4490 . ПМК 4115152 . ПМИД 25073782 .
- ^ Ларссон СК, Волк А (май 2007 г.). «Потребление кофе и риск рака печени: метаанализ» . Гастроэнтерология . 132 (5): 1740–5. дои : 10.1053/j.gastro.2007.03.044 . ПМИД 17484871 .
- ^ Чжэн В., Ли С.А. (2009). «Хорошо приготовленное мясо, воздействие гетероциклических аминов и риск рака» . Питание и рак . 61 (4): 437–46. дои : 10.1080/01635580802710741 . ПМК 2769029 . ПМИД 19838915 .
- ^ Фергюсон Л.Р. (февраль 2010 г.). «Мясо и рак». Мясная наука . 84 (2): 308–13. doi : 10.1016/j.meatsci.2009.06.032 . ПМИД 20374790 .
- ^ Персонал (26 октября 2015 г.). «В монографиях Всемирной организации здравоохранения – МАИР оценивается потребление красного мяса и мясных продуктов» (PDF) . Международное агентство по исследованию рака . Архивировано (PDF) из оригинала 26 октября 2015 г. Проверено 26 октября 2015 г.
- ^ Хаузер С (26 октября 2015 г.). «Доклад ВОЗ связывает некоторые виды рака с переработанным или красным мясом» . Нью-Йорк Таймс . Архивировано из оригинала 26 октября 2015 года . Проверено 26 октября 2015 г.
- ^ Голландия Глава 33
- ^ Ростом А., Дюбе С., Левин Г., Церцвадзе А., Барроумен Н., Код С и др. (март 2007 г.). «Нестероидные противовоспалительные препараты и ингибиторы циклооксигеназы-2 для первичной профилактики колоректального рака: систематический обзор, подготовленный для Целевой группы профилактических служб США» . Анналы внутренней медицины . 146 (5): 376–89. дои : 10.7326/0003-4819-146-5-200703060-00010 . ПМИД 17339623 .
- ^ Ротвелл П.М., Фаукс Ф.Г., Белч Дж.Ф., Огава Х., Варлоу К.П., Мид Т.В. (январь 2011 г.). «Влияние ежедневного приема аспирина на долгосрочный риск смерти от рака: анализ индивидуальных данных пациентов из рандомизированных исследований». Ланцет . 377 (9759): 31–41. дои : 10.1016/S0140-6736(10)62110-1 . ПМИД 21144578 . S2CID 22950940 .
- ^ Купер К., Сквайрс Х., Кэрролл С., Папайоанну Д., Бут А., Логан Р.Ф. и др. (июнь 2010 г.). «Химиопрофилактика колоректального рака: систематический обзор и экономическая оценка» . Оценка технологий здравоохранения . 14 (32): 1–206. дои : 10.3310/hta14320 . ПМИД 20594533 .
- ^ Томсен А., Колесар Дж. М. (декабрь 2008 г.). «Химиопрофилактика рака молочной железы». Американский журнал аптеки системы здравоохранения . 65 (23): 2221–28. дои : 10.2146/ajhp070663 . ПМИД 19020189 .
- ^ Уилт Т.Дж., Макдональд Р., Хагерти К., Шеллхаммер П., Крамер Б.С. (апрель 2008 г.). Уилт Ти Джей (ред.). «Ингибиторы пятиальфа-редуктазы для профилактики рака простаты» . Кокрейновская база данных систематических обзоров (2): CD007091. дои : 10.1002/14651858.CD007091 . ПМЦ 11270836 . ПМИД 18425978 .
- ^ «Витамины и минералы: не для профилактики рака или сердечно-сосудистых заболеваний» . Пресрайр Интернэшнл . 19 (108): 182. Август 2010. PMID 20939459 . Архивировано из оригинала 25 мая 2012 года.
- ^ Джованнуччи Э., Лю Ю., Римм Э.Б., Холлис Б.В., Фукс К.С., Стампфер М.Дж. и др. (апрель 2006 г.). «Проспективное исследование предикторов статуса витамина D, заболеваемости и смертности от рака у мужчин». Журнал Национального института рака . 98 (7): 451–59. CiteSeerX 10.1.1.594.1654 . дои : 10.1093/jnci/djj101 . ПМИД 16595781 .
- ^ «Витамин D играет роль в профилактике рака толстой кишки» . Архивировано из оригинала 4 декабря 2006 года . Проверено 27 июля 2007 г.
- ^ Холик М.Ф. (январь 2013 г.). «Витамин D, связь солнечного света и рака». Противораковые агенты в медицинской химии . 13 (1): 70–82. дои : 10.2174/187152013804487308 . ПМИД 23094923 .
- ^ Шварц Г.Г., Блот В.Дж. (апрель 2006 г.). «Статус витамина D, заболеваемость и смертность от рака: что-то новое под солнцем» . Журнал Национального института рака . 98 (7): 428–30. дои : 10.1093/jnci/djj127 . ПМИД 16595770 .
- ^ Перейти обратно: а б Болланд М.Дж., Грей А., Гэмбл Г.Д., Рид И.Р. (апрель 2014 г.). «Влияние добавок витамина D на исходы со стороны скелета, сосудов или рака: последовательный метаанализ исследования». «Ланцет». Диабет и эндокринология . 2 (4): 307–320. дои : 10.1016/S2213-8587(13)70212-2 . ПМИД 24703049 .
- ^ Белакович Г., Глууд Л.Л., Николова Д., Уитфилд К., Веттерслев Дж., Симонетти Р.Г. и др. (январь 2014 г.). «Добавка витамина D для профилактики смертности у взрослых». Кокрановская база данных систематических обзоров . 1 (1): CD007470. дои : 10.1002/14651858.cd007470.pub3 . ПМИД 24414552 . S2CID 205189615 .
- ^ Фриц Х., Кеннеди Д., Фергюссон Д., Фернандес Р., Дусетт С., Кули К. и др. (2011). Минна Джей Ди (ред.). «Витамин А и производные ретиноидов при раке легких: систематический обзор и метаанализ» . ПЛОС ОДИН . 6 (6): е21107. Бибкод : 2011PLoSO...621107F . дои : 10.1371/journal.pone.0021107 . ПМК 3124481 . ПМИД 21738614 .
- ^ Коул Б.Ф., Барон Дж.А., Сэндлер Р.С., Хейл Р.В., Анен Д.Д., Бресалье Р.С. и др. (июнь 2007 г.). «Фолиевая кислота для профилактики колоректальных аденом: рандомизированное клиническое исследование» . ДЖАМА . 297 (21): 2351–2359. дои : 10.1001/jama.297.21.2351 . ПМИД 17551129 .
- ^ Винчети М., Филиппини Т., Дель Джоване С., Деннерт Г., Цвален М., Бринкман М. и др. (январь 2018 г.). «Селен для профилактики рака» . Кокрановская база данных систематических обзоров . 1 (1): CD005195. дои : 10.1002/14651858.CD005195.pub4 . ПМК 6491296 . ПМИД 29376219 .
- ^ Перейти обратно: а б с «Информационный бюллетень о вакцине против рака» . НЦИ . 8 июня 2006 г. Проверено 28 марта 2018 г.
- ^ Перейти обратно: а б Лертхачонсук А.А., Йип Ч., Хухапрема Т., Чен Д.С. , Пламмер М., Джи Ш. и др. (ноябрь 2013 г.). «Профилактика рака в Азии: рекомендации по стратификации ресурсов Азиатского онкологического саммита 2013 г.». «Ланцет». Онкология . 14 (12): e497–507. arXiv : cond-mat/0606434 . дои : 10.1016/S1470-2045(13)70350-4 . ПМИД 24176569 .
- ^ Перейти обратно: а б с «Обзор скрининга рака (PDQ®) – версия для пациентов» . Национальный институт рака. 13 января 2010 г. Проверено 28 марта 2018 г.
- ^ Перейти обратно: а б с Уилсон Дж. М., Юнгнер Г. (1968) Принципы и практика скрининга заболеваний. Женева: Всемирная организация здравоохранения . Документы общественного здравоохранения, № 34.
- ^ «Скрининг рака шейки матки» . Рабочая группа США по профилактическим услугам . 2003. Архивировано из оригинала 23 декабря 2010 года . Проверено 21 декабря 2010 г.
- ^ «Скрининг колоректального рака» . Рабочая группа США по профилактическим услугам . 2008. Архивировано из оригинала 7 февраля 2015 года . Проверено 21 декабря 2010 г.
- ^ «Скрининг рака кожи» . Рабочая группа США по профилактическим услугам . 2009. Архивировано из оригинала 8 января 2011 года . Проверено 21 декабря 2010 г.
- ^ «Скрининг рака полости рта» . Рабочая группа США по профилактическим услугам . 2004. Архивировано из оригинала 24 октября 2010 года . Проверено 21 декабря 2010 г.
- ^ «Скрининг рака легких» . Рабочая группа США по профилактическим услугам . 2004. Архивировано из оригинала 4 ноября 2010 года . Проверено 21 декабря 2010 г.
- ^ «Скрининг рака простаты» . Рабочая группа США по профилактическим услугам . 2008. Архивировано из оригинала 31 декабря 2010 года . Проверено 21 декабря 2010 г.
- ^ «Скрининг рака мочевого пузыря» . Рабочая группа США по профилактическим услугам . 2004. Архивировано из оригинала 23 августа 2010 года . Проверено 21 декабря 2010 г.
- ^ «Скрининг рака яичек» . Рабочая группа США по профилактическим услугам . 2004. Архивировано из оригинала 15 мая 2016 года . Проверено 21 декабря 2010 г.
- ^ «Скрининг рака яичников» . Рабочая группа США по профилактическим услугам . 2004. Архивировано из оригинала 23 октября 2010 года . Проверено 21 декабря 2010 г.
- ^ «Скрининг рака поджелудочной железы» . Рабочая группа США по профилактическим услугам . 2004. Архивировано из оригинала 21 ноября 2010 года . Проверено 21 декабря 2010 г.
- ^ Чоу Р., Кросвелл Дж.М., Дана Т., Бугатсос С., Блазина И., Фу Р. и др. (декабрь 2011 г.). «Скрининг рака простаты: обзор данных для Целевой группы профилактических служб США» . Анналы внутренней медицины . 155 (11). Целевая группа профилактических служб США : 762–71. дои : 10.7326/0003-4819-155-11-201112060-00375 . ПМИД 21984740 .
- ^ «Скрининг рака молочной железы» . Рабочая группа США по профилактическим услугам . 2009. Архивировано из оригинала 2 января 2013 года . Проверено 21 декабря 2010 г.
- ^ Гётше ПК, Йоргенсен К.Дж. (июнь 2013 г.). «Скрининг рака молочной железы с помощью маммографии» . Кокрановская база данных систематических обзоров . 2013 (6): CD001877. дои : 10.1002/14651858.CD001877.pub5 . ПМК 6464778 . ПМИД 23737396 .
- ^ Перейти обратно: а б Гулати А.П., Домчек С.М. (январь 2008 г.). «Клиническое ведение носителей мутаций BRCA1 и BRCA2». Текущие отчеты по онкологии . 10 (1): 47–53. дои : 10.1007/s11912-008-0008-9 . ПМИД 18366960 . S2CID 29630942 .
- ^ Линд М.Дж. (2008). «Принципы цитотоксической химиотерапии». Лекарство . 36 (1): 19–23. дои : 10.1016/j.mpmed.2007.10.003 .
- ^ Фрей III Э, Эдер Дж.П. (2003). Комбинированная химиотерапия . Проверено 4 апреля 2020 г.
- ^ Уважаемый РФ, МакГичан К., Дженкинс М.К., Барратт А., Таттерсолл М.Х., Уилкен Н. (декабрь 2013 г.). «Комбинированная химиотерапия по сравнению с последовательной монохимиотерапией при метастатическом раке молочной железы» . Кокрановская база данных систематических обзоров . 2021 (12): CD008792. дои : 10.1002/14651858.CD008792.pub2 . ПМК 8094913 . ПМИД 24347031 .
- ^ «Таргетная терапия рака» . О Раке . Национальный институт рака. 26 февраля 2018 года . Проверено 28 марта 2018 г.
- ^ Перейти обратно: а б Голландия Чп. 40
- ^ Наступиль Ж.Дж., Роуз AC, Flowers CR (май 2012 г.). «Диффузная В-крупноклеточная лимфома: современные подходы к лечению». Онкология . 26 (5): 488–95. ПМИД 22730604 .
- ^ Фридман А. (октябрь 2012 г.). «Фолликулярная лимфома: обновленная информация о диагностике и лечении 2012 г.» . Американский журнал гематологии . 87 (10): 988–95. дои : 10.1002/ajh.23313 . ПМИД 23001911 . S2CID 35447562 .
- ^ Рэмплинг Р., Джеймс А., Папанастассиу В. (июнь 2004 г.). «Современное и будущее лечение злокачественных опухолей головного мозга: хирургия, лучевая терапия, химиотерапия» . Журнал неврологии, нейрохирургии и психиатрии . 75 (Приложение 2): ii24–30. дои : 10.1136/jnnp.2004.040535 . ПМЦ 1765659 . ПМИД 15146036 .
- ^ Мадан В., Лир Дж. Т., Сеймис Р. М. (февраль 2010 г.). «Немеланомный рак кожи» . Ланцет . 375 (9715): 673–85. дои : 10.1016/S0140-6736(09)61196-X . ПМЦ 3339125 . ПМИД 20171403 .
- ^ Витале И., Галлуцци Л., Кастедо М., Кремер Г. (июнь 2011 г.). «Митотическая катастрофа: механизм предотвращения геномной нестабильности». Обзоры природы. Молекулярно-клеточная биология . 12 (6): 385–392. дои : 10.1038/nrm3115 . ПМИД 21527953 . S2CID 22483746 .
- ^ Бомфорд К.К., Канклер И.Х., Уолтер Дж. Уолтер и Учебник лучевой терапии Миллера (6-е изд.). п. 311.
- ^ МакМорран Дж., Кроутер Д., МакМорран С., Янгмин С., Вакогн И., Плит Дж. и др. «Радиочувствительность опухолей – Тетрадь общей практики» . Архивировано из оригинала 24 сентября 2015 года.
- ^ Tidy C (23 декабря 2015 г.). «Радиотерапия» . Пациент Великобритания . Архивировано из оригинала 9 июля 2017 года. Последняя проверка: 23 декабря 2015 года.
- ^ Хилл Р., Хили Б., Холлоуэй Л., Кунчич З., Туэйтс Д., Бэлдок С. (март 2014 г.). «Достижения в области киловольтной рентгеновской дозиметрии». Физика в медицине и биологии . 59 (6): R183–231. Бибкод : 2014PMB....59R.183H . дои : 10.1088/0031-9155/59/6/r183 . ПМИД 24584183 . S2CID 18082594 .
- ^ Перейти обратно: а б Голландия Чп. 41
- ^ «Лучевая терапия метастазов в головной мозг: систематический обзор» . ПКОРИ . 13 августа 2019 года . Проверено 10 октября 2023 г.
- ^ Перейти обратно: а б с д и Американское общество клинической онкологии . «Пять вопросов, которые должны задать врачи и пациенты» (PDF) . Выбираем мудро: инициатива Фонда ABIM . Архивировано из оригинала (PDF) 31 июля 2012 года . Проверено 14 августа 2012 г.
- ^ * Американское общество клинической онкологии дало эту рекомендацию на основании различных видов рака. Видеть Американское общество клинической онкологии . «Пять вопросов, которые должны задать врачи и пациенты» (PDF) . Выбираем мудро: инициатива Фонда ABIM . Архивировано из оригинала (PDF) 31 июля 2012 года . Проверено 14 августа 2012 г.
- о раке легких см. Аццоли К.Г., Темин С., Алифф Т., Бейкер С., Брамер Дж., Джонсон Д.Х. и др. (октябрь 2011 г.). «Специальное обновление обновленных рекомендаций по клинической практике Американского общества клинической онкологии за 2011 г. по химиотерапии при немелкоклеточном раке легких IV стадии» . Журнал клинической онкологии . 29 (28): 3825–31. дои : 10.1200/JCO.2010.34.2774 . ПМЦ 3675703 . ПМИД 21900105 . и Эттингер Д.С., Акерли В., Беплер Г., Блюм М.Г., Чанг А., Чейни Р.Т. и др. (июль 2010 г.). «Немелкоклеточный рак легкого» . Журнал Национальной комплексной онкологической сети . 8 (7): 740–801. дои : 10.6004/jnccn.2010.0056 . ПМИД 20679538 .
- о раке молочной железы см. Карлсон Р.В., Оллред Д.К., Андерсон Б.О., Бурштейн Х.Дж., Картер В.Б., Эдж С.Б. и др. (февраль 2009 г.). «Рак молочной железы. Клинические рекомендации по онкологии» . Журнал Национальной комплексной онкологической сети . 7 (2): 122–92. дои : 10.6004/jnccn.2009.0012 . ПМИД 19200416 .
- о раке толстой кишки см. Энгстрем П.Ф., Арнолетти Дж.П., Бенсон А.Б., Чен Ю.Дж., Чоти М.А., Купер Х.С. и др. (сентябрь 2009 г.). «Руководство по клинической практике NCCN в онкологии: рак толстой кишки» . Журнал Национальной комплексной онкологической сети . 7 (8): 778–831. дои : 10.6004/jnccn.2009.0056 . ПМИД 19755046 .
- другие общие положения см. Смит Т.Дж., Хиллнер Б.Е. (май 2011 г.). «Изгиб кривой затрат на лечение рака» . Медицинский журнал Новой Англии . 364 (21): 2060–5. дои : 10.1056/NEJMsb1013826 . ПМК 4042405 . ПМИД 21612477 . и Пепперкорн Дж.М., Смит Т.Дж., Хелфт PR, Дебоно DJ, Берри С.Р., Воллинз Д.С. и др. (февраль 2011 г.). «Заявление Американского общества клинической онкологии: к индивидуальному лечению пациентов с запущенным раком». Журнал клинической онкологии . 29 (6): 755–60. дои : 10.1200/JCO.2010.33.1744 . ПМИД 21263086 . S2CID 40873748 .
- ^ «Руководство NCCN» . Архивировано из оригинала 14 мая 2008 года.
- ^ «Руководство по клинической практике качественной паллиативной помощи» (PDF) . Национальный консенсусный проект по качественной паллиативной помощи (NCP). Архивировано из оригинала (PDF) 16 мая 2011 года.
- ^ Леви М.Х., Бэк А., Базарган С., Бенедетти С., Биллингс Дж.А., Блок С. и др. (сентябрь 2006 г.). «Паллиативная помощь. Клинические рекомендации по онкологии». Журнал Национальной комплексной онкологической сети . 4 (8): 776–818. дои : 10.6004/jnccn.2006.0068 . ПМИД 16948956 . S2CID 44343423 .
- ^ Вальдманн Т.А. (март 2003 г.). «Иммунотерапия: прошлое, настоящее и будущее» . Природная медицина . 9 (3): 269–77. дои : 10.1038/nm0303-269 . ПМИД 12612576 . S2CID 9745527 .
- ^ «Лазеры в лечении рака» . Национальные институты здравоохранения, Национальный институт рака. 13 сентября 2011 года . Проверено 15 декабря 2017 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Кассилет Б.Р., Дэн Г. (2004). «Дополнительные и альтернативные методы лечения рака» (PDF) . Онколог . 9 (1): 80–89. doi : 10.1634/теонколог.9-1-80 . ПМИД 14755017 . S2CID 6453919 .
- ^ Что такое CAM? Архивировано 8 декабря 2005 года в Wayback Machine Национальном центре дополнительной и альтернативной медицины . Проверено 3 февраля 2008 г.
- ^ Викерс А (2004). «Альтернативные методы лечения рака: «недоказано» или «опровергнуто»?». CA: Журнал рака для врачей . 54 (2): 110–18. CiteSeerX 10.1.1.521.2180 . дои : 10.3322/canjclin.54.2.110 . ПМИД 15061600 . S2CID 35124492 .
- ^ «Три показателя смертности от рака» . Наш мир в данных . Проверено 7 марта 2020 г.
- ^ Таммела Т., Сейдж Дж. (март 2020 г.). «Исследование гетерогенности опухоли на мышиных моделях» . Ежегодный обзор биологии рака . 4 (1): 99–119. doi : 10.1146/annurev-cancerbio-030419-033413 . ПМЦ 8218894 . ПМИД 34164589 .
- ^ Всемирный доклад о раке, 2014 год . Всемирная организация здравоохранения. 2014. с. 22. ISBN 978-92-832-0429-9 . Архивировано из оригинала 12 июля 2017 года.
- ^ Перейти обратно: а б Рейнгольд С., Нойгут А., Медоуз А. (2003). «156: Вторичный рак: заболеваемость, факторы риска и лечение» . В Фрей Э., Куфе Д.В., Холланд Дж.Ф. (ред.). Медицина рака Холланд-Фрай (6-е изд.). Гамильтон, Онтарио: BC Декер. п. 2399 . ISBN 978-1-55009-213-4 .
- ^ Монтазери А (декабрь 2009 г.). «Данные о качестве жизни как прогностические показатели выживаемости онкологических больных: обзор литературы с 1982 по 2008 год» . Результаты по здоровью и качеству жизни . 7 :102. дои : 10.1186/1477-7525-7-102 . ПМК 2805623 . ПМИД 20030832 .
- ^ Перейти обратно: а б с Акл Э.А., Кахале Л.А., Хакум М.Б., Матар К.Ф., Сперати Ф., Барба М. и др. (сентябрь 2017 г.). «Парентеральная антикоагуляция у амбулаторных онкологических больных» . Кокрановская база данных систематических обзоров . 2021 (9): CD006652. дои : 10.1002/14651858.CD006652.pub5 . ПМК 6419241 . ПМИД 28892556 .
- ^ Радха Г., Лопус М. (сентябрь 2021 г.). «Спонтанная ремиссия рака: современные идеи и терапевтическое значение» . Трансляционная онкология . 14 (9): 101166. doi : 10.1016/j.tranon.2021.101166 . ПМЦ 8271173 . ПМИД 34242964 .
- ^ «Смертность от рака» . Наш мир в данных . Проверено 4 октября 2019 г.
- ^ Перейти обратно: а б «Последние глобальные данные о раке: бремя рака возросло до 18,1 миллиона новых случаев и 9,6 миллиона случаев смерти от рака в 2018 году» (PDF) . iarc.fr. Проверено 5 декабря 2018 г.
- ^ Перейти обратно: а б Лозано Р., Нагави М., Форман К., Лим С., Сибуя К., Абоянс В. и др. (декабрь 2012 г.). «Глобальная и региональная смертность от 235 причин смерти в 20 возрастных группах в 1990 и 2010 годах: систематический анализ для исследования глобального бремени болезней 2010 года» . Ланцет . 380 (9859): 2095–128. дои : 10.1016/S0140-6736(12)61728-0 . hdl : 10536/DRO/DU:30050819 . ПМЦ 10790329 . ПМИД 23245604 . S2CID 1541253 .
- ^ Перейти обратно: а б Коулман В.Б., Рубинас Т.К. (2009). «4» . В Цонгалис Г.Дж., Коулман В.Л. (ред.). Молекулярная патология: молекулярная основа болезней человека . Амстердам: Elsevier Academic Press. п. 66. ИСБН 978-0-12-374419-7 . [ постоянная мертвая ссылка ]
- ^ Джонсон Дж. (28 декабря 2010 г.). «Раскопки доисторических опухолей и дебаты» . Нью-Йорк Таймс . Архивировано из оригинала 24 июня 2017 года.
- ^ Павелец Г., Дерхованессян Е., Ларби А. (август 2010 г.). «Иммуностарение и рак». Критические обзоры по онкологии/гематологии . 75 (2): 165–72. дои : 10.1016/j.critrevonc.2010.06.012 . ПМИД 20656212 .
- ^ Альбертс Б., Джонсон А., Льюис Дж. и др. (2002). «Предупредимые причины рака» . Молекулярная биология клетки (4-е изд.). Нью-Йорк: Garland Science. ISBN 978-0-8153-4072-0 . Архивировано из оригинала 2 января 2016 года.
Независимо от обстоятельств следует ожидать определенной неснижаемой фоновой заболеваемости раком: мутаций никогда нельзя полностью избежать, поскольку они являются неизбежным следствием фундаментальных ограничений точности репликации ДНК, как обсуждается в Глава 5. Если бы человек мог жить достаточно долго, неизбежно, что хотя бы одна из его клеток со временем накопила бы набор мутаций, достаточный для развития рака.
- ^ Анисимов В.Н., Сикора Е., Павелец Г. (август 2009 г.). «Связь между раком и старением: многоуровневый подход». Биогеронтология . 10 (4): 323–38. дои : 10.1007/s10522-008-9209-8 . ПМИД 19156531 . S2CID 17412298 .
- ^ де Магальяйнс JP (май 2013 г.). «Как процессы старения влияют на рак». Обзоры природы. Рак . 13 (5): 357–65. дои : 10.1038/nrc3497 . ПМИД 23612461 . S2CID 5726826 .
- ^ Дэвид С., Фраумени Дж.Ф. (24 августа 2006 г.). Эпидемиология и профилактика рака . Издательство Оксфордского университета. п. 977. ИСБН 978-0-19-974797-9 .
- ^ Боствик Д.Г., Эбл Дж.Н. (2007). Урологическая хирургическая патология . Сент-Луис: Мосби. п. 468. ИСБН 978-0-323-01970-5 .
- ^ Перейти обратно: а б Каатч П. (июнь 2010 г.). «Эпидемиология детского рака». Обзоры лечения рака . 36 (4): 277–285. дои : 10.1016/j.ctrv.2010.02.003 . ПМИД 20231056 .
- ^ Перейти обратно: а б Уорд Э., ДеСантис С., Роббинс А., Колер Б., Джемал А. (январь 2014 г.). «Статистика рака у детей и подростков, 2014» . КА . 64 (2): 83–103. дои : 10.3322/caac.21219 . ПМИД 24488779 . S2CID 34364885 .
- ^ Уорд Э.М., Тун М.Дж., Ханнан Л.М., Джемал А. (сентябрь 2006 г.). «Интерпретация тенденций рака». Анналы Нью-Йоркской академии наук . 1076 (1): 29–53. Бибкод : 2006NYASA1076...29W . дои : 10.1196/анналы.1371.048 . ПМИД 17119192 . S2CID 1579801 .
- ^ Перейти обратно: а б с д и ж Хайду С.И. (март 2011 г.). «Записка из истории: вехи истории рака, часть 1» . Рак . 117 (5): 1097–102. дои : 10.1002/cncr.25553 . ПМИД 20960499 . S2CID 39667103 .
- ^ Павел Эгинский, 7 век нашей эры, цитируется в Мосс Р.В. (2004). «Гален о раке» . Решения о раке. Архивировано из оригинала 16 июля 2011 года. Ссылка на Майкла Шимкина, «Вопреки природе», Вашингтон, округ Колумбия: суперинтендант документации, публикация DHEW № (NIH) 79–720, стр. 35.
- ^ Майно Г., Йорис I (12 августа 2004 г.). Клетки, ткани и болезни: Принципы общей патологии: Принципы общей патологии . Издательство Оксфордского университета. ISBN 978-0-19-974892-1 . Проверено 11 сентября 2013 г.
- ^ Перейти обратно: а б Хайду С.И. (июнь 2011 г.). «Записка из истории: вехи истории рака, часть 2» . Рак . 117 (12): 2811–20. дои : 10.1002/cncr.25825 . ПМИД 21656759 . S2CID 28148111 .
- ^ Ялом М (1998). История груди (1-е изд.). Нью-Йорк: Ballantine Books. ISBN 978-0-679-43459-7 .
- ^ Хайду С.И. (февраль 2012 г.). «Записка из истории: вехи истории рака, часть 3» . Рак . 118 (4): 1155–68. дои : 10.1002/cncr.26320 . ПМИД 21751192 . S2CID 38892895 .
- ^ Грейндж Дж. М., Стэнфорд Дж. Л., Стэнфорд, Калифорния (июнь 2002 г.). «Наблюдения Кэмпбелла Де Моргана о раке и их актуальность сегодня» . Журнал Королевского медицинского общества . 95 (6): 296–299. дои : 10.1177/014107680209500609 . ПМЦ 1279913 . ПМИД 12042378 .
- ^ Барбара Э. (ноябрь 2001 г.). «Добро пожаловать в Раковую страну» . Журнал Харпера . ISSN 0017-789X . Архивировано из оригинала 8 ноября 2013 года.
- ^ Позорский А (20 марта 2015 г.). «Противостояние слову на букву «С»: рак и смерть в художественной литературе Филипа Рота» . Исследования Филипа Рота . 11 (1): 105–123. дои : 10.5703/philrothstud.11.1.105 . ISSN 1940-5278 . S2CID 160969212 . Проверено 13 апреля 2020 г. .
- ^ Волластон С (4 мая 2015 г.). «Обзор C-Word – прекрасное свидетельство женщине, которая столкнулась с раком честно, воодушевленно и остроумно» . Хранитель . Проверено 13 апреля 2020 г. .
- ^ «Избегайте слова на букву «C», обозначающего рак щитовидной железы низкого риска» . Медскейп . Проверено 13 апреля 2020 г. .
- ^ «Слово на букву C: как мы сегодня реагируем на рак» . Сети Национальной службы здравоохранения . Архивировано из оригинала 22 октября 2020 года . Проверено 13 апреля 2020 г. .
- ^ Перейти обратно: а б с д Чочинов Х.М., Брейтбарт В. (2009). Справочник психиатрии по паллиативной медицине . Издательство Оксфордского университета. п. 196. ИСБН 978-0-19-530107-6 .
- ^ Рапини Р.П., Болонья Дж.Л., Хориццо Дж.Л. (2007). Дерматология: Набор из 2 томов . Сент-Луис: Мосби. ISBN 978-1-4160-2999-1 .
- ^ «Рак кожи» . Всемирная организация здравоохранения. Архивировано из оригинала 27 сентября 2010 года . Проверено 19 января 2011 г.
- ^ Маккалли М., Гринвелл П. (2007). Молекулярная терапия: медицина XXI века . Лондон: Дж. Уайли. п. 207. ИСБН 978-0-470-01916-0 . [ постоянная мертвая ссылка ]
- ^ Низкая G, Кэмерон Л. (1999). «10» . Исследование и применение метафоры . Издательство Кембриджского университета. ISBN 978-0-521-64964-3 .
- ^ Сулик Г.А. (2010). Блюз «Розовой ленты»: как культура рака молочной железы подрывает женское здоровье . Издательство Оксфордского университета. стр. 78–89. ISBN 978-0-19-974993-5 .
- ^ Перейти обратно: а б с Олсон Дж.С. (2005). Грудь Вирсавии: женщины, рак и история . Джу Пресс. стр. 145–70. ISBN 978-0-8018-8064-3 . OCLC 186453370 .
- ^ Перейти обратно: а б с д Эренрайх Б (2009). Яркая сторона: как неустанная пропаганда позитивного мышления подорвала Америку . Генри Холт и компания. стр. 15–44. ISBN 978-0-8050-8749-9 .
- ^ Хафф С. (24 сентября 2013 г.). «Больная стигма: почему больных раком обвиняют в их болезни?» . Сланец . Архивировано из оригинала 11 октября 2013 года.
- ^ «Экономическое воздействие рака» . Американское онкологическое общество . 3 января 2018 года . Проверено 5 июля 2018 г.
- ^ Бозанке Н., Сикора К. (2004). «Экономика лечения рака в Великобритании». Ланцет онкологии . 5 (9): 568–74. дои : 10.1016/S1470-2045(04)01569-4 . ПМИД 15337487 .
- ^ Мариотто А.Б., Яброфф К.Р., Шао Ю., Фойер Э.Дж., Браун М.Л. (2011). «Прогнозы стоимости лечения рака в США: 2010–2020 годы» . Журнал Национального института рака . 103 (2): 117–28. дои : 10.1093/jnci/djq495 . ПМК 3107566 . ПМИД 21228314 .
- ^ Йонссон Б., Хофмарчер Т., Линдгрен П., Вилкинг Н. (2016). «Стоимость и бремя рака в Европейском Союзе 1995–2014 гг.». Европейский журнал рака . 66 (октябрь): 162–70. дои : 10.1016/j.ejca.2016.06.022 . ПМИД 27589247 .
- ^ Перейти обратно: а б Хофмарчер Т., Линдгрен П., Вилкинг Н., Йонссон Б. (2020). «Стоимость рака в Европе 2018» . Европейский журнал рака . 129 (апрель): 41–49. doi : 10.1016/j.ejca.2020.01.011 . ПМИД 32120274 .
- ^ Луенго-Фернандес Р., Лил Дж., Грей А., Салливан Р. (2013). «Экономическое бремя рака в Европейском Союзе: анализ затрат на уровне населения». Ланцет онкологии . 14 (12): 1165–74. дои : 10.1016/S1470-2045(13)70442-X . ПМИД 24131614 .
- ^ Перейти обратно: а б Комиссия США по равным возможностям трудоустройства. «Вопросы и ответы о раке на рабочем месте и Законе об американцах с ограниченными возможностями (ADA)». https://www.eeoc.gov/laws/types/cancer.cfm
- ^ Гланц М.Дж., Чемберлен М.К., Лю К., Се С.К., Эдвардс К.Р., Ван Хорн А. и др. (ноябрь 2009 г.). «Гендерное неравенство в частоте отказа от партнера у пациентов с серьезными заболеваниями». Рак . 115 (22): 5237–5242. дои : 10.1002/cncr.24577 . ПМИД 19645027 .
- ^ Стивенс С., Вестмаас Дж.Л., Ким Дж., Каннади Р., Стейн К. (октябрь 2016 г.). «Гендерные различия в связях между проблемами, связанными с раком, и разрывом отношений среди людей, переживших рак». Журнал выживания после рака . 10 (5): 865–873. дои : 10.1007/s11764-016-0532-9 . ПМИД 26995006 .
- ^ Фугманн Д., Букер М., Хольстег С., Штайнер Н., Принс Дж., Каргер А. (9 марта 2022 г.). «Систематический обзор: влияние рака на уровень разводов» . Границы в психологии . 13 : 828656. doi : 10.3389/fpsyg.2022.828656 . ПМЦ 8959852 . ПМИД 35356338 .
- ^ «Что такое рак?» . Национальный институт рака . 17 сентября 2007 года . Проверено 28 марта 2018 г.
- ^ «Информационный бюллетень о раке» . Агентство по регистрации токсичных веществ и заболеваний. 30 августа 2002 года. Архивировано из оригинала 13 августа 2009 года . Проверено 17 августа 2009 г.
- ^ Ванек С. (16 сентября 2006 г.). «Новые захватывающие методы лечения рака появляются на фоне стойких мифов» . Живая наука . Архивировано из оригинала 16 мая 2008 года . Проверено 17 августа 2009 г.
- ^ Хайден ЕС (апрель 2009 г.). «Отрезаем пути распространения рака» . Природа . 458 (7239): 686–87. дои : 10.1038/458686b . ПМИД 19360048 .
- ^ Багри А., Курос-Мехр Х., Леонг К.Г., Пахарь Г.Д. (март 2010 г.). «Использование адъювантной терапии против VEGF при раке: проблемы и обоснование». Тенденции молекулярной медицины . 16 (3): 122–32. doi : 10.1016/j.molmed.2010.01.004 . ПМИД 20189876 .
- ^ Сани С.Х., Бартон CL (2010). «Перепрофилирование стратегий терапии». Фармацевтическая медицина . 24 (3): 151–59. дои : 10.1007/BF03256811 . S2CID 25267555 .
- ^ Винтер Х, Йоргенсен Дж.Т. (2010). «Совместная разработка лекарств и диагностики рака». Фармацевтическая медицина . 24 (6): 363–75. дои : 10.1007/BF03256837 . S2CID 43505621 .
- ^ Бегли С. (16 сентября 2008 г.). «Переосмысление войны с раком» . Newsweek . Архивировано из оригинала 10 сентября 2008 года . Проверено 8 сентября 2008 г.
- ^ Перейти обратно: а б Колата Г. (23 апреля 2009 г.). «Неуловимые достижения в борьбе с раком» . Нью-Йорк Таймс . Архивировано из оригинала 14 января 2012 года . Проверено 5 мая 2009 г.
- ^ Альбертс Б. , Киршнер М.В., Тилман С. (2014). «Спасение биомедицинских исследований США от их системных недостатков» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (16): 5773–77. Бибкод : 2014PNAS..111.5773A . дои : 10.1073/pnas.1404402111 . ПМК 4000813 . ПМИД 24733905 .
- ^ Колата Г (27 июня 2009 г.). «Система грантов побуждает исследователей рака действовать осторожно» . Нью-Йорк Таймс . Архивировано из оригинала 8 июня 2011 года . Проверено 29 декабря 2009 г.
- ^ Пауэлл К. (2016). «Молодые, талантливые и сытые: ученые рассказывают свои истории» . Природа . 538 (7626): 446–49. Бибкод : 2016Natur.538..446P . дои : 10.1038/538446а . ПМИД 27786221 . S2CID 4465686 .
- ^ «Мнение | Я онколог. Мои худшие опасения по поводу Covid и рака сбываются» . Новости Эн-Би-Си . 12 февраля 2021 г.
- ^ «Не жертвуйте лечением рака ради COVID» . Нью-Йорк Дейли Ньюс . 13 января 2021 г.
- ^ Перейти обратно: а б «Революционные нанодроны позволяют целенаправленно лечить рак» . ScienceDaily . Проверено 24 марта 2024 г.
- ^ Перейти обратно: а б с д и ж Ярбро Ч., Вуйчик Д., Гобель Б.Х. (2010). Сестринское дело при раке: принципы и практика . Джонс и Бартлетт Обучение. стр. 901–905. ISBN 978-0-7637-6357-2 .
- ^ Тамм Д. (март 2009 г.). «Как животные-компаньоны способствуют борьбе с раком у людей» (PDF) . Итальянская ветеринария . 54 (1): 111–20. ПМИД 20391394 . Архивировано (PDF) из оригинала 23 июля 2014 года . Проверено 18 июля 2014 г.
- ^ Винце О., Кольшеро Ф., Леметр Ж.Ф., Конде Д.А., Павар С., Бьевиль М. и др. (январь 2022 г.). «Риск рака у млекопитающих» . Природа . 601 (7892): 263–267. Бибкод : 2022Natur.601..263V . дои : 10.1038/s41586-021-04224-5 . ПМЦ 8755536 . ПМИД 34937938 . S2CID 245425871 .
- ^ Мурджиа С., Притчард Дж.К., Ким С.Ю., Фассати А., Вайс Р.А. (август 2006 г.). «Клональное происхождение и эволюция трансмиссивного рака» . Клетка . 126 (3): 477–87. дои : 10.1016/j.cell.2006.05.051 . ПМЦ 2593932 . ПМИД 16901782 .
Дальнейшее чтение
- Баст Р.К., Кроу С.М., Хаит В.Н., Хонг В.К., Куфе Д.В., Пиккарт-Гебхарт М. и др. (2016). Холланд-Фрай, онкологическая медицина . Уайли. ISBN 978-1-118-93469-2 .
- Кляйнсмит ЖЖ (2006). Принципы биологии рака . Пирсон Бенджамин Каммингс. ISBN 978-0-8053-4003-7 .
- Мукерджи С. (2010). Император всех болезней: биография рака . Саймон и Шустер. ISBN 978-1-4391-0795-9 . Проверено 7 августа 2013 г.
- Паздур Р., Кампхаузен К.А., Вагман Л.Д., Хоскинс У.Дж. (2009). Лечение рака: междисциплинарный подход . CMP United Business Media. ISBN 978-1-891483-62-2 . Рак в Google Книгах . Архивировано из оригинала 15 мая 2009 года.
- Шваб М (2008). Энциклопедия рака . Springer Science & Business Media. ISBN 978-3-540-36847-2 .
- Таннок I (2005). Фундаментальная наука онкология . МакГроу-Хилл Профессионал. ISBN 978-0-07-138774-3 .



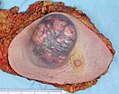

![Гистопатология мелкоклеточного рака с типичными находками.[127]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/43/Histopathology_of_small_cell_carcinoma%2C_annotated.png/120px-Histopathology_of_small_cell_carcinoma%2C_annotated.png)