Афлатоксин Б 1
 Химическая структура (-)-афлатоксина B 1 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК (6a R ,9a S )-4-Метокси-2,3,6a,9a-тетрагидроциклопента[ c ]фуро[3',2':4,5]фуро[2,3- h ][1]бензопиран-1 ,11-дион | |
| Другие имена НСК 529592 | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.013.276 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 17 Н 12 О 6 | |
| Молярная масса | 312.277 g·mol −1 |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Канцероген – Мутаген – Острая токсичность / Яд [3] |
| СГС Маркировка : | |
  | |
| Опасность | |
| Х300 , Х310 , Х330 , Х340 , Х350 | |
| P201 , P202 , P260 , P262 , P264 , P270 , P271 , P280 , P281 , P284 , P301+P330+P331 , P350 , P304+P340 , P308+P313 , P310 , P311 , П321 20 , П322 , П330 , P302 + , П361 , П363 , П403+П233 , П405 , П501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Афлатоксин B 1 представляет собой афлатоксин, продуцируемый Aspergillus flavus и A. parasiticus . Это очень сильный канцероген с TD 50 3,2 мкг/кг/день для крыс. [4] Эта канцерогенная активность варьируется у разных видов, причем некоторые из них, например крысы и обезьяны, по-видимому, гораздо более восприимчивы, чем другие. [5] [6] Афлатоксин B 1 является распространенным загрязнителем различных пищевых продуктов, включая арахис, хлопковую муку, кукурузу и другие зерна; [7] а также корма для животных. [8] Афлатоксин B 1 считается наиболее токсичным афлатоксином и активно участвует в развитии гепатоцеллюлярной карциномы (ГЦК) у человека. [9] У животных афлатоксин B1 также оказался мутагенным . [10] тератогенный , [11] и вызвать иммуносупрессию . [12] проверки Для афлатоксином B1 в загрязнение на продукты питания. [13] По данным Продовольственной и сельскохозяйственной организации (ФАО), подразделения ООН , во всем мире максимально переносимые уровни афлатоксина B 1 находятся в диапазоне 1–20 мкг/кг (или 0,001 ppm – 1 часть). на миллиард) в продуктах питания и 5–50 мкг/кг (0,005 частей на миллион) в пищевых кормах для крупного рогатого скота в 2003 году. [14]
Источники воздействия
[ редактировать ]Афлатоксин B 1 в основном содержится в загрязненных пищевых продуктах, и люди почти полностью подвергаются воздействию афлатоксина B 1 через свой рацион. [15] профессиональном воздействии афлатоксина B 1 на свиней. Сообщалось также о [16] и птицеводство. [17] Хотя загрязнение афлатоксином B1 распространено во многих основных продуктах питания, его производство максимально увеличивается в продуктах, хранящихся в жарком и влажном климате. [18] Таким образом, заражение наиболее распространено в Юго-Восточной Азии, Южной Америке и странах Африки к югу от Сахары. [18]
Патология
[ редактировать ]Афлатоксин B 1 может проникать через кожу. Воздействие этого афлатоксина на кожу в определенных условиях окружающей среды может привести к серьезным рискам для здоровья. [19] Печень является наиболее чувствительным органом к токсичности афлатоксина B1 . В исследованиях на животных патологические поражения, связанные с интоксикацией афлатоксином В 1 , включали уменьшение массы печени, [20] вакуолизация гепатоцитов , [21] печени и рак . [22] Другие поражения печени включают увеличение печеночных клеток, жировую инфильтрацию, некроз , кровоизлияния , фиброз , регенерацию узелков и пролиферацию/ гиперплазию желчных протоков . [23]
Аспергилл желтый
[ редактировать ]Aspergillus flavus — гриб семейства Trichocomaceae, распространенный по всему миру. Плесень живет в почве, выживая за счет мертвых растений и животных, но распространяется по воздуху через конидии, передающиеся по воздуху . [24] Этот гриб растет в длинных разветвленных гифах и способен выживать на многочисленных источниках пищи, включая кукурузу и арахис. [25] Гриб и продукты его жизнедеятельности патогенны для ряда видов, включая человека. [24] Хотя токсичность продуктов Aspergillus flavus, афлатоксинов, рассматривается в этой статье, сам Aspergillus flavus также оказывает патогенное воздействие через аспергиллез или заражение плесенью. Эта инфекция в основном возникает в легких пациентов с ослабленным иммунитетом, но инфекция может также возникать в коже или других органах. [26] В отличие от многих видов плесени, Aspergillus flavus предпочитает жаркие и сухие условия. Его оптимальный рост при температуре 37 ° C (99 ° F) способствует его патогенности для человека. [24]
Биосинтетический путь
[ редактировать ]Афлатоксин B 1 происходит как из специализированной синтазы жирных кислот (FAS), так и из поликетидсинтазы (PKS), вместе известных как синтаза норсолориновой кислоты. Биосинтез начинается с синтеза гексаноата ФАС, который затем становится стартовой единицей для итеративного ПКС I типа. [27] [28] [29] PKS добавляет малонил-КоА к гексаноату семь удлинителей с образованием поликетидного соединения C20. PKS сворачивает поликетид особым образом, вызывая циклизацию с образованием антрахинона норсолориновой кислоты. Затем редуктаза катализирует восстановление кетона на боковой цепи норсолориновой кислоты с образованием аверантина. [27] [28] [29] Аверантин превращается в аверуфин с помощью двух разных ферментов: гидроксилазы и алкогольдегидрогеназы. Это приведет к насыщению кислородом и циклизации боковой цепи аверантина с образованием кеталя в аверуфине.
С этого момента путь биосинтеза афлатоксина B 1 становится намного более сложным и сопровождается несколькими серьезными скелетными изменениями. Большинство ферментов не охарактеризовано, и возможно, существуют еще несколько промежуточных продуктов, которые до сих пор неизвестны. [27] Однако известно, что аверуфин окисляется Р450- оксидазой AvfA при окислении Байера-Виллигера . При этом эфирные кольца раскрываются, и при перегруппировке образуется версикональ-ацетат. Теперь эстераза EstA катализирует гидролиз ацетила, образуя первичный спирт в версиконале. [27] [29] Ацеталь версиколорина А образуется в результате циклизации боковой цепи версиколорина, которая катализируется VERB-синтазой, а затем VerB, десатураза, восстанавливает версиколорин B с образованием дигидробисфурана. [27] [29]
Есть еще два фермента, катализирующих превращение версиколорина А в деметилстеригматоцистин: AflN — оксидаза и AflM — редуктаза. Эти ферменты используют как молекулярный кислород, так и два НАДФН для дегидратации одной из гидроксильных групп антрахинона и открытия хинина молекулярным кислородом. [27] [29] После образования альдегида на стадии раскрытия кольца он окисляется с образованием карбоновой кислоты, а затем происходит событие декарбоксилирования, замыкающее кольцо, образуя шестичленную эфирную кольцевую систему, наблюдаемую в деметилстеригматоцистине. Следующими двумя этапами пути биосинтеза является метилирование S -аденозилметионином (SAM) двух гидроксильных групп ксантоновой части деметистеригматоцистина двумя разными метилтрансферазами, OmtB и OmtA. [27] [29] В результате образуется О -метилстеригматоцистин. На заключительных стадиях происходит окислительное расщепление ароматического кольца и потеря одного углерода в О -метилстеригматоцистине, что катализируется OrdA, оксидоредуктазой . [27] [29] Затем происходит окончательная рециклизация с образованием афлатоксина В 1 .
Механизм канцерогенности
[ редактировать ]Афлатоксин B 1 является мощным генотоксичным гепатоканцерогеном, воздействие которого тесно связано с развитием гепатоцеллюлярной карциномы и опухолей печени, особенно при коинфекции вирусом гепатита B. [18] Эти эффекты, по-видимому, в значительной степени опосредованы мутациями гуанина в кодоне 249 гена р53 , гена, подавляющего опухоль. [30] и в нескольких остатках гуанина в 12-м и 13-м кодонах гена ras , гена, продукт которого контролирует сигналы клеточной пролиферации. [31] [32] Афлатоксин B 1 должен сначала метаболизироваться в его реактивную электрофильную форму, афлатоксин B 1 -8,9-экзоэпоксид, с помощью цитохрома p450. [18] Эта активная форма затем интеркалирует между остатками оснований ДНК и образует аддукты с остатками гуанина, чаще всего с афлатоксином B 1 -N7-Gua. Эти аддукты могут затем перегруппировываться или полностью удаляться из основной цепи, образуя апуриновый сайт. Эти аддукты и изменения представляют собой повреждения, которые при репликации ДНК вызывают вставку несовпадающего основания в противоположную цепь. До 44% гепатоцеллюлярных карцином в регионах с высоким уровнем воздействия афлатоксина имеют трансверсию GC → TA в кодоне 249 р53, характерную мутацию, наблюдаемую для этого токсина. [32]
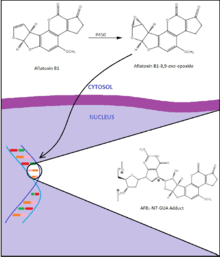
Распространенность гепатоцеллюлярной карциномы у лиц, подвергшихся воздействию афлатоксина, увеличивается при коинфекции вирусом гепатита В. По оценкам одного исследования, люди с биомаркерами афлатоксина в моче подвергались в три раза большему риску развития гепатоцеллюлярной карциномы, чем нормальная популяция; инфицированные вирусом гепатита В подвергались четырехкратному риску; а люди с биомаркерами афлатоксина и инфицированные вирусом гепатита В имели в 60 раз больший риск развития гепатоцеллюлярной карциномы, чем нормальное население. [33] [32]
Токсичность
[ редактировать ]Несколько исследований токсичности афлатоксина B 1 было проведено на различных видах животных. [34]
- Острая токсичность
- Диапазон пероральной LD 50 афлатоксина B 1 оценивается в 0,3–17,9 мг/кг массы тела для большинства видов животных. [35] Например, пероральная LD 50 афлатоксина B 1 оценивается в 17,9 мг/кг массы тела у самок крыс и 7,2 мг/кг массы тела у самцов крыс. У самцов крыс внутрибрюшинная ЛД 50 афлатоксина В 1 оценивается в 6,0 мг/кг массы тела. [36] Симптомы включают анорексию, недомогание и субфебрильную температуру. [37]
- Подострая токсичность
- Исследования подострой токсичности афлатоксина B 1 на животных показали поражение печени от умеренного до тяжелого. Например, исследования подострой токсичности на обезьянах показали воспаление воротной вены и жировое изменение. [38]
- Хроническая токсичность
- Исследования хронической токсичности афлатоксина B 1 на цыплятах показали снижение концентрации печеночного микросомального цитохрома P-450, снижение потребления корма и снижение привеса. [39]
- Субхроническая токсичность
- Исследования субхронической токсичности афлатоксина B 1 у рыб показали, что у рыб наблюдаются предопухолевые поражения одновременно с изменениями в жабрах, поджелудочной железе, кишечнике и селезенке. [40]
- Генотоксичность
- Обработка клеток печени человека афлатоксином В 1 в дозах 3–5 мкмоль/л приводила к образованию аддуктов афлатоксина В 1 - ДНК , повреждениям 8-гидроксигуанина и повреждению ДНК . [41]
- Канцерогенность
- В исследованиях на крысах сообщалось о канцерогенности афлатоксина B 1 , которая характеризуется развитием рака печени. [42]
- Эмбриотоксичность
- эмбриональной гибели и нарушении эмбрионального развития фабрициевой сумки у кур под действием афлатоксина В1 . Сообщалось об [43]
- Тератогенность
- тератогенные эффекты афлатоксина B 1 Сообщалось, что у кроликов включают, среди прочего, снижение веса плода, падение запястий, увеличение глазницы , агенезию , хвостовых позвонков микрофтальмию , пороки сердца и дегенерацию хрусталика. [44]
- Иммунотоксичность
- Исследования на рыбах показали, что афлатоксин B 1 оказывает значительное иммунодепрессивное действие, включая снижение общего уровня глобулина в сыворотке и снижение бактерицидной активности. [45]
Управление рисками и регулирование
[ редактировать ]Воздействие афлатоксина B 1 лучше всего контролировать с помощью мер, направленных на предотвращение заражения сельскохозяйственных культур в поле, послеуборочной обработки и хранения, или с помощью мер, направленных на обнаружение и обеззараживание загрязненных товаров или материалов, используемых в кормах для животных. Например, биологическая очистка, включающая использование одного вида бактерий, Flavobacterium aurantiacum, использовалась для удаления афлатоксина B 1 из арахиса и кукурузы. [46]
В нескольких странах мира действуют правила и положения, регулирующие содержание афлатоксина B 1 в пищевых продуктах, и они включают максимально разрешенные или рекомендуемые уровни афлатоксина B 1 для определенных продуктов. [47]
- Соединенные Штаты (США)
- Правила безопасности пищевых продуктов США установили максимально допустимый уровень 20 мкг/кг для афлатоксина B 1 в сочетании с другими афлатоксинами (B 2 , G 1 и G 2 ) во всех пищевых продуктах, за исключением молока, для которого разрешен максимально допустимый уровень. уровень 0,5 мкг/кг. Для некоторых кормов для животных допустимы более высокие уровни 100–300 мкг/кг. [48] [49]
- Европейский Союз (ЕС)
- ЕС установил максимально допустимые уровни афлатоксина B 1 в орехах, сухофруктах, крупах и специях в диапазоне 2–12 мкг/кг, тогда как максимально разрешенный уровень афлатоксина B 1 в детском питании установлен на уровне 0,1 мкг/кг. [46] Максимально разрешенные уровни афлатоксина B 1 в кормах для животных, установленные ЕС, варьируются от 5 до 50 мкг/кг, и эти уровни намного ниже, чем уровни, установленные в США. [50]
- Объединенный комитет экспертов Продовольственной и сельскохозяйственной организации Объединенных Наций (ФАО)/Всемирной организации здравоохранения (ВОЗ) по пищевым добавкам (JECFA)
- JECFA ФАО/ВОЗ установил максимально допустимые уровни афлатоксина B 1 в сочетании с другими афлатоксинами (B 2 , G 1 и G 2 ) на уровне 15 мкг/кг в сыром арахисе и 10 мкг/кг в обработанном арахисе; в то время как уровень толерантности только к афлатоксину B 1 составляет 5 мкг/кг для корма для молочного скота. [51] [52]
Известные разоблачения
[ редактировать ]Открытие афлатоксина B 1 произошло сразу после массовой гибели индеек в Англии летом 1960 года от какой-то неизвестной болезни, в то время получившей название «Болезнь X». В ходе 500 вспышек болезнь унесла жизни более 100 000 индеек, которые выглядели здоровыми. Позже выяснилось, что массовая смерть была вызвана Aspergillus flavus . заражением арахисовой муки [53] [54]
Двенадцать пациентов умерли от острого отравления афлатоксином в нескольких больницах округа Мачакос в Кении в 1981 году после употребления зараженной кукурузы. Все пациенты также страдали гепатитом. [55]
После вспышек заражения кукурузы афлатоксином, достигших 4400 частей на миллиард весной 2004 года, 125 человек в Кении умерли от острой печеночной недостаточности, а всего было зарегистрировано около 317 случаев. На сегодняшний день это была крупнейшая известная вспышка афлатоксикоза с точки зрения зарегистрированного количества погибших. [37]
Ссылки
[ редактировать ]- ^ «AFLATC: сольват афлатоксина B 1 с хлороформом» . Кембриджская структурная база данных : Структуры доступа . Кембриджский центр кристаллографических данных . Проверено 23 марта 2021 г.
- ^ ван Зост Т.К., Пердеман А.Ф. (1970). «Кристаллические структуры афлатоксина В 1 . I. Строение хлороформного сольвата афлатоксина В 1 и абсолютная конфигурация афлатоксина В 1 ». Акта Кристаллогр. Б. 26 (12): 1940–1947. дои : 10.1107/S0567740870005228 .
- ^ «Афлатоксин В1» . ПабХим . Национальная медицинская библиотека США.
- ^ «Сводная таблица результатов канцерогенности по химическим веществам в CPDB для химических веществ 1547» (PDF) . Токснет .
- ^ Маклин М., Даттон М.Ф. (февраль 1995 г.). «Клеточные взаимодействия и метаболизм афлатоксина: обновленная информация». Фармакология и терапия . 65 (2): 163–192. дои : 10.1016/0163-7258(94)00054-7 . ПМИД 7540767 .
- ^ «Афлатоксин В1 (CAS 1162-65-8)» . Проект канцерогенной активности .
- ^ Гальвано Ф, Ритьени А, Пива Г, Пьетри А (2005). «Микотоксины в пищевой цепи человека». . В Диас Д.Е. (ред.). Синяя книга по микотоксинам . Ноттингем, Великобритания: Издательство Ноттингемского университета. стр. 187–224.
- ^ Азаб Р.М., Таваккол В.М., Хамад А.М., Абу-Эльмагд М.К., Эль-Аграб Х.М., Рефаи М.К. (2005). «Обнаружение и оценка афлатоксина В1 в кормах и его биодеградация бактериями и грибами» . Египетский журнал природных токсинов . 2 : 39–56.
- ^ Чен Т, Лю Дж, Ли Ю, Вэй С (февраль 2022 г.). «Бремя болезней, связанных с воздействием афлатоксинов в питании, в Китае в 2020 году» . Питательные вещества . 14 (5): 1027. дои : 10.3390/nu14051027 . ПМЦ 8912679 . ПМИД 35268003 .
- ^ Чен Т., Хефлих Р.Х., Мур М.М., Мэй Н. (март 2010 г.). «Дифференциальная мутагенность афлатоксина В1 в печени новорожденных и взрослых мышей» . Экологический и молекулярный мутагенез . 51 (2): 156–163. дои : 10.1002/em.20518 . ПМК 6359889 . ПМИД 19642212 .
- ^ Гейсслер Ф., Фаустман Э.М. (февраль 1988 г.). «Токсичность развития афлатоксина B1 у эмбрионов грызунов in vitro: вклад экзогенных систем биотрансформации в токсичность». Тератология . 37 (2): 101–111. дои : 10.1002/tera.1420370203 . ПМИД 3127910 .
- ^ Мейсонье Г.М., Пинтон П., Лаффит Дж., Коссалтер А.М., Гонг Ю.И., Уайлд К.П. и др. (сентябрь 2008 г.). «Иммунотоксичность афлатоксина B1: нарушение клеточного ответа на вакцинный антиген и модуляция экспрессии цитокинов». Токсикология и прикладная фармакология . 231 (2): 142–149. дои : 10.1016/j.taap.2008.04.004 . ПМИД 18501398 .
- ^ Ваку А.П., Вендиро Д., Вузи ПК, Хавумба Дж.Ф. (2014). «Методы обнаружения афлатоксинов в сельскохозяйственных пищевых культурах» . Журнал прикладной химии . 2014 : 1–15. дои : 10.1155/2014/706291 .
- ^ «Всемирные правила содержания микотоксинов в пищевых продуктах и кормах в 2003 г.» . Продовольственная и сельскохозяйственная организация . Объединенные Нации.
- ^ Куломб Р.А. (март 1993 г.). «Биологическое действие микотоксинов» . Журнал молочной науки . 76 (3): 880–891. doi : 10.3168/jds.s0022-0302(93)77414-7 . ПМИД 8463495 .
- ^ Вьегас С., Вейга Л., Фигередо П., Алмейда А., Каролино Э., Сабино Р. и др. (2013). «Профессиональное воздействие афлатоксина B1 в свиноводстве и возможные источники загрязнения». Журнал токсикологии и гигиены окружающей среды. Часть А. 76 (15): 944–951. дои : 10.1080/15287394.2013.826569 . hdl : 10400.21/2889 . ПМИД 24156697 . S2CID 36686813 .
- ^ Вьегас С., Вейга Л., Мальта-Вакас Дж., Сабино Р., Фигередо П., Алмейда А. и др. (2012). «Профессиональное воздействие афлатоксина (AFB₁) в птицеводстве». Журнал токсикологии и гигиены окружающей среды. Часть А. 75 (22–23): 1330–1340. дои : 10.1080/15287394.2012.721164 . HDL : 10400.21/1927 . ПМИД 23095151 . S2CID 205866375 .
- ^ Jump up to: а б с д Кью MC (сентябрь 2013 г.). «Афлатоксины как причина гепатоцеллюлярной карциномы». Журнал желудочно-кишечных заболеваний и заболеваний печени . 22 (3): 305–310. ПМИД 24078988 .
- ^ Боонен Дж., Малышева С.В., Таевернье Л., Диана Ди Мавунгу Дж., Де Сагер С., Де Шпигелер Б (ноябрь 2012 г.). «Проникновение избранных модельных микотоксинов в кожу человека». Токсикология . 301 (1–3): 21–32. дои : 10.1016/j.tox.2012.06.012 . ПМИД 22749975 .
- ^ Фернандес А., Рамос Х.Дж., Санс М., Саес Т., Фернандес де Луко Д. (1996). «Изменения продуктивности, гематологии и клинической биохимии растущих ягнят, которых кормили афлатоксином в рационе». Журнал прикладной токсикологии . 16 (1): 85–91. doi : 10.1002/(SICI)1099-1263(199601)16:1<85::AID-JAT315>3.0.CO;2-T . ПМИД 8821681 .
- ^ Эспада Ю., Доминго М., Гомес Дж., Кальво М.А. (ноябрь 1992 г.). «Патологические поражения после экспериментальной интоксикации афлатоксином В1 у цыплят-бройлеров». Исследования в области ветеринарии . 53 (3): 275–9. дои : 10.1016/0034-5288(92)90127-н . ПМИД 1465501 .
- ^ Ларссон П., Буск Л., Тьялве Х. (май 1994 г.). «Печеночная и внепеченочная биоактивация и GSH-конъюгация афлатоксина B1 у овец». Канцерогенез . 15 (5): 947–955. дои : 10.1093/carcin/15.5.947 . ПМИД 8200100 .
- ^ Паттерсон Д.С. (1977). «Афлатоксин и родственные соединения: Введение». В Wyllie TD, Morehouse LG (ред.). Микотоксические грибы, микотоксины, микотоксикозы: Энциклопедический справочник . Том. 1 (1-е изд.). Нью-Йорк, штат Нью-Йорк, США: Marcel Dekker Inc., стр. 131–135. ISBN 978-0-8247-6550-7 .
- ^ Jump up to: а б с Хедаяти М.Т., Паскуалотто AC, Уорн П.А., Бойер П., Деннинг Д.В. (июнь 2007 г.). «Aspergillus flavus: патоген человека, аллерген и продуцент микотоксинов» . Микробиология . 153 (Часть 6): 1677–1692. дои : 10.1099/mic.0.2007/007641-0 . ПМИД 17526826 .
- ^ «Aspergillus flavus :: Центр комплексных исследований грибов» . www.cifr.ncsu.edu . Проверено 8 мая 2017 г.
- ^ «Определение аспергиллеза | Аспергиллез | Виды грибковых заболеваний | Грибковые заболевания | CDC» . www.cdc.gov . Проверено 8 мая 2017 г.
- ^ Jump up to: а б с д и ж г час Дьюик ПМ (2009). Лекарственные натуральные продукты: биосинтетический подход (3-е изд.). Уайли. стр. 122–124. ISBN 978-0-470-74279-2 .
- ^ Jump up to: а б Сингх Р., Се Д.П. (январь 1977 г.). «Путь биосинтеза афлатоксина: выяснение с использованием заблокированных мутантов Aspergillus parasiticus». Архив биохимии и биофизики . 178 (1): 285–292. дои : 10.1016/0003-9861(77)90193-x . ПМИД 836036 .
- ^ Jump up to: а б с д и ж г Ю Дж., Чанг П.К., Эрлих К.С., Кэри Дж.В., Бхатнагар Д., Кливленд Т.Э. и др. (март 2004 г.). «Кластерные гены пути биосинтеза афлатоксина» . Прикладная и экологическая микробиология . 70 (3): 1253–1262. Бибкод : 2004ApEnM..70.1253Y . дои : 10.1128/АЕМ.70.3.1253-1262.2004 . ПМЦ 368384 . ПМИД 15006741 .
- ^ Белок-супрессор опухоли р53 . Национальный центр биотехнологической информации (США). Январь 1998 года.
- ^ Фернандес-Медарде А., Сантос Э (март 2011 г.). «Рас при раке и заболеваниях развития» . Гены и рак . 2 (3): 344–358. дои : 10.1177/1947601911411084 . ПМК 3128640 . ПМИД 21779504 .
- ^ Jump up to: а б с Смела М.Э., Карриер С.С., Бейли Э.А., Эссигманн Дж.М. (апрель 2001 г.). «Химия и биология афлатоксина B(1): от мутационной спектрометрии к канцерогенезу» . Канцерогенез . 22 (4): 535–545. дои : 10.1093/carcin/22.4.535 . ПМИД 11285186 .
- ^ Росс Р.К., Юань Дж.М., Ю М.К., Воган Г.Н., Цянь Г.С., Ту Дж.Т. и др. (апрель 1992 г.). «Мочевые биомаркеры афлатоксина и риск гепатоцеллюлярной карциномы». Ланцет . 339 (8799): 943–946. дои : 10.1016/0140-6736(92)91528-г . ПМИД 1348796 . S2CID 30127032 .
- ^ Воган Г.Н. (июнь 1966 г.). «Химическая природа и биологическое действие афлатоксинов» . Бактериологические обзоры . 30 (2): 460–470. дои : 10.1128/BR.30.2.460-470.1966 . ПМК 441006 . ПМИД 5327461 .
- ^ Агаг Б.И. (2004). «Микотоксины в пищевых продуктах и кормах. 1-афлатоксины». Бюллетень экологических исследований Университета Асьюта . 7 (1): 173–205. дои : 10.21608/auber.2004.150623 .
- ^ Батлер WH (декабрь 1964 г.). «Острая токсичность афлатоксина B1 у крыс» . Британский журнал рака . 18 (4): 756–762. дои : 10.1038/bjc.1964.87 . ПМК 2071183 . ПМИД 14264941 .
- ^ Jump up to: а б Аззиз-Баумгартнер Э., Линдблэйд К., Гизекер К., Роджерс Х.С., Кишак С., Ньяпау Х. и др. (декабрь 2005 г.). «Исследование случай-контроль вспышки острой афлатоксикоза, Кения, 2004 г.» . Перспективы гигиены окружающей среды . 113 (12): 1779–1783. дои : 10.1289/ehp.8384 . JSTOR 3436751 . ПМЦ 1314920 . ПМИД 16330363 .
- ^ Тулпуле П.Г., Мадхаван ТВ, Гопалан С (май 1964 г.). «Эффект кормления афлатоксином молодых обезьян». Ланцет . 1 (7340): 962–963. дои : 10.1016/s0140-6736(64)91748-9 . ПМИД 14121357 .
- ^ Далви Р.Р., Макгоуэн С. (март 1984 г.). «Экспериментальная индукция хронического афлатоксикоза у кур очищенным афлатоксином B1 и его устранение активированным углем, фенобарбиталом и восстановленным глутатионом» . Птицеводство . 63 (3): 485–491. дои : 10.3382/ps.0630485 . ПМИД 6425817 .
- ^ Саху ПК, Мукерджи СК, Наяк СК, Дей С (2001). Острая и субхроническая токсичность афлатоксина B1 для роху, Labeo rohita (Гамильтон). Индийский J Exp Biol. 39(5): 453-8.
- ^ Гурсой-Юзугуллу О, Юзугуллу Х, Йылмаз М, Озтюрк М (апрель 2011 г.). «Генотоксичность афлатоксина связана с дефектной реакцией на повреждение ДНК в обход активации р53». Печень Интернационал . 31 (4): 561–571. дои : 10.1111/j.1478-3231.2011.02474.x . hdl : 11693/21978 . ПМИД 21382167 . S2CID 18055477 .
- ^ Ньюберн П.М., Воган Г.Н. (апрель 1968 г.). «Последовательные морфологические изменения в канцерогенезе афлатоксина B у крыс». Исследования рака . 28 (4): 770–781. ПМИД 4296938 .
- ^ Сур Э, Челик I (сентябрь 2003 г.). «Влияние афлатоксина B1 на развитие фабрициевой сумки и кислой фосфатазы лимфоцитов крови курицы». Британская наука о птицеводстве . 44 (4): 558–566. дои : 10.1080/00071660310001618352 . ПМИД 14584846 . S2CID 23402434 .
- ^ Вангикар П.Б., Двиведи П., Синха Н., Шарма А.К., Теланг А.Г. (апрель 2005 г.). «Влияние афлатоксина B1 на развитие эмбриона и плода кроликов». Пищевая и химическая токсикология . 43 (4): 607–615. дои : 10.1016/j.fct.2005.01.004 . ПМИД 15721209 .
- ^ Саху ПК, Мукерджи СК (2001). Иммуносупрессивное действие афлатоксина B1 у индийского карпа (Labeo rohita). Комп Иммунол Микробиол Инфект Дис. 24(3):143-9.
- ^ Jump up to: а б «Афлатоксины» . Архивировано из оригинала 6 июля 2017 г. Проверено 7 декабря 2015 г.
- ^ Рустом И.Я. (1997). «Афлатоксин в пищевых продуктах и кормах: возникновение, законодательство и инактивация физическими методами». Пищевая химия . 59 : 57–67. дои : 10.1016/S0308-8146(96)00096-9 .
- ^ Пак Д.Л., Нджапау Х. (1989). «Проблемы загрязнения, технологии». Журнал Американского общества нефтехимиков . 66 (10): 1402–1405. дои : 10.1007/BF02661958 .
- ^ Пак Д.Л., Лян Б. (октябрь 1993 г.). «Перспективы контроля афлатоксина в продуктах питания человека и кормах для животных». Тенденции в пищевой науке и технологиях . 4 (10): 334–342. дои : 10.1016/0924-2244(93)90104-I .
- ^ ЕЭС (1991). Директива Совета ЕЭС 91/126/EEC. Внесение изменений в приложения к Директиве Совета 74/63/EEC о нежелательных веществах и продуктах в питании животных. Выключенный. Дж. Эур. Коммун., № Л 60.
- ^ ФАО/ВОЗ (1990). Программа стандартов ФАО/ВОЗ. Комиссия Кодекса Алиментариус, Алинорм 91/29.
- ^ ФАО/ВОЗ (1992). Программа стандартов ФАО/ВОЗ. Комиссия Кодекса Алиментариус, Алинорм 93/12.
- ^ Ванноп CC (январь 1961 г.). «Гистопатология турецкой болезни «X» в Великобритании». Птичьи болезни . 5 (4): 371–381. дои : 10.2307/1587768 . JSTOR 1587768 .
- ^ Ричард Дж.Л. (январь 2008 г.). «Открытие афлатоксинов и важные исторические особенности». Обзоры токсинов . 27 (3–4): 171–201. дои : 10.1080/15569540802462040 . ISSN 1556-9543 . S2CID 85650401 .
- ^ Нгинду А., Джонсон Б.К., Кения П.Р., Нгира Дж.А., Оченг Д.М., Нандва Х. и др. (июнь 1982 г.). «Вспышка острого гепатита, вызванная отравлением афлатоксином в Кении». Ланцет . 1 (8285): 1346–1348. дои : 10.1016/S0140-6736(82)92411-4 . ПМИД 6123648 . S2CID 36408376 .
Внешние ссылки
[ редактировать ] СМИ, связанные с афлатоксином B1, на Викискладе?
СМИ, связанные с афлатоксином B1, на Викискладе? - «Афлатоксин Б 1 » . Молекула недели . Американское химическое общество.