Колоректальный рак
| Колоректальный рак | |
|---|---|
| Другие имена |
|
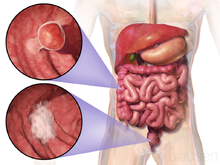 | |
| Расположение и внешний вид двух примеров колоректальных опухолей | |
| Специальность | Гастроэнтерология Общая хирургия Онкология |
| Симптомы |
|
| Причины | |
| Факторы риска |
|
| Метод диагностики | Биопсия ткани во время ректороманоскопии или колоноскопии [1] |
| Профилактика | Скрининг от 45 до 75 лет |
| Уход | |
| Прогноз | Пятилетняя выживаемость 65% (США) [6] |
| Частота | 9,4 миллиона (2015) [7] |
| Летальные исходы | 551,000 (2018) [8] |
Колоректальный рак КРР ) , также известный как рак кишечника , рак толстой кишки или рак прямой кишки , представляет собой развитие рака толстой ( или прямой кишки (частей толстой кишки ). [5] Признаки и симптомы могут включать кровь в стуле , изменение стула , потерю веса, боль в животе и усталость. [9] Большинство случаев колоректального рака обусловлено старостью и факторами образа жизни, и лишь небольшое количество случаев связано с генетическими нарушениями . [2] [3] Факторы риска включают диету, ожирение , курение и отсутствие физической активности . [2] Диетические факторы, повышающие риск, включают красное мясо , обработанное мясо и алкоголь . [2] [4] Другим фактором риска являются воспалительные заболевания кишечника , в том числе болезнь Крона и язвенный колит . [2] Некоторые из наследственных генетических нарушений, которые могут вызвать колоректальный рак, включают семейный аденоматозный полипоз и наследственный неполипозный рак толстой кишки ; однако это составляет менее 5% случаев. [2] [3] Обычно оно начинается как доброкачественная опухоль , часто в форме полипа , который со временем становится раковым . [2]
Колоректальный рак может быть диагностирован путем получения образца толстой кишки во время ректороманоскопии или колоноскопии . [1] Затем следует медицинская визуализация , чтобы определить, распространилось ли заболевание. [5] Скрининг эффективен для предотвращения и снижения смертности от колоректального рака. [10] Скрининг одним из нескольких методов рекомендуется начинать в возрасте от 45 до 75 лет. Было рекомендовано начинать с 50 лет, но оно было изменено на 45 лет из-за увеличения количества случаев рака толстой кишки. [10] [11] Во время колоноскопии небольшие полипы могут быть удалены, если они обнаружены. [2] Если обнаружен большой полип или опухоль, может быть проведена биопсия , чтобы проверить, является ли он раковым. Аспирин и другие нестероидные противовоспалительные препараты снижают риск боли во время удаления полипа. [2] [12] Однако их общее использование для этой цели не рекомендуется из-за побочных эффектов. [13]
Лечение колоректального рака может включать в себя комбинацию хирургического вмешательства, лучевой терапии , химиотерапии и таргетной терапии . [5] Рак, ограниченный стенкой толстой кишки, можно излечить хирургическим путем, в то время как рак, который широко распространился, обычно не излечим, а лечение направлено на улучшение качества жизни и облегчения симптомов. [5] в Пятилетняя выживаемость США в 2014 году составила около 65%. [6] Индивидуальная вероятность выживания зависит от того, насколько запущен рак, можно ли удалить весь рак хирургическим путем, а также от общего состояния здоровья человека. [1] Во всем мире колоректальный рак является третьим наиболее распространенным типом рака, на него приходится около 10% всех случаев. [14] В 2018 году от этой болезни было зарегистрировано 1,09 миллиона новых случаев и 551 000 смертей. [8] Чаще встречается в развитых странах , где встречается более 65% случаев. [2] У женщин это встречается реже, чем у мужчин. [2]
Признаки и симптомы
[ редактировать ]Признаки и симптомы колоректального рака зависят от местоположения опухоли в кишечнике и от того, распространилась ли она в другие части тела ( метастазирует ). Классические предупреждающие признаки включают: усиление запора , кровь в стуле , уменьшение толщины стула, потерю аппетита, потерю веса, а также тошноту или рвоту у людей старше 50 лет. [15] Около 50% людей, больных колоректальным раком, не сообщают о каких-либо симптомах. [16]
Ректальное кровотечение или анемия являются симптомами высокого риска у людей старше 50 лет. [17] Потеря веса и изменения в работе кишечника обычно вызывают беспокойство только в том случае, если они связаны с ректальным кровотечением. [17] [18]
Причина
[ редактировать ]75–95% случаев колоректального рака возникают у людей с небольшим генетическим риском или без него. [19] [20] Факторы риска включают пожилой возраст, мужской пол, [20] высокое потребление жиров, сахара , алкоголя , красного мяса , обработанных мясных продуктов , ожирение , курение и отсутствие физических упражнений . [19] [21] Калькулятор выживаемости при раке прямой кишки, разработанный Онкологическим центром доктора медицины Андерсона, дополнительно считает расовую принадлежность фактором риска; однако существуют вопросы справедливости относительно того, может ли это привести к неравенству в принятии клинических решений. [22] [23] Примерно 10% случаев связаны с недостаточной активностью. [24] Риск употребления алкоголя увеличивается, если выпить более одной порции алкоголя в день. [25] Употребление пяти стаканов воды в день связано со снижением риска развития колоректального рака и аденоматозных полипов. [26] Streptococcus Gallolyticus связан с колоректальным раком. [27] Некоторые штаммы комплекса Streptococcus bovis/Streptococcus equinus ежедневно потребляются миллионами людей и поэтому могут быть безопасными. [28] От 25 до 80% людей с бактериемией Streptococcus bovis/gallolyticus имеют сопутствующие колоректальные опухоли. [29] Серораспространенность Streptococcus bovis/gallolyticus рассматривается как кандидатный практический маркер для раннего прогнозирования основного поражения кишечника в группах высокого риска. [29] Высказано предположение, что наличие антител к антигенам Streptococcus bovis/gallolyticus или самих антигенов в кровотоке может выступать маркерами канцерогенеза в толстой кишке. [29]
Патогенная кишечная палочка может увеличить риск колоректального рака, генотоксичный метаболит колибактин производя . [30]
Воспалительное заболевание кишечника
[ редактировать ]Люди с воспалительными заболеваниями кишечника ( язвенный колит и болезнь Крона ) подвергаются повышенному риску рака толстой кишки. [31] [32] Риск увеличивается, чем дольше человек болеет заболеванием и чем тяжелее тяжесть воспаления. [33] В этих группах высокого риска как профилактика с помощью аспирина , так и регулярные колоноскопии . рекомендуется [34] Эндоскопический надзор в этой группе высокого риска может снизить развитие колоректального рака благодаря ранней диагностике, а также снизить вероятность смерти от рака толстой кишки. [34] На долю людей с воспалительными заболеваниями кишечника приходится менее 2% случаев рака толстой кишки ежегодно. [33] Среди больных болезнью Крона 2% заболевают колоректальным раком через 10 лет, 8% - через 20 лет и 18% - через 30 лет. [33] Примерно у 16% людей с язвенным колитом в течение 30 лет развивается либо предшественник рака , либо рак толстой кишки. [33]
Генетика
[ редактировать ]Те, у кого в семейном анамнезе есть два или более родственников первой степени (например, родитель, брат или сестра), имеют в два-три раза больший риск заболевания, и на эту группу приходится около 20% всех случаев. Ряд генетических синдромов также связан с более высоким уровнем заболеваемости колоректальным раком. Наиболее распространенным из них является наследственный неполипозный колоректальный рак (HNPCC или синдром Линча), который присутствует примерно у 3% людей с колоректальным раком. [20] Другие синдромы, которые тесно связаны с колоректальным раком, включают синдром Гарднера и семейный аденоматозный полипоз (САП). [35] У людей с этими синдромами рак возникает почти всегда и составляет 1% случаев рака. [36] Тотальная проктоколэктомия может быть рекомендована людям с САП в качестве профилактической меры из-за высокого риска злокачественного новообразования. Колэктомия, удаление толстой кишки, может оказаться недостаточной в качестве профилактической меры из-за высокого риска рака прямой кишки, если прямая кишка останется. [37] Наиболее распространенным синдромом полипоза, поражающим толстую кишку, является синдром зубчатого полипоза . [38] что связано с 25-40% риском развития CRC. [39]
Мутации в паре генов ( POLE и POLD1 ) связаны с семейным раком толстой кишки. [40]
Большинство смертей от рака толстой кишки связаны с метастатическим заболеванием. ген, который, по-видимому, способствует развитию метастатического заболевания, метастазирования, связанного с раком толстой кишки 1 ( MACC1 ). Был выделен [41] Это транскрипционный фактор, который влияет на экспрессию фактора роста гепатоцитов . Этот ген связан с пролиферацией, инвазией и рассеянием клеток рака толстой кишки в клеточной культуре , а также с ростом опухоли и метастазированием у мышей. MACC1 может быть потенциальной мишенью для лечения рака, но эта возможность должна быть подтверждена клиническими исследованиями. [42]
Эпигенетические факторы, такие как аномальное метилирование ДНК промоторов- супрессоров опухоли , играют роль в развитии колоректального рака. [43]
У евреев-ашкенази на 6% выше риск развития аденомы , а затем рака толстой кишки из-за мутаций в гене APC . более распространенных [44]
Патогенез
[ редактировать ]Колоректальный рак — это заболевание, возникающее из эпителиальных клеток, выстилающих ободочную или прямую кишку желудочно -кишечного тракта , чаще всего в результате генетических мутаций сигнального пути Wnt , которые повышают сигнальную активность. [45] Сигнальный путь Wnt обычно играет важную роль для нормального функционирования этих клеток, включая поддержание этой выстилки. Мутации могут передаваться по наследству или приобретаться и, скорее всего, возникают в кишечных крипт стволовых клетках . [46] [47] [48] Наиболее часто мутирующим геном при колоректальном раке является ген APC , который продуцирует белок APC. [45] Белок APC предотвращает накопление белка β-катенина . АПК β-катенин накапливается до высоких уровней и транслоцируется (перемещается) в ядро , связывается с ДНК и активирует транскрипцию протоонкогенов Без . Эти гены обычно важны для обновления и дифференциации стволовых клеток, но при неправильной экспрессии на высоких уровнях они могут вызвать рак. [45] В то время как APC мутирует при большинстве видов рака толстой кишки, в некоторых видах рака уровень β-катенина увеличивается из-за мутаций в β-катенине (CTNNB1), которые блокируют его собственный распад, или из-за мутаций в других генах с функцией, аналогичной APC, таких как AXIN1 , AXIN2 , TCF7L2. , или НКД1 . [49]
Помимо дефектов сигнального пути Wnt , для того, чтобы клетка стала раковой, должны произойти и другие мутации. Белок p53 , продуцируемый геном TP53 , обычно контролирует деление клеток и вызывает их запрограммированную гибель, если у них есть дефекты пути Wnt. В конце концов, клеточная линия приобретает мутацию в гене TP53 и трансформирует ткань из доброкачественной эпителиальной опухоли в инвазивный эпителиально-клеточный рак . Иногда ген, кодирующий р53, не мутирует, а другой защитный белок, называемый BAX . вместо этого мутирует [49]
Другими белками, ответственными за запрограммированную гибель клеток, которые обычно деактивируются при колоректальном раке, являются TGF-β и DCC ( удалены при колоректальном раке ). TGF-β имеет деактивирующую мутацию по крайней мере в половине случаев колоректального рака. Иногда TGF-β не деактивируется, но нижестоящий белок, называемый SMAD . деактивируется [49] DCC обычно имеет удаленный сегмент хромосомы при колоректальном раке. [50]
Приблизительно 70% всех человеческих генов экспрессируются при колоректальном раке, при этом чуть более 1% имеют повышенную экспрессию при колоректальном раке по сравнению с другими формами рака. [51] Некоторые гены являются онкогенами : они сверхэкспрессируются при колоректальном раке. Например, гены, кодирующие белки KRAS , RAF и PI3K , которые обычно стимулируют деление клеток в ответ на факторы роста, могут приобретать мутации, которые приводят к чрезмерной активации клеточной пролиферации. Иногда важен хронологический порядок мутаций. Если ранее произошла мутация APC, первичная мутация KRAS часто прогрессирует до рака, а не до самоограничивающегося гиперпластического или пограничного поражения. [52] PTEN , супрессор опухоли, обычно ингибирует PI3K, но иногда может мутировать и деактивироваться. [49]
Комплексный геномный анализ показал, что колоректальные карциномы можно разделить на гипермутированные и негипермутированные типы опухолей. [53] Помимо онкогенных и инактивирующих мутаций, описанных для генов выше, негипермутированные образцы также содержат мутированные CTNNB1 , FAM123B , SOX9 , ATM и ARID1A . Прогрессируя через определенный набор генетических событий, гипермутированные опухоли демонстрируют мутированные формы ACVR2A , TGFBR2 , MSH3 , MSH6 , SLC9A9, TCF7L2 и BRAF . Общей темой этих генов для обоих типов опухолей является их участие в сигнальных путях Wnt и TGF-β, что приводит к повышению активности MYC , центрального игрока при колоректальном раке. [53]
Опухоли с дефицитом репарации ошибочного спаривания (MMR) характеризуются относительно высоким количеством полинуклеотидных тандемных повторов . [54] Это вызвано дефицитом белков MMR, который обычно вызывается эпигенетическим молчанием или наследственными мутациями ( например , синдром Линча ). [55] От 15 до 18 процентов опухолей колоректального рака имеют дефицит MMR, причем 3 процента развиваются из-за синдрома Линча. [56] Роль системы исправления несоответствий заключается в защите целостности генетического материала внутри клеток ( т.е. в обнаружении и исправлении ошибок). [55] Следовательно, дефицит белков MMR может привести к неспособности обнаружить и устранить генетические повреждения, что приведет к возникновению дальнейших мутаций, вызывающих рак, и прогрессированию колоректального рака. [55]
Последовательность прогрессирования полипа в рак является классической моделью патогенеза колоректального рака . [57] В этой аденома-карцинома последовательности [58] нормальные эпителиальные клетки превращаются в диспластические клетки, такие как аденомы , а затем в карциному. в результате прогрессивной генетической мутации [59] Центральное место в последовательности полипа и CRC занимают генные мутации, эпигенетические изменения и местные воспалительные изменения. [57] Последовательность от полипа до CRC можно использовать в качестве основы для иллюстрации того, как конкретные молекулярные изменения приводят к различным подтипам рака. [57]
Полевые дефекты
[ редактировать ]
Термин «поле канцеризации» был впервые использован в 1953 году для описания области или «поля» эпителия, который был предварительно обусловлен (с помощью процессов, которые в то время были в значительной степени неизвестными), предрасполагающими его к развитию рака. [60] С тех пор термины «полевое канцерообразование», «полевой канцерогенез», «полевой дефект» и « полевой эффект » использовались для описания предзлокачественной или преднеопластической ткани, в которой вероятно возникновение новых видов рака. [61]
Дефекты поля играют важную роль в прогрессировании рака толстой кишки. [62] [63]
Однако, как отмечает Рубин, «подавляющее большинство исследований рака было проведено на четко определенных опухолях in vivo или на отдельных неопластических очагах in vitro . Тем не менее, есть свидетельства того, что более 80% обнаруженных соматических мутаций в мутаторном фенотипе колоректальные опухоли человека возникают до начала терминальной клональной экспансии». [64] [65] Аналогично, Фогельштейн и др. [66] указал, что более половины соматических мутаций, выявленных в опухолях, возникали в предопухолевой фазе (в поле дефекта), во время роста внешне нормальных клеток. Аналогично, эпигенетические изменения, присутствующие в опухолях, могли возникать в преднеопластических дефектах полей. [67]
Расширенный взгляд на полевой эффект получил название «этиологический полевой эффект», который охватывает не только молекулярные и патологические изменения в предопухолевых клетках, но также влияние экзогенных факторов окружающей среды и молекулярных изменений в локальном микроокружении на эволюцию неопластики от возникновения опухоли до смерти. . [68]
Эпигенетика
[ редактировать ]Эпигенетические изменения при раке толстой кишки встречаются гораздо чаще, чем генетические (мутационные) изменения. Как описано Фогельштейном и др., [66] средний рак толстой кишки имеет только 1 или 2 мутации онкогена и от 1 до 5 мутаций-супрессоров опухоли (вместе называемые «водящими мутациями»), а также около 60 дополнительных мутаций «пассажиров». Онкогены и гены-супрессоры опухолей хорошо изучены и описаны выше в разделе «Патогенез» . [69] [70]
Помимо эпигенетических изменений экспрессии микроРНК, другие распространенные типы эпигенетических изменений при раке, которые изменяют уровни экспрессии генов, включают прямое гиперметилирование или гипометилирование CpG-островков генов, кодирующих белки, и изменения в гистонах и хромосомной архитектуре, которые влияют на экспрессию генов. [71] Например, 147 гиперметилирований и 27 гипометилирований генов, кодирующих белки, часто были связаны с колоректальным раком. Из гиперметилированных генов 10 были гиперметилированы в 100% случаев рака толстой кишки, а многие другие были гиперметилированы более чем в 50% случаев рака толстой кишки. [72] Кроме того, 11 гиперметилирований и 96 гипометилирований микроРНК также были связаны с колоректальным раком. [72] Аномальное (аберрантное) метилирование возникает как нормальное следствие нормального старения, и риск колоректального рака увеличивается с возрастом. [73] Источник и триггер этого возрастного метилирования неизвестны. [73] [74] Примерно половина генов, которые демонстрируют возрастные изменения метилирования, являются теми же генами, которые, как было установлено, участвуют в развитии колоректального рака. [73] Эти данные могут указывать на причину, по которой возраст связан с повышенным риском развития колоректального рака. [73]
Эпигенетическое снижение экспрессии ферментов репарации ДНК, вероятно, может привести к геномной и эпигеномной нестабильности, характерной для рака. [75] [76] [67] Как резюмировано в статьях «Карциногенез и неоплазма» , при спорадическом раке в целом дефицит репарации ДНК иногда возникает из-за мутации гена репарации ДНК, но гораздо чаще это происходит из-за эпигенетических изменений, которые уменьшают или подавляют экспрессию генов репарации ДНК. . [77]
Эпигенетические изменения, связанные с развитием колоректального рака, могут повлиять на реакцию человека на химиотерапию. [78]
Геномика и эпигеномика
[ редактировать ]Классификация колоректального рака на основе консенсуса молекулярных подтипов (CMS) была впервые представлена в 2015 году. Классификация CMS до сих пор считалась наиболее надежной системой классификации, доступной для CRC, которая имеет четкую биологическую интерпретируемость и основу для будущей клинической стратификации и целевых вмешательств на основе подтипов. . [79]
В 2021 году была предложена новая классификация колоректального рака на основе эпигенома (EpiC), включающая 4 подтипа энхансеров у людей с CRC. Состояния хроматина с использованием 6 меток гистонов характеризуются для идентификации подтипов EpiC. Комбинаторный терапевтический подход, основанный на ранее представленных консенсусных молекулярных подтипах (CMS) и EpiC, может значительно улучшить текущие стратегии лечения. [80]
Диагностика
[ редактировать ]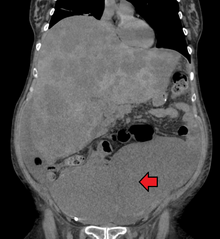
Диагностика колоректального рака проводится путем отбора проб из участков толстой кишки, подозрительных на возможное развитие опухоли, обычно во время колоноскопии или ректороманоскопии, в зависимости от локализации поражения. [20]
Медицинская визуализация
[ редактировать ]Колоректальный рак иногда первоначально обнаруживается при компьютерной томографии . [81]
Наличие метастазов определяют с помощью компьютерной томографии грудной клетки, брюшной полости и таза. [20] другие потенциальные методы визуализации, такие как ПЭТ и МРТ . В некоторых случаях могут использоваться [20] МРТ особенно полезна для определения местной стадии опухоли и планирования оптимального хирургического подхода. [81]
МРТ также проводится после завершения неоадъювантной химиолучевой терапии для выявления пациентов, достигших полного ответа. Пациентам с полным ответом как на МРТ, так и на эндоскопию может не потребоваться хирургическая резекция, и они могут избежать ненужных хирургических осложнений и осложнений. [82] Пациенты, отобранные для нехирургического лечения рака прямой кишки, должны периодически проходить МРТ, физические осмотры и эндоскопические процедуры для выявления любого повторного роста опухоли, который может произойти у меньшинства этих пациентов. Когда возникает местный рецидив, периодическое наблюдение может обнаружить его, когда он еще мал и излечим с помощью спасательной операции. Кроме того, после химиолучевой терапии можно определить степень регрессии опухоли на МРТ, которая коррелирует с долгосрочными результатами выживаемости пациентов. [83]
Гистопатология
[ редактировать ]

О гистопатологических характеристиках опухоли сообщают на основе анализа ткани, взятой в результате биопсии или операции. Отчет о патологии содержит описание микроскопических характеристик опухолевой ткани, включая как опухолевые клетки, так и то, как опухоль проникает в здоровые ткани и, наконец, выглядит ли опухоль полностью удаленной. Наиболее распространенной формой рака толстой кишки является аденокарцинома , составляющая от 95% [85] и 98% [86] всех случаев колоректального рака. Другие, более редкие типы включают лимфому , аденосквамозную и плоскоклеточную карциному . Некоторые подтипы более агрессивны. [87] Иммуногистохимия может быть использована в неопределенных случаях. [88]
Постановка
[ редактировать ]Стадирование рака основано как на радиологических, так и на патологоанатомических данных. Как и в случае большинства других форм рака, определение стадии опухоли основано на системе TNM , которая учитывает степень распространения первичной опухоли и наличие метастазов в лимфатических узлах и более отдаленных органах. [20] Восьмое издание AJCC вышло в свет в 2018 году. [89]
Профилактика
[ редактировать ]Подсчитано, что около половины случаев колоректального рака вызваны факторами образа жизни, и около четверти всех случаев можно предотвратить. [90] Усиление надзора, физическая активность, употребление продуктов с высоким содержанием клетчатки, отказ от курения и ограничение потребления алкоголя снижают риск. [91] [92]
Образ жизни
[ редактировать ]К факторам риска образа жизни, подтвержденным убедительными доказательствами, относятся отсутствие физических упражнений, курение сигарет, алкоголь и ожирение. [93] [94] [95] Риск рака толстой кишки можно снизить, поддерживая нормальный вес тела за счет сочетания достаточных физических упражнений и здорового питания . [96]
Текущие исследования последовательно связывают употребление большего количества красного мяса и обработанного мяса с более высоким риском заболевания. [97] Начиная с 1970-х годов, диетические рекомендации по предотвращению колоректального рака часто включали увеличение потребления цельнозерновых продуктов , фруктов и овощей, а также сокращение потребления красного мяса и обработанных мясных продуктов . Это было основано на исследованиях на животных и ретроспективных наблюдательных исследованиях. Однако крупномасштабные проспективные исследования не смогли продемонстрировать значительный защитный эффект, а из-за множества причин рака и сложности изучения корреляции между питанием и здоровьем неясно, будут ли какие-либо конкретные диетические вмешательства иметь значительный защитный эффект. [98] : 432–433 [99] : 125–126 В 2018 году Национальный институт рака заявил, что «нет надежных доказательств того, что диета, начатая в зрелом возрасте с низким содержанием жиров и мяса и высоким содержанием клетчатки, фруктов и овощей, снижает риск развития колоректального рака в клинически значимой степени». [93] [100]
Употребление алкогольных напитков и употребление обработанного мяса увеличивают риск развития колоректального рака. [101]
В отчете Всемирной организации здравоохранения за 2014 год отмечалось, что была выдвинута гипотеза о том, что пищевые волокна могут помочь предотвратить колоректальный рак, но большинство исследований в то время еще не изучали эту корреляцию. [99] Однако обзор 2019 года обнаружил доказательства пользы пищевых волокон и цельнозерновых продуктов. [102] Всемирный фонд исследования рака назвал пользу клетчатки для профилактики колоректального рака «вероятной» по состоянию на 2017 год. [103] 2022 года В обзоре говорится, что есть «убедительные доказательства» этой связи. [104]
Рекомендуется более высокая физическая активность. [21] [105] Физические упражнения связаны с умеренным снижением риска рака толстой кишки, но не прямой кишки. [106] [107] Высокий уровень физической активности снижает риск рака толстой кишки примерно на 21%. [108] Регулярное сидение в течение длительного времени связано с более высокой смертностью от рака толстой кишки. Регулярные физические упражнения не отменяют риск, но снижают его. [109]
Лекарства и добавки
[ редактировать ]Аспирин и целекоксиб , по-видимому, снижают риск колоректального рака у людей из группы высокого риска. [110] [111] Аспирин рекомендуется людям в возрасте от 50 до 60 лет, у которых нет повышенного риска кровотечений и риска сердечно-сосудистых заболеваний, для предотвращения колоректального рака. [112] Не рекомендуется людям со средним риском. [113]
Имеются предварительные данные о необходимости приема добавок кальция , но их недостаточно, чтобы давать рекомендации. [114] Потребление витамина D и его уровень в крови связаны с более низким риском рака толстой кишки. [115] [116]
Скрининг
[ редактировать ]Поскольку более 80% случаев колоректального рака возникают из аденоматозных полипов , скрининг этого рака эффективен как для раннего выявления, так и для профилактики. [20] [117] Диагностика случаев колоректального рака посредством скрининга обычно происходит за 2–3 года до диагностики случаев с симптомами. [20] Любые обнаруженные полипы можно удалить, обычно с помощью колоноскопии или ректороманоскопии , и таким образом предотвратить их превращение в рак. Скрининг может снизить смертность от колоректального рака на 60%. [118]
Тремя основными скрининговыми тестами являются колоноскопия, анализ кала на скрытую кровь и гибкая ректороманоскопия . Из этих трех только ректороманоскопия не может выявить правую часть толстой кишки , где обнаруживается 42% случаев рака. [119] Однако гибкая ректороманоскопия имеет наилучшие доказательства снижения риска смерти по любой причине. [120]
Анализ кала на скрытую кровь (FOBT) обычно рекомендуется проводить каждые два года и может быть либо гваяковым , либо иммунохимическим . [20] Если обнаруживаются аномальные результаты FOBT, участников обычно направляют на контрольную колоноскопию. Проведение скрининга FOBT один раз в 1–2 года снижает смертность от колоректального рака на 16%, а среди тех, кто участвует в скрининге, смертность от колоректального рака может снизиться до 23%, хотя не доказано, что он снижает смертность от всех причин. [121] Иммунохимические тесты точны и не требуют изменения диеты или лекарств перед тестированием. [122] Однако исследования, проведенные в Великобритании, показали, что для этих иммунохимических тестов порог дальнейшего расследования установлен на уровне, при котором может быть пропущено более половины случаев рака кишечника. Исследование предполагает, что программа скрининга рака кишечника Национальной службы здравоохранения Англии могла бы лучше использовать способность теста определять точную концентрацию крови в кале (а не только то, превышает ли она или ниже пороговый уровень). [123] [124]
Другие варианты включают виртуальную колоноскопию и скрининг ДНК кала (FIT-DNA). Виртуальная колоноскопия с помощью компьютерной томографии столь же эффективна, как и стандартная колоноскопия, для выявления рака и крупных аденом, но является дорогостоящей, связана с радиационным воздействием и не может удалить обнаруженные аномальные новообразования, как это может сделать стандартная колоноскопия. [20] Скрининговый тест ДНК кала ищет биомаркеры, связанные с колоректальным раком и предраковыми поражениями, включая измененную ДНК и гемоглобин крови . При положительном результате следует провести колоноскопию . FIT-ДНК имеет больше ложноположительных результатов, чем FIT, и, следовательно, приводит к большему количеству побочных эффектов. [10] Начиная с 2016 года необходимы дальнейшие исследования, чтобы определить, является ли трехлетний интервал скрининга правильным. [10]
Рекомендации
[ редактировать ]В Соединенных Штатах скрининг обычно рекомендуется в возрасте от 50 до 75 лет. [10] [125] Американское онкологическое общество рекомендует начинать с 45 лет. [126] Для людей в возрасте от 76 до 85 лет решение о проведении скрининга должно быть индивидуальным. [10] Для людей из группы высокого риска скрининг обычно начинается примерно в 40 лет. [20] [127]
Рекомендуются несколько методов скрининга, включая анализ кала каждые 2 года, ректороманоскопию каждые 10 лет, иммунохимическое исследование кала каждые два года и колоноскопию каждые 10 лет. [125] Неясно, какой из этих двух методов лучше. [128] Колоноскопия может выявить больше раковых опухолей в первой части толстой кишки, но она связана с более высокими затратами и большим количеством осложнений. [128] Для людей со средним риском, прошедших качественную колоноскопию с нормальными результатами, Американская гастроэнтерологическая ассоциация не рекомендует проводить какие-либо обследования в течение 10 лет после колоноскопии. [129] [130] Людям старше 75 лет или людям с ожидаемой продолжительностью жизни менее 10 лет скрининг не рекомендуется. [131] Для того, чтобы один из 1000 человек получил пользу, после скрининга требуется около 10 лет. [132] USPSTF перечисляет семь потенциальных стратегий скрининга, причем наиболее важным является то, чтобы хотя бы одна из этих стратегий использовалась надлежащим образом. [10]
В Канаде людям в возрасте от 50 до 75 лет с нормальным риском иммунохимическое тестирование кала или FOBT рекомендуется каждые два года или ректороманоскопию каждые 10 лет. [133] Колоноскопия менее предпочтительна. [133]
В некоторых странах существуют национальные программы колоректального скрининга, которые предлагают скрининг FOBT для всех взрослых в определенной возрастной группе, обычно начиная с возраста 50–60 лет. Примеры стран с организованным скринингом включают Великобританию, [134] Австралия, [135] Нидерланды, [136] Гонконг и Тайвань. [137]
Британская программа скрининга рака кишечника направлена на выявление настораживающих признаков у людей в возрасте от 60 до 74 лет, рекомендуя проходить иммунохимический анализ кала (FIT) каждые два года. FIT измеряет содержание крови в фекалиях, и людям с уровнем выше определенного порога может быть проведено исследование тканей кишечника на наличие признаков рака. Наросты, имеющие раковый потенциал, удаляются. [138] [124]
Уход
[ редактировать ]Лечение колоректального рака может быть направлено на излечение или паллиативное лечение. Решение о том, какую цель выбрать, зависит от различных факторов, включая здоровье и предпочтения человека, а также стадию опухоли. [139] Оценка в многопрофильных бригадах является важной частью определения того, подходит ли пациент для операции или нет. [140] При раннем выявлении колоректального рака хирургическое вмешательство может оказаться излечивающим. Однако когда она обнаруживается на более поздних стадиях (при наличии метастазов ), это менее вероятно, и лечение часто направлено на паллиативное лечение, чтобы облегчить симптомы, вызванные опухолью, и обеспечить максимальный комфорт человека. [20]
Операция
[ редактировать ]
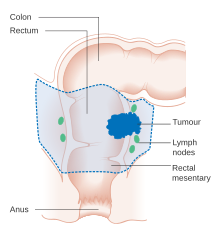

На ранней стадии колоректальный рак можно удалить во время колоноскопии с использованием одного из нескольких методов, включая эндоскопическую резекцию слизистой оболочки или эндоскопическую диссекцию подслизистой оболочки . [5] Эндоскопическая резекция возможна, если вероятность метастазирования в лимфатические узлы мала, а размер и расположение опухоли делают возможной резекцию единым блоком. [141] Для людей с локализованным раком предпочтительным лечением является полное хирургическое удаление с адекватными краями с попыткой достижения излечения. Процедурой выбора является частичная колэктомия (или проктоколэктомия при поражениях прямой кишки), при которой удаляется пораженная часть ободочной или прямой кишки вместе с частями ее среднеободочной кишки и кровоснабжения для облегчения удаления дренирующих лимфатических узлов . Это можно сделать либо путем открытой лапаротомии , либо лапароскопически , в зависимости от индивидуальных особенностей человека и факторов поражения. [20] Затем толстую кишку можно снова соединить или наложить колостому . [5]
Если метастазов в печени или легких всего несколько, их также можно удалить. Химиотерапию можно использовать перед операцией, чтобы уменьшить рак перед попыткой его удаления. Двумя наиболее распространенными местами рецидива колоректального рака являются печень и легкие . [20] При карциноматозе брюшины циторедуктивную хирургию , иногда в сочетании с HIPEC . в попытке удалить рак можно использовать [142]
Химиотерапия
[ редактировать ]Как при раке толстой , и прямой кишки так химиотерапия в некоторых случаях в дополнение к хирургическому вмешательству может использоваться . Решение о добавлении химиотерапии в лечение рака толстой и прямой кишки зависит от стадии заболевания. [143]
При раке толстой кишки I стадии химиотерапия не проводится, и окончательным лечением является хирургическое вмешательство. Роль химиотерапии при раке толстой кишки II стадии дискуссионна и обычно не назначается, если не выявлены такие факторы риска, как опухоль Т4, недифференцированная опухоль, сосудистая и периневральная инвазия или неадекватный забор лимфатических узлов. [144] Также известно, что люди, несущие аномалии генов репарации несоответствия, не получают пользы от химиотерапии. При раке толстой кишки III и IV стадий химиотерапия является неотъемлемой частью лечения. [20]
Если рак распространился на лимфатические узлы или отдаленные органы, что имеет место при раке толстой кишки III и IV стадии соответственно, добавление химиотерапевтических препаратов фторурацила , капецитабина или оксалиплатина увеличивает продолжительность жизни. Если лимфатические узлы не содержат рака, польза от химиотерапии спорна. Если рак имеет обширные метастазы или неоперабельный, лечение носит паллиативный характер . Обычно в этой ситуации можно использовать несколько различных химиотерапевтических препаратов. [20] Химиотерапевтические препараты для этого состояния могут включать капецитабин , фторурацил , иринотекан , оксалиплатин и UFT . [145] Препараты капецитабин и фторурацил взаимозаменяемы: капецитабин является пероральным препаратом, а фторурацил — препаратом для внутривенного введения. Некоторыми конкретными схемами, используемыми при колоректальном раке, являются CAPOX , FOLFOX , FOLFOXIRI и FOLFIRI . [146] Антиангиогенные препараты, такие как бевацизумаб, часто добавляются в терапию первой линии. [147] Другой класс препаратов, используемых во второй линии, — это ингибиторы рецепторов эпидермального фактора роста , из которых три одобренных FDA препарата — афлиберцепт , цетуксимаб и панитумумаб . [148] [149]
Основное отличие в подходе к раку прямой кишки низкой стадии заключается во включении лучевой терапии. Часто его используют в сочетании с химиотерапией неоадъювантным способом , чтобы обеспечить хирургическую резекцию, так что в конечном итоге колостома не требуется. Однако это может оказаться невозможным при низколежащих опухолях, и в этом случае может потребоваться постоянная колостома. Рак прямой кишки IV стадии лечится аналогично раку толстой кишки IV стадии.
У некоторых людей колоректальный рак IV стадии, вызванный карциноматозом брюшины, можно лечить с помощью HIPEC в сочетании с циторедуктивной хирургией. [150] [151] [152] Кроме того, колоректальный рак Т4 можно лечить с помощью HIPEC, чтобы избежать рецидивов в будущем. [153]
Лучевая терапия
[ редактировать ]Хотя сочетание лучевой и химиотерапии может быть полезно при раке прямой кишки , [20] для некоторых людей, нуждающихся в лечении, химиолучевая терапия может увеличить острую токсичность, связанную с лечением, и не было показано, что она улучшает показатели выживаемости по сравнению с одной лучевой терапией, хотя она связана с меньшим количеством местных рецидивов. [142] Использование лучевой терапии при раке толстой кишки не является рутинным из-за чувствительности кишечника к радиации. [154] Как и химиотерапия, лучевая терапия может использоваться в качестве неоадъюванта на клинических стадиях Т3 и Т4 рака прямой кишки. [155] Это приводит к уменьшению размера или понижению стадии опухоли, подготавливая ее к хирургической резекции, а также снижает частоту местных рецидивов. [155] При местно-распространенном раке прямой кишки неоадъювантная химиолучевая терапия стала стандартным методом лечения. [156] Кроме того, когда хирургическое вмешательство невозможно, лучевая терапия считается эффективным методом лечения легочных метастазов колоректального рака, которые развиваются у 10-15% людей с колоректальным раком. [157]
Иммунотерапия
[ редактировать ]Было обнаружено, что иммунотерапия ингибиторами иммунных контрольных точек полезна при типе колоректального рака с дефицитом репарации несоответствий и микросателлитной нестабильностью. [158] [159] [160] Pembrolizumab is approved for advanced CRC tumours that are MMR deficient and have failed usual treatments.[161] Most people who do improve, however, still worsen after months or years.[159]
On the other hand, in a prospective phase 2 study published in June 2022 in The New England Journal of Medicine, 12 patients with Deficient Mismatch Repair (dMMR) stage II or III rectal adenocarcinoma were administered single-agent dostarlimab, an anti–PD-1 monoclonal antibody, every three weeks for six months. After a median follow-up of 12 months (range, 6 to 25 months), all 12 patients had a complete clinical response with no evidence of tumor on MRI, 18F-fluorodeoxyglucose–positron-emission tomography, endoscopic evaluation, digital rectal examination, or biopsy. Moreover, no patient in the trial needed chemoradiotherapy or surgery, and no patient reported adverse events of grade 3 or higher. However, although the results of this study are promising, the study is small and has uncertainties about long-term outcomes.[162]
Palliative care
[edit]Palliative care is recommended for any person who has advanced colon cancer or who has significant symptoms.[163][164]
Involvement of palliative care may be beneficial to improve the quality of life for both the person and his or her family, by improving symptoms, anxiety and preventing admissions to the hospital.[165]
In people with incurable colorectal cancer, palliative care can consist of procedures that relieve symptoms or complications from the cancer but do not attempt to cure the underlying cancer, thereby improving quality of life. Surgical options may include non-curative surgical removal of some of the cancer tissue, bypassing part of the intestines, or stent placement. These procedures can be considered to improve symptoms and reduce complications such as bleeding from the tumor, abdominal pain and intestinal obstruction.[166] Non-operative methods of symptomatic treatment include radiation therapy to decrease tumor size as well as pain medications.[167]
Psychosocial Intervention
[edit]In addition to medical intervention, a variety of psychosocial interventions have been implemented to address psychosocial concerns in the context of colorectal cancer.[168] Depression and anxiety are highly prevalent in patients diagnosed with CRC, therefore psychosocial interventions can be helpful for alleviating psychological distress.[169][170] Many patients continue to experience symptoms of anxiety and depression following treatment, regardless of treatment outcome.[169][171] Societal stigmas associated with colorectal cancer present further psychosocial challenges for CRC patients and their families.[172][173]
Depression and Anxiety
[edit]Colorectal cancer patients have a 51% higher risk of experiencing depression than individuals without the disease.[170] Additionally, CRC patients are at high risk of experiencing severe anxiety, low self-esteem, poor self-concept, and social anxiety.[169][174]
Post-Treatment Distress
[edit]Regardless of treatment outcome, many CRC patients experience ongoing symptoms of anxiety, depression, and distress.[169]
Survivorship of CRC can involve significant lifestyle adjustments.[173] Postoperative afflictions may include stomas, bowel issues, incontinence, odor, and changes to sexual functioning.[173][174] These changes can result in distorted body image, social anxiety, depression, and distress—all of which contribute to a poorer quality of life.[173][175]
Colorectal cancer is the second leading cause of cancer-related death worldwide.[176] Transitioning into palliative care and contending with mortality can be a deeply distressing experience for a CRC patient and their loved ones.
Stigma
[edit]Colorectal cancer is highly stigmatized and can elicit feelings of disgust from patients, healthcare professionals, family, intimate partners, and the general public.[172] Patients with stomas are especially vulnerable to stigmatization due to unavoidable odors, gas, and unpleasant noises from stoma bags.[172] Additionally, associated CRC risk factors like poor diet, alcohol consumption, and lack of physical activity prompt negative assumptions of blame and personal responsibility onto CRC patients.[173] Judgement from others along with internalized self-blame and embarrassment can negatively affect self-esteem, sociability, and quality of life.[173]
Methods of Intervention
[edit]Face-to-face interventions such as clinician-patient talk therapy, body-mind-spirit practices, and support group sessions have been identified as most effective in reducing anxiety and depression in CRC patients.[168] Additionally, journaling exercises and over-the-phone talk therapy sessions have been implemented.[168] Though deemed less effective, these non-face-to-face interventions are economically inclusive and have been found to reduce both depression and anxiety in CRC patients.[168]
Follow-up
[edit]The U.S. National Comprehensive Cancer Network and American Society of Clinical Oncology provide guidelines for the follow-up of colon cancer.[177][178] A medical history and physical examination are recommended every 3 to 6 months for 2 years, then every 6 months for 5 years. Carcinoembryonic antigen blood level measurements follow the same timing, but are only advised for people with T2 or greater lesions who are candidates for intervention. A CT-scan of the chest, abdomen and pelvis can be considered annually for the first 3 years for people who are at high risk of recurrence (for example, those who had poorly differentiated tumors or venous or lymphatic invasion) and are candidates for curative surgery (with the aim to cure). A colonoscopy can be done after 1 year, except if it could not be done during the initial staging because of an obstructing mass, in which case it should be performed after 3 to 6 months. If a villous polyp, a polyp >1 centimeter or high-grade dysplasia is found, it can be repeated after 3 years, then every 5 years. For other abnormalities, the colonoscopy can be repeated after 1 year.[143]
Routine PET or ultrasound scanning, chest X-rays, complete blood count or liver function tests are not recommended.[177][178]
For people who have undergone curative surgery or adjuvant therapy (or both) to treat non-metastatic colorectal cancer, intense surveillance and close follow-up have not been shown to provide additional survival benefits.[179]
Exercise
[edit]Exercise may be recommended in the future as secondary therapy to cancer survivors. In epidemiological studies, exercise may decrease colorectal cancer-specific mortality and all-cause mortality. Results for the specific amounts of exercise needed to observe a benefit were conflicting. These differences may reflect differences in tumour biology and the expression of biomarkers. People with tumors that lacked CTNNB1 expression (β-catenin), involved in Wnt signalling pathway, required more than 18 Metabolic equivalent (MET) hours per week, a measure of exercise, to observe a reduction in colorectal cancer mortality. The mechanism of how exercise benefits survival may be involved in immune surveillance and inflammation pathways. In clinical studies, a pro-inflammatory response was found in people with stage II-III colorectal cancer who underwent 2 weeks of moderate exercise after completing their primary therapy. Oxidative balance may be another possible mechanism for benefits observed. A significant decrease in 8-oxo-dG was found in the urine of people who underwent 2 weeks of moderate exercise after primary therapy. Other possible mechanisms may involve metabolic hormone and sex-steroid hormones, although these pathways may be involved in other types of cancers.[180][181]
Another potential biomarker may be p27. Survivors with tumors that expressed p27 and performed greater and equal to 18 MET hours per week were found to have reduced colorectal cancer mortality survival compared to those with less than 18 MET hours per week. Survivors without p27 expression who exercised were shown to have worse outcomes. The constitutive activation of PI3K/AKT/mTOR pathway may explain the loss of p27 and excess energy balance may up-regulate p27 to stop cancer cells from dividing.[181]
Physical activity provides benefits to people with non-advanced colorectal cancer. Improvements in aerobic fitness, cancer-related fatigue and health-related quality of life have been reported in the short term.[182] However, these improvements were not observed at the level of disease-related mental health, such as anxiety and depression.[182]
Prognosis
[edit]Fewer than 600 genes are linked to outcomes in colorectal cancer.[51] These include both unfavorable genes, where high expression is related to poor outcome, for example the heat shock 70 kDa protein 1 (HSPA1A), and favorable genes where high expression is associated with better survival, for example the putative RNA-binding protein 3 (RBM3).[51] The prognosis is also correlated with a poor fidelity of the pre-mRNA splicing apparatus, and thus a high number of deviating alternative splicing.[183]
Recurrence rates
[edit]The average five-year recurrence rate in people with colon cancer where surgery is successful is 5% for stage I cancers, 12% in stage II and 33% in stage III. However, depending on the number of risk factors it ranges from 9–22% in stage II and 17–44% in stage III.[184] The average five-year recurrence rate in people with rectal cancer where surgery is successful is 9% for stage 0 (after pre-treatment) cancers, 8% for stage I cancers, 18% in stage II and 34% in stage III. Depending on the number of risk factors (0-2) the risk for distant metastasis in rectal cancer ranges from 4-11% in stage 0, 6-12% in stage I, 11-28% in stage II and 15-43% in stage III.[185]
The recurrence rates have decreased over the past decades as a result of improvements in the colorectal cancer management.[186] The risk of recurrence after five years of surveillance remain very low.[187]
Survival rates
[edit]In Europe the five-year survival rate for colorectal cancer is less than 60%. In the developed world about a third of people who get the disease die from it.[20]
Survival is directly related to detection and the type of cancer involved, but overall is poor for symptomatic cancers, as they are typically quite advanced. Survival rates for early stage detection are about five times that of late stage cancers. People with a tumor that has not breached the muscularis mucosa (TNM stage Tis, N0, M0) have a five-year survival rate of 100%, while those with invasive cancer of T1 (within the submucosal layer) or T2 (within the muscular layer) have an average five-year survival rate of approximately 90%. Those with a more invasive tumor yet without node involvement (T3-4, N0, M0) have an average five-year survival rate of approximately 70%. People with positive regional lymph nodes (any T, N1-3, M0) have an average five-year survival rate of approximately 40%, while those with distant metastases (any T, any N, M1) have a poor prognosis and the five year survival ranges from <5 percent to 31 percent.[188][189][190][191][192]
Five-year overall survival (OS) in rectal cancer after modern preoperative treatment and surgery was 90% for stage 0, 86% for stage I, 78% for stage II, and 67% for stage III according to a nationwide, population-based study.[185]
Whilst the impact of colorectal cancer on those who survive varies greatly there will often be a need to adapt to both physical and psychological outcomes of the illness and its treatment.[193] For example, it is common for people to experience incontinence,[194] sexual dysfunction,[195] problems with stoma care[196] and fear of cancer recurrence[197] after primary treatment has concluded.
A qualitative systematic review published in 2021 highlighted that there are three main factors influencing adaptation to living with and beyond colorectal cancer: support mechanisms, severity of late effects of treatment and psychosocial adjustment. Therefore, it is essential that people are offered appropriate support to help them better adapt to life following treatment.[198]
Epidemiology
[edit]
Globally more than 1 million people get colorectal cancer every year[20] resulting in about 715,000 deaths as of 2010 up from 490,000 in 1990.[199]
As of 2012[update], it is the second most common cause of cancer in women (9.2% of diagnoses) and the third most common in men (10.0%)[14]: 16 with it being the fourth most common cause of cancer death after lung, stomach, and liver cancer.[200] It is more common in developed than developing countries.[201] Global incidence varies 10-fold, with highest rates in Australia, New Zealand, Europe and the US and lowest rates in Africa and South-Central Asia.[202]
United States
[edit]Ожидается, что в 2022 году заболеваемость колоректальным раком в США составит около 151 000 взрослых, включая более 106 000 новых случаев рака толстой кишки (около 54 000 мужчин и 52 000 женщин) и около 45 000 новых случаев рака прямой кишки. [203] Since the 1980s, the incidence of colorectal cancer decreased, dropping by about 2% annually from 2014 to 2018 in adults aged 50 and older, due mainly to improved screening.[203] However, incidence of colorectal cancer has increased in individuals aged 25 to 50. In early 2023, the American Cancer Society (ACS) reported that 20% of diagnoses (of colon cancer) in 2019 were in patients under age 55, which is about double the rate in 1995, and rates of advanced disease increased by about 3% annually in people younger than 50. It predicted that, in 2023, an estimated 19,550 diagnoses and 3,750 deaths would be in people younger than 50.[204] Colorectal cancer also disproportionately affects the Black community, where the rates are the highest of any racial/ethnic group in the US. African Americans are about 20% more likely to get colorectal cancer and about 40% more likely to die from it than most other groups. Black Americans often experience greater obstacles to cancer prevention, detection, treatment, and survival, including systemic racial disparities that are complex and go beyond the obvious connection to cancer.
Великобритания
[ редактировать ]В Великобритании около 41 000 человек в год заболевают раком толстой кишки, что делает его четвертым по распространенности типом. [205]
Австралия
[ редактировать ]У одного из 19 мужчин и одной из 28 женщин в Австралии колоректальный рак заболеет в возрасте до 75 лет; к 85 годам он разовьется у одного из 10 мужчин и одной из 15 женщин. [206]
Папуа-Новая Гвинея
[ редактировать ]В развивающихся странах, таких как Папуа-Новая Гвинея и других островных государствах Тихого океана, включая Соломоновы Острова, колоректальный рак является очень редким раком среди людей, который встречается реже всего по сравнению с раком легких, желудка, печени или молочной железы. По оценкам, по крайней мере, у 8 из 100 000 людей ежегодно чаще развивается колоректальный рак, что в отличие от рака легких или молочной железы, где только последний рак встречается у 24 из 100 000 женщин. [207]
Колоректальный рак с ранним началом (EOCC)
[ редактировать ]Диагноз колоректального рака у пациентов в возрасте до 50 лет называется колоректальным раком с ранним началом (EOCC). [176] [208] За последнее десятилетие число случаев EOCC увеличилось, особенно среди пациентов в возрасте от 20 до 40 лет в Северной Америке, Европе, Австралии и Китае. [208] [209]
Заболеваемость по возрасту
[ редактировать ]Заболеваемость колоректальным раком среди более молодого населения увеличилась за последнее десятилетие. [176] [208] [209] Хотя достижения в диагностических процедурах могут иметь определенное влияние, снижение вероятности скрининга среди этих групп населения позволяет предположить, что систематическая ошибка выявления не является основным фактором, способствующим этой тенденции. Более вероятно, что этому способствуют когортные эффекты. [209]
Наибольший рост случаев EOCC составляют мужчины и женщины в возрасте от 20 до 29 лет, при этом заболеваемость увеличивалась на 7,9% в год в период с 2004 по 2016 год. [209] Аналогичным образом, хотя и менее серьезно, у мужчин и женщин в возрасте от 30 до 39 лет наблюдался рост случаев заболевания на 3,4% в год в течение того же периода времени. Несмотря на это увеличение, уровень смертности от колоректального рака остался прежним. [209]
Факторы риска
[ редактировать ]Факторы риска, связанные с EOCC, аналогичны факторам риска всех случаев колоректального рака. [208] Наблюдаемые когортные эффекты, вероятно, являются результатом смены поколений в образе жизни и факторах окружающей среды. [176] [208]
Профилактический осмотр
[ редактировать ]В 2018 году Американское онкологическое общество изменило свои предыдущие рекомендации по скринингу колоректального рака с 50 до 45 лет после признания увеличения случаев EOCC. [209] Лица в возрасте до 60 лет были признаны наиболее подверженными неучастию в скрининге колоректального рака. [210]
История
[ редактировать ]Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( январь 2024 г. ) |
Рак прямой кишки был диагностирован у древнеегипетской мумии , которая жила в оазисе Дахле в период Птолемеев . [211]
Общество и культура
[ редактировать ]В США март — месяц осведомленности о колоректальном раке . [118]
Исследовать
[ редактировать ]Этот раздел необходимо обновить . Причина: все источники старше 5 лет. ( январь 2024 г. ) |
Предварительные in vitro данные позволяют предположить, что молочнокислые бактерии (например, лактобактерии , стрептококки или лактококки ) могут защищать от развития и прогрессирования колоректального рака посредством нескольких механизмов, таких как антиоксидантная активность, иммуномодуляция , содействие запрограммированной гибели клеток , антипролиферативный эффект и эпигенетическая модификация. раковых клеток. [212]
- Атлас генома рака [53]
- Был разработан Атлас колоректального рака, объединяющий геномные и протеомные данные, относящиеся к тканям и клеточным линиям колоректального рака. [213]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д «Общая информация о раке толстой кишки» . НЦИ . 12 мая 2014 года. Архивировано из оригинала 4 июля 2014 года . Проверено 29 июня 2014 г.
- ^ Jump up to: а б с д и ж г час я дж к л Босман FT (2014). «Глава 5.5: Колоректальный рак» . В Стюарте Б.В., Wild CP (ред.). Всемирный доклад о раке . Международное агентство по изучению рака, Всемирная организация здравоохранения. стр. 392–402. ISBN 978-92-832-0443-5 .
- ^ Jump up to: а б с «Профилактика колоректального рака (PDQ®)» . Национальный институт рака . 27 февраля 2014. Архивировано из оригинала 5 июля 2014 года . Проверено 29 июня 2014 г.
- ^ Jump up to: а б Теодорату Э, Тимофеева М, Ли Х, Мэн Х, Иоаннидис Дж. П. (август 2017 г.). «Природа, воспитание и риски рака: генетический и пищевой вклад в развитие рака» . Ежегодный обзор питания (обзор). 37 : 293–320. doi : 10.1146/annurev-nutr-071715-051004 . ПМК 6143166 . ПМИД 28826375 .
- ^ Jump up to: а б с д и ж г «Лечение рака толстой кишки (PDQ®)» . НЦИ . 12 мая 2014. Архивировано из оригинала 5 июля 2014 года . Проверено 29 июня 2014 г.
- ^ Jump up to: а б «Информационные бюллетени SEER: рак толстой и прямой кишки» . НЦИ . Архивировано из оригинала 24 июня 2014 года . Проверено 18 июня 2014 г.
- ^ Вос Т., Барбер Р.М., Белл Б., Бертоцци-Вилла А., Бирюков С., Боллигер И. и др. (Сотрудники ГББ 2015 г. по заболеваемости и распространенности заболеваний и травм) (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и количество лет жизни с инвалидностью по 310 заболеваниям и травмам, 1990–2015 гг.: систематический анализ для исследования глобального бремени болезней 2015 г.» . Ланцет . 388 (10053): 1545–1602. дои : 10.1016/S0140-6736(16)31678-6 . ПМК 5055577 . ПМИД 27733282 .
- ^ Jump up to: а б Брэй Ф., Ферлей Дж., Сурджоматарам И., Сигел Р.Л., Торре Л.А., Джемал А. (ноябрь 2018 г.). «Глобальная статистика рака за 2018 год: оценки GLOBOCAN заболеваемости и смертности во всем мире от 36 видов рака в 185 странах» . CA: Журнал рака для врачей . 68 (6): 394–424. дои : 10.3322/caac.21492 . ПМИД 30207593 . S2CID 52188256 .
- ^ «Признаки и симптомы колоректального рака | Признаки колоректального рака» . www.cancer.org . Проверено 8 февраля 2023 г.
- ^ Jump up to: а б с д и ж г Биббинс-Доминго К., Гроссман Д.С., Карри С.Дж., Дэвидсон К.В., Эплинг Дж.В., Гарсиа Ф.А. и др. (июнь 2016 г.). «Скрининг колоректального рака: Рекомендации Целевой группы профилактической службы США» . ДЖАМА . 315 (23): 2564–2575. дои : 10.1001/jama.2016.5989 . ПМИД 27304597 .
- ^ «Первая колоноскопия теперь рекомендуется в возрасте 45 лет» . ТедаКэр . Проверено 30 декабря 2022 г.
- ^ Торат М.А., Кузик Дж. (декабрь 2013 г.). «Роль аспирина в профилактике рака» . Текущие отчеты по онкологии . 15 (6): 533–540. дои : 10.1007/s11912-013-0351-3 . ПМИД 24114189 . S2CID 40187047 .
- ^ «Рутинный прием аспирина или нестероидных противовоспалительных препаратов для первичной профилактики колоректального рака: рекомендации» . Американский семейный врач . 76 (1): 109–113. Июль 2007 г. PMID 17668849 . Архивировано из оригинала 14 июля 2014 года.
- ^ Jump up to: а б Форман Д., Ферлей Дж. (2014). «Глава 1.1: Глобальное и региональное бремя рака» . В Стюарте Б.В., Wild CP (ред.). Всемирный доклад о раке . Международное агентство по изучению рака, Всемирная организация здравоохранения. стр. 16–53. ISBN 978-92-832-0443-5 .
- ^ Альперс Д.Х., Каллоо А.Н., Капловиц Н., Оуян С., Пауэлл Д.В. (2008). Ямада Т. (ред.). Основы клинической гастроэнтерологии . Чичестер, Западный Суссекс: Уайли-Блэквелл. п. 381. ИСБН 978-1-4051-6910-3 . Архивировано из оригинала 28 сентября 2015 года.
- ^ Юул Дж.С., Хорнунг Н., Андерсен Б., Лаурберг С., Олесен Ф., Ведстед П. (август 2018 г.). «Ценность использования фекального иммунохимического теста в общей практике у пациентов с не тревожными симптомами колоректального рака» . Британский журнал рака . 119 (4): 471–479. дои : 10.1038/s41416-018-0178-7 . ПМК 6133998 . ПМИД 30065255 .
- ^ Jump up to: а б Эстин М., Гриффин Т., Нил Р.Д., Роуз П., Гамильтон В. (май 2011 г.). «Диагностическая ценность симптомов колоректального рака в первичной медико-санитарной помощи: систематический обзор» . Британский журнал общей практики . 61 (586): с231–е243. дои : 10.3399/bjgp11X572427 . ПМК 3080228 . ПМИД 21619747 .
- ^ Адельштейн Б.А., Макаскилл П., Чан С.Ф., Кателарис П.Х., Ирвиг Л. (май 2011 г.). «Большинство симптомов рака кишечника не указывают на колоректальный рак и полипы: систематический обзор» . БМК Гастроэнтерология . 11:65 . дои : 10.1186/1471-230X-11-65 . ПМК 3120795 . ПМИД 21624112 .
- ^ Jump up to: а б Уотсон Эй Джей, Коллинз П. Д. (2011). «Рак толстой кишки: цивилизационное расстройство» . Пищеварительные заболевания . 29 (2): 222–228. дои : 10.1159/000323926 . ПМИД 21734388 . S2CID 7640363 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т Каннингем Д., Аткин В., Ленц Х.Дж., Линч Х.Т., Мински Б., Нордлингер Б. и др. (март 2010 г.). «Колоректальный рак». Ланцет . 375 (9719): 1030–1047. дои : 10.1016/S0140-6736(10)60353-4 . ПМИД 20304247 . S2CID 25299272 .
- ^ Jump up to: а б «Отчет о колоректальном раке за 2011 год: пища, питание, физическая активность и профилактика колоректального рака» (PDF) . Всемирный фонд исследования рака и Американский институт исследований рака. 2011. Архивировано (PDF) из оригинала 9 сентября 2016 года.
- ^ Вьяс Д.А., Эйзенштейн Л.Г., Джонс Д.С. (27 августа 2020 г.). Малина Д. (ред.). «Скрыто на виду — пересмотр использования расовой коррекции в клинических алгоритмах» . Медицинский журнал Новой Англии . 383 (9): 874–882. дои : 10.1056/NEJMms2004740 . ISSN 0028-4793 . ПМИД 32853499 . S2CID 221359557 .
- ^ Боулз Т.Л., Ху С.И., Ю Нью-Йорк, Скиббер Дж.М., Родригес-Бигас М.А., Чанг Г.Дж. (май 2013 г.). «Индивидуальный калькулятор условной выживаемости для пациентов с раком прямой кишки» . Заболевания толстой и прямой кишки . 56 (5): 551–559. дои : 10.1097/DCR.0b013e31827bd287 . ISSN 0012-3706 . ПМЦ 3673550 . ПМИД 23575393 .
- ^ Ли И.М., Широма Э.Дж., Лобело Ф., Пушка П., Блэр С.Н., Кацмарзик П.Т. (июль 2012 г.). «Влияние отсутствия физической активности на основные неинфекционные заболевания во всем мире: анализ бремени болезней и ожидаемой продолжительности жизни» . Ланцет . 380 (9838): 219–229. дои : 10.1016/S0140-6736(12)61031-9 . ПМЦ 3645500 . ПМИД 22818936 .
- ^ Федирко В., Трамасере И., Багнарди В., Рота М., Скотти Л., Ислами Ф. и др. (сентябрь 2011 г.). «Употребление алкоголя и риск колоректального рака: общий метаанализ опубликованных исследований и реакция на дозу» . Анналы онкологии . 22 (9): 1958–1972. дои : 10.1093/annonc/mdq653 . ПМИД 21307158 .
- ^ Валтин Х. (ноябрь 2002 г.). « Пейте не менее восьми стаканов воды в день». Правда? Есть ли научные доказательства «8 х 8»?». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология . 283 (5): Р993–1004. дои : 10.1152/ajpregu.00365.2002 . ПМИД 12376390 . S2CID 2256436 .
- ^ Болей А., ван Гелдер М.М., Свинкелс Д.В., Тьялсма Х. (ноябрь 2011 г.). «Клиническое значение инфекции Streptococcus Gallolyticus среди больных колоректальным раком: систематический обзор и метаанализ» . Клинические инфекционные болезни . 53 (9): 870–878. дои : 10.1093/cid/cir609 . ПМИД 21960713 .
- ^ Янс С., Мейле Л., Лакруа С., Стивенс М.Дж. (июль 2015 г.). «Геномика, эволюция и молекулярная эпидемиология комплекса Streptococcus bovis/Streptococcus equinus (SBSEC)». Инфекция, генетика и эволюция . 33 : 419–436. Бибкод : 2015InfGE..33..419J . дои : 10.1016/j.meegid.2014.09.017 . ПМИД 25233845 .
- ^ Jump up to: а б с Абдуламир А.С., Хафид Р.Р., Абу Бакар Ф. (январь 2011 г.). «Ассоциация Streptococcus bovis/gallolyticus с колоректальными опухолями: природа и механизмы ее этиологической роли» . Журнал экспериментальных и клинических исследований рака . 30 (1): 11. дои : 10.1186/1756-9966-30-11 . ПМК 3032743 . ПМИД 21247505 .
 В эту статью включен текст Ахмеда С. Абдуламира, Ранда Р. Хафида и Фатимы Абу Бакар, доступный по лицензии CC BY 2.0 .
В эту статью включен текст Ахмеда С. Абдуламира, Ранда Р. Хафида и Фатимы Абу Бакар, доступный по лицензии CC BY 2.0 . - ^ Артур Джей Си (июнь 2020 г.). «Микробиота и колоректальный рак: колибактин оставляет свой след». Обзоры природы. Гастроэнтерология и гепатология . 17 (6): 317–318. дои : 10.1038/s41575-020-0303-y . ПМИД 32317778 . S2CID 216033220 .
- ^ Джавад Н., Дирекзе Н., Лидхэм С.Дж. (2011). «Воспалительные заболевания кишечника и рак толстой кишки». Воспаление и рак желудочно-кишечного тракта . Последние результаты исследований рака. Том. 185. стр. 99–115. дои : 10.1007/978-3-642-03503-6_6 . ISBN 978-3-642-03502-9 . ПМИД 21822822 .
- ^ Ху Т, Ли ЛФ, Шен Дж, Чжан Л, Чо Ч (2015). «Хроническое воспаление и колоректальный рак: роль фактора роста эндотелия сосудов». Текущий фармацевтический дизайн . 21 (21): 2960–2967. дои : 10.2174/1381612821666150514104244 . ПМИД 26004415 .
- ^ Jump up to: а б с д Триантафиллидис Дж.К., Насиулас Г., Космидис П.А. (июль 2009 г.). «Колоректальный рак и воспалительные заболевания кишечника: эпидемиология, факторы риска, механизмы канцерогенеза и стратегии профилактики». Противораковые исследования . 29 (7): 2727–2737. ПМИД 19596953 .
- ^ Jump up to: а б Пока, В.А., Нгуен Т.М., Паркер С.Э., Джайрат В., Ист Дж.Э. (сентябрь 2017 г.). «Стратегии выявления рака толстой кишки у пациентов с воспалительными заболеваниями кишечника» . Кокрановская база данных систематических обзоров . 2017 (9): CD000279. дои : 10.1002/14651858.cd000279.pub4 . ПМК 6483622 . ПМИД 28922695 .
- ^ Джун Э, Хачемун А (2010). «Синдром Гарднера: кожные проявления, дифференциальный диагноз и лечение». Американский журнал клинической дерматологии . 11 (2): 117–122. дои : 10.2165/11311180-000000000-00000 . ПМИД 20141232 . S2CID 36836169 .
- ^ Хаф Э, Беркович Д, Розен П (октябрь 2009 г.). «Семейный аденоматозный полипоз» . Сиротский журнал редких заболеваний . 4:22 . дои : 10.1186/1750-1172-4-22 . ПМЦ 2772987 . ПМИД 19822006 .
- ^ Мёслейн Г., Писториус С., Сагер Х.Д., Шакерт Х.К. (март 2003 г.). «Профилактическая хирургия рака толстой кишки при семейном аденоматозном полипозе и синдроме наследственного неполипозного колоректального рака». Архив хирургии Лангенбека . 388 (1): 9–16. дои : 10.1007/s00423-003-0364-8 . ПМИД 12690475 . S2CID 21385340 .
- ^ Манкени Дж., Руфаэль С., Берк, Калифорния (апрель 2020 г.). «Синдром зубчатого полипоза» . Клиническая гастроэнтерология и гепатология . 18 (4): 777–779. дои : 10.1016/j.cgh.2019.09.006 . ПМИД 31520728 .
- ^ Фан С., Юнис А., Букхаут CE, Крокетт С.Д. (март 2018 г.). «Лечение зубчатых полипов толстой кишки» . Современные варианты лечения в гастроэнтерологии . 16 (1): 182–202. дои : 10.1007/s11938-018-0176-0 . ПМК 6284520 . ПМИД 29445907 .
- ^ Бурдэ Р., Руссо Б., Пухальс А., Буссион Х., Жоли С., Гиймен А. и др. (май 2017 г.). «Мутации домена корректировки полимеразы: новые возможности иммунотерапии при гипермутированном колоректальном раке, помимо дефицита MMR». Критические обзоры по онкологии/гематологии . 113 : 242–248. дои : 10.1016/j.critrevonc.2017.03.027 . ПМИД 28427513 .
- ^ Штейн У., Вальтер В., Арльт Ф., Швабе Х., Смит Дж., Фихтнер И. и др. (январь 2009 г.). «MACC1, недавно идентифицированный ключевой регулятор передачи сигналов HGF-MET, предсказывает метастазы рака толстой кишки». Природная медицина . 15 (1): 59–67. дои : 10.1038/нм.1889 . ПМИД 19098908 . S2CID 8854895 .
- ^ Stein U (2013) MACC1 – новая мишень для солидного рака. Мнения экспертов
- ^ Шубель К.Э., Чен В., Коуп Л., Глёкнер С.С., Сузуки Х., Йи Дж.М. и др. (сентябрь 2007 г.). «Сравнение гиперметилома ДНК с генными мутациями при колоректальном раке человека» . ПЛОС Генетика . 3 (9): 1709–1723. дои : 10.1371/journal.pgen.0030157 . ЧВК 1988850 . ПМИД 17892325 .
- ^ «Какова связь между евреями-ашкенази и колоректальным раком?» . ВебМД . Проверено 17 октября 2019 г.
- ^ Jump up to: а б с Табибзаде А., Тамешкель Ф.С., Моради Й., Солтани С., Моради-Лаке М., Ашрафи Г.Х. и др. (30 октября 2020 г.). «Мутации пути сигнальной трансдукции при раке желудочно-кишечного тракта (ЖКТ): систематический обзор и метаанализ» . Научные отчеты . 10 (1): 18713. Бибкод : 2020NatSR..1018713T . дои : 10.1038/s41598-020-73770-1 . ISSN 2045-2322 . ПМЦ 7599243 . ПМИД 33127962 .
- ^ Ионов Ю., Пейнадо М.А., Малхосян С., Шибата Д., Перучо М. (июнь 1993 г.). «Повсеместные соматические мутации в простых повторяющихся последовательностях открывают новый механизм канцерогенеза толстой кишки». Природа . 363 (6429): 558–561. Бибкод : 1993Natur.363..558I . дои : 10.1038/363558a0 . ПМИД 8505985 . S2CID 4254940 .
- ^ Чакраварти С., Кришнан Б., Мадхаван М. (1999). «Апоптоз и экспрессия р53 при колоректальных новообразованиях». Индийский Дж. Мед. Рез . 86 (7): 95–102.
- ^ Абдул Халек Ф.Дж., Галликано Дж.И., Мишра Л. (ноябрь 2010 г.). «Стволовые клетки рака толстой кишки» . Исследования рака желудочно-кишечного тракта (Приложение 1): S16–S23. ПМК 3047031 . ПМИД 21472043 .
- ^ Jump up to: а б с д Марковиц С.Д., Бертаньолли М.М. (декабрь 2009 г.). «Молекулярное происхождение рака: Молекулярная основа колоректального рака» . Медицинский журнал Новой Англии . 361 (25): 2449–2460. дои : 10.1056/NEJMra0804588 . ПМЦ 2843693 . ПМИД 20018966 .
- ^ Мелен П., Фирон Э.Р. (август 2004 г.). «Роль рецептора зависимости DCC в патогенезе колоректального рака». Журнал клинической онкологии . 22 (16): 3420–3428. дои : 10.1200/JCO.2004.02.019 . ПМИД 15310786 .
- ^ Jump up to: а б с Улен М., Чжан С., Ли С., Сьёстедт Е., Фагерберг Л., Бидхори Г. и др. (август 2017 г.). «Атлас патологии транскриптома рака человека» . Наука . 357 (6352): eaan2507. дои : 10.1126/science.aan2507 . ПМИД 28818916 .
- ^ Фогельштейн Б., Кинцлер К.В. (август 2004 г.). «Гены рака и пути, которыми они управляют». Природная медицина . 10 (8): 789–799. дои : 10.1038/nm1087 . PMID 15286780 . S2CID 205383514 .
- ^ Jump up to: а б с Музни Д.М., Бейнбридж М.Н., Чанг К., Динь Х.Х., Драммонд Дж.А., Фаулер Г. и др. (Сеть атласов генома рака) (июль 2012 г.). «Комплексная молекулярная характеристика рака толстой и прямой кишки человека» . Природа . 487 (7407): 330–337. Бибкод : 2012Natur.487..330T . дои : 10.1038/nature11252 . ПМК 3401966 . ПМИД 22810696 .
- ^ Гаталика З., Вранич С., Сю Дж., Свенсен Дж., Редди С. (июль 2016 г.). «Колоректальный рак с высокой микросателлитной нестабильностью (MSI-H): краткий обзор прогностических биомаркеров в эпоху персонализированной медицины» . Семейный рак . 15 (3): 405–412. дои : 10.1007/s10689-016-9884-6 . ПМЦ 4901118 . ПМИД 26875156 .
- ^ Jump up to: а б с Райан Э., Шихан К., Кревин Б., Мохан Х.М., Винтер, округ Колумбия (август 2017 г.). «Текущая ценность определения статуса репарации несоответствия при колоректальном раке: обоснование рутинного тестирования». Критические обзоры по онкологии/гематологии . 116 : 38–57. дои : 10.1016/j.critrevonc.2017.05.006 . ПМИД 28693799 .
- ^ Хиссонг Э., Кроу Э.П., Янтисс Р.К., Чен Ю.Т. (ноябрь 2018 г.). «Оценка статуса восстановления несоответствия колоректального рака в современную эпоху: обзор текущей практики и переоценка роли тестирования микросателлитной нестабильности» . Современная патология . 31 (11): 1756–1766. дои : 10.1038/s41379-018-0094-7 . ПМИД 29955148 .
- ^ Jump up to: а б с Грейди В.М., Марковиц С.Д. (март 2015 г.). «Молекулярный патогенез колоректального рака и его потенциальное применение для скрининга колоректального рака» . Пищеварительные заболевания и науки . 60 (3): 762–772. дои : 10.1007/s10620-014-3444-4 . ПМЦ 4779895 . ПМИД 25492499 .
- ^ Лесли А., Кэри Ф.А., Пратт Н.Р., Стил Р.Дж. (июль 2002 г.). «Последовательность колоректальной аденомы-карциномы» . Британский журнал хирургии . 89 (7): 845–860. дои : 10.1046/j.1365-2168.2002.02120.x . ISSN 0007-1323 . ПМИД 12081733 . S2CID 36456541 .
- ^ Нгуен Л.Х., Гоэль А., Чунг, округ Колумбия (январь 2020 г.). «Пути колоректального канцерогенеза» . Гастроэнтерология . 158 (2): 291–302. дои : 10.1053/j.gastro.2019.08.059 . ISSN 0016-5085 . ПМК 6981255 . ПМИД 31622622 .
- ^ Слотер ДП, Саутвик HW, Смейкал В (сентябрь 1953 г.). «Полевая канцеризация многослойного плоского эпителия полости рта; клинические последствия мультицентрического происхождения» . Рак . 6 (5): 963–968. doi : 10.1002/1097-0142(195309)6:5<963::AID-CNCR2820060515>3.0.CO;2-Q . ПМИД 13094644 . S2CID 6736946 .
- ^ Джованнуччи Э., Огино С. (сентябрь 2005 г.). «Метилирование ДНК, полевые эффекты и колоректальный рак» . Журнал Национального института рака . 97 (18): 1317–1319. дои : 10.1093/jnci/dji305 . ПМИД 16174847 .
- ^ Бернштейн С., Бернштейн Х., Пейн С.М., Дворжак К., Гаревал Х. (февраль 2008 г.). «Полевые дефекты при прогрессировании рака желудочно-кишечного тракта» . Письма о раке . 260 (1–2): 1–10. дои : 10.1016/j.canlet.2007.11.027 . ПМЦ 2744582 . ПМИД 18164807 .
- ^ Нгуен Х., Лустаунау С., Фациста А., Рэмси Л., Хассуна Н., Тейлор Х. и др. (июль 2010 г.). «Дефицит Pms2, ERCC1, Ku86, CcOI в дефектах поля во время прогрессирования рака толстой кишки» . Журнал визуализированных экспериментов (41): 1931. doi : 10.3791/1931 . ПМК 3149991 . ПМИД 20689513 . 28-минутное видео
- ^ Рубин Х (март 2011 г.). «Поля и канцеризация полей: предопухолевые источники рака: бессимптомные гиперпластические поля являются предшественниками неоплазии, и их прогрессирование в опухоли можно отследить по плотности насыщения в культуре». Биоэссе . 33 (3): 224–231. doi : 10.1002/bies.201000067 . ПМИД 21254148 . S2CID 44981539 .
- ^ Цао Дж.Л., Ятабе Ю., Саловаара Р., Ярвинен Х.Дж., Меклин Дж.П., Аалтонен Л.А. и др. (февраль 2000 г.). «Генетическая реконструкция историй отдельных колоректальных опухолей» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (3): 1236–1241. Бибкод : 2000PNAS...97.1236T . дои : 10.1073/pnas.97.3.1236 . ПМК 15581 . ПМИД 10655514 .
- ^ Jump up to: а б Фогельштейн Б., Пападопулос Н., Велкулеску В.Е., Чжоу С., Диас Л.А., Кинцлер К.В. (март 2013 г.). «Пейзажи генома рака» . Наука . 339 (6127): 1546–1558. Бибкод : 2013Sci...339.1546V . дои : 10.1126/science.1235122 . ПМК 3749880 . ПМИД 23539594 .
- ^ Jump up to: а б Бернштейн С., Нфонсам В., Прасад А.Р., Бернштейн Х. (март 2013 г.). «Дефекты эпигенетического поля при прогрессировании рака» . Всемирный журнал желудочно-кишечной онкологии . 5 (3): 43–49. дои : 10.4251/wjgo.v5.i3.43 . ПМЦ 3648662 . ПМИД 23671730 .
- ^ Локхед П., Чан А.Т., Нишихара Р., Фукс К.С., Бек А.Х., Джованнуччи Е. и др. (январь 2015 г.). «Этиологический полевой эффект: переоценка концепции полевого эффекта в предрасположенности и прогрессировании рака» . Современная патология . 28 (1): 14–29. дои : 10.1038/modpathol.2014.81 . ПМК 4265316 . ПМИД 24925058 .
- ^ Уилбур Б., изд. (2009). Мир клетки (7-е изд.). Сан-Франциско, К.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Страницы биологии Кимбалла. Архивировано 31 декабря 2017 года в Wayback Machine "Онкогены". Полный текст бесплатно.
- ^ Канвал Р., Гупта С. (апрель 2012 г.). «Эпигенетические модификации рака» . Клиническая генетика . 81 (4): 303–311. дои : 10.1111/j.1399-0004.2011.01809.x . ПМК 3590802 . ПМИД 22082348 .
- ^ Jump up to: а б Шнекенбургер М., Дидерих М. (март 2012 г.). «Эпигенетика открывает новые горизонты в профилактике колоректального рака» . Текущие отчеты о колоректальном раке . 8 (1): 66–81. дои : 10.1007/s11888-011-0116-z . ПМК 3277709 . ПМИД 22389639 .
- ^ Jump up to: а б с д Лао В.В., Грейди В.М. (октябрь 2011 г.). «Эпигенетика и колоректальный рак» . Обзоры природы. Гастроэнтерология и гепатология . 8 (12): 686–700. дои : 10.1038/nrgastro.2011.173 . ПМЦ 3391545 . ПМИД 22009203 .
- ^ Клутштейн М., Нейман Д., Гринфилд Р., Сидар Х. (июнь 2016 г.). «Метилирование ДНК при раке и старении» . Исследования рака . 76 (12): 3446–3450. дои : 10.1158/0008-5472.CAN-15-3278 . ПМИД 27256564 .
- ^ Хасинто Ф.В., Эстеллер М. (июль 2007 г.). «Мутаторные пути, вызванные эпигенетическим молчанием при раке человека» . Мутагенез . 22 (4): 247–253. дои : 10.1093/mutage/gem009 . ПМИД 17412712 .
- ^ Латц К., Пфайфер GP (февраль 2011 г.). «Эпигенетические изменения генов репарации ДНК при раке» . Журнал молекулярно-клеточной биологии . 3 (1): 51–58. дои : 10.1093/jmcb/mjq053 . ПМК 3030973 . ПМИД 21278452 .
- ^ «Колоректальный рак» . Библиотека медицинских концепций Lecturio . Проверено 22 июля 2021 г.
- ^ Коппеде Ф, Лопомо А, Списни Р, Мильоре Л (январь 2014 г.). «Генетические и эпигенетические биомаркеры для диагностики, прогноза и лечения колоректального рака» . Всемирный журнал гастроэнтерологии . 20 (4): 943–956. дои : 10.3748/wjg.v20.i4.943 . ПМЦ 3921546 . ПМИД 24574767 .
- ^ Гинни Дж., Динстманн Р., Ван Х., де Рейньес А., Шликер А., Сонесон С. и др. (ноябрь 2015 г.). «Консенсусные молекулярные подтипы колоректального рака» . Природная медицина . 21 (11): 1350–1356. дои : 10.1038/нм.3967 . ПМЦ 4636487 . ПМИД 26457759 .
- ^ Оруджи Э., Раман А.Т., Сингх А.К., Сорокин А., Арслан Э., Гош А.К. и др. (май 2021 г.). «Динамика состояния хроматина определяет конкретные терапевтические стратегии при энхансерных подтипах колоректального рака» . Гут . 71 (5): 938–949. doi : 10.1136/gutjnl-2020-322835 . ПМЦ 8745382 . ПМИД 34059508 . S2CID 235269540 .
- ^ Jump up to: а б «Колоректальный рак» . Библиотека медицинских концепций Lecturio . Проверено 10 июля 2021 г.
- ^ Авиви М.О., Каур Х., Эрнст Р., Раух Г.М., Морани А.С., Станицкий Н. и др. (2023). «Восстановление МРТ аденокарциномы прямой кишки после неоадъювантной химиолучевой терапии: результаты визуализации и потенциальные опасности». Рентгенография . 43 (4): e220135. дои : 10.1148/rg.220135 . ПМИД 36927125 . S2CID 257583845 .
- ^ Авиви М.О., Каур Х., Эрнст Р., Раух Г.М., Морани А.С., Станицкий Н. и др. (апрель 2023 г.). «Восстановление МРТ аденокарциномы прямой кишки после неоадъювантной химиолучевой терапии: результаты визуализации и потенциальные опасности». Рентгенография . 43 (4): e220135. дои : 10.1148/rg.220135 . ПМИД 36927125 . S2CID 257583845 .
- ^ Канг Х, О'Коннелл Дж.Б., Леонарди М.Дж., Маггард М.А., МакГори М.Л., Ко С.И. (февраль 2007 г.). «Редкие опухоли толстой и прямой кишки: национальный обзор». Международный журнал колоректальных заболеваний . 22 (2): 183–189. дои : 10.1007/s00384-006-0145-2 . ПМИД 16845516 . S2CID 34693873 .
- ^ «Эквивалентные термины и определения для толстой, ректосигмовидной и прямой кишки C180-C189, C199, C209 (исключая лимфому и лейкоз M9590 – M9992 и саркому Капоши M9140) – Правила для солидных опухолей толстой кишки 2018 г. Обновление за июль 2019 г.» (PDF) . Национальный институт рака . Архивировано (PDF) из оригинала 16 января 2020 г.
- ^ «Виды колоректального рака» . Центры лечения рака Америки . 4 октября 2018 г. Проверено 16 января 2020 г.
- ^ Ди Комо Х.А., Махендрарадж К., Лау К.С., Чемберлен Р.С. (октябрь 2015 г.). «Аденосквамозная карцинома ободочной и прямой кишки: популяционное исследование клинических результатов с участием 578 пациентов из базы данных эпидемиологии и конечных результатов (SEER) (1973–2010)». Журнал Американского колледжа хирургов . 221 (4): 56. doi : 10.1016/j.jamcollsurg.2015.08.044 .
- ^ Уайтсайд Дж., Мунглани Р. (сентябрь 1998 г.). «TUNEL, Hoechst и тройная маркировка иммуногистохимии: улучшенный метод обнаружения апоптоза в срезах тканей - обновление». Исследования мозга. Протоколы исследования мозга . 3 (1): 52–53. дои : 10.1016/s1385-299x(98)00020-8 . ПМИД 9767106 .
- ^ «Стадирование колоректального рака по TNM (8-е издание AJCC)» . www.pathologyoutlines.com . Проверено 24 февраля 2019 г.
- ^ Паркин Д.М., Бойд Л., Уокер Л.С. (декабрь 2011 г.). «16. Доля рака, обусловленная образом жизни и факторами окружающей среды в Великобритании в 2010 году» . Британский журнал рака . 105 (С2): С77–С81. дои : 10.1038/bjc.2011.489 . ПМК 3252065 . ПМИД 22158327 .
- ^ Сирк Д. (2006). Эпидемиология и профилактика рака (3-е изд.). Издательство Оксфордского университета. п. 809. ИСБН 978-0-19-974797-9 . Архивировано из оригинала 28 сентября 2015 года.
- ^ Реннерт Г (2007). Профилактика рака . Спрингер. п. 179. ИСБН 978-3-540-37696-5 . Архивировано из оригинала 3 октября 2015 года.
- ^ Jump up to: а б «Обзор профилактики колоректального рака» . Национальный институт рака . 1 марта 2018 года . Проверено 26 октября 2018 г.
- ^ «Профилактика рака» . Всемирная организация здравоохранения . Проверено 27 октября 2018 г.
- ^ Чаплин А., Родригес Р.М., Сегура-Сампедро Х.Дж., Очогавиа-Сеги А., Ромагера Д., Барсело-Коблин Г. (октябрь 2022 г.). «Идея взаимосвязи между колоректальным раком и ожирением: является ли висцеральная жировая ткань недостающим звеном?» . Международный журнал молекулярных наук . 23 (21): 13128. doi : 10.3390/ijms232113128 . ПМЦ 9655590 . ПМИД 36361914 .
- ^ Лауби-Секретан Б, Скоччианти С, Лумис Д, Гросс Й, Бьянкини Ф, Страйф К (август 2016 г.). «Ожирение и рак – точка зрения рабочей группы IARC» . Медицинский журнал Новой Англии . 375 (8): 794–798. дои : 10.1056/nejmsr1606602 . ПМК 6754861 . ПМИД 27557308 .
- ^ «Колоректальный рак – факторы риска и профилактика» . 25 июня 2012 г.
- ^ Уиллетт У.К. (2014). «Диета, питание и рак: что дальше в области общественного здравоохранения?» . В Стюарте Б.В., Wild CP (ред.). Всемирный доклад о раке . Международное агентство по изучению рака, Всемирная организация здравоохранения. стр. 432–435. ISBN 978-92-832-0443-5 .
- ^ Jump up to: а б Уиллетт У.К., Ки Т., Ромье I (2014). «Глава 2.6: Диета, ожирение и физическая активность» . В Стюарте Б.В., Wild CP (ред.). Всемирный доклад о раке . Международное агентство по исследованию рака, Всемирная организация здравоохранения. стр. 124–133. ISBN 978-92-832-0443-5 .
Несколько крупных проспективных когортных исследований пищевых волокон и риска рака толстой кишки не подтвердили наличие связи, хотя обратная связь наблюдалась в большом исследовании Европейского проспективного исследования рака и питания (EPIC) и недавнем метаанализе. Необходимо лучше понять различия в результатах проспективных исследований; Пищевые волокна сложны и неоднородны, и связь с колоректальным раком может различаться в зависимости от источника питания. (стр. 127)
- ^ «Описание фактических данных по профилактике колоректального рака» . Национальный институт рака . 1 марта 2018 года . Проверено 26 октября 2018 г.
- ^ Туан Дж, Чен YX (18 декабря 2015 г.). «Факторы питания и образа жизни, связанные с риском колоректального рака, и взаимодействие с микробиотой: клетчатка, красное или обработанное мясо и алкогольные напитки» . Желудочно-кишечные опухоли . 3 (1). С. Каргер АГ: 17–24. дои : 10.1159/000442831 . ISSN 2296-3774 . ПМК 5040877 . ПМИД 27722153 .
- ^ Рейнольдс А., Манн Дж., Каммингс Дж., Винтер Н., Мете Э., Те Моренга Л. (февраль 2019 г.). «Качество углеводов и здоровье человека: серия систематических обзоров и метаанализов» . Ланцет . 393 (10170): 434–445. дои : 10.1016/S0140-6736(18)31809-9 . ПМИД 30638909 . S2CID 58632705 .
- ^ Сон М, Чан А.Т. (январь 2019 г.). «Факторы окружающей среды, кишечная микробиота и профилактика колоректального рака» . Клиническая гастроэнтерология и гепатология . 17 (2): 275–289. дои : 10.1016/j.cgh.2018.07.012 . ПМК 6314893 . ПМИД 30031175 .
Несмотря на давнюю гипотезу о том, что диета с высоким содержанием клетчатки может защитить от колоректального рака... эпидемиологические исследования, связывающие потребление пищевых волокон с последующим риском колоректального рака, дали противоречивые результаты... Тем не менее, основываясь на существующих данных, самый последний экспертный отчет от Всемирный фонд исследования рака и Американский институт исследований рака в 2017 году пришли к выводу, что существуют вероятные доказательства
- ^ Джаббари М., Пурморадиан С., Эйни-Зинаб Х., Мошаркеш Э., Хоссейни Балам Ф., Ягмаи Ю. и др. (ноябрь 2022 г.). «Уровни доказательств связи между потреблением различных групп продуктов питания / предметов и риском возникновения различных локализаций рака: общий обзор». Международный журнал пищевых наук и питания . 73 (7): 861–874. дои : 10.1080/09637486.2022.2103523 . ПМИД 35920747 . S2CID 251280745 .
- ^ Перес-Куэто Ф.Д., Вербеке В. (апрель 2012 г.). «Потребительские последствия постоянных обновлений WCRF о колоректальном раке». Мясная наука . 90 (4): 977–978. дои : 10.1016/j.meatsci.2011.11.032 . ПМИД 22196090 .
- ^ Харрисс Дж., Аткинсон Дж., Баттерхэм А., Джордж К., Кейбл НТ, Рейли Т. и др. (сентябрь 2009 г.). «Факторы образа жизни и риск колоректального рака (2): систематический обзор и метаанализ связей с физической активностью в свободное время». Колоректальное заболевание . 11 (7): 689–701. дои : 10.1111/j.1463-1318.2009.01767.x . ПМИД 19207713 . S2CID 8026021 .
- ^ Робсам Т.Э., Агнес Б., Хьяртокер А., Лангсет Х., Брэй Ф.И., Ларсен И.К. (ноябрь 2013 г.). «Индекс массы тела, физическая активность и колоректальный рак по анатомическим участкам: систематический обзор и метаанализ когортных исследований». Европейский журнал профилактики рака . 22 (6): 492–505. дои : 10.1097/CEJ.0b013e328360f434 . ПМИД 23591454 . S2CID 24764995 .
- ^ Кю Х.Х., Бахман В.Ф., Александр Л.Т., Мамфорд Дж.Э., Афшин А., Эстеп К. и др. (август 2016 г.). «Физическая активность и риск рака молочной железы, рака толстой кишки, диабета, ишемической болезни сердца и ишемического инсульта: систематический обзор и метаанализ зависимости доза-эффект для исследования глобального бремени болезней 2013» . БМЖ . 354 : i3857. дои : 10.1136/bmj.i3857 . ПМЦ 4979358 . ПМИД 27510511 .
- ^ Бисвас А., О П.И., Фолкнер Г.Е., Баджадж Р.Р., Сильвер М.А., Митчелл М.С. и др. (январь 2015 г.). «Сидячий образ жизни и его связь с риском заболеваемости, смертности и госпитализации у взрослых: систематический обзор и метаанализ». Анналы внутренней медицины . 162 (2): 123–132. дои : 10.7326/M14-1651 . ПМИД 25599350 . S2CID 7256176 .
- ^ Купер К., Сквайрс Х., Кэрролл С., Папайоанну Д., Бут А., Логан Р.Ф. и др. (июнь 2010 г.). «Химиопрофилактика колоректального рака: систематический обзор и экономическая оценка» . Оценка технологий здравоохранения . 14 (32): 1–206. дои : 10.3310/hta14320 . ПМИД 20594533 .
- ^ Эмильссон Л., Холм О., Бреттауэр М., Кук Н.Р., Беринг Дж.Э., Лёберг М. и др. (январь 2017 г.). «Систематический обзор с мета-анализом: сравнительная эффективность аспирина и скрининга для профилактики колоректального рака» . Алиментарная фармакология и терапия . 45 (2): 193–204. дои : 10.1111/кв.13857 . ПМИД 27859394 .
- ^ Биббинс-Доминго К. (июнь 2016 г.). «Использование аспирина для первичной профилактики сердечно-сосудистых заболеваний и колоректального рака: рекомендательное заявление Целевой группы профилактических служб США» . Анналы внутренней медицины . 164 (12): 836–845. дои : 10.7326/M16-0577 . ПМИД 27064677 .
- ^ Агентство медицинских исследований и качества. «Аспирин или нестероидные противовоспалительные препараты для первичной профилактики колоректального рака» . Министерство здравоохранения и социальных служб США. Архивировано из оригинала 5 января 2016 г.
2010/2011.
- ^ Вайнгартен М.А., Залманович А., Яфе Дж. (январь 2008 г.). «Диетические добавки кальция для профилактики колоректального рака и аденоматозных полипов» . Кокрановская база данных систематических обзоров . 2010 (1): CD003548. дои : 10.1002/14651858.CD003548.pub4 . ПМЦ 8719254 . ПМИД 18254022 .
- ^ Ма Ю, Чжан П, Ван Ф, Ян Дж, Лю Цз, Цинь Х (октябрь 2011 г.). «Связь между витамином D и риском колоректального рака: систематический обзор проспективных исследований» . Журнал клинической онкологии . 29 (28): 3775–3782. дои : 10.1200/JCO.2011.35.7566 . ПМИД 21876081 .
- ^ Инь Л., Гранди Н., Раум Э., Хауг У., Арндт В., Бреннер Х. (2011). «Метаанализ: сывороточный витамин D и риск колоректальной аденомы». Профилактическая медицина . 53 (1–2): 10–16. дои : 10.1016/j.ypmed.2011.05.013 . ПМИД 21672549 .
- ^ «Что я могу сделать, чтобы снизить риск развития колоректального рака?» . Центры по контролю и профилактике заболеваний . 2 апреля 2014. Архивировано из оригинала 26 февраля 2015 года . Проверено 5 марта 2015 г.
- ^ Jump up to: а б Он Дж, Эфрон Дж. Э. (2011). «Скрининг колоректального рака». Достижения хирургии . 45 : 31–44. дои : 10.1016/j.yasu.2011.03.006 . hdl : 2328/11906 . ПМИД 21954677 .
- ^ Сигел Р.Л., Уорд Э.М., Джемал А. (март 2012 г.). «Тенденции заболеваемости колоректальным раком в США по локализации и стадии опухоли, 1992–2008 гг.» . Эпидемиология рака, биомаркеры и профилактика . 21 (3): 411–416. дои : 10.1158/1055-9965.EPI-11-1020 . ПМИД 22219318 .
- ^ Шварц А.В., Эберт Дж.М., Джози М.Дж., Страйер С.М. (октябрь 2017 г.). «Повторный анализ смертности от всех причин в докладе Целевой группы профилактических служб США о скрининге колоректального рака за 2016 год» . Анналы внутренней медицины . 167 (8): 602–603. дои : 10.7326/M17-0859 . ПМК 5823607 . ПМИД 28828493 .
- ^ Хьюитсон П., Гласиу П., Уотсон Э., Таулер Б., Ирвиг Л. (июнь 2008 г.). «Кокрейновский систематический обзор скрининга колоректального рака с использованием анализа кала на скрытую кровь (гемоккультизм): обновленная информация». Американский журнал гастроэнтерологии . 103 (6): 1541–1549. дои : 10.1111/j.1572-0241.2008.01875.x . ПМИД 18479499 . S2CID 26338156 .
- ^ Ли Дж.К., Лайлз Э.Г., Бент С., Левин Т.Р., Корли Д.А. (февраль 2014 г.). «Точность фекальных иммунохимических тестов на колоректальный рак: систематический обзор и метаанализ» . Анналы внутренней медицины . 160 (3): 171. дои : 10.7326/M13-1484 . ПМК 4189821 . ПМИД 24658694 .
- ^ «Новые пути могут улучшить скрининг рака кишечника» . Доказательства НИХР . 13 сентября 2021 г. doi : 10.3310/alert_47581 . S2CID 239113610 . Проверено 5 августа 2022 г.
- ^ Jump up to: а б Ли С.Дж., Шарплс Л.Д., Бентон С.К., Блюсс О., Мэтьюз С., Сасиени П. и др. (сентябрь 2021 г.). «Фекальное иммунохимическое тестирование при скрининге рака кишечника: оценка результатов различных диагностических стратегий» . Журнал медицинского скрининга . 28 (3): 277–285. дои : 10.1177/0969141320980501 . ПМЦ 8366184 . ПМИД 33342370 .
- ^ Jump up to: а б Касим А., Крэндалл С.Дж., Мустафа Р.А., Хикс Л.А., Уилт Т.Дж., Форсиа М.А. и др. (ноябрь 2019 г.). «Скрининг колоректального рака у бессимптомных взрослых со средним риском: рекомендации Американского колледжа врачей» . Анналы внутренней медицины . 171 (9): 643–654. дои : 10.7326/M19-0642 . ПМК 8152103 . ПМИД 31683290 .
- ^ Вольф А.М., Фонтам Э.Т., Черч Т.Р., Флауэрс С.Р., Герра С.Э., Ламонте С.Дж. и др. (июль 2018 г.). «Скрининг колоректального рака у взрослых со средним риском: обновление рекомендаций Американского онкологического общества на 2018 год» . CA: Журнал рака для врачей . 68 (4): 250–281. дои : 10.3322/caac.21457 . ПМИД 29846947 .
- ^ «Скрининг колоректального рака» . Рабочая группа США по профилактическим услугам . 2008. Архивировано из оригинала 7 февраля 2015 года . Проверено 19 декабря 2011 г.
- ^ Jump up to: а б Бреннер Х., Сток С., Хоффмайстер М. (апрель 2014 г.). «Влияние скрининговой ректороманоскопии и скрининговой колоноскопии на заболеваемость и смертность от колоректального рака: систематический обзор и метаанализ рандомизированных контролируемых исследований и обсервационных исследований» . БМЖ . 348 (1 апреля 2009 г.): g2467. дои : 10.1136/bmj.g2467 . ПМЦ 3980789 . ПМИД 24922745 .
- ^ «Пять вопросов, которые должны задать врачи и пациенты» (PDF) . Выбираем мудро: инициатива Фонда ABIM . Американская Гастроэнтерологическая Ассоциация . Архивировано из оригинала (PDF) 9 августа 2012 года . Проверено 17 августа 2012 г.
- ^ Винавер С., Флетчер Р., Рекс Д., Бонд Дж., Берт Р., Ферруччи Дж. и др. (февраль 2003 г.). «Скрининг и эпиднадзор за колоректальным раком: клинические рекомендации и обоснование. Обновление на основе новых данных» . Гастроэнтерология . 124 (2): 544–560. дои : 10.1053/gast.2003.50044 . ПМИД 12557158 . S2CID 29354772 .
- ^ Касим А., Денберг Т.Д., Хопкинс Р.Х., Хамфри Л.Л., Левин Дж., Свит Д.Е. и др. (март 2012 г.). «Скрининг колоректального рака: рекомендации Американского колледжа врачей» . Анналы внутренней медицины . 156 (5): 378–386. дои : 10.7326/0003-4819-156-5-201203060-00010 . ПМИД 22393133 .
- ^ Тан В., Боскардин В.Дж., Стиячич-Цензер И., Ли С.Дж. (апрель 2015 г.). «Время извлечь выгоду из скрининга колоректального рака: метаанализ выживаемости гибких ректороманоскопических исследований» . БМЖ . 350 : h1662. дои : 10.1136/bmj.h1662 . ПМК 4399600 . ПМИД 25881903 .
- ^ Jump up to: а б Бахус С.М., Данфилд Л., Горбер С.К., Холмс Н.М., Бертвистл Р., Дикинсон Дж.А. и др. (март 2016 г.). «Рекомендации по скринингу колоректального рака в учреждениях первичной медико-санитарной помощи» . CMAJ . 188 (5): 340–348. дои : 10.1503/cmaj.151125 . ПМЦ 4786388 . ПМИД 26903355 .
- ^ «Программа скрининга рака кишечника Национальной службы здравоохранения» . www.cancerscreening.nhs.uk . Архивировано из оригинала 29 ноября 2014 года.
- ^ «Дом – рак кишечника, Австралия» . www.boelcanceraustralia.org . Архивировано из оригинала 24 декабря 2014 года.
- ^ «Обследование населения по раку кишечника» . rivm.nl. Архивировано из оригинала 17 декабря 2014 года.
- ^ Тепус М., Яу ТО (июль 2020 г.). «Неинвазивный скрининг колоректального рака: обзор» . Желудочно-кишечные опухоли . 7 (3): 62–73. дои : 10.1159/000507701 . ПМЦ 7445682 . ПМИД 32903904 .
- ^ «Новые пути могут улучшить скрининг рака кишечника» . Доказательства НИХР . 13 сентября 2021 г. doi : 10.3310/alert_47581 . S2CID 239113610 .
- ^ Штейн А, Атанакович Д, Бокемейер С (сентябрь 2011 г.). «Современные стандарты и новые тенденции в первичном лечении колоректального рака». Европейский журнал рака . 47 (Приложение 3): S312–S314. дои : 10.1016/S0959-8049(11)70183-6 . ПМИД 21943995 .
- ^ Чиореан Э.Г., Нандакумар Г., Фаделу Т., Темин С., Аларкон-Розас А.Е., Бехарано С. и др. (март 2020 г.). «Лечение пациентов с поздней стадией колоректального рака: Руководство ASCO по стратификации ресурсов» . JCO Глобальная онкология . 6 (6): 414–438. дои : 10.1200/JGO.19.00367 . ПМК 7124947 . ПМИД 32150483 .
- ^ Ямашита К., Ока С., Танака С., Нагата С., Кувай Т., Фурудой А. и др. (1 марта 2019 г.). «Долгосрочный прогноз после лечения рака Т1 с латерально распространяющимися опухолями: многоцентровое ретроспективное исследование» . Международный журнал колоректальных заболеваний . 34 (3): 481–490. дои : 10.1007/s00384-018-3203-7 . ISSN 1432-1262 . ПМИД 30607579 . S2CID 57427824 .
- ^ Jump up to: а б Маккарти К., Пирсон К., Фултон Р., Хьюитт Дж. и др. (Кокрейновская группа по колоректальному раку) (декабрь 2012 г.). «Предоперационная химиолучевая терапия при неметастатическом местно-распространенном раке прямой кишки». Кокрановская база данных систематических обзоров . 12 : CD008368. дои : 10.1002/14651858.CD008368.pub2 . ПМИД 23235660 .
- ^ Jump up to: а б «Колоректальный рак» . Кливлендская клиника . Проверено 9 июля 2021 г.
- ^ Бёкельман С., Энгельманн Б.Е., Каприо Т., Хансен Т.Ф., Глимелиус Б. (январь 2015 г.). «Риск рецидива у пациентов с раком толстой кишки II и III стадии: систематический обзор и метаанализ современной литературы» . Акта Онкологика . 54 (1): 5–16. дои : 10.3109/0284186x.2014.975839 . ПМИД 25430983 .
- ^ «Химиотерапия метастатического колоректального рака». Пресрайр Интернэшнл . 19 (109): 219–224. Октябрь 2010 г. PMID 21180382 .
- ^ Факих М.Г. (июнь 2015 г.). «Метастатический колоректальный рак: современное состояние и будущие направления» . Журнал клинической онкологии . 33 (16): 1809–1824. дои : 10.1200/JCO.2014.59.7633 . ПМИД 25918280 .
- ^ Бенделл Дж. (14 марта 2024 г.). «Антиангиогенные агенты в терапии первой и второй линии при распространенном колоректальном раке» . Исследования рака желудочно-кишечного тракта . 1 (4 Приложение 2). Международное общество желудочно-кишечной онкологии: S22-8. ПМК 2666834 . ПМИД 19365574 .
- ^ Шаиб В., Махаджан Р., Эль-Райес Б. (сентябрь 2013 г.). «Маркеры резистентности к терапии анти-EGFR при колоректальном раке» . Журнал желудочно-кишечной онкологии . 4 (3): 308–318. дои : 10.3978/j.issn.2078-6891.2013.029 . ПМЦ 3712296 . ПМИД 23997942 .
- ^ Яу ТО (октябрь 2019 г.). «Точное лечение колоректального рака: настоящее и будущее» . JGH Открыть . 3 (5): 361–369. дои : 10.1002/jgh3.12153 . ПМЦ 6788378 . ПМИД 31633039 .
- ^ Шугарбейкер П.Х., Ван дер Спитен К. (февраль 2016 г.). «Хирургическая технология и фармакология гипертермической периоперационной химиотерапии» . Журнал желудочно-кишечной онкологии . 7 (1): 29–44. дои : 10.3978/j.issn.2078-6891.2015.105 . ПМЦ 4754302 . ПМИД 26941982 .
- ^ Сегура-Сампедро Дж. Джей, Моралес-Сориано Р. (август 2020 г.). «Профилактическое применение HIPEC с оксалиплатином может быть полезным при Т4 и перфоративном раке толстой кишки: еще одна возможная интерпретация результатов COLOPEC» . Revista Espanola de Enfermedades Digestivas . 112 (8): 666. дои : 10.17235/reed.2020.6755/2019 . hdl : 20.500.13003/12309 . ПМИД 32686435 .
- ^ Эскивель Дж., Стикка Р., Шугарбейкер П., Левин Э., Ян Т.Д., Александр Р. и др. (январь 2007 г.). «Циторедуктивная хирургия и гипертермическая внутрибрюшинная химиотерапия в лечении злокачественных новообразований поверхности брюшины толстой кишки: консенсусное заявление. Общество хирургической онкологии». Анналы хирургической онкологии . 14 (1): 128–133. дои : 10.1245/s10434-006-9185-7 . ПМИД 17072675 . S2CID 21282326 .
- ^ Архона-Санчес А., Эспиноза-Редондо Е., Гутьеррес-Балд А., Сейф-Сампедро Дж.Дж., Перес-Олд Е., Консепсьон-Мартин В. и др. (апрель 2023 г.). «Эффективность и безопасность интраоперационной гипертермической внутрибрюшинной химиотерапии при местно-распространенном раке толстой кишки: рандомизированное клиническое исследование фазы 3» . ДЖАМА Хирургия 158 (7): 683–691. дои : 10.1001/jamasurg.2023.0662 . ПМЦ 10134040 . ПМИД 37099280 .
- ^ ДеВита В.Т., Лоуренс Т.С., Розенберг С.А. (2008). Рак ДеВиты, Хеллмана и Розенберга: принципы и практика онкологии . Липпинкотт Уильямс и Уилкинс. стр. 1258–. ISBN 978-0-7817-7207-5 .
- ^ Jump up to: а б Фини Дж., Сегал Р., Шиэн М., Хоган А., Риган М., Джойс М. и др. (сентябрь 2019 г.). «Неоадъювантная лучевая терапия в лечении рака прямой кишки» . Всемирный журнал гастроэнтерологии . 25 (33): 4850–4869. дои : 10.3748/wjg.v25.i33.4850 . ПМЦ 6737323 . ПМИД 31543678 .
- ^ Ли Ю, Ван Дж, Ма Х, Тан Л, Ян Ю, Сюэ С и др. (2016). «Обзор неоадъювантной химиолучевой терапии местно-распространенного рака прямой кишки» . Международный журнал биологических наук . 12 (8): 1022–1031. дои : 10.7150/ijbs.15438 . ПМЦ 4971740 . ПМИД 27489505 .
- ^ Цао С., Ван Д., Тянь Д.Х., Уилсон-Смит А., Хуан Дж., Римнер А. (декабрь 2019 г.). «Систематический обзор и метаанализ стереотаксической лучевой терапии тела при колоректальных метастазах в легких» . Журнал торакальных заболеваний . 11 (12): 5187–5198. дои : 10.21037/jtd.2019.12.12 . ПМК 6988072 . ПМИД 32030236 .
- ^ Боланд П.М., Ма В.В. (май 2017 г.). «Иммунотерапия колоректального рака» . Раки . 9 (5): 50. дои : 10.3390/cancers9050050 . ПМК 5447960 . ПМИД 28492495 .
- ^ Jump up to: а б Син Н.Л., Тенг М.В., Мок Т.С., Су Р.А. (декабрь 2017 г.). «De-novo и приобретенная устойчивость к нацеливанию на иммунные контрольные точки». «Ланцет». Онкология . 18 (12): е731–е741. дои : 10.1016/s1470-2045(17)30607-1 . ПМИД 29208439 .
- ^ Боррас Д.М., Вербандт С., Ауссерхофер М. и др. (ноябрь 2023 г.). «Динамика специфичности опухоли в сравнении с активностью свидетеля в CD8+ Т-клетках определяет разнообразные иммунные ландшафты при колоректальном раке» . Открытие клеток . 9 (114): 114. дои : 10.1038/s41421-023-00605-4 . ПМК 10652011 . ПМИД 37968259 .
- ^ «FDA предоставляет ускоренное одобрение пембролизумабу для первых показаний, не зависящих от ткани/места» . Управление по контролю за продуктами и лекарствами США . 9 февраля 2019 г.
- ^ Черчек А., Лумиш М., Синополи Дж., Вайс Дж., Шайа Дж., Ламендола-Эссель М. и др. (июнь 2022 г.). «Блокада PD-1 при дефектном восстановлении несоответствия, местно-распространенном раке прямой кишки» . Медицинский журнал Новой Англии . 386 (25): 2363–2376. дои : 10.1056/NEJMoa2201445 . ПМЦ 9492301 . ПМИД 35660797 . S2CID 249395846 .
- ^ «Паллиативная или поддерживающая помощь» . Американское онкологическое общество. Архивировано из оригинала 21 августа 2014 года . Проверено 20 августа 2014 г.
- ^ «Предварительное клиническое заключение ASCO: интеграция паллиативной помощи в стандартную онкологическую помощь» . АСКО. Архивировано из оригинала 21 августа 2014 года . Проверено 20 августа 2014 г.
- ^ Хиггинсон И.Дж., Эванс С.Дж. (сентябрь – октябрь 2010 г.). «Какие доказательства того, что команды паллиативной помощи улучшают результаты лечения онкологических больных и их семей?» . Раковый журнал . 16 (5): 423–435. дои : 10.1097/PPO.0b013e3181f684e5 . ПМИД 20890138 . S2CID 39881122 .
- ^ Вассерберг Н., Кауфман Х.С. (декабрь 2007 г.). «Паллиативная терапия колоректального рака». Хирургическая онкология . 16 (4): 299–310. дои : 10.1016/j.suronc.2007.08.008 . ПМИД 17913495 .
- ^ Амерси Ф, Стамос МД, Ко С.И. (июль 2004 г.). «Паллиативная помощь при колоректальном раке». Клиники хирургической онкологии Северной Америки . 13 (3): 467–477. дои : 10.1016/j.soc.2004.03.002 . ПМИД 15236729 .
- ^ Jump up to: а б с д Сон Х, Сон YJ, Ким Х, Ли Ю (8 июня 2018 г.). «Влияние психосоциальных вмешательств на качество жизни пациентов с колоректальным раком: систематический обзор и метаанализ» . Результаты по здоровью и качеству жизни . 16 (1): 119. дои : 10.1186/s12955-018-0943-6 . ISSN 1477-7525 . ПМК 5994008 . ПМИД 29884182 .
- ^ Jump up to: а б с д Пэн Юнь, Хуан МЛ, Као Ч. (31 января 2019 г.). «Распространенность депрессии и тревоги у больных колоректальным раком: обзор литературы» . Международный журнал экологических исследований и общественного здравоохранения . 16 (3): 411. doi : 10.3390/ijerph16030411 . ISSN 1660-4601 . ПМЦ 6388369 . ПМИД 30709020 .
- ^ Jump up to: а б Ченг В., Овейси Н., МакТаггарт-Коуэн Х., Лори Дж.М., Мерфи Р.А., Де Вера Массачусетс (2022). «Колоректальный рак и начало тревоги и депрессии: систематический обзор и метаанализ» . Современная онкология . 29 (11): 8751–8766. doi : 10.3390/curroncol29110689 . ISSN 1718-7729 . ПМЦ 9689519 . ПМИД 36421342 .
- ^ Мошер CE, Вингер Дж.Г., Гивен BA, Хелфт PR, О'Нил Б.Х. (2016). «Результаты психического здоровья при выживании при колоректальном раке: обзор литературы: Психическое здоровье при выживании при колоректальном раке» . Психоонкология . 25 (11): 1261–1270. дои : 10.1002/пон.3954 . ПМЦ 4894828 . ПМИД 26315692 .
- ^ Jump up to: а б с Рейнольдс Л.М., Конседин Н.С., Писарро Д.А., Биссетт И.П. (2013). «Отвращение и поведенческое избегание при скрининге и лечении колоректального рака: систематический обзор и программа исследований» . Уход за раком . 36 (2): 122–130. дои : 10.1097/NCC.0b013e31826a4b1b . ISSN 0162-220X . ПМИД 23047793 .
- ^ Jump up to: а б с д и ж Фелан С.М., Гриффин Дж.М., Джексон Г.Л., Зафар С.Ю., Хеллерстедт В., Стар М. и др. (2013). «Стигма, воспринимаемая вина, самообвинение и депрессивные симптомы у мужчин с колоректальным раком» . Психоонкология . 22 (1): 65–73. дои : 10.1002/пон.2048 . ISSN 1057-9249 . ПМК 6000725 . ПМИД 21954081 .
- ^ Jump up to: а б Хун Л.С., Чи Салли CW, Хонг-Гу Х (2013). «Влияние психосоциальных вмешательств на исходы лечения пациентов с колоректальным раком: обзор литературы» . Европейский журнал сестринского дела в онкологии . 17 (6): 883–891. дои : 10.1016/j.ejon.2013.05.001 . ISSN 1462-3889 . ПМИД 23759360 .
- ^ Мэн X, Ван X, Донг Z (1 октября 2021 г.). «Влияние нефармакологических вмешательств на качество жизни, уровень тревоги и депрессии у пациентов с колоректальным раком: систематический обзор и метаанализ рандомизированных контролируемых исследований» . Поддерживающая терапия при раке . 29 (10): 5635–5652. дои : 10.1007/s00520-021-06185-x . ISSN 1433-7339 . ПМИД 33786669 .
- ^ Jump up to: а б с д Хуа Х, Цзян Ц, Сунь П, Сюй Сюй (5 мая 2023 г.). «Факторы риска колоректального рака с ранним началом: систематический обзор и метаанализ» . Границы онкологии . 13 . дои : 10.3389/fonc.2023.1132306 . ISSN 2234-943X . ПМЦ 10196487 . ПМИД 37213277 .
- ^ Jump up to: а б «Национальная комплексная онкологическая сеть» (PDF) . nccn.org . Архивировано (PDF) из оригинала 25 марта 2009 г.
- ^ Jump up to: а б Деш С.Э., Бенсон А.Б., Сомерфилд М.Р., Флинн П.Дж., Краузе С., Лопринци С.Л. и др. (ноябрь 2005 г.). «Эпиднадзор за колоректальным раком: обновление практического руководства Американского общества клинической онкологии, 2005 г.» . Журнал клинической онкологии . 23 (33): 8512–8519. дои : 10.1200/JCO.2005.04.0063 . ПМИД 16260687 .
- ^ Джеффри М., Хики Б.Е., Хидер П.Н. (сентябрь 2019 г.). «Стратегии последующего наблюдения за пациентами, лечившимися от неметастатического колоректального рака» . Кокрановская база данных систематических обзоров . 2019 (9): CD002200. дои : 10.1002/14651858.CD002200.pub4 . ПМК 6726414 . ПМИД 31483854 .
- ^ Бетоф А.С., Дьюхерст М.В., Джонс Л.В. (март 2013 г.). «Влияние и потенциальные механизмы физических упражнений на прогрессирование рака: трансляционная перспектива» . Мозг, поведение и иммунитет . 30 (Дополнение): S75–S87. дои : 10.1016/j.bbi.2012.05.001 . ПМЦ 3638811 . ПМИД 22610066 .
- ^ Jump up to: а б Баллард-Барбаш Р., Фриденрайх К.М., Курнея К.С., Сиддики С.М., Мактирнан А., Альфано К.М. (июнь 2012 г.). «Физическая активность, биомаркеры и исходы заболеваний у выживших после рака: систематический обзор» . Журнал Национального института рака . 104 (11): 815–840. дои : 10.1093/jnci/djs207 . ПМЦ 3465697 . ПМИД 22570317 .
- ^ Jump up to: а б МакГеттиган М., Кардвелл Ч.Р., Кантвелл М.М., Талли М.А. (май 2020 г.). «Вмешательства в области физической активности для улучшения физического и психического здоровья, связанного с заболеванием, во время и после лечения у людей с не запущенным колоректальным раком» . Кокрановская база данных систематических обзоров . 2020 (5): CD012864. дои : 10.1002/14651858.cd012864.pub2 . ПМЦ 7196359 . ПМИД 32361988 .
- ^ Стрёмме Дж. М., Йоханнессен Б., Скотхайм Р.И. (2023 г.). «Отклоняющийся альтернативный сплайсинг как молекулярный подтип микросателлитно-стабильного колоректального рака» . JCO Клиническая информатика рака . 7 (7): e2200159. дои : 10.1200/CCI.22.00159 . hdl : 10852/108838 . ПМИД 36821799 .
- ^ Остерман Э., Глимелиус Б (сентябрь 2018 г.). «Риск рецидива после современных стадий, операций и патологий рака толстой кишки: анализ всего населения Швеции» . Заболевания толстой и прямой кишки . 61 (9): 1016–1025. doi : 10.1097/dcr.0000000000001158 . ПМИД 30086050 . S2CID 51934598 .
- ^ Jump up to: а б Дорудян С., Остерман Э., Глимелиус Б. (9 июня 2024 г.). «Факторы риска рецидива после операции по поводу рака прямой кишки в современной общенациональной популяционной когорте» . Анналы хирургической онкологии . дои : 10.1245/s10434-024-15552-x . ISSN 1068-9265 . ПМИД 38853216 .
- ^ Норс Дж., Иверсен Л.Х., Эриксен Р., Готшальк К.А., Андерсен К.Л. (1 января 2024 г.). «Частота рецидивов и время до рецидива на стадиях I–III колоректального рака: общенациональное датское когортное исследование» . JAMA Онкология . 10 (1): 54–62. дои : 10.1001/jamaoncol.2023.5098 . ISSN 2374-2437 . ПМЦ 10654928 . ПМИД 37971197 .
- ^ Норс Дж., Готшалк К.А., Эриксен Р., Андерсен К.Л. (1 июня 2024 г.). «Частота позднего рецидива и второго первичного рака через 5-10 лет после неметастатического колоректального рака» . Международный журнал рака . 154 (11): 1890–1899. дои : 10.1002/ijc.34871 . ПМИД 38323453 .
- ^ Захаракис М., Ксинос И.Д., Лазарис А., Смаро Т., Космас С., Доку А. и др. (февраль 2010 г.). «Предикторы выживаемости при метастатическом колоректальном раке IV стадии» . Противораковые исследования . 30 (2): 653–660. ПМИД 20332485 .
- ^ Агабеги ЭД, Агабеги С.С. (2008). Шаг вперед к медицине (серия «Шаг вперед») . Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-7153-5 .
- ^ Хун Ю (30 июня 2020 г.). «Клиническое исследование операции при колоректальном раке: анализ выживаемости» . Корейский журнал клинической онкологии 2020 . 16 (1): 3–8. дои : 10.14216/kjco.20002 . ПМЦ 9942716 . ПМИД 36945303 .
- ^ «Пятилетняя выживаемость» . Национальный институт рака . Проверено 9 мая 2021 г.
- ^ Сюй З., Бесерра А.З., Флеминг Ф.Дж., Аквина К.Т., Долан Дж.Г., Монсон Дж.Р. и др. (октябрь 2019 г.). «Лечение рака толстой кишки IV стадии и общая выживаемость». Журнал хирургических исследований . 242 : 47–54. дои : 10.1016/j.jss.2019.04.034 . ПМИД 31071604 . S2CID 149443256 .
- ^ Drageset S, Lindstrøm TC, Underlid K (апрель 2016 г.). « Мне просто нужно двигаться дальше»: опыт женщин и их размышления после первого года после первичной операции по поводу рака молочной железы». Европейский журнал сестринского дела в онкологии . 21 : 205–211. дои : 10.1016/j.ejon.2015.10.005 . ПМИД 26521054 .
- ^ Рестиво А., Зорколо Л., Д'Алия Г., Кокко Ф., Коссу А., Сцинту Ф. и др. (февраль 2016 г.). «Риск осложнений и долгосрочных функциональных изменений после местного иссечения опухолей прямой кишки с помощью трансанальной эндоскопической микрохирургии (ТЕМ)». Международный журнал колоректальных заболеваний . 31 (2): 257–266. дои : 10.1007/s00384-015-2371-y . ПМИД 26298182 . S2CID 29087556 .
- ^ Брегендал С., Эммерцен К.Дж., Линдегаард Дж.К., Лаурберг С. (январь 2015 г.). «Мочевая и сексуальная дисфункция у женщин после резекции с предоперационной лучевой терапией и без нее при раке прямой кишки: популяционное поперечное исследование». Колоректальное заболевание . 17 (1): 26–37. дои : 10.1111/codi.12758 . ПМИД 25156386 . S2CID 42069306 .
- ^ Рамирес М., Макмаллен С., Грант М., Альтшулер А., Хорнбрук М.С., Крауз Р.С. (декабрь 2009 г.). «Выяснение пола в измененном теле: опыт женщин, переживших колоректальный рак, со стомой» . Женщины и здоровье . 49 (8): 608–624. дои : 10.1080/03630240903496093 . ПМЦ 2836795 . ПМИД 20183104 .
- ^ Стил Н., Хей Р., Ноулз Г., Макин М. (сентябрь 2007 г.). «Тестирование карциноэмбрионального антигена (СЕА) при наблюдении за колоректальным раком: что думают пациенты?» . Последипломный медицинский журнал . 83 (983): 612–614. дои : 10.1136/pgmj.2007.059634 . ПМК 2600007 . ПМИД 17823231 .
- ^ Макгичан Г.Дж., Бирнс К., Кэмпбелл М., Карти Н., Эберхардт Дж., Патон В. и др. (январь 2021 г.). «Систематический обзор и качественный синтез опыта жизни с колоректальным раком как хроническим заболеванием» . Психология и здоровье . 37 (3): 350–374. дои : 10.1080/08870446.2020.1867137 . ПМИД 33499649 . S2CID 231771176 .
- ^ Лозано Р., Нагави М., Форман К., Лим С., Сибуя К., Абоянс В. и др. (декабрь 2012 г.). «Глобальная и региональная смертность от 235 причин смерти в 20 возрастных группах в 1990 и 2010 годах: систематический анализ для исследования глобального бремени болезней 2010 года» . Ланцет . 380 (9859): 2095–2128. дои : 10.1016/S0140-6736(12)61728-0 . hdl : 10536/DRO/DU:30050819 . ПМЦ 10790329 . ПМИД 23245604 . S2CID 1541253 .
- ^ ВОЗ (февраль 2010 г.). "Рак" . Всемирная организация здравоохранения. Архивировано из оригинала 29 декабря 2010 года . Проверено 5 января 2011 г.
- ^ Мерика Э., Саиф М.В., Кац А., Сиригос К., Сиригос С., Морс М. (2010). «Обзор. Вакцины против рака толстой кишки: обновленная информация». В Виво . 24 (5): 607–628. ПМИД 20952724 .
- ^ Ферли Дж., Шин Х.Р., Брей Ф., Форман Д., Мазерс С., Паркин Д.М. (2010). «Заболеваемость, смертность и распространенность колоректального рака во всем мире в 2008 г. – Резюме» . Архивировано из оригинала 17 октября 2012 года . ; «GLOBOCAN 2008 v2.0, Заболеваемость раком и смертность во всем мире: IARC CancerBase № 10» . Лион, Франция: Международное агентство по исследованию рака. Архивировано из оригинала 8 мая 2011 года.
- ^ Jump up to: а б «Колоректальный рак: Статистика» . Cancer.net, Американское общество клинической онкологии. февраль 2022 года . Проверено 13 мая 2022 г.
- ^ Кателла К. «Колоректальный рак: что нужно знать миллениалам и поколению Z» . Йельская медицина .
- ^ «Рак кишечника | О раке кишечника | Исследования рака в Великобритании» . www.cancerresearchuk.org . Архивировано из оригинала 9 марта 2017 года . Проверено 12 мая 2017 г.
- ^ Рак в Австралии: обзор, 2014. Серия «Рак» № 90. Кат. № CAN 88 . Канберра: Австралийский институт здравоохранения и социального обеспечения. 2014. ISBN 978-1-74249-677-1 .
- ^ Рак в Папуа-Новой Гвинее: обзор, 2016. Серия «Рак» № 176. Кат. № CAN 88 . Департамент здравоохранения Папуа-Новой Гвинеи. 2016.
- ^ Jump up to: а б с д и Пуццоно М., Мануччи А., Гранно С., Зуппардо Р.А., Галли А., Данезе С. и др. (2021). «Роль диеты и образа жизни при раннем начале колоректального рака: систематический обзор» . Раки . 13 (23): 5933. doi : 10.3390/cancers13235933 . ISSN 2072-6694 . ПМЦ 8657307 . ПМИД 34885046 .
- ^ Jump up to: а б с д и ж Вуик Ф.Е., Ньювенбург С.А., Барду М., Лансдорп-Фогелаар И., Динис-Рибейро М., Бенто М.Дж. и др. (2019). «Рост заболеваемости колоректальным раком среди молодых людей в Европе за последние 25 лет» . Гут . 68 (10): 1820–1826. дои : 10.1136/gutjnl-2018-317592 . ISSN 0017-5749 . ПМК 6839794 . ПМИД 31097539 .
- ^ Унануэ-Арса С., Солис-Ибинагойтия М., Диас-Сеоан М., Москера-Меткалф I, Идигорас I, Бильбао I и др. (12 декабря 2020 г.). «Неравенство и факторы риска, связанные с неучастием в программах скрининга колоректального рака: систематический обзор» . Европейский журнал общественного здравоохранения . 31 (2): 346–355. дои : 10.1093/eurpub/ckaa203 . ISSN 1101-1262 . ПМЦ 8071594 . ПМИД 33313657 .
- ^ Рехемтулла А (декабрь 2010 г.). «Динозавры и древние цивилизации: размышления о лечении рака» . Неоплазия . 12 (12): 957–968. дои : 10.1593/neo.101588 . ПМК 3003131 . ПМИД 21170260 .
- ^ Чжун Л., Чжан Х., Коваса М. (июнь 2014 г.). «Новая роль молочнокислых бактерий в защите от колоректального рака» . Всемирный журнал гастроэнтерологии . 20 (24): 7878–7886. дои : 10.3748/wjg.v20.i24.7878 . ПМК 4069315 . ПМИД 24976724 .
- ^ «Атлас колоректального рака» . Архивировано из оригинала 13 января 2016 года.