Хиральные препараты
Химические соединения, которые представляют собой зеркальные пары, химики называют хиральными или ручными молекулами. [1] Каждый близнец называется энантиомером . Лекарства, обладающие направленностью, называются хиральными лекарствами . Хиральные препараты, представляющие собой эквимолярную (1:1) смесь энантиомеров, называются рацемическими лекарствами и, очевидно, лишены оптического вращения. Наиболее часто встречающаяся стереогенная единица, [2] Придающий хиральность молекулам лекарственного средства является стереогенным центром. Стереогенный центр может быть обусловлен наличием тетраэдрических тетракоординатных атомов (C,N,P) и пирамидальных трехкоординатных атомов (N,S). Слово «хиральный» описывает трехмерную архитектуру молекулы и не раскрывает стереохимический состав. Следовательно, термин «хиральное лекарственное средство» не указывает, является ли лекарственное средство рацемическим (рацемическим лекарственным средством), одиночным энантиомером (специфическое хиральное лекарственное средство) или какой-либо другой комбинацией стереоизомеров. Чтобы решить эту проблему, Джозеф Гал ввел новый термин, названный уникиральным . [3] [4] Уникиральный означает, что стереохимический состав хирального лекарственного средства является гомогенным и состоит из одного энантиомера.
Многие лекарственные средства, важные для жизни, представляют собой комбинации зеркальных близнецов. Несмотря на большое сходство таких близнецов, различия в их биологических свойствах могут быть глубокими. Другими словами, энантиомеры компонентов рацемического хирального лекарственного средства могут сильно различаться по своему фармакокинетическому и фармакодинамическому профилю. [5] [6] [7] [8] Трагедия талидомида иллюстрирует возможность экстремальных последствий применения рацемата, проявляющего множественные эффекты, обусловленные отдельными энантиомерами. [9] С развитием хиральной технологии и ростом осведомленности о трехмерных последствиях действия и распределения лекарств возникла специализированная область «хиральная фармакология». Одновременно развивалась и система номенклатуры киральности. Краткий обзор истории киральности и терминологии/дескрипторов приведен ниже. Подробная временная шкала киральности не является целью этой статьи.
Хиральность: обзор истории
[ редактировать ]
Хиральность можно проследить до 1812 года, когда физик Жан-Батист Био узнал о явлении, названном «оптической активностью». [10] Луи Пастер , знаменитый ученик Био, сделал ряд наблюдений, которые привели его к предположению, что оптическая активность некоторых веществ обусловлена их молекулярной асимметрией, которая создает несовмещаемые зеркальные изображения. В 1848 году Пастер вырастил два разных типа кристаллов из рацемической натриево-аммониевой соли винной кислоты. Он был первым человеком, который вручную отделил энантиомерные кристаллы. [11] Фактически Пастер заложил основы стереохимии и хиральности.
В 1874 году Якобус Хенрикус ван 'т Хофф выдвинул идею асимметричного атома углерода. Он сказал, что все оптически активные соединения углерода имеют асимметричный атом углерода. [12] В том же году Жозеф Ахилл Ле Бель использовал только аргументы асимметрии и говорил об асимметрии молекул в целом, а не об асимметрии каждого атома углерода. [13] Таким образом, идею Ле Беля можно рассматривать как общую теорию стереоизомерии, тогда как идею Ван 'т-Гоффа можно рассматривать как частный случай (ограниченный тетраэдрическим углеродом).
Вскоре ученые начали изучать, какое значение хиральные соединения имеют для живых существ. В 1903 году Кушни был первым, кто показал, что энантиомеры хиральной молекулы обладают различными биологическими эффектами. [14] Лорд Кельвин впервые использовал слово «хиральный» в 1904 году. [15]
Хиральность: терминология/дескрипторы
[ редактировать ]Это сделано для того, чтобы дать обзор развивающейся системы номенклатуры хиральности, обычно используемой для различения энантиомеров хирального лекарственного средства. Вначале энантиомеры различали по их способности вращать плоскость плоскополяризованного света. Энантиомер, который вращает плоскополяризованный свет вправо, называется «правовращательным», сокращенно «декстро» или «d», а его аналог — «лево» или «l» . Рацемическая смесь обозначается как «(±)», «rac» или «dl» . Сейчас система наименования d/l, основанная на оптическом вращении, выходит из употребления.
Позже конвенция Фишера [16] [17] был введен для указания конфигурации стереогенного центра и использует символы D и L. Использование заглавных букв предназначено для отличия от обозначения «d» / «l» (оптического дескриптора), описанного ранее. В этой системе энантиомеры названы в соответствии с D- и L-глицеральдегидом, который принят в качестве стандарта для сравнения. Структуру хиральной молекулы следует представить в формуле проекции Фишера. Если гидроксильная группа, присоединенная к высшему хиральному атому углерода, находится справа, ее называют D-серией, а если слева, то ее называют L-серией. Эта номенклатурная система также устарела. Но D-/L-система наименования по-прежнему используется для обозначения конфигурации аминокислот и сахаров. В целом система номенклатуры D/L заменяется правилом Кана-Ингольда-Прелога (CIP) для описания конфигурации стереогенного / хирального центра.
В соглашении CIP или R/S или правиле последовательности конфигурация, пространственное расположение лигандов/заместителей вокруг хирального центра, обозначается либо «R», либо «S». [18] [2] В настоящее время это соглашение используется почти во всем мире и стало частью правил номенклатуры IUPAC (Международного союза теоретической и прикладной химии). В этом подходе: идентифицируйте хиральный центр, пометьте четыре атома, непосредственно присоединенные к рассматриваемому стереогенному центру, назначьте приоритеты в соответствии с правилом последовательности (от 1 до 4), вращайте молекулу до тех пор, пока заместитель с самым низким приоритетом (номер 4) не исчезнет. от наблюдателя/зрителя нарисуйте кривую от заместителя номер 1 к номеру 2 и номеру 3. Если кривая направлена по часовой стрелке, хиральный центр имеет R-абсолютную конфигурацию, «R» (лат. «rectus» = правый). Если кривая направлена против часовой стрелки, хиральный центр имеет S-абсолютную конфигурацию, «S» (лат. зловещий = левый). См. рисунок: правило Кана-Ингольда-Прелога.
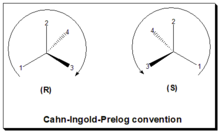
Обзор номенклатурной системы представлен в таблице ниже.
| Дескриптор хиральности ( используется как префикс ) | Описание | Комментарии |
| (+)- / вправо-/ д- | Оптические знаки вращения; не отражает конфигурацию | д; Устаревшие термины/выходящие из употребления |
| (-)- / левый- | Оптические знаки вращения; не отражает конфигурацию | л; Устаревшие термины/выходящие из употребления |
| (±)- / rac- / дл- | Рацемат или рацемическая смесь представляет собой эквимолярную (1:1) смесь энантиомеров; соответствует энантиомерному избытку 0%. | дл; Устаревшие термины/выходящие из употребления |
| Д- | Относительная конфигурация по отношению к D-глицеральдегиду; называется конвенцией Фишера | - |
| Л- | Относительная конфигурация по отношению к L-глицеральдегиду; называется конвенцией Фишера | - |
| Р- | Латинское: прямая мышца = правая; абсолютная конфигурация согласно правилу Кана-Ингольда-Прелога/правилу последовательности | - |
| С- | Латинское: зловещий = левый; абсолютная конфигурация согласно правилу Кана-Ингольда-Прелога/правилу последовательности | - |
Рацемические препараты
[ редактировать ]В течение многих лет ученые, занимающиеся разработкой лекарств, были слепы к трехмерным последствиям стереохимии, главным образом из-за отсутствия технологий для проведения энантиоселективных исследований. Помимо трагедии с талидомидом, еще одним событием, которое подняло важность вопросов стереохимии в исследованиях и разработках лекарств, стала публикация в 1984 году рукописи Ариенса под названием «Стереохимия, основа сложной чепухи в фармакокинетике и клинической фармакологии». [19] В этой статье и в серии последующих статей критиковалась практика проведения фармакокинетических и фармакодинамических исследований рацемических препаратов и игнорирование вклада отдельных энантиомеров. [20] [21] [22] [23] [24] [25] Эти статьи помогли кристаллизовать некоторые важные проблемы, связанные с рацемическими лекарствами, и стимулировали многочисленные дискуссии в промышленности, правительстве и научных кругах.
Хиральная фармакология
[ редактировать ]В результате этой критики и нового осознания трехмерных эффектов действия лекарств, вызванного экспоненциальным взрывом хиральных технологий, возникла новая область «стереофармакология». Более конкретный термин — «хиральная фармакология», фраза, популяризированная Джоном Колдуэллом. [26] Эта область превратилась в специализированную дисциплину, изучающую трехмерные аспекты действия и распределения лекарств. Этот подход по существу рассматривает каждую версию хиральных близнецов как отдельные химические виды. Для выражения фармакологической активности каждого из хиральных близнецов были придуманы два технических термина: эутомер и дистомер . [27] Член хирального двойника, обладающий большей физиологической активностью, называется эутомером, а другой, обладающий меньшей активностью, — дистомером. Обычно понимается, что эта ссылка обязательно относится к одному изучаемому виду деятельности. Эутомер одного эффекта вполне может оказаться дистомером при изучении другого эффекта. Соотношение эутомеров и дистомеров называется эвдисмическим соотношением . [28]
Биоокружение и хиральные близнецы
[ редактировать ]Поведение хиральных двойников зависит главным образом от природы среды (ахиральный/хиральный), в которой они находятся. Ахиральная среда не различает молекулярных близнецов, тогда как хиральная среда отличает левостороннюю версию от правосторонней версии. Человеческое тело, классическая биосреда, по своей сути является управляемым, поскольку оно наполнено хиральными дискриминаторами, такими как аминокислоты, ферменты, углеводы, липиды, нуклеиновые кислоты и т. д. Следовательно, когда рацемический терапевтический препарат подвергается воздействию биологической системы, его компоненты-энантиомеры будут действовать. стереоселективно. [29] Для лекарственных средств хиральная дискриминация может происходить либо на фармакокинетической, либо на фармакодинамической фазе.
Хиральная дискриминация
[ редактировать ]Иссон и Стедман [30] (1933) разработали модель взаимодействия лекарственного средства с рецептором, позволяющую объяснить дифференциальную фармакодинамическую активность между энантиомерными парами. В этой модели более активный энантиомер (эутомер) участвует как минимум в трех одновременных межмолекулярных взаимодействиях с поверхностью рецептора (хорошее соответствие), рис. A., где менее активный энантиомер (дистомер) взаимодействует только в двух сайтах (плохое соответствие), рисунок B. [См. изображение рисунка: модель Иссона-Стедмана]. Таким образом, «подгонка» отдельных энантиомеров к рецепторному участку различна, как и энергия взаимодействия. Это упрощенная модель, но она используется для объяснения биологической дискриминации между энантиомерными парами.

На самом деле взаимодействие лекарственного средства и рецептора не так просто, но такой взгляд на столь сложное явление позволил лучше понять механизм действия лекарств.
Фармакодинамические соображения
[ редактировать ]Рацемические лекарственные средства представляют собой не комбинации лекарственных средств в общепринятом смысле двух или более совместно составленных терапевтических агентов, а комбинации изомерных веществ, фармакологическая активность которых может проявляться преимущественно в одной конкретной энантиомерной форме. При стереоселективности действия истинно активным является только один из компонентов рацемической смеси. Другой изомер, дистомер, следует рассматривать как примесь или изомерный балласт. [31] термин, придуманный Ариенсом, не способствующий достижению намеченных эффектов. В отличие от фармакокинетических свойств энантиомерной пары, различия в фармакодинамической активности, как правило, более очевидны. Существует широкий спектр возможностей действия дистомера, многие из которых подтверждены экспериментально. [32] [33] [34] Отдельные примеры действия дистомера (а именно: эквипотентный, менее активный, неактивный, антагонистический, хиральная инверсия ) представлены в таблице ниже.
| Хиральный препарат | Стереогенный центр(ы) | Терапевтическое действие | Эутомер | Дистомер | Действие Дистомера | Ссылка |
| прометазин | 1 | Антигистаминный препарат | ( Р )-/( С )- | - | Эквипотентный | [35] |
| Сальбутамол | 1 | Бронходилятатор | ( Р )- | ( С )- | Менее активен; нет серьезных побочных эффектов | [5] |
| Пропранолол | 1 | Антигипертензивный | ( С )- | ( Р )- | Неактивный; половина плацебо | [36] [37] |
| Индакринон | 1 | Мочегонное средство | ( Р )- | ( С )- | Противодействует побочному эффекту эутомера. | [38] |
| Пропоксифен | 2 | Анальгетик; (Декспропоксифен) | (2R ) ,(3S ) - | (2С ) ,(3Р ) - | Независимая терапевтическая ценность | [39] |
| противокашлевое; (левопропоксифен) | (2С ) ,(3Р ) - | (2R ) ,(3S ) - | ||||
| Ибупрофен | 1 | Противовоспалительное средство | ( С )- | ( Р )- | Хиральная инверсия (однонаправленная; от [(R)- до (S)-] | [40] |
Токсичность лекарств
[ редактировать ]Поскольку между энантиомерами хирального лекарственного средства часто наблюдаются большие фармакокинетические и фармакодинамические различия, неудивительно, что энантиомеры могут приводить к стереоселективной токсичности. Они могут находиться в фармакологически активном энантиомере (эутомере) или в неактивном (дистомере). [41] [42] [43] Также были продемонстрированы токсикологические различия между энантиомерами. Ниже приведены примеры некоторых хиральных препаратов, токсичные/нежелательные побочные эффекты которых сохраняются почти в дистомере. Казалось бы, это явный случай использования кирального переключателя .
пеницилламин
[ редактировать ]Пеницилламин представляет собой хиральный препарат с одним хиральным центром и существует в виде пары энантиомеров. (S)-пеницилламин представляет собой эутомер с желаемой противоартритной активностью, тогда как (R)-пеницилламин чрезвычайно токсичен. [44]
Кетамин
[ редактировать ]
Кетамин – широко используемый анестетик. Это хиральная молекула, которую вводят в виде рацемата. Исследования показывают, что (S)-(+)-кетамин является активным анестетиком, а нежелательные побочные эффекты (галлюцинации и возбуждение) связаны с дистомером, (R)-(-)-кетамином. [45] [46] [47]
Допа
[ редактировать ]
Первоначальное использование рацемической допы для лечения болезни Паркинсона привело к ряду побочных эффектов, а именно. тошнота, рвота, анорексия, непроизвольные движения и гранулоцитопения. Использование L-допы [(S)-энантиомера] привело к снижению необходимой дозы и побочным эффектам. Гранулоцитопения не наблюдалась при использовании одного энантиомера. [48] [49] [50]
Этамбутол
[ редактировать ]
Противотуберкулезное средство Этамбутол содержит в своей структуре два конституционно-симметричных стереогенных центра и существует в трех стереоизомерных формах. Энантиомерная пара (S,S)- и (R,R)-этамбутол вместе с ахиральным стереоизомером, называемым мезо -формой, поддерживает диастереомерные отношения с оптически активными стереоизомерами. Активность препарата заключена в (S,S)-энантиомере, который в 500 и 12 раз более эффективен, чем (R,R)-этамбутол и мезоформа . Первоначально препарат был введен для клинического применения в виде рацемата, но был заменен на (S,S)-энантиомер в результате неврита зрительного нерва, приведшего к слепоте. Токсичность зависит как от дозы, так и от продолжительности лечения. Все три стереоизомера были почти равносильны в отношении побочных эффектов. Следовательно, использование S,S)-энантиомера значительно улучшило соотношение риск/польза. [51] [52]
Талидомид
[ редактировать ]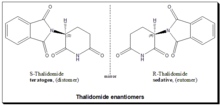
Талидомид является классическим примером, подчеркивающим предполагаемую роль хиральности в токсичности лекарств. Талидомид был рацемическим терапевтическим средством и назначался беременным женщинам для контроля тошноты и рвоты. Препарат был снят с мирового рынка, когда стало очевидно, что его применение во время беременности вызывает фокомелию (клиническое состояние, при котором дети рождаются с деформированными руками и конечностями). Позже, в конце 1970-х годов, исследования показали, что (R)-энантиомер является эффективным седативным средством , а (S)-энантиомер оказывает тератогенное действие и вызывает аномалии развития плода. [53] [54] [55] Более поздние исследования установили, что в биологических условиях ( R) -талидомид, «хороший партнер», претерпевает метаболическую инверсию in vivo в ( S) -талидомид, «злой партнер», и наоборот. Это двунаправленная киральная инверсия . Следовательно, аргумент о том, что трагедии талидомида можно было бы избежать, используя один энантиомер, является двусмысленным и бессмысленным. [56] [57] [58]
Основные особенности представлены в таблице ниже.
| Хиральный препарат | Хиральные центры | Клинические эффекты | |
|---|---|---|---|
| Эутомер; Активность | Дистомер; Активность | ||
| пеницилламин | 1 | (С)-; Противоартритный | (Р)-; Мутаген |
| Кетамин | 1 | (С)-; Анестетик | (Р)-; Галлюциноген |
| Допа | 1 | (С)-; Антипаркинсонизм | (Р)-; Гранулоцитопения |
| Этамбутол | 2 | (SS)-; Туберкулостатический | (Р,Р)-; и мезо-форма; Слепота |
| Талидомид | 1 | (Р)-; Седативное | (С)-; тератогенный |
Уникиральные препараты
[ редактировать ]Уникиральное означает конфигурационно однородное вещество (т.е. состоящее из хиральных молекул одной и той же конфигурации). Другими часто используемыми синонимами являются энантиомерно чистые лекарства и энантиомерно чистые лекарства. В качестве еще одного синонима также предлагались монохиральные препараты. [59] Профессор Элиэль, Вилен и Галь выразили глубокую обеспокоенность по поводу неправильного использования термина «гомохиральный» в статьях для обозначения энантиомерно чистых лекарств, что неверно. [60] [61] [62] Гомохиральный означает объекты или молекулы одинаковой направленности. Следовательно, его следует использовать только для сравнения двух или более объектов одинаковой «хиральности». Например, левые руки разных людей, или, скажем, Р-напроксен и Р-ибупрофен.
Фармацевтические компании и регулирующие органы во всем мире склонны к разработке уникиральных лекарств вследствие растущего понимания различных биологических свойств отдельных энантиомеров рацемических терапевтических средств. Большинство этих унимиральных препаратов являются результатом подхода хирального переключения . В таблице ниже перечислены избранные унимиральные препараты, используемые в медикаментозной терапии.
| Уникиральные препараты | Класс препарата/Тип лекарства | Терапевтическая область |
|---|---|---|
| Эзомепразол | Ингибитор протонной помпы | Гастроэнтерология |
| S-пантопразол | Ингибитор протонной помпы | |
| Дексрабипразол | Ингибитор протонной помпы | |
| Левосальбутамол | Бронходилятатор | Пульмонология |
| Левоцетризин | Антигистаминный препарат | |
| Левофлоксацин | Антибактериальный | Инфекционные заболевания |
| S-пеницилламин | Ревматоидный артрит | Ревматология/Боль/Воспаление |
| S-этодолак | НПВП | |
| Декскетопрофен | НПВП | |
| S-кетамин | Анестетик | Анестезиология |
| Левобупивакаин | Местный анестетик | |
| Левотироксин | Антигипотиреоз | Эндокринология |
| Леводопа | АнтиПаркинсон | нейропсихиатрия |
| S-амлодипин | Антиангинальное/антигипертензивное средство | Кардиология |
| S-метопролол | Антигипертензивный | |
| S-атенолол | Антигипертензивный |
Компания может заняться разработкой рацемического препарата против энантиомера, предоставив адекватное обоснование. Обоснование того, почему компания может заняться разработкой рацемических препаратов [63] [64] [65] может включать дорогостоящее разделение энантиомеров, рацематов эутомеров в растворе (например, оксазепам), [66] активности энантиомерной пары различны, но дополняют друг друга, дистомер неактивен, но разделение чрезмерно. Незначительная/низкая токсичность дистомера, высокий терапевтический индекс, взаимовыгодность, фармакологическая активность обоих энантиомеров, а также если разработка энантиомера занимает огромное количество времени для препарата экстренной необходимости, например, рака, СПИДа и т. д.
Хиральная чистота
[ редактировать ]Хиральная чистота является мерой чистоты хирального лекарственного средства. Другие используемые синонимы включают энантиомерный избыток , энантиомерную чистоту, энантиомерную чистоту и оптическую чистоту. Оптическая чистота — устаревший термин, поскольку сегодня большая часть измерений хиральной чистоты выполняется с использованием хроматографических методов (не основанных на оптических принципах). Энантиомерный избыток показывает, насколько (в %) хиральное вещество содержит один энантиомер над другим. Для рацемического препарата энантиомерный избыток будет составлять 0%. Существует ряд инструментов хирального анализа , таких как поляриметрия, ЯМР-спектроскопия с использованием реагентов хирального сдвига, хиральная ГХ (газовая хроматография), хиральная ВЭЖХ (высокоэффективная жидкостная хроматография), хиральная ТСХ (тонкослойная хроматография). [67] и другие методы хиральной хроматографии, которые используются для оценки хиральной чистоты. [68] Оценка чистоты унихирального лекарственного средства или энантиочистого лекарственного средства имеет большое значение с точки зрения безопасности и эффективности лекарственного средства.
См. также
[ редактировать ]- Хиральность (химия)
- Хиральный переключатель
- Хиральный анализ
- Энантиочистый препарат
- Хиральная инверсия
- Рацемат
- Стереохимия
- Хронология хиральности
Ссылки
[ редактировать ]- ^ Бассиндейл, А. (1984). Третье измерение в органической химии . Нью-Йорк: Джон Уайли, Нью-Йорк. ISBN 047190189X .
- ^ Jump up to: а б Мислоу, Курт; Сигел, Джей (1984). «Стереоизомерия и локальная хиральность» . Журнал Американского химического общества . 106 (11): 3319–3328. дои : 10.1021/ja00323a043 . ISSN 0002-7863 .
- ^ Гал, Джозеф; Линднер, Вольфганг (2006). «Хиральные лекарства с исторической точки зрения». Во Франкотте, Эрик (ред.). Хиральность в исследованиях лекарств . Германия: Wiley-VCH Verlag GmbH & Co., стр. 3–26. ISBN 3-527-31076-2 .
- ^ Гал, Дж (1998). «Проблемы стереохимической номенклатуры и терминологии. 1. Гомохиральный спор. Его природа, происхождение и предлагаемое решение». Энантиомер . 3 : 263–273.
- ^ Jump up to: а б Джамали, Ф.; Мехвар, Р.; Пасутто, FM (1989). «Энантиоселективные аспекты действия и распределения лекарств: терапевтические ловушки». Журнал фармацевтических наук . 78 (9): 695–715. дои : 10.1002/jps.2600780902 . ISSN 0022-3549 . ПМИД 2685226 .
- ^ Уильямс, Кеннет М. (1991), Молекулярная асимметрия и ее фармакологические последствия , Достижения в фармакологии, том. 22, Elsevier, стр. 57–135, doi : 10.1016/s1054-3589(08)60033-2 , ISBN. 978-0-12-032922-9 , PMID 1958505 , получено 3 июня 2021 г.
- ^ Кроссли, Роджер (1992). «Значение хиральности для изучения биологической активности» . Тетраэдр . 48 (38): 8155–8178. дои : 10.1016/s0040-4020(01)80486-5 . ISSN 0040-4020 .
- ^ Гросс, Майкл (1990), Глава 34. Значение стереохимии лекарств в современных фармацевтических исследованиях и разработках , Ежегодные отчеты по медицинской химии, том. 25, Elsevier, стр. 323–331, doi : 10.1016/s0065-7743(08)61610-3 , ISBN. 978-0-12-040525-1 , получено 3 июня 2021 г.
- ^ Декамп, Вт (1989). «Взгляд FDA на разработку стереоизомеров» . Хиральность . 1 (1): 2–6. дои : 10.1002/чир.530010103 . ПМИД 2642032 .
- ^ Био, ЖБ (1812). «Вращение осей поляризации света некоторыми веществами». Память Класс Науки. Математика. Физ. Инст. Имперская Франция . II : 41–136.
- ^ Пастер, Л. (1848). «Память о взаимосвязи, которая может существовать между кристаллической формой и химическим составом, а также о причине вращательной поляризации» [Заметка о связи кристаллической формы с химическим составом и о причине вращательной поляризации] (PDF) . CR Еженедельник. Заседания академии. Наука . 26 :535–538.
- ^ Вант-Хофф, Дж. Х. (1874). «Предложение о распространении нынешних химических структурных формул на космос, вместе с соответствующими наблюдениями о связи между оптически активной силой и химическим составом органических соединений». Арх. Неерл. наук. Точный Нат. (9): 445–454.
- ^ Ле Бель, Ж.А. (1874). «О связи, существующей между атомными формулами органических соединений и вращательной силой их растворов». Бык. Соц. Хим. о . 22 : 337–347.
- ^ Кушни, Артур Р. (2 ноября 1903 г.). «Атропин и гиосциамины — исследование действия оптических изомеров» . Журнал физиологии . 30 (2): 176–194. дои : 10.1113/jphysicalol.1903.sp000988 . ISSN 0022-3751 . ПМК 1540678 . ПМИД 16992694 .
- ^ Кельвин, Лорд (В. Томсон) (1904), Балтиморские лекции по молекулярной динамике и волновой теории света, CJ Clay & Sons, Лондон. Лекции читались в 1884 и 1893 годах.
- ^ Хартунг, Уолтер Х.; Андрако, Джон (1961). «Стереохимия» . Журнал фармацевтических наук . 50 (10): 805–818. дои : 10.1002/jps.2600501002 . ISSN 0022-3549 . ПМИД 14036070 .
- ^ Слокам, Д.В.; Сургарман, Д.; Такер, СП (1971). «Два лица номенклатуры D и L» . Журнал химического образования . 48 (9): 597. Бибкод : 1971ЖЧЭд..48..597С . дои : 10.1021/ed048p597 . ISSN 0021-9584 .
- ^ Кан, бакалавр наук; Инголд, СК; Прелог, В (1956). «Спецификация асимметричной конфигурации в органической химии». Эксперименты . 12 (3): 81–88. дои : 10.1007/BF02157171 . S2CID 43026989 .
- ^ Ариенс, Э.Дж. (1984). «Стереохимия – основа изощренной чепухи в фармакокинетике и клинической фармакологии» . Европейский журнал клинической фармакологии . 26 (6): 663–668. дои : 10.1007/bf00541922 . ISSN 0031-6970 . ПМИД 6092093 . S2CID 30916093 .
- ^ Ариенс, Эверардус Дж. (1987). «Стереохимия в анализе действия лекарств. Часть II» . Обзоры медицинских исследований . 7 (3): 367–387. дои : 10.1002/med.2610070305 . ISSN 0198-6325 . ПМИД 3041134 . S2CID 31403941 .
- ^ Ариенс, Э.Дж. (1988). «Стереохимические последствия гибридных и псевдогибридных лекарств. Часть III» . Обзоры медицинских исследований . 8 (2): 309–320. дои : 10.1002/med.2610080206 . ISSN 0198-6325 . ПМИД 3288823 . S2CID 33013615 .
- ^ Ариенс, Э.Дж. (1987). «Последствия пренебрежения стереохимией в фармакокинетике и клинической фармакологии». Бр. Дж. Клин. Фармакол. Там . 21 (10): 827–829. дои : 10.1177/106002808702101013 . ПМИД 3322758 . S2CID 23007083 .
- ^ Ариенс, Эверд Дж. (1987). «Последствия пренебрежения стереохимией в фармакокинетике и клинической фармакологии» . Разведка по наркотикам и клиническая фармация . 21 (10): 827–829. дои : 10.1177/106002808702101013 . ISSN 0012-6578 . ПМИД 3322758 . S2CID 23007083 .
- ^ Ариенс, Э.Дж. (1989). «Стереоселективность в действии лекарств» . Фармакология и токсикология . 64 (4): 319–320. дои : 10.1111/j.1600-0773.1989.tb00655.x . ISSN 0901-9928 . ПМИД 2748538 .
- ^ Ариенс, Э.Дж. (1986). «Хиральность биоактивных веществ и ее подводные камни» . Тенденции в фармакологических науках . 7 : 200–205. дои : 10.1016/0165-6147(86)90313-5 . ISSN 0165-6147 .
- ^ Колдуэлл, Джон (1995). «Хиральная фармакология и регулирование новых лекарств». Химия и промышленность . 6 : 176–179.
- ^ Пфайффер, CC (6 июля 1956 г.). «Оптическая изомерия и фармакологическое действие, обобщение» . Наука . 124 (3210): 29–31. Бибкод : 1956Sci...124...29P . дои : 10.1126/science.124.3210.29 . ISSN 0036-8075 . ПМИД 13337345 .
- ^ Ариенс, Эверхардус Дж.; Вуис, Эвелин В.; Веринга, Эрик Дж. (1988). «Стереоселективность биоактивных ксенобиотиков» . Биохимическая фармакология . 37 (1): 9–18. дои : 10.1016/0006-2952(88)90749-6 . ISSN 0006-2952 . ПМИД 3276322 .
- ^ Вайнер, Ирвинг В. (1 сентября 1992 г.). «Трехмерный взгляд на фармакологию» . Американский журнал аптеки системы здравоохранения . 49 (9_Suppl): S4–S8. дои : 10.1093/ajhp/49.9_suppl_1.s4 . ISSN 1079-2082 . ПМИД 1530004 .
- ^ Иссон, Лесли Хилтон; Стедман, Эдгар (1 января 1933 г.). «Исследования взаимосвязи между химическим строением и физиологическим действием» . Биохимический журнал . 27 (4): 1257–1266. дои : 10.1042/bj0271257 . ISSN 0306-3283 . ПМК 1253018 . ПМИД 16745220 .
- ^ Драйер, Деннис Э (1986). «Фармакодинамические и фармакокинетические различия между энантиомерами лекарств у человека: обзор» . Клиническая фармакология и терапия . 40 (2): 125–133. дои : 10.1038/clpt.1986.150 . ISSN 0009-9236 . ПМИД 3731675 . S2CID 33537650 .
- ^ Скотт, Эндрю К. (1990). «Стереоизомеры в клинической фармакологии» . Информационный журнал о лекарствах . 24 (1): 121–123. дои : 10.1177/009286159002400123 . ISSN 0092-8615 . S2CID 72095771 .
- ^ Леманн, Педро А.Ф. (1986). «Стереоизомерия и действие лекарств» . Тенденции в фармакологических науках . 7 : 281–285. дои : 10.1016/0165-6147(86)90353-6 . ISSN 0165-6147 .
- ^ ARIENS, EJ (1990), «Рацемическая терапия — проблемы по всей линии» , Хиральность в разработке и синтезе лекарств , Elsevier, стр. 29–43, doi : 10.1016/b978-0-12-136670-4.50008-4 , ISBN 978-0-12-136670-4 , получено 3 июня 2021 г.
- ^ Хатт, Эй Джей; Тан, Южная Каролина (1996). «Хиральность лекарственного средства и его клиническое значение» . Наркотики . 52 (Приложение 5): 1–12. дои : 10.2165/00003495-199600525-00003 . ISSN 0012-6667 . ПМИД 8922553 . S2CID 41802235 .
- ^ Симони, Миклош (1984). «О хиральном действии лекарственных средств» . Обзоры медицинских исследований . 4 (3): 359–413. дои : 10.1002/мед.2610040304 . ISSN 0198-6325 . ПМИД 6087043 . S2CID 38829275 .
- ^ Уильямс, Кеннет; Ли, Эдмунд (1985). «Важность энантиомеров лекарственных средств в клинической фармакологии» . Наркотики . 30 (4): 333–354. дои : 10.2165/00003495-198530040-00003 . ISSN 0012-6667 . ПМИД 3905334 . S2CID 23999344 .
- ^ Ариенс, Эверардус Дж. (1986). «Стереохимия: источник проблем медицинской химии» . Обзоры медицинских исследований . 6 (4): 451–466. дои : 10.1002/мед.2610060404 . ISSN 0198-6325 . ПМИД 3534485 . S2CID 36115871 .
- ^ Болдуин, Джей-Джей; Абрамс, WB (1988). Вайнер, И.В.; Драйер, DE (ред.). Стереохимия лекарственных средств, аналитические методы и фармакология . Нью-Йорк: Марсель Деккер, Нью-Йорк. стр. 311–356.
- ^ Уильямс, К.М. (1990). Проблемы и чудеса хиральных молекул . Будапешт: Академический Киадо, Будапешт. стр. 181–204. ISBN 963-05-5881-5 .
- ^ Скотт, Эндрю К. (1993). «Стереоизомеры и токсичность лекарств» . Безопасность лекарств . 8 (2): 149–159. дои : 10.2165/00002018-199308020-00005 . ISSN 0114-5916 . ПМИД 8452656 . S2CID 20426452 .
- ^ Пауэлл, Дж. Р. (1988). Стереохимия наркотиков. Аналитические методы и фармакология . Нью-Йорк: Марсель Деккер, Нью-Йорк. стр. 245–270.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Райт, Мэтью Р.; Джамали, Фахреддин (1993). «Методы анализа энантиомеров рацемических лекарственных средств для фармакологических и фармакокинетических исследований» . Журнал фармакологических и токсикологических методов . 29 (1): 1–9. дои : 10.1016/1056-8719(93)90044-ф . ISSN 1056-8719 . ПМИД 8481555 .
- ^ Ариенс, Э.Дж. (1989). Хиральное разделение методом ВЭЖХ . Чичестер: Эллис Хорвуд, Чичестер. стр. 31–68.
- ^ Уайт, Пол Ф.; Хэм, Джей; Путь, Уолтер Л.; Тревор, Энтони (1980). «Фармакология изомеров кетамина у хирургических больных» . Анестезиология . 52 (3): 231–239. дои : 10.1097/00000542-198003000-00008 . ПМИД 6989292 . S2CID 38711416 .
- ^ Корс, Райнер; Дюрье, Марсель Э. (1998). «Кетамин» . Анестезия и анальгезия . 87 (5): 1186–1193. дои : 10.1213/00000539-199811000-00039 . ISSN 0003-2999 .
- ^ Тревор, Энтони; Мариетта, Майкл; Падвилл, Чарльз; Путь, Уолтер (1977). «Метаболизм и перераспределение как факторы, определяющие продолжительность воздействия кетамина на крыс». Шестой международный фармацевтический конгресс: тезисы докладов . Эльзевир. п. 583. дои : 10.1016/b978-0-08-021308-8.51428-9 . ISBN 9780080213088 .
- ^ Хайнек, М. (1990). Хиральность в разработке и синтезе лекарств . Нью-Йорк: Академическая пресса, Нью-Йорк. стр. 1–28.
- ^ Котзиас, Джордж К.; Ван Вёрт, Мелвин Х.; Шиффер, Льюис М. (16 февраля 1967 г.). «Ароматические аминокислоты и модификация паркинсонизма» . Медицинский журнал Новой Англии . 276 (7): 374–379. дои : 10.1056/nejm196702162760703 . ISSN 0028-4793 . ПМИД 5334614 .
- ^ Котзиас, Джордж К.; Папавасилиу, Пол С.; Гелен, Розмари (13 февраля 1969 г.). «Модификация паркинсонизма — хроническое лечение леводопой» . Медицинский журнал Новой Англии . 280 (7): 337–345. дои : 10.1056/nejm196902132800701 . ISSN 0028-4793 . ПМИД 4178641 .
- ^ Блессингтон, Бернард (1997). Влияние стереохимии на разработку и использование лекарств . Нью-Йорк: Джон Уайли и сыновья, Нью-Йорк. стр. 235–261. ISBN 0-471-59644-2 .
- ^ Каннаппан, Валлиаппан. «Этамбутол – Хиральпедия» . Проверено 27 августа 2022 г.
- ^ Меллин, Гилберт В.; Каценштейн, Майкл (1962-12-06). «Сага о Талидомиде» . Медицинский журнал Новой Англии . 267 (23): 1184–1193. дои : 10.1056/nejm196212062672305 . ISSN 0028-4793 . ПМИД 13934699 .
- ^ Де Камп, Уилсон Х. (1989). «Письмо в редакцию» . Хиральность . 1 (2): 97–98. дои : 10.1002/чир.530010202 . ISSN 0899-0042 . ПМИД 2642047 .
- ^ «Талидомид – Хиральпедия» . 20 августа 2022 г. Проверено 27 августа 2022 г.
- ^ Стереохимические аспекты действия и распределения лекарственных средств . SK Branch, Мишель Эйхельбаум, Бернар Теста, Эндрю Шомодьи. Берлин: Шпрингер. 2003. ISBN 978-3-540-41593-0 . OCLC 52515592 .
{{cite book}}: CS1 maint: другие ( ссылка ) - ^ Эрикссон, Томми; Бьёркман, Свен; Рот, Бодил; Файдж, Орса; Хёугланд, Питер (1995). «Стереоспецифическое определение, хиральная инверсия in vitro и фармакокинетика энантиомеров талидомида у человека: КИНЕТИКА ЭНАНТИОМЕРОВ ТАЛИДОМИДА» . Хиральность . 7 (1): 44–52. дои : 10.1002/чир.530070109 . ПМИД 7702998 .
- ^ Эрикссон, Томми; Бьоркман, Свен; Хёглунд, Питер (2001). «Клиническая фармакология талидомида» . Европейский журнал клинической фармакологии . 57 (5): 365–376. дои : 10.1007/s002280100320 . ISSN 0031-6970 . ПМИД 11599654 . S2CID 7417671 .
- ^ Корнфорт, Р.Х.; Корнфорт, JW (1996). «Как быть правым и неправым». Хорват. хим. Акта . 69 : 427–433.
- ^ Эрнест, Л. Элиэль; Сэмюэл Х, Вилен (1990). «Неправильное использование гомохирального». Новости химии и техники . 10 :2.
- ^ Элиэль, Эрнест Л. (1997). <428::aid-chir5>3.0.co;2-1 "Неудачная стереохимическая номенклатура" . Хиральность . 9 (5–6): 428–430. doi : 10.1002/(sici)1520-636x(1997)9:5/6<428::aid-chir5>3.0.co;2-1 . ISSN 0899-0042 .
- ^ Гал, Джозеф (2013), Шуриг, Волкер (редактор), «Молекулярная хиральность: язык, история и значение» , Дифференциация энантиомеров I , Темы современной химии, том. 340, Чам: Springer International Publishing, стр. 1–20, номер документа : 10.1007/128_2013_435 , ISBN. 978-3-319-03238-2 , PMID 23666078 , получено 4 июля 2021 г.
- ^ Кайен, Митчелл Н. (1991). «Рацемические смеси и отдельные стереоизомеры: промышленные проблемы и проблемы разработки лекарств» . Хиральность . 3 (2): 94–98. дои : 10.1002/чир.530030203 . ISSN 0899-0042 .
- ^ Колдуэлл, Джон (1996). «Важность стереоспецифического биоаналитического мониторинга при разработке лекарств» . Журнал хроматографии А. 719 (1): 3–13. дои : 10.1016/0021-9673(95)00465-3 . ISSN 0021-9673 . ПМИД 8589835 .
- ^ Кэмпбелл, Д.Б. (1990). «Разработка хиральных препаратов». Акта Фарм. Норд . 2 (3): 217–226. ПМИД 2200432 .
- ^ Теста, Бернар; Карруп, Пьер-Ален; Гал, Джозеф (1993). «Так называемая «взаимная конверсия» стереоизомерных препаратов: попытка разъяснения» . Хиральность . 5 (3): 105–111. дои : 10.1002/чир.530050302 . ISSN 0899-0042 . ПМИД 8338720 .
- ^ Бхушан, Р .; Танвар, SJ Chromatogr. А 2010 , 1217 , 1395–1398. , дои : 10.1016/j.chroma.2009.12.071 )
- ^ Алленмарк, Стиг Г. (1988). Хроматографическое энантиоразделение: методы и применение . Чичестер: Эллис Хорвуд. стр. 27–40. ISBN 9780131329454 .
Внешние ссылки
[ редактировать ] СМИ, связанные с хиральными препаратами, на Викискладе?
СМИ, связанные с хиральными препаратами, на Викискладе?

