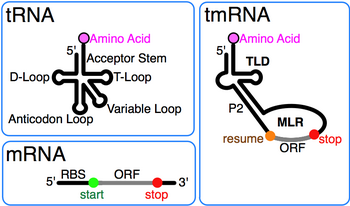
Переносная РНК
| РНК-переносчик | |
|---|---|
 | |
| Идентификаторы | |
| Символ | тмРНК |
| Рфам | RF00023 |
| Другие данные | |
| РНК Тип | ген |
| PDB Структуры | ПДБе |
Транспортная РНК (сокращенно тмРНК , также известная как 10Sa РНК и по ее генетическому названию SsrA ) представляет собой молекулу бактериальной РНК с двойными свойствами, подобными тРНК и информационной РНК . ТмРНК образует рибонуклеопротеиновый комплекс ( tmRNP ) вместе с малым белком B ( SmpB ), фактором элонгации Tu ( EF-Tu ) и рибосомальным белком S1. При транстрансляции тмРНК и связанные с ней белки связываются с бактериальными рибосомами , которые остановились в середине биосинтеза белка , например, при достижении конца информационной РНК , потерявшей свой стоп-кодон. ТмРНК удивительно универсальна: она перерабатывает остановленную рибосому, добавляет метку, индуцирующую протеолиз , к незавершенному полипептиду и облегчает деградацию аберрантной информационной РНК . [1] У большинства бактерий эти функции выполняют стандартные цельные тмРНК . У других видов бактерий пермутированный ген ssrA продуцирует тмРНК, состоящую из двух частей , в которой две отдельные цепи РНК соединены путем спаривания оснований.
Открытие и ранние работы
[ редактировать ]тмРНК впервые была обозначена как 10Sa РНК в 1979 году, после того как смешанная электрофоретическая фракция «10S» РНК Escherichia coli аналогичного размера была в дальнейшем разделена на тмРНК и РНКазу P (10Sb). [2] Присутствие псевдоуридина в смешанной 10S РНК указывает на то, что тмРНК имеет модифицированные основания, обнаруженные также в тРНК . Сходство 3'-конца тмРНК с Т-петлей тРНК было впервые обнаружено при секвенировании ssrA из Mycobacterium Tuberculosis . [3] Последующее сравнение последовательностей выявило полный тРНК-подобный домен (TLD), образованный 5'- и 3'- концами тРНК, включая акцепторный стебель с элементами, подобными элементам аланиновой тРНК, которые способствуют ее аминоацилированию с помощью аланин-тРНК-лигазы . [4] Также были выявлены отличия от тРНК : антикодоновое в тРНК отсутствует плечо, а область D-плеча представляет собой петлю без пар оснований.
Структура
[ редактировать ]Вторичная структура стандартных цельных тмРНК
[ редактировать ]
Полная E. coli тмРНК вторичная структура была выяснена с помощью сравнительного анализа последовательностей и структурного зондирования . [5] [6] Уотсона-Крика и GU Пары оснований были идентифицированы путем сравнения последовательностей бактериальной тмРНК с использованием автоматизированных вычислительных методов в сочетании с процедурами ручного выравнивания . [7] [8] На прилагаемом рисунке показана структура спаривания оснований этой прототипной тмРНК, которая организована в 12 филогенетически поддерживаемых спиралей (также называемых парами P1-P12), некоторые из которых разделены на спиральные сегменты.
Характерной особенностью каждой тРНК является консервативный тРНК-подобный домен (TLD), состоящий из спиралей 1, 12 и 2а (аналоги акцепторного стебля тРНК, Т-ствола и вариабельного стебля соответственно) и содержащий 5'-монофосфат. и аланилируемые 3'-концы CCA. Подобная мРНК область (MLR) в стандартной тмРНК представляет собой большую петлю, содержащую псевдоузлы и кодирующую последовательность (CDS) для меточного пептида возобновления , отмеченную кодоном и стоп-кодоном . Кодируемый пептид-метка (ANDENYALAA в E. coli ) варьируется среди бактерий, возможно, в зависимости от набора доступных протеаз и адаптеров. [9]
тмРНК обычно содержат четыре псевдоузла : один (pk1) выше CDS меточного пептида, а три других псевдоузла (от pk2 до pk4) ниже CDS. Области псевдоузлов, хотя в целом и консервативны, эволюционно пластичны. Например, в (цельных) тмРНК цианобактерий pk4 заменен двумя тандемно расположенными меньшими псевдоузлами. Это указывает на то, что сворачивание тмРНК за пределами TLD может быть важным, однако в области псевдоузла отсутствуют консервативные остатки, и псевдоузлы являются одними из первых структур, которые теряются, поскольку последовательности ssrA расходятся в пластидных и эндосимбионтных линиях. Спаривание оснований в области трех псевдоузлов E. coli нарушается во время транстрансляции . тмРНК [7] [10]
Двухчастные тмРНК
[ редактировать ]циркулярно перестановленном ssrA Сообщалось о в трех основных линиях: i) во всех альфапротеобактериях и примитивных митохондриях якобидных простейших, ii) в двух разрозненных группах цианобактерий ( Gloeobacter и клада, содержащая Prochromococcus и множество Synechococcus ), и iii) в некоторых представителях бетапротеобактерий. ( Cupriavidus и некоторые Rhodocyclales). [11] [12] Все они имеют одинаковую общую форму, состоящую из двух частей (акцепторная и кодирующая части), эквивалентную стандартной форме, прорезанной после рамки считывания. Ни один из них не сохраняет более двух псевдоузлов по сравнению с четырьмя (или более) стандартными тмРНК.
Альфапротеобактерии имеют две характерные последовательности: замену типичной последовательности Т-петли TΨCRANY на GGCRGUA и последовательность AACAGAA в большой петле 3'-концевого псевдоузла. В митохондриях MLR утрачен, и замечательная перестановка митохондриальной ssrA приводит к образованию небольшого цельного продукта Jakoba libera . [13]
Цианобактерии штаммов представляют собой наиболее вероятный случай эволюции пермутированного гена из стандартного гена из-за значительного сходства последовательностей между двумя типами генов, поскольку они встречаются у разных Synechococcus .
обработка тмРНК
[ редактировать ]Большинство тмРНК транскрибируются как более крупные предшественники, которые процессируются так же, как и тРНК . Расщепление на 5'-конце осуществляется P. рибонуклеазой [4] В процессинге 3'-конца тмРНК могут участвовать несколько экзонуклеаз, хотя РНКаза Т и РНКаза PH . наиболее эффективны [14] [15] В зависимости от вида бактерий 3'-CCA либо кодируется, либо добавляется тРНК нуклеотидилтрансферазой .
Подобный процессинг во внутренних сайтах пермутированной тРНК-предшественника объясняет ее физическое расщепление на две части. Двухчастные тмРНК имеют два дополнительных конца, процессинг которых необходимо учитывать. У альфапротеобактерий один 5´-конец является непроцессированным местом начала транскрипции. [16] Дальний 3'-конец в некоторых случаях может быть результатом ро-независимой терминации.
Трехмерные структуры
[ редактировать ]

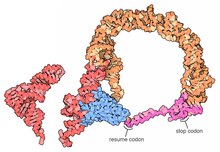
Структуры полных молекул тмРНК с высоким разрешением в настоящее время недоступны, и их может быть трудно получить из-за присущей MLR гибкости. В 2007 году Кристаллическая структура TLD Thermus thermophilus, связанного с белком SmpB , была получена с разрешением 3 Å. Эта структура показывает, что SmpB имитирует стебель D и антикодон канонической тРНК, тогда как спиральный участок 2а тРНК соответствует вариабельному плечу тРНК. [18] Криоэлектронно -микроскопическое исследование тмРНК на ранней стадии транстрансляции белком показывает пространственное взаимоотношение между рибосомой и тмРНП (тмРНК, связанной с EF-Tu ). TLD расположен вблизи центра, ассоциированного с ГТФазой, в субъединице 50S рибосомы; спираль 5 и псевдоузлы от pk2 до pk4 образуют дугу вокруг клюва рибосомной субъединицы 30S. [19]
Транс -перевод
[ редактировать ]
Кодирование тмРНК было обнаружено в 1995 году. [20] когда Симпсон и его коллеги сверхэкспрессировали мышиный цитокин IL-6 в E. coli и обнаружили несколько укороченных цитокинов, происходящих из пептидов, каждый из которых помечен на карбоксильных концах одинаковым удлинением из 11 аминокислотных остатков (A)ANDENYALAA. За исключением N-концевого аланина , который происходит от 3'-конца самой тмРНК, эта меточная последовательность была прослежена до короткой открытой рамки считывания в тмРНК E. coli . Кейлер и др. признали, что пептид-метка обеспечивает протеолиз , и предложили транстрансляционную модель действия тмРНК. [21]
Хотя детали механизма транстрансляции еще изучаются, общепринято, что тмРНК сначала занимает пустой А-сайт остановившейся рибосомы . Впоследствии рибосома перемещается с 3'-конца укороченной информационной РНК на кодон возобновления MLR, после чего следует стадия, склонная к проскальзыванию, с которой трансляция продолжается нормально до тех пор, пока стоп-кодон не встретится тРНК в рамке кадра. Транстрансляция важна для некоторых видов бактерий, тогда как другим бактериям требуется тмРНК, чтобы выжить в стрессовых условиях роста. [22] Считается, что тмРНК может помочь клетке с устойчивостью к антибиотикам, спасая рибосомы, остановленные антибиотиками. [23] В зависимости от организма меточный пептид может распознаваться различными протеазами или протеазными адаптерами. [9]
Мобильные генетические элементы и ген тмРНК
[ редактировать ]
ssrA является одновременно мишенью для некоторых мобильных ДНК и пассажиром для других. Было обнаружено, что он прерван тремя типами мобильных элементов. С помощью различных стратегий ни один из них не нарушает функцию гена: интроны группы I удаляются путем самосплайсинга, риккетсиальные палиндромные элементы , кодирующие интегразу, (RPE) встраиваются в безобидные сайты, а геномные островки расщепляют свою целевую ssrA , но восстанавливают отщепленную часть. [24] [25] [26] [27]
Нехромосомный ssrA впервые был обнаружен при геномном исследовании микобактериофагов (у 10% фагов). [28] другие мобильные элементы Были обнаружены , включая плазмиды и геномные острова, несущие ssrA . Одним из интересных случаев является Rhodobacter sphaeroides ATCC 17025, чей нативный ген тмРНК разрушен геномным островком; в отличие от всех других геномных островков в генах тмРНК (или тРНК), этот остров инактивировал нативный ген-мишень без восстановления, но компенсирует это, неся собственный ген тмРНК. Очень необычный родственник ssrA обнаружен в литическом микобактериофаге DS6A, который кодирует немногим больше, чем TLD.
Митохондриальные тмРНК ( ген ssrA )
[ редактировать ]Кодируемая митохондриями структурно восстановленная форма тмРНК (мт-тмРНК) была впервые постулирована для жгутиковых якобидов Reclinomonas americana . [11] Впоследствии наличие митохондриального гена ( ssrA ), кодирующего тмРНК, а также сайтов транскрипции и процессинга РНК было подтверждено у всех представителей якобидов , кроме одного . [29] [13] Функциональные доказательства, т.е. аминоацилирование , мт- тмРНК аланином доступны для Jakoba libera . [13] Совсем недавно ssrA был также идентифицирован в митохондриальных геномах оомицетов . [30] Как и у α-протеобактерий (предков митохондрий ), мт-тмРНК представляют собой двухчастные молекулы РНК с кольцевыми перестановками, за исключением Jakoba libera , где ген вернулся к кодированию одночастной конформации тмРНК. [13]
Идентификация ssrA в митохондриальных геномах
[ редактировать ]
Гены митохондриальной тРНК первоначально были признаны как короткие последовательности, которые консервативны среди якобидов и обладают потенциалом сворачиваться в отдельную тРНК-подобную вторичную структуру. Имея девять полных якобидов последовательностей мтДНК , [29] и значительно улучшенный инструмент поиска ковариаций (Infernal; [31] [32] [33] ), была разработана ковариационная модель на основе митохондриальных тмРНК якобидов , которая идентифицировала митохондриальные гены ssrA также у оомицетов . В настоящее время всего обнаружено 34 мт-тмРНК оомицетов шести родов: Albugo , Bremia , Phytophthora , Pseudoperonospora , Pythium и Saprolegnia . Ковариационная модель, построенная с использованием последовательностей как якобидов , так и оомицетов, теперь доступна в Rfam под названием «мт-тмРНК». [30]
Структура мт-тмРНК
[ редактировать ]Стандартная бактериальная тмРНК состоит из тРНК(Ala)-подобного домена (позволяющего добавлять некодируемый аланин к мРНК, у которых отсутствует стоп-кодирование) и мРНК-подобного домена, кодирующего белковую метку, которая предназначена для полипептида для дальнейшего использования. протеолиз. МРНК-подобный домен был потерян в мт-тмРНК. Сравнительный анализ последовательностей указывает на особенности, типичные для мт-тмРНК. [30] Наиболее консервативной является первичная последовательность акцепторного ствола аминоацила. Эта часть молекулы имеет неизменный остаток А в положении дискриминатора и пару GU в положении 3 (за исключением Seculamonas ecuadoriensis , которая имеет пару GC); это положение является сайтом узнавания аланил-тРНК-синтазы. P2 представляет собой спираль переменной длины (от 3 до 10 пар оснований) и соответствует антикодонному стеблю тРНК, но без антикодоновой петли (поскольку она не требуется для функции тмРНК). P2 стабилизирует тРНК-подобную структуру, но четыре нуклеотида, инвариантные у оомицетов и якобидов, предполагают дополнительную, в настоящее время неидентифицированную функцию. P3 имеет пять пар оснований и соответствует Т-плечу тРНК, но с разными консенсусными нуклеотидами как в парной области, так и в петле. Последовательность Т-петли консервативна у оомицетов и якобидов , лишь с небольшими отклонениями (например, ) Saprolegniaferax . Наконец, вместо тРНК-подобного D-стержня с укороченной трехнуклеотидной D-петлей, характерной для бактериальных тмРНК, митохондриальные аналоги имеют весьма вариабельную петлю длиной от 5 до 14 нуклеотидов. Промежуточная последовательность (Int.) состоящих из двух частей мт-тмРНК богата A+U и имеет неправильную длину (4–34 нт). ). Модели вторичной структуры одно- и двухкомпонентных мт-тмРНК см. на рисунке 1.
Процессинг и экспрессия мт-тмРНК
[ редактировать ]
Данные RNA-Seq Phytophthora sojae показывают уровень экспрессии, аналогичный уровню экспрессии соседних митохондриальных тРНК , а четыре основных сайта процессинга подтверждают предсказанные концы зрелой мт-тмРНК. [30] Молекула-предшественник тРНК, вероятно, процессируется РНКазой P и 3'-процессирующей тРНК эндонуклеазой (см. рисунок 2); Предполагается, что последняя активность приводит к удалению промежуточной последовательности. После добавления CCA к 3'-дискриминаторному нуклеотиду тмРНК может быть заряжена аланил-тРНК-синтетазой с помощью аланина.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Кейлер К.К. (2008). «Биология транстрансляции». Ежегодный обзор микробиологии . 62 : 133–51. дои : 10.1146/annurev.micro.62.081307.162948 . ПМИД 18557701 .
- ^ Рэй Б.К., Апирион Д. (июль 1979 г.). «Характеристика 10S РНК: новая стабильная молекула РНК из Escherichia coli». Молекулярная и общая генетика . 174 (1): 25–32. дои : 10.1007/BF00433301 . ПМИД 384159 . S2CID 22699560 .
- ^ Тьяги Дж.С., Кингер А.К. (январь 1992 г.). «Идентификация структурного гена 10Sa РНК микобактерии туберкулеза» . Исследования нуклеиновых кислот . 20 (1): 138. doi : 10.1093/nar/20.1.138 . ПМК 310338 . ПМИД 1371186 .
- ^ Jump up to: а б Комине Ю, Китабатаке М, Ёкогава Т, Нисикава К, Инокучи Х (сентябрь 1994 г.). «ТРНК-подобная структура присутствует в 10Sa РНК, небольшой стабильной РНК из Escherichia coli» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (20): 9223–7. Бибкод : 1994PNAS...91.9223K . дои : 10.1073/pnas.91.20.9223 . ПМК 44784 . ПМИД 7524073 .
- ^ Уильямс КП, Бартель ДП (декабрь 1996 г.). «Филогенетический анализ вторичной структуры тмРНК» . РНК . 2 (12): 1306–10. ПМЦ 1369456 . ПМИД 8972778 .
- ^ Фелден Б., Химено Х., Муто А., Маккатчеон Дж.П., Аткинс Дж.Ф., Гестеланд Р.Ф. (январь 1997 г.). «Зондирование структуры 10Sa РНК (тмРНК) Escherichia coli» . РНК . 3 (1): 89–103. ПМЦ 1369465 . ПМИД 8990402 .
- ^ Jump up to: а б Звиб С., Вауэр I, Вауэр Дж. (май 1999 г.). «Сравнительный анализ последовательностей тмРНК» . Исследования нуклеиновых кислот . 27 (10): 2063–71. дои : 10.1093/нар/27.10.2063 . ПМК 148424 . ПМИД 10219077 .
- ^ Андерсен Е.С., Линд-Томсен А., Кнудсен Б., Кристенсен С.Е., Хавгаард Дж.Х., Тораринссон Е., Ларсен Н., Цвиб С., Сестофт П., Кьемс Дж., Городкин Дж. (ноябрь 2007 г.). «Полуавтоматическое улучшение выравнивания РНК» . РНК . 13 (11): 1850–9. дои : 10.1261/rna.215407 . ПМК 2040093 . ПМИД 17804647 .
- ^ Jump up to: а б Гур Э, Зауэр РТ (октябрь 2008 г.). «Эволюция метки деградации ssrA в микоплазме: переключение специфичности на другую протеазу» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (42): 16113–8. Бибкод : 2008PNAS..10516113G . дои : 10.1073/pnas.0808802105 . ПМК 2570983 . ПМИД 18852454 .
- ^ Вауэр И.К., Звиб С., Вауэр Дж. (май 2005 г.). «РНК-переносчик разворачивается при прохождении через рибосому» . РНК . 11 (5): 668–73. дои : 10.1261/rna.7269305 . ПМК 1370753 . ПМИД 15811920 .
- ^ Jump up to: а б Кейлер К.К., Шапиро Л., Уильямс К.П. (июль 2000 г.). «ТмРНК, которые кодируют метки, индуцирующие протеолиз, обнаружены во всех известных бактериальных геномах: у Caulobacter функционирует двухкомпонентная тмРНК» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (14): 7778–83. Бибкод : 2000PNAS...97.7778K . дои : 10.1073/pnas.97.14.7778 . ПМК 16621 . ПМИД 10884408 .
- ^ Шаркади С.М., Уильямс КП (2004). «Третья линия с двухчастной тРНК» . Исследования нуклеиновых кислот . 32 (15): 4531–8. дои : 10.1093/nar/gkh795 . ПМК 516066 . ПМИД 15326226 .
- ^ Jump up to: а б с д Джейкоб Ю., Сейф Э., Пакет ПО, Ланг Б.Ф. (апрель 2004 г.). «Потеря мРНК-подобной области в митохондриальных тмРНК якобидов» . РНК . 10 (4): 605–14. дои : 10.1261/rna.5227904 . ПМК 1370551 . ПМИД 15037770 .
- ^ Шривастава Р.А., Шривастава Н., Апирион Д. (май 1992 г.). «Характеристика фермента процессинга РНК РНКазы III из дикого типа и сверхэкспрессирующих клеток Escherichia coli при обработке природных субстратов РНК». Международный журнал биохимии . 24 (5): 737–49. дои : 10.1016/0020-711X(92)90007-N . ПМИД 1375563 .
- ^ Ли З., Пандит С., депутат парламента Германии (март 1998 г.). «3'-экзорибонуклеолитическая обрезка является общей чертой созревания небольших стабильных РНК в Escherichia coli» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (6): 2856–61. Бибкод : 1998PNAS...95.2856L . дои : 10.1073/pnas.95.6.2856 . ЧВК 19659 . ПМИД 9501180 .
- ^ Мао С., Бхардвадж К., Шаркади С.М., Фиш Р.И., Дрисколл Т., Вауэр Дж., Звиб С., Собрал Б.В., Уильямс К.П. (2009). «Вариации гена тмРНК» . Биология РНК . 6 (4): 355–61. дои : 10.4161/rna.6.4.9172 . ПМИД 19617710 .
- ^ Сомея Т., Намеки Н., Хосой Х., Сузуки С., Хатанака Х., Фуджи М., Терада Т., Широзу М., Иноуэ Ю., Сибата Т., Курамицу С., Ёкояма С., Каваи Г. (январь 2003 г.). «Структура раствора тмРНК-связывающего белка SmpB из Thermus thermophilus» . Письма ФЭБС . 535 (1–3): 94–100. дои : 10.1016/S0014-5793(02)03880-2 . ПМИД 12560085 .
- ^ Jump up to: а б Бессё Ю., Сибата Р., Секинэ С., Мураяма К., Хигасидзима К., Хори-Такемото С., Ширузу М., Курамицу С., Ёкояма С. (май 2007 г.). «Структурная основа функциональной мимикрии тРНК с длинным вариабельным плечом с помощью транспортной РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (20): 8293–8. Бибкод : 2007PNAS..104.8293B . дои : 10.1073/pnas.0700402104 . ЧВК 1895943 . ПМИД 17488812 .
- ^ Валле М., Жилле Р., Каур С., Хенне А., Рамакришнан В., Фрэнк Дж. (апрель 2003 г.). «Визуализация входа тмРНК в остановившуюся рибосому». Наука . 300 (5616): 127–30. Бибкод : 2003Sci...300..127В . дои : 10.1126/science.1081798 . ПМИД 12677067 . S2CID 28845151 .
- ^ Ту Г.Ф., Рид Г.Е., Чжан Дж.Г., Мориц Р.Л., Симпсон Р.Дж. (апрель 1995 г.). «С-концевое удлинение укороченных рекомбинантных белков Escherichia coli с декапептидом РНК 10Sa» . Журнал биологической химии . 270 (16): 9322–6. дои : 10.1074/jbc.270.16.9322 . ПМИД 7536743 .
- ^ Кейлер К.К., Уоллер П.Р., Зауэр RT (февраль 1996 г.). «Роль системы пептидной маркировки в деградации белков, синтезированных из поврежденной информационной РНК». Наука . 271 (5251): 990–3. Бибкод : 1996Sci...271..990K . дои : 10.1126/science.271.5251.990 . ПМИД 8584937 . S2CID 29254050 .
- ^ Тибонье М., Тиберг Ж.М., Де Реус Х. (2008). Ахмед Н. (ред.). «Транстрансляция у Helicobacter pylori: необходимость спасения рибосом и необходимость маркировки белков для стрессоустойчивости и компетентности» . ПЛОС ОДИН . 3 (11): е3810. Бибкод : 2008PLoSO...3.3810T . дои : 10.1371/journal.pone.0003810 . ПМЦ 2584231 . ПМИД 19043582 .
- ^ Мюллер, Клаудия; Кроу-Маколифф, Кайлан; Уилсон, Дэниел Н. (18 марта 2021 г.). «Пути спасения рибосом в бактериях» . Границы микробиологии . 12 : 652980. дои : 10.3389/fmicb.2021.652980 . ISSN 1664-302X . ПМК 8012679 . ПМИД 33815344 .
- ^ Кирби Дж. Э., Тремпи Дж. Э., Готтесман С. (апрель 1994 г.). «Иссечение P4-подобного загадочного профага приводит к экспрессии Alp-протеазы в Escherichia coli» . Журнал бактериологии . 176 (7): 2068–81. дои : 10.1128/jb.176.7.2068-2081.1994 . ПМК 205313 . ПМИД 7511583 .
- ^ Уильямс КП (январь 2002 г.). «Веб-сайт тмРНК: вторжение интрона» . Исследования нуклеиновых кислот . 30 (1): 179–82. дои : 10.1093/нар/30.1.179 . ПМК 99078 . ПМИД 11752287 .
- ^ Дуайер Д.С. (январь 2001 г.). «Эгоистичная ДНК и происхождение генов». Наука . 291 (5502): 252–3. дои : 10.1126/science.291.5502.252 . ПМИД 11253208 . S2CID 5369275 .
- ^ Уильямс КП (февраль 2003 г.). «Трафик в гене тмРНК» . Журнал бактериологии . 185 (3): 1059–70. дои : 10.1128/JB.185.3.1059-1070.2003 . ПМЦ 142792 . ПМИД 12533482 .
- ^ Хэтфулл Г.Ф., Педулла М.Л., Джейкобс-Сера Д., Сичон П.М., Фоли А., Форд М.Э., Гонда Р.М., Хаутц Дж.М., Гриковян А.Дж., Келхнер В.А., Намбури С., Пайчини К.В., Попович М.Г., Шлейхер Д.Т., Симанек Б.З., Смит А.Л., Зданович Г.М., Кумар В., Пиблз К.Л., Джейкобс В.Р., Лоуренс Дж.Г., Хендрикс Р.В. (июнь 2006 г.). «Изучение метапротеома микобактериофага: фаговая геномика как образовательная платформа» . ПЛОС Генетика . 2 (6): е92. дои : 10.1371/journal.pgen.0020092 . ПМЦ 1475703 . ПМИД 16789831 .
- ^ Jump up to: а б Burger G, Grey MW, Forget L, Lang BF (2013). «Поразительно бактериоподобные и богатые генами митохондриальные геномы всех якобидных простейших» . Геномная биология и эволюция . 5 (2): 418–38. дои : 10.1093/gbe/evt008 . ПМК 3590771 . ПМИД 23335123 .
- ^ Jump up to: а б с д Хафез М., Бургер Г., Стейнберг С.В., Ланг Б.Ф. (июль 2013 г.). «Вторая группа эукариот с тмРНК, кодируемой митохондриями: идентификация in silico и экспериментальное подтверждение» . Биология РНК . 10 (7): 1117–24. дои : 10.4161/rna.25376 . ПМЦ 3849159 . ПМИД 23823571 . Архивировано из оригинала 21 февраля 2014 г. Проверено 13 февраля 2014 г.
- ^ Эдди, С. «Адский сайт» . Проверено 14 августа 2016 г.
- ^ Эдди С.Р., Дурбин Р. (июнь 1994 г.). «Анализ последовательности РНК с использованием ковариационных моделей» . Исследования нуклеиновых кислот . 22 (11): 2079–88. дои : 10.1093/нар/22.11.2079 . ПМК 308124 . ПМИД 8029015 .
- ^ Навроцкий Е.П., Кольбе Д.Л., Эдди С.Р. (май 2009 г.). «Инфернал 1.0: вывод о выравнивании РНК» . Биоинформатика . 25 (10): 1335–7. doi : 10.1093/биоинформатика/btp157 . ПМЦ 2732312 . ПМИД 19307242 .
Дальнейшее чтение
[ редактировать ]- Хонг С.Дж., Тран QA, Кейлер К.С. (июль 2005 г.). «Регулируемая клеточным циклом деградация тмРНК контролируется РНКазой R и SmpB» . Молекулярная микробиология . 57 (2): 565–75. дои : 10.1111/j.1365-2958.2005.04709.x . ПМЦ 3776457 . ПМИД 15978085 .