Короткая шпилька РНК
Короткая РНК-шпилька или малая РНК-шпилька ( shRNA /Вектор шпильки) представляет собой искусственную молекулу РНК с плотным витком шпильки, которую можно использовать для подавления экспрессии целевого гена посредством РНК-интерференции (RNAi). [1] [2] Экспрессия shRNA в клетках обычно осуществляется путем доставки плазмид или с помощью вирусных или бактериальных векторов . shRNA является выгодным медиатором RNAi, поскольку она имеет относительно низкую скорость деградации и обмена. Однако для этого требуется использование вектора экспрессии , который может вызывать побочные эффекты в медицинских целях. [3]
Выбор промотора важен для достижения устойчивой экспрессии shRNA. Сначала полимеразы III, использовались промоторы такие как U6 и H1; однако этим промоторам не хватает пространственного и временного контроля. [3] Таким образом, произошел переход к использованию полимеразы II индуцируемых промоторов для регуляции экспрессии shRNA.
Доставка
[ редактировать ]Экспрессию шРНК в клетках можно получить путем доставки плазмид или с помощью вирусных или бактериальных векторов .
Доставка плазмид в клетки посредством трансфекции для получения экспрессии shRNA может быть осуществлена с использованием коммерчески доступных реагентов in vitro . Однако этот метод неприменим in vivo и поэтому имеет ограниченную полезность.
Использование бактериального вектора для получения экспрессии шРНК в клетках является относительно недавним подходом. Он основан на исследованиях, показывающих, что рекомбинантная Escherichia coli , содержащая плазмиду с shRNA, которую скармливают мышам, может подавлять экспрессию целевых генов в эпителии кишечника. [4] Этот подход использовался в 2012 году в клинических испытаниях для лечения пациентов с семейным аденоматозным полипозом. [5]
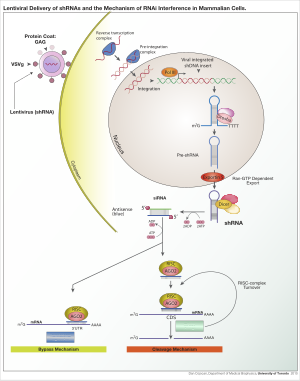
Для достижения экспрессии shRNA в клетках можно использовать различные вирусные векторы, включая аденоассоциированные вирусы (AAV), аденовирусы и лентивирусы . Геномы аденоассоциированных вирусов и аденовирусов остаются эписомальными. Это выгодно, поскольку позволяет избежать инсерционного мутагенеза. Недостаток этого подхода заключается в том, что потомство клетки быстро потеряет вирус в результате деления клетки, если только клетка не делится очень медленно. AAV отличаются от аденовирусов тем, что вирусные гены удалены и у них уменьшена упаковочная способность. Лентивирусы интегрируются в участки транскрипционно активного хроматина и таким образом передаются клеткам-потомкам. При таком подходе повышается риск инсерционного мутагенеза; однако риск можно снизить, используя лентивирус с дефицитом интегразы. [6]

Механизм действия
[ редактировать ]Как только вектор интегрируется в геном хозяина, shRNA транскрибируется в ядре полимеразой II или полимеразой III в зависимости от выбора промотора. Продукт имитирует при-микроРНК (при-миРНК) и обрабатывается компанией Drosha . Полученная пре-shRNA экспортируется из ядра с помощью экспортина 5. Этот продукт затем обрабатывается Dicer и загружается в комплекс РНК-индуцированного молчания (RISC). Чувствительная (пассажирская) цепь деградирует. Антисмысловая (направляющая) цепь направляет RISC к мРНК, имеющей комплементарную последовательность. В случае идеальной комплементарности RISC расщепляет мРНК. В случае несовершенной комплементарности RISC подавляет трансляцию мРНК. В обоих этих случаях shRNA приводит к молчанию целевого гена.
Применение в генной терапии
[ редактировать ]Из-за способности shRNA обеспечивать специфическое, продолжительное подавление генов, существует большой интерес к использованию shRNA для применения в генной терапии. Ниже обсуждаются три примера терапии на основе shRNA.
Компания Gradalis, Inc. разработала вакцину FANG, которая используется для лечения рака на поздних стадиях. FANG основан на бифункциональной shRNA (bi-shRNA) против иммуносупрессивных трансформирующих факторов роста (TGF) β1 и β2. [8] Аутологичные опухолевые клетки собирали у пациентов и плазмиду, кодирующую бифункциональную shRNA и гранулоцитарно-макрофагальный колониестимулирующий фактор (GMCSF), вводили ex vivo посредством электропорации. Эти клетки позже были облучены и введены обратно пациенту.
Компания Marina Biotech разработала CEQ508, который используется для лечения семейного аденоматозного полипоза. CEQ508 использует бактериальный вектор для доставки shRNA против β-катенина.
Компания Gradalis, Inc. разработала бифункциональную shRNA-STMN1 (pbi-shRNA STMN1), которая используется для лечения распространенного и/или метастатического рака. Эта pbi-shRNA STMN1 действует против статмина 1 и доставляется внутрь опухоли с помощью технологии липоплекса (LP) биламеллярных инвагинированных везикул (BIV) .
Терапия на основе shRNA обычно сталкивается с рядом проблем. Самая большая проблема – это доставка. shRNA обычно доставляется с помощью вектора, и хотя они в целом эффективны, они вызывают серьезные проблемы с безопасностью. В частности, в прошлых клинических испытаниях подходы к генной терапии, основанные на вирусах, оказались опасными. В первом поколении ретровирусной генной терапии у некоторых пациентов, получавших вирусные векторы от синдрома Вискотта-Олдрича, развился острый Т-клеточный лейкоз. Было установлено, что это было вызвано местом вставки вирусного вектора. [9] Потенциальное перенасыщение RISC также является проблемой. Если shRNA экспрессируется на слишком высоких уровнях, клетка может быть не в состоянии правильно обрабатывать эндогенную РНК, что может вызвать серьезные проблемы. Еще одной проблемой является возможность того, что у пациента может возникнуть иммунный ответ против терапии. [10] Наконец, могут возникнуть нецелевые эффекты, и shRNA может заставить замолчать другие непреднамеренные гены. При разработке новых успешных терапевтических средств на основе shRNA необходимо учитывать все эти проблемы.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Пэддисон П.Дж., Коди А.А., Бернштейн Э. , Хэннон Г.Дж., Конклин Д.С. (апрель 2002 г.). «Короткие шпильковые РНК (shRNA) вызывают специфичное для последовательности молчание в клетках млекопитающих» . Гены и развитие . 16 (8): 948–58. дои : 10.1101/gad.981002 . ПМЦ 152352 . ПМИД 11959843 .
- ^ Бруммелькамп Т.Р., Бернардс Р. , Агами Р. (апрель 2002 г.). «Система стабильной экспрессии коротких интерферирующих РНК в клетках млекопитающих». Наука . 296 (5567): 550–3. Бибкод : 2002Sci...296..550B . дои : 10.1126/science.1068999 . hdl : 1874/15573 . ПМИД 11910072 .
- ^ Перейти обратно: а б Ван З, Рао Д.Д., Сензер Н., Немунайтис Дж. (декабрь 2011 г.). «РНК-интерференция и терапия рака». Фармацевтические исследования . 28 (12): 2983–95. дои : 10.1007/s11095-011-0604-5 . ПМИД 22009588 . S2CID 36738846 .
- ^ Сян С., Фрюхауф Дж., Ли CJ (июнь 2006 г.). «Бактерии, экспрессирующие короткую шпильку РНК, вызывают интерференцию РНК у млекопитающих». Природная биотехнология . 24 (6): 697–702. дои : 10.1038/nbt1211 . ПМИД 16699500 . S2CID 17700388 .
- ^ Бернетт Дж.С., Росси Дж.Дж., Тиманн К. (сентябрь 2011 г.). «Текущий прогресс терапии siRNA/shRNA в клинических испытаниях» . Биотехнологический журнал . 6 (9): 1130–46. дои : 10.1002/biot.201100054 . ПМК 3388104 . ПМИД 21744502 .
- ^ Ломбардо А., Дженовезе П., Босежур С.М., Коллеони С., Ли Ю.Л., Ким К.А., Андо Д., Урнов Ф.Д., Галли С., Грегори П.Д., Холмс М.К., Нальдини Л. (ноябрь 2007 г.). «Редактирование генов в стволовых клетках человека с использованием нуклеаз с цинковыми пальцами и доставки лентивирусных векторов с дефектом интегразы». Природная биотехнология . 25 (11): 1298–306. дои : 10.1038/nbt1353 . ПМИД 17965707 . S2CID 16008349 .
- ^ Макрэ И.Дж., Чжоу К., Ли Ф., Репик А., Брукс А.Н., Канде В.З., Адамс П.Д., Дудна Дж.А. (январь 2006 г.). «Структурная основа процессинга двухцепочечной РНК с помощью Dicer». Наука . 311 (5758): 195–8. Бибкод : 2006Sci...311..195M . дои : 10.1126/science.1121638 . ПМИД 16410517 . S2CID 23785494 .
- ^ Сензер Н, Барв М, Кун Дж, Мельник А, Бейч П, Лазар М, Лифшиц С, Маги М, О Дж, Милл СВ, Беделл С, Хиггс С, Кумар П, Ю Ю, Норвелл Ф, Фалон С, Такет Н , Рао Д.Д., Ван З., Джей СМ, Паппен Б.О., Уоллрейвен Дж., Бруникади ФК, Шанахан Д.М., Мейплз П.Б., Немунайтис Дж. (март 2012 г.). «Фаза I испытания вакцины «би-shRNAi (фурин)/GMCSF ДНК/аутологичные опухолевые клетки» (FANG) при распространенном раке» . Молекулярная терапия . 20 (3): 679–86. дои : 10.1038/mt.2011.269 . ПМК 3293620 . ПМИД 22186789 .
- ^ Лица Д.А., Баум С (февраль 2011 г.). «Решение проблемы γ-ретровирусных векторов, содержащих длинные концевые повторы» . Молекулярная терапия . 19 (2): 229–31. дои : 10.1038/mt.2010.305 . ПМК 3034864 . ПМИД 21289636 .
- ^ Уайтхед К.А., Дальман Дж.Э., Лангер Р.С., Андерсон Д.Г. (2011). «Замалчивание или стимуляция? Доставка миРНК и иммунная система». Ежегодный обзор химической и биомолекулярной инженерии . 2 : 77–96. doi : 10.1146/annurev-chembioeng-061010-114133 . ПМИД 22432611 .