Сульфитоксидаза
| сульфитоксидаза | |||
|---|---|---|---|
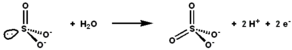 Сульфитоксидаза катализирует окислительно-восстановительную реакцию сульфита и воды с образованием сульфата. | |||
| Идентификаторы | |||
| Номер ЕС. | 1.8.3.1 | ||
| Номер CAS. | 9029-38-3 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| СУОКС | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | SUOX , энтрез:6821, сульфитоксидаза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 606887 ; МГИ : 2446117 ; Гомологен : 394 ; GeneCards : SUOX ; ОМА : SUOX - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Сульфитоксидаза ( EC 1.8.3.1 ) — фермент митохондрий . всех эукариот , за исключением дрожжей [ нужна ссылка ] Он окисляет сульфит до сульфата и через цитохром с переносит образующиеся электроны в цепь переноса электронов , позволяя генерировать АТФ при окислительном фосфорилировании . [5] [6] [7] Это последний этап метаболизма серосодержащих соединений, и сульфат выводится из организма.
Сульфитоксидаза представляет собой металлофермент, который использует кофактор молибдоптерина и гемовую группу (в случае животных). Это один из цитохромов b 5 и принадлежит к суперсемейству ферментов молибденоксотрансфераз , которое также включает ДМСО-редуктазу , ксантиноксидазу и нитритредуктазу .
У млекопитающих уровень экспрессии сульфитоксидазы высок в печени, почках и сердце и очень низок в селезенке, мозге, скелетных мышцах и крови.
Структура
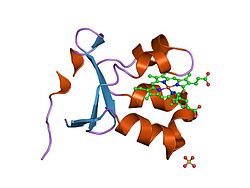
[ редактировать ]Будучи гомодимером , сульфитоксидаза содержит две идентичные субъединицы с N-концевым доменом и С-концевым доменом. Эти два домена соединены десятью аминокислотами, образующими петлю. N-концевой домен имеет гем- кофактор с тремя соседними антипараллельными бета-листами и пятью альфа-спиралями . С-концевой домен содержит кофактор молибдоптерина, окруженный тринадцатью бета-листами и тремя альфа-спиралями. Кофактор молибдоптерина имеет центр Mo(VI), который связан с серой из цистеина , ен-дитиолатом из пираноптерина и двумя концевыми атомами кислорода. Именно в этом молибденовом центре происходит каталитическое окисление сульфита.
Пираноптериновый лиганд, который координирует молибденовый центр через эндитиолат. Молибденовый центр имеет квадратно-пирамидальную геометрию и отличается от семейства ксантиноксидаз ориентацией оксогруппы вниз, а не вверх.
Активный сайт и механизм
[ редактировать ] |
Активный центр сульфитоксидазы содержит кофактор молибдоптерина и поддерживает молибден в его высшей степени окисления +6 (Mo МЫ ). В окисленном состоянии фермента молибден координируется тиолатом цистеина, дитиоленовой группой молибдоптерина и двумя концевыми атомами кислорода ( оксосами ). При реакции с сульфитом один атом кислорода передается сульфиту с образованием сульфата, а молибденовый центр восстанавливается двумя электронами до Мо. IV . Затем вода вытесняет сульфат и происходит удаление двух протонов (H + ) и два электрона (e − ) возвращает активный сайт в исходное состояние. Ключевой особенностью этого фермента переноса атомов кислорода является то, что переносимый атом кислорода возникает из воды, а не из дикислорода (O 2 ).
Электроны передаются по одному от молибдена к гемовой группе, которая реагирует с цитохромом с, повторно окисляя фермент. Электроны в результате этой реакции попадают в цепь переноса электронов (ЭТЦ).
Эта реакция обычно является реакцией, лимитирующей скорость. При реакции фермента с сульфитом он восстанавливается на 2 электрона. Отрицательный потенциал, наблюдаемый при повторном восстановлении фермента, показывает, что окисленное состояние предпочтительнее.
Среди классов ферментов Мо сульфитоксидаза наиболее легко окисляется. Однако в условиях низкого pH окислительная реакция становится частично лимитирующей.
Дефицит
[ редактировать ]Сульфитоксидаза необходима для метаболизма серосодержащих аминокислот цистеина и метионина в пищевых продуктах. Отсутствие функциональной сульфитоксидазы вызывает заболевание, известное как дефицит сульфитоксидазы. Это редкое, но смертельное заболевание вызывает неврологические расстройства, умственную отсталость, физические уродства, деградацию мозга и смерть. Причины отсутствия функциональной сульфитоксидазы включают генетический дефект, приводящий к отсутствию молибдоптерина кофактора , и точковые мутации фермента. [8] Мутация G473D нарушает димеризацию и катализ сульфитоксидазы человека. [9] [10]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000139531 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000049858 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Д'Эррико Дж., Ди Салле А., Ла Кара Ф., Росси М., Каннио Р. (январь 2006 г.). «Идентификация и характеристика новой бактериальной сульфитоксидазы без гем-связывающего домена из Deinococcus radiodurans» . Дж. Бактериол . 188 (2): 694–701. дои : 10.1128/JB.188.2.694-701.2006 . ПМЦ 1347283 . ПМИД 16385059 .
- ^ Тан В.Х., Эйхлер Ф.С., Хода С., Ли М.С., Барис Х., Хэнли К.А., Грант П.Е., Кришнамурти К.С., Ши В.Е. (сентябрь 2005 г.). «Изолированный дефицит сульфитоксидазы: отчет о случае с новой мутацией и обзор литературы». Педиатрия . 116 (3): 757–66. дои : 10.1542/пед.2004-1897 . ПМИД 16140720 . S2CID 6506338 .
- ^ Коэн Х.Дж., Бетчер-Ланге С., Кесслер Д.Л., Раджагопалан К.В. (декабрь 1972 г.). «Печеночная сульфитоксидаза. Конгруэнтность в митохондриях простетических групп и активности» . Ж. Биол. Хим . 247 (23): 7759–66. дои : 10.1016/S0021-9258(19)44588-2 . ПМИД 4344230 .
- ^ Каракас Э., Кискер С. (ноябрь 2005 г.). «Структурный анализ миссенс-мутаций, вызывающих изолированный дефицит сульфитоксидазы». Далтон Транзакции (21): 3459–63. дои : 10.1039/b505789m . ПМИД 16234925 .
- ^ Уилсон Х.Л., Уилкинсон С.Р., Раджагопалан К.В. (февраль 2006 г.). «Мутация G473D нарушает димеризацию и катализ сульфитоксидазы человека». Биохимия . 45 (7): 2149–60. дои : 10.1021/bi051609l . ПМИД 16475804 .
- ^ Фэн С., Толлин Г., Энемарк Дж. Х. (май 2007 г.). «Сульфитокисляющие ферменты» . Биохим. Биофиз. Акта . 1774 (5): 527–39. дои : 10.1016/j.bbapap.2007.03.006 . ЧВК 1993547 . ПМИД 17459792 .
Дальнейшее чтение
[ редактировать ]- Кискер, К. «Сульфитоксидаза», Мессершимдт, А.; Хубер, Р.; Пулос, Т.; Вигхардт, К.; ред. Справочник по металлопротеинам, том 2; John Wiley and Sons, Ltd: Нью-Йорк, 2002 г.
- Фэн С., Уилсон Х.Л., Херли Дж.К. и др. (2003). «Основная роль консервативного аргинина 160 во внутримолекулярном переносе электронов в сульфитоксидазе человека». Биохимия . 42 (42): 12235–42. дои : 10.1021/bi0350194 . ПМИД 14567685 .
- Ли Х.Ф., Мак Б.С., Чи К.С. и др. (2002). «Новая мутация при изолированном дефиците сульфитоксидазы у новорожденных». Нейропедиатрия . 33 (4): 174–9. дои : 10.1055/s-2002-34491 . ПМИД 12368985 . S2CID 39922068 .
- Стейнберг К.К., Реллинг М.В., Галлахер М.Л. и др. (2007). «Генетические исследования группы случаев острого лимфобластного лейкоза в округе Черчилль, штат Невада» . Окружающая среда. Перспектива здоровья . 115 (1): 158–64. дои : 10.1289/ehp.9025 . ПМК 1817665 . ПМИД 17366837 .
- Кимура К., Вакамацу А., Судзуки Ю. и др. (2006). «Диверсификация транскрипционной модуляции: крупномасштабная идентификация и характеристика предполагаемых альтернативных промоторов генов человека» . Геном Рез . 16 (1): 55–65. дои : 10.1101/гр.4039406 . ПМК 1356129 . ПМИД 16344560 .
- Уилсон Х.Л., Уилкинсон С.Р., Раджагопалан К.В. (2006). «Мутация G473D нарушает димеризацию и катализ сульфитоксидазы человека». Биохимия . 45 (7): 2149–60. дои : 10.1021/bi051609l . ПМИД 16475804 .
- Хоффманн С., Бен-Зеев Б., Аникстер Ю. и др. (2007). «Магнитно-резонансная томография и магнитно-резонансная спектроскопия при изолированном дефиците сульфитоксидазы». Дж. Детский Нейрол . 22 (10): 1214–21. дои : 10.1177/0883073807306260 . ПМИД 17940249 . S2CID 24050167 .
- Джонсон Дж.Л., Койн К.Е., Гарретт Р.М. и др. (2002). «Изолированный дефицит сульфитоксидазы: идентификация 12 новых мутаций SUOX у 10 пациентов» . Хм. Мутат . 20 (1): 74. дои : 10.1002/humu.9038 . ПМИД 12112661 . S2CID 45465780 .
- Ву WH, Ян Х, Вонг КП, Холливелл Б (2003). «Экспрессия гена сульфитоксидазы в мозге человека и в других тканях человека и крысы». Биохим. Биофиз. Рез. Коммун . 305 (3): 619–23. дои : 10.1016/S0006-291X(03)00833-7 . ПМИД 12763039 .
- Фэн С., Уилсон Х.Л., Толлин Дж. и др. (2005). «Патогенные мутанты сульфитоксидазы человека G473D и A208D дефектны во внутримолекулярном переносе электронов». Биохимия . 44 (42): 13734–43. дои : 10.1021/bi050907f . ПМИД 16229463 .
- Тан В.Х., Эйхлер Ф.С., Хода С. и др. (2005). «Изолированный дефицит сульфитоксидазы: отчет о случае с новой мутацией и обзор литературы». Педиатрия . 116 (3): 757–66. дои : 10.1542/пед.2004-1897 . ПМИД 16140720 . S2CID 6506338 .
- Асташкин А.В., Джонсон-Винтерс К., Кляйн Е.Л. и др. (2008). «Структурные исследования молибденового центра патогенного мутанта R160Q сульфитоксидазы человека методами импульсной ЭПР-спектроскопии и мечения 17O и 33S» . Дж. Ам. хим. Соц . 130 (26): 8471–80. дои : 10.1021/ja801406f . ПМЦ 2779766 . ПМИД 18529001 .
- Дронов Р., Курт Д.Г., Мёвальд Х. и др. (2008). «Послойное расположение за счет белок-белкового взаимодействия сульфитоксидазы и цитохрома с, катализирующего окисление сульфита». Дж. Ам. хим. Соц . 130 (4): 1122–3. дои : 10.1021/ja0768690 . ПМИД 18177044 .
- Эдвардс М.К., Джонсон Дж.Л., Брак Б. и др. (1999). «Изолированный дефицит сульфитоксидазы: обзор двух случаев в одной семье». Офтальмология . 106 (10): 1957–61. дои : 10.1016/S0161-6420(99)90408-6 . ПМИД 10519592 .
- Герхард Д.С., Вагнер Л., Фейнгольд Е.А. и др. (2004). «Статус, качество и расширение проекта полноразмерной кДНК Национального института здравоохранения: Коллекция генов млекопитающих (MGC)» . Геном Рез . 14 (10Б): 2121–7. дои : 10.1101/гр.2596504 . ПМК 528928 . ПМИД 15489334 .
- Рудольф М.Дж., Джонсон Дж.Л., Раджагопалан К.В., Кискер С. (2003). «Структура 1,2 А домена цитохрома b (5) сульфитоксидазы человека». Акта Кристаллогр. Д. 59 (Часть 7): 1183–91. дои : 10.1107/S0907444903009934 . ПМИД 12832761 .
- Фэн С., Уилсон Х.Л., Херли Дж.К. и др. (2003). «Роль консервативного тирозина 343 во внутримолекулярном переносе электронов в сульфитоксидазе человека» . Ж. Биол. Хим . 278 (5): 2913–20. дои : 10.1074/jbc.M210374200 . ПМИД 12424234 .
- Нойман М., Леймкюлер С. (2008). «Ионы тяжелых металлов ингибируют активность молибдофермента, связываясь с дитиоленовой частью молибдоптерина в Escherichia coli» . ФЕБС Дж . 275 (22): 5678–89. дои : 10.1111/j.1742-4658.2008.06694.x . ПМИД 18959753 . S2CID 45452761 .
- Штраусберг Р.Л., Фейнгольд Е.А., Граус Л.Х. и др. (2002). «Получение и первоначальный анализ более 15 000 полноразмерных последовательностей кДНК человека и мыши» . Учеб. Натл. акад. наук. США . 99 (26): 16899–903. Бибкод : 2002PNAS...9916899M . дои : 10.1073/pnas.242603899 . ПМК 139241 . ПМИД 12477932 .
- Уилсон Х.Л., Раджагопалан К.В. (2004). «Роль тирозина 343 в связывании субстрата и катализе сульфитоксидазой человека» . Ж. Биол. Хим . 279 (15): 15105–13. дои : 10.1074/jbc.M314288200 . ПМИД 14729666 .
- Хаконарсон Х., штаб-квартира Цюй, Брэдфилд Дж.П. и др. (2008). «Новый локус восприимчивости к диабету 1 типа на Chr12q13, выявленный в ходе полногеномного исследования ассоциации» . Диабет . 57 (4): 1143–6. дои : 10.2337/db07-1305 . ПМИД 18198356 .
Внешние ссылки
[ редактировать ]- Сульфит + оксидаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Исследовательская деятельность Саркар Групп
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для сульфитоксидазы человека, митохондриальной



