Фенолы
В органической химии , фенолы иногда называемые фенолами , представляют собой класс химических соединений , состоящих из одной или нескольких гидроксильных групп ( -OH ) , связанных непосредственно с ароматической углеводородной группой. [1] Самый простой — фенол , С
66Ч
5 ОХ . Фенольные соединения классифицируются как простые фенолы или полифенолы в зависимости от количества фенольных звеньев в молекуле.
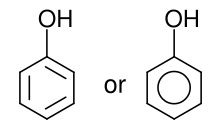
Фенолы как синтезируются в промышленности, так и производятся растениями и микроорганизмами. [2]
Характеристики
[ редактировать ]Кислотность
[ редактировать ]Фенолы более кислые , чем типичные спирты. Кислотность гидроксильной группы фенолов обычно занимает промежуточное положение между кислотностью алифатических спиртов и карбоновых кислот (их рК а обычно составляет от 10 до 12). Депротонирование фенола образует соответствующий отрицательный фенолят-ион или феноксид-ион , а соответствующие соли называются фенолятами или феноксидами ( арилоксидами согласно Золотой книге ИЮПАК). [ нужна ссылка ]
Конденсация с альдегидами и кетонами
[ редактировать ]Фенолы подвержены электрофильным ароматическим замещениям . Конденсация с формальдегидом дает смолистые материалы, известные как бакелит . [ нужна ссылка ]
Еще одним электрофильным ароматическим замещением в промышленных масштабах является производство бисфенола А , который получают конденсацией с ацетоном . [3]
C-Алкилирование алкенами
[ редактировать ]Фенол легко алкилируется в орто-положениях с использованием алкенов в присутствии кислоты Льюиса, такой как феноксид алюминия : [ нужна ссылка ]
- CH 2 =CR 2 + C 6 H 5 OH → R 2 CHCH 2 -2-C 6 H 4 OH
более 100 000 тонн трет- Таким способом ежегодно производится бутилфенолов (2000 год) с использованием изобутилена (CH 2 =CMe 2 ) в качестве алкилирующего агента. Особенно важен 2,6-дитрет-бутилфенол , универсальный антиоксидант . [3]
Другие реакции
[ редактировать ]Фенолы подвергаются этерификации . Эфиры фенола являются активными эфирами , склонными к гидролизу. Фенолы являются активными веществами в отношении окисления . Окислительное расщепление, например расщепление 1,2-дигидроксибензола до монометилового эфира 2,4-гексадиендиовой кислоты кислородом, хлорида меди в пиридине. [4] Окислительная деароматизация до хинонов, также известная как реакция Тойбера . [5] и оксон . [6] В реакции, изображенной ниже, 3,4,5-триметилфенол реагирует с синглетным кислородом , образующимся из оксона / карбоната натрия в смеси ацетонитрил /вода, с образованием пара-пероксихинола. Этот гидропероксид восстанавливают до хинола тиосульфатом натрия .
Фенолы окисляются до гидрохинонов при персульфатном окислении Эльбса .
Реакция нафтолов, гидразинов и бисульфита натрия в синтезе карбазола Бюхерера .
Синтез
[ редактировать ]Многие фенолы, представляющие коммерческий интерес, получают путем разработки фенола или крезолов . Обычно их получают путем алкилирования бензола / толуола с пропиленом образованием кумола , а затем O.
2 добавляется с H
2 ТАК
4 с образованием фенола ( процесс Хока ). Помимо реакций, описанных выше, фенолы образуются во многих других, более специализированных реакциях:
- перегруппировка сложных эфиров в перегруппировке Фриса [7] [8]
- перегруппировка N -фенилгидроксиламинов в перегруппировке Бамбергера [9] [10]
- деалкилирование фенольных эфиров
- снижение хинонов
- замена ароматического амина гидроксильной группой водой и бисульфидом натрия в реакции Бухерера [11]
- термическое разложение солей арилдиазония с превращением солей в фенол [12]
- путем окисления арилсиланов - ароматического варианта окисления Флеминга-Тамао. [13]
- каталитический синтез из арилбромидов и йодидов с использованием закиси азота [14]
Классификация
[ редактировать ]
Существуют различные схемы классификации . [15] : 2 Широко используемая схема основана на количестве атомов углерода и была разработана Джеффри Харборном и Симмондсом в 1964 году и опубликована в 1980 году: [15] : 2 [16]
| Фенол | исходное соединение, используемое в качестве дезинфицирующего средства и для химического синтеза. |
| Бисфенол А | и другие бисфенолы, полученные из кетонов и фенола/крезола |
| БХТ | (бутилированный гидрокситолуол) — жирорастворимый антиоксидант и пищевая добавка. |
| 4-нонилфенол | продукт распада моющих средств и ноноксинола-9 |
| Ортофенил фенол | фунгицид , используемый для восковой обработки цитрусовых |
| Пикриновая кислота | (тринитрофенол) – взрывчатое вещество |
| фенолфталеин | индикатор рН |
| Ксиленол | используется в антисептиках и дезинфицирующих средствах |
Лекарства и биологически активные натуральные продукты
[ редактировать ]Более 371 препарата, одобренного FDA в период с 1951 по 2020 год, содержат либо фенол, либо фенольный эфир (фенол с алкилом), при этом представлены почти все классы низкомолекулярных лекарств, причем большую часть составляют натуральные продукты. этого списка. [17]
| тирозин | одна из 20 стандартных аминокислот |
| Леводопа | пролекарство дофамина , используемое для лечения болезни Паркинсона |
| пропофол | короткого внутривенный анестетик действия |
| витамин К гидрохинон | кровоостанавливающее средство, превращающее |
| левотироксин (L-тироксин) | Самый продаваемый препарат для лечения дефицита гормонов щитовидной железы. |
| амоксициллин | Самый продаваемый антибиотик |
| эстрадиол | главный женский половой гормон |
Ссылки
[ редактировать ]- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Фенолы ». doi : 10.1351/goldbook.P04539
- ^ Хеттеншвилер, Стефан; Витоусек, Питер М. (2000). «Роль полифенолов в круговороте питательных веществ в наземной экосистеме». Тенденции в экологии и эволюции . 15 (6): 238–243. дои : 10.1016/S0169-5347(00)01861-9 . ПМИД 10802549 .
- ^ Jump up to: а б Фиге Х; Фогес HW; Хамамото Т; Умемура С; Ивата Т; Мики Х; Фудзита Ю; Буйш Х.Дж.; Связка Д; Пол В. (2000). «Производные фенола». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a19_313 . ISBN 978-3527306732 .
{{cite encyclopedia}}:|work=игнорируется ( помогите ) - ^ 2,4-Гексадиенедиовая кислота, монометиловый эфир, (Z,Z) -Органический синтез , Сб. Том. 8, с. 490 (1993); Том. 66, с. 180 (1988) Ст .
- ^ «2,5-Циклогексадиен-1,4-дион, 2,3,5-триметил». Органические синтезы . 52 : 83. 1972.
- ^ Карреньо, М. Кармен; Гонсалес-Лопес, Маркос; Урбано, Антонио (2006). «Окислительная деароматизация пара-алкилфенолов в пара-пероксихинолы и пара-хинолы, опосредованная оксоном как источником синглетного кислорода». Angewandte Chemie, международное издание . 45 (17): 2737–2741. дои : 10.1002/anie.200504605 . ПМИД 16548026 .
- ^ Фрис, К .; Финк, Г. (1908). «О гомологах кумаранона и их производных» . Химические отчеты . 41 (3): 4271–4284. дои : 10.1002/cber.190804103146 .
- ^ Фрис, К.; Пфаффендорф, В. (1910). «О продукте конденсации кумаранона и превращении его в оксиндирубин» . Химические отчеты . 43 (1): 212–219. дои : 10.1002/cber.19100430131 .
- ^ Бамбергер, Э. (1894). «О восстановлении нитросоединений» . Химические отчеты . 27 (2): 1347–1350. дои : 10.1002/cber.18940270229 .
- ^ Бамбергер, Э. (1894). «О фенилгидроксиламине» . Химические отчеты . 27 (2): 1548–1557. дои : 10.1002/cber.18940270276 .
- ^ Х. Бухерер (1904). «О действии солей серной кислоты на ароматические амидо- и гидроксильные соединения» . Дж. Практика. Хим. (на немецком языке). 69 (1): 49–91. дои : 10.1002/prac.19040690105 .
- ^ HE Ungnade, EF Orwoll (1943). «3-Бром-4-гидрокситолуол». Органические синтезы . 23:11 . дои : 10.15227/orgsyn.023.0011 .
- ^ Брейсгедл, Соня; Андерсон, Эдвард А. (2010). «Окисление арилсилана - новые пути получения гидроксилированных ароматических соединений». хим. Комм . 46 (20): 3454–6. дои : 10.1039/b924135c . ПМИД 20582346 . S2CID 31736757 .
- ^ Ле Валлиант, Франк; Матеос Кальбет, Ана; Гонсалес-Пелайо, Сильвия; Рейджерс, Эдвард Дж.; Ни, Шэнъян; Буш, Джулия; Корнелла, Хосеп (2022). «Каталитический синтез фенолов закисью азота» . Природа . 604 (7907): 677–683. Бибкод : 2022Nature.604..677L . дои : 10.1038/s41586-022-04516-4 . ПМК 9046086 . ПМИД 35478236 .
- ^ Jump up to: а б Уилфред Вермеррис и Ральф Николсон. Биохимия фенольных соединений Springer, 2008.
- ^ Харборн, Дж. Б. (1980). «Растительные фенолы». В Белле, EA; Чарлвуд, Б.В. (ред.). Энциклопедия физиологии растений, том 8. Вторичные растительные продукты . Берлин Гейдельберг Нью-Йорк: Springer-Verlag. стр. 329–395.
- ^ Скотт, Кевин А.; Кокс, Филип Б.; Ньярдарсон, Джон Т. (26 мая 2022 г.). «Фенолы в фармацевтике: анализ повторяющегося мотива» . Журнал медицинской химии . 65 (10): 7044–7072. doi : 10.1021/acs.jmedchem.2c00223 . ISSN 0022-2623 . ПМИД 35533692 . S2CID 248667453 .

