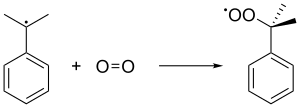Сделано процесс
Процесс смита ( процесс кумоли-фенола , процесс HOCK ) является промышленным процессом синтеза фенола и ацетона от бензола и пропилена . Термин проистекает из кумона (изопропилбензола), промежуточного материала во время процесса. Он был изобретен Р. Одрисом и П. Сергеев в 1942 году (СССР), [ 1 ] и независимо от Генриха Хока в 1944 году. [ 2 ] [ 3 ]
Этот процесс преобразует два относительно дешевых начальных материала, бензол и пропилен , в еще два ценных, фенол и ацетон . Другими требуемыми реагентами являются кислород от воздуха и небольшие количества радикального инициатора . Большая часть мировой продукции фенола и ацетона в настоящее время основана на этом методе. В 2022 году процесс смина был произведен почти 10,8 миллиона тонн фенола. [ 4 ] Чтобы этот процесс был экономичным, также должен быть спрос на побочный продукт ацетона , а также фенол . [ 5 ]


Шаги процесса
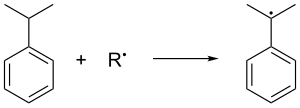
[ редактировать ]Комен образуется в алкилировании бензола фриделя-крафта фриделя-крафтами пропеном. Бензол и пропен сжимаются вместе до давления 30 стандартных атмосфер при 250 ° С в присутствии каталитической кислоты Льюиса . Фосфорная кислота часто предпочитается по алюминиевым галогенидам . Кумонь окисляется в воздухе, который удаляет третичный бензиловый водород из кумора и, следовательно, образует кумовый радикал :
Затем радикал кумона связывается с молекулой кислорода с получением радикала пероксида кумола , который, в свою очередь, образует сомид гидропероксид (C 6 H 5 C (CH 3 ) 2 O 2 H) путем абстрагирования бензилового водорода из другой молекулы смина. Этот последний кумон преобразуется в кумовый радикал и питается обратно в последующие цепные образования гидропероксидов кумы. Давление 5 атм используется для обеспечения того, чтобы нестабильный перекись хранится в жидком состоянии.
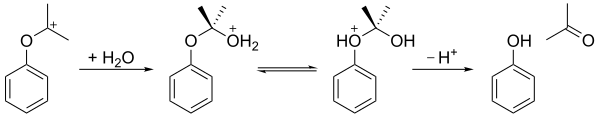
Гидропероксид кумы подвергается реакции перестройки в кислой среде ( перестройка HOCK ), чтобы получить фенол и ацетон . На первом этапе терминальный гидропероксический атом кислорода протонируется. За этим следует стадия, на которой фенильная группа мигрирует из бензилгалета в соседний кислород, а молекула воды теряется, что приводит к резонансной стабилизированной третичной карбокате . Согласованный механизм этого шага похож на механизмы окисления Байера -Виллигера [ 6 ] и реакции перестройки Criegee , а также стадия окисления процесса окисления гидроборации . [ 7 ] подкисленная бентонитовая В 2009 году оказалось, что глина является более экономичным катализатором, чем серной кислоты в качестве кислотной среды.
Полученная карбокация затем атаковается водой, образуя гемиаакоподобную структуру. После переноса протона от гидрокси кислорода к эфирному кислороду ион разваливается в фенол и ацетон.
Связанные реакции и модификации
[ редактировать ]Альтернативы совместному производству ацетона
[ редактировать ]Циклогексилбензол может заменить изопропилбензол. Через перестройку HOCK циклогексилбензол гидропероксид расщепляет фенол и циклогексанон . Циклогексанон является важным предшественником некоторых нейлонов . [ 8 ]
Начиная с алкилирования бензола с смесью 1 и 2-бутенов , процесс кумы производит фенол и бутаноны . [ 5 ]
Альтернативы производству фенола
[ редактировать ]- Гидрохинон готовятся путем диакилирования бензола с пропеном с получением 1,4-диизопропилбензола . Это соединение реагирует с воздухом, чтобы позволить себе бис (гидропероксид). Аналогично поведению гидропероксида кумы , он переставляется в кислоте с получением ацетона и гидрохинона. Окисление гидрохинона дает 1,4-бензохинон: [ 9 ]
- Резорцинол аналогично готовит путем преобразования 1,3-диизопропилбензола в бис (гидропероксид), который фрагменты в резорцинол и ацетон. [ 10 ]
- 2-нафтол также может быть получен методом, аналогичным процессу кумона. [ 11 ]
- 3-хлорфенол , который не возникает при хлорировании фенола, может быть получен путем кумона, начиная с алкилирования хлорбензола с пропиленом. [ 12 ]
- Крезолы производятся из изопропилтолуена. [ 13 ]
Обработка ацетона
[ редактировать ]Сырой ацетон гидрогенизируется в жидкой фазе над никелем Рэйни или смесью медного и оксида хрома с получением изопропилового спирта . Этот процесс полезен, когда он сочетается с избыточным производством ацетона. [ 14 ] Mitsui & Co. разработала дополнительные шаги (ы) для гидрирования ацетона и дегидратирующего продукта изопропанола с пропеном, который перерабатывается в качестве стартового реагента. [ 5 ]
Побочные продукты
[ редактировать ]Побочные продукты процесса кумола с производством фенола и ацетона являются ацетофеноном и альфа-метилстиролом .
Смотрите также
[ редактировать ]- Бисфенол а
- Процесс Dow (фенол)
- Алкилирование Фриделя
- Baeyer -villiger Окисление
- Процесс Рашиг -Хукер (также производит фенол)
Ссылки
[ редактировать ]- ^ «Латвиан» . Архивировано с оригинала 2016-03-03 . Получено 2011-02-27 .
- ^ Hock, H. and Lang, S. (1944), Аусидация углеводородов, IX. Цент.: О перекиси производных бензола. Отчеты Германского химического общества (серия A и B), 77: 257–264 два : 10.1002/cber.19440770321
- ^ Краткая химия энциклопедии (1993) Мэри Иглесо
- ^ «Размер рынка фенола, доля, анализ и прогноз, 2035 - Chemanalyst» . Chemanalyst . Получено 2024-04-09 .
- ^ Jump up to: а беременный в «Прямые маршруты в фенол» . Архивировано из оригинала на 2007-04-09 . Получено 2006-12-26 .
- ^ Streitwieser, A; Хиткок, Ч. (1992). "30" . Введение в органическую химию . Kosower, Em (4 -е изд.). Нью -Йорк: Макмиллан. с. 1018 . ISBN 0-02-418170-6 .
- ^ KPC, Vollhardt; NE Schore (2003). "22" . Органическая химия: структура и функция (4 -е изд.). Нью -Йорк: Фримен. п. 988. ISBN 0-7167-4374-4 .
- ^ Плоткин, Джеффри С. (2016-03-21). "Что нового в производстве фенола?" Полем Американское химическое общество. Архивировано из оригинала 2019-10-27 . Получено 2018-01-02 .
- ^ Герхард Франц, Роджер А. Шелдон "окисление" в энциклопедии промышленной химии Уллмана , Wiley-VCH, Weinheim, 2000 Два : 10.1002/14356007.A18_261
- ^ KW Schmiedel; Д. Декер (2012). «Ресорцинол». Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. Doi : 10.1002/14356007.a23_111.pub2 . ISBN 978-3527306732 .
- ^ Джеральд Бут «Производные нафталины» в энциклопедии Ульмана промышленной химии, 2005, Wiley-VCH, Вайнхайм. Два : 10.1002/14356007.A17_009 .
- ^ Франсуа Мюллер; Лилиан Кайллард (2011). «Хлорофенолы». Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. Doi : 10.1002/14356007.a07_001.pub2 . ISBN 978-3527306732 .
- ^ Роджер А. Шелдон (1983). Патай, Саул (ред.). Синтез и использование гидропероксидов и диалкилпероксидов . Химия функциональных групп Патая. Джон Уайли и сыновья. doi : 10.1002/9780470771730.CH6 .
- ^ Папа, AJ "Пропанолы". Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. doi : 10.1002/14356007.a22_173 . ISBN 978-3527306732 .