Медный белок
Медные белки — это белки , которые содержат один или несколько меди ионов в качестве простетических групп . Медные белки встречаются у всех форм жизни, дышащих воздухом. Эти белки обычно связаны с переносом электронов с участием кислорода (O 2 ) или без него. Некоторые организмы даже используют медные белки для переноса кислорода вместо белков железа. Важным белком меди у человека является цитохром с-оксидаза (cco). Этот фермент cco опосредует контролируемое горение, в результате которого образуется АТФ . [1] Другие белки меди включают некоторые супероксиддисмутазы, используемые для защиты от свободных радикалов, пептидил-α-монооксигеназу для производства гормонов и тирозиназу, которая влияет на пигментацию кожи. [2]
Классы
[ редактировать ]Металлоцентры в медных белках можно разделить на несколько типов: [3]
- Медные центры типа I (T1Cu) характеризуются одним атомом меди, координируемым двумя остатками гистидина и остатком цистеина в тригональной планарной структуре, а также переменным аксиальным лигандом . В белках T1Cu класса I (например, амицианин , пластоцианин и псевдоазурин) осевым лигандом является сера метионина , тогда как аминокислоты, отличные от метионина (например, глютамин ), дают начало медным белкам T1Cu класса II. Азурины содержат центры T1Cu третьего типа: помимо метионина в одном аксиальном положении они содержат второй аксиальный лиганд ( группу остатка глицина карбонильную ). T1Cu-содержащие белки обычно называют «купредоксинами» и демонстрируют сходную трехмерную структуру, относительно высокие потенциалы восстановления (> 250 мВ) и сильное поглощение вблизи 600 нм (из-за S → Cu переноса заряда ), что обычно приводит к синий цвет. Поэтому купредоксины часто называют «белками голубой меди». Это может ввести в заблуждение, поскольку некоторые центры T1Cu также поглощают длину волны около 460 нм и поэтому имеют зеленый цвет. При изучении В ЭПР- спектроскопии центры T1Cu демонстрируют небольшие сверхтонкие расщепления в параллельной области спектра (по сравнению с обычными координационными соединениями меди). [4]
- Медные центры типа II (T2Cu) демонстрируют плоскую квадратную координацию с помощью N- или N/O -лигандов . Они демонстрируют аксиальный спектр ЭПР со сверхтонким расщеплением меди в параллельной области, аналогичный наблюдаемому в обычных координационных соединениях меди. Поскольку лигирование серы отсутствует, оптические спектры этих центров не имеют отличительных особенностей. Центры T2Cu встречаются в ферментах , где они способствуют окислению или оксигенации. [5]
- Медные центры типа III (T3Cu) состоят из пары медных центров, каждый из которых координируется тремя остатками гистидина. Эти белки не проявляют сигнала ЭПР из-за сильной антиферромагнитной связи (т.е. спаривания спинов) между двумя ионами металлов с S = 1/2 из-за их ковалентного перекрывания с мостиковым лигандом . Эти центры присутствуют в некоторых оксидазах и белках, переносящих кислород (например, гемоцианине и тирозиназе ). [6]
- Биядерные центры меди А (Cu A ) обнаружены в цитохром с оксидазе и редуктазе закиси азота ( EC 1.7.99.6 ). Два атома меди координируются двумя гистидинами, одним метионином, карбонильным кислородом основной цепи белка и двумя мостиковыми остатками цистеина. [7]
- Медные центры B (Cu B ) обнаружены в цитохром с -оксидазе . Атом меди координируется тремя гистидинами в тригонально-пирамидальной геометрии.
- Четырехъядерный медный Z-центр (Cu Z ) обнаружен в редуктазе закиси азота. Четыре атома меди координируются семью остатками гистидина и соединены мостиком атома серы.
Белки синей меди
[ редактировать ]Синие медные белки получили свое название из-за своей интенсивной синей окраски ( Cu(II) ). Белок синей меди часто называют « белком, работающим по совместительству », что означает, что белок может выполнять более одной функции. Они служат агентами переноса электронов, при этом активный центр перемещается между Cu(I) и Cu(II). Cu 2+ в окисленном состоянии может принять один электрон с образованием Cu 1+ в восстановленном белке. Геометрия центра меди оказывает большое влияние на его окислительно-восстановительные свойства. Искажение Яна-Теллера не применимо к белкам синей меди, поскольку медный участок имеет низкую симметрию, которая не поддерживает вырождение в d-орбитальном многообразии. Отсутствие крупных реорганизационных изменений увеличивает скорость их электронного переноса. Активный центр белка синей меди I типа. В координационной сфере присутствуют два 2-гистидина, 1 метионин и 1 цистеин. Примерами белка синей меди типа I являются пластоцианин , азурин и нитритредуктаза, гемоцианин и тирозиназа .
Структура голубых медных белков Медные центры I типа
[ редактировать ]Синие медные белки, класс медных белков типа 1, представляют собой небольшие белки, содержащие купредоксиновую складку и один ион меди типа I, координируемый двумя гистидина N-донорами цистеина : S-донором тиолат и S-донором тиоэфира метионина . [8] В окисленном состоянии Cu +2 Ион будет образовывать либо тригонально-бипирамидальную, либо тетраэдрическую координацию. [8] Медные белки типа 1 идентифицируются как синие медные белки из-за переноса заряда от лиганда к металлу по интенсивной полосе при 600 нм, которая придает характерный темно-синий цвет, присутствующий в спектре электронного поглощения. [9]
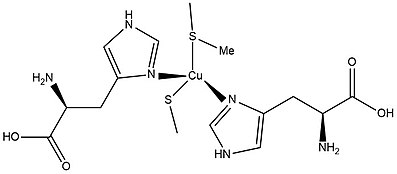
Белковая структура белка синей меди типа 1, амицианина , построена из полипептидных складок, которые обычно встречаются в β-сэндвич-структуре белков синей меди. [10] Структура очень похожа на пластоцианин и азурин , поскольку они также идентифицируются как медные белки типа 1. [10] Они также похожи друг на друга благодаря геометрии медного участка каждого медного белка. Белок азурин имеет тригонально-бипирамидальную геометрию с вытянутыми осевыми глициновыми и метоинионовыми серными лигандами. Пластоцианины имеют дополнительный метионин-серный лиганд в аксиальном положении. Основное отличие каждого медного белка состоит в том, что каждый белок имеет разное количество и виды лигандов, координированных с медным центром.
Электронная структура медных комплексов синего медного белка I типа
[ редактировать ]Прочная связь между ионом меди и серой цистеина позволяет несвязанному электрону серы цистеина присутствовать как на ионе меди с низким/высоким спином, d x 2 - д й 2 орбиталь и р-орбиталь цистеина серы. [9] Большинство комплексов меди (II) проявляют эффект Яна-Теллера , когда комплекс образует тетрагональное искажение октаэдрической комплексной геометрии. [11] С белками синей меди будет образовываться искаженный тетраэдрический комплекс из-за сильного экваториального цистеинового лиганда и слабого аксиального метионинового лиганда. [11] Два нейтральных гистидиновых лиганда расположены белковым лигандом, поэтому геометрия искажена тетраэдрической. Это приведет к тому, что они не смогут идеально координироваться как тетраэдрические или плоские квадраты.
Спектральные изменения с температурой
[ редактировать ]Понижение температуры может изменить переходы. Интенсивное поглощение при длине волны около 16000 см. −1 охарактеризована особенность поглощения голубой меди. Была вторая полоса с более низкой энергией и умеренной интенсивностью поглощения. Данные по поглощению поляризованного сигнального кристалла на пластоцианине показали, что обе полосы имеют одинаковую степень поляризации, связанную со связью Cu(II)-S(Cys). Это объясняется тем, что нормальный комплекс меди имеет высокоэнергетические сигма-связи и низкоэнергетические слабые π-связи. Однако в случае белка синей меди имеются низкоэнергетические интенсивные сигма-связи и высокоэнергетические слабые π-связи, поскольку интенсивность CT отражает перекрытие донорных и акцепторных орбиталей в процессе CT. Для этого требовалось, чтобы 3d (x 2 -и 2 ) орбиталь синего медного участка должна быть ориентирована так, чтобы ее лепестки делили пополам связь Cu-S (Cys), что давало доминирующее π-перекрытие непосредственно с серой. Наконец, природа волновой функции основного состояния белка синей меди богата спектром электронного поглощения.
Координация металлов внутренней и внешней сферы
[ редактировать ]Длина связей ионов цистеина, серы и меди (II) составляет от 2,6 до 3,2 Å. [12] В восстановленной форме CuI белковые структуры по-прежнему образуются с удлиненными связями на 0,1 Å или менее. с окисленными и восстановленными белковыми структурами они накладываются друг на друга. Исключением является амицианин , поскольку гистидин лигируется и не связан с йодидом меди. [12] В азурине 112 тиолат цистеина принимает водородные связи от амидного остова аспарагина 47 и фенилаланина 114, а гистидин 46 отдает водородную связь карбонильному остову аспарагина 10. цистеина 84 Тиолат пластоцианина лейцина принимает водородную связь от амидного остова аспарагина 38 и гистидина 37 сильно взаимодействует с карбонильным остовом аланина 33 и более слабо с карбонильным остовом 5 , глицина 34 и амидным остовом фенилаланина 35. [12]

Синий медный белок «Энтатическое состояние»
[ редактировать ]С 2+ комплексы часто имеют относительно низкую скорость передачи данных. Примером является Cu 2+/+ комплекс aquo , который составляет 5 х 10 −7 М −1 .сек −1 по сравнению с белком синей меди, время которого составляет от 1 мс до 01 мкс. [13] При переносе электрона окисленная Cu 2+ Состояние в активном центре белка синей меди будет минимизировано, поскольку минимизирован эффект Яна-Теллера. Искаженная геометрия предотвращает искажение Яна-Теллера. Орбитальное вырождение снимается за счет асимметричного поля лиганда. [11] На поле асимметричных лигандов влияют сильный экваториальный цистеиновый лиганд и слабый аксиальный метиониновый лиганд. На рисунке 2 диаграмма энергетических уровней показывает три различные соответствующие геометрии и их расщепление d-орбиталей, а эффект Яна-Теллера показан синим цветом. [11] (i) показана диаграмма энергетических уровней тетраэдрической геометрии с вырожденной . Тетраэдрическая структура может претерпевать искажение Яна-Теллера из-за вырожденных орбиталей. (ii) показана диаграмма расщепления энергетических уровней симметричной геометрии C 3v с 2 Основное состояние E, которое является вырожденным. Геометрия C 3v образована удлиненной тиоэфирной связью метионина в восстановленном сайте. Неспаренные электроны приводят к эффекту Яна-Теллера. (iii) показана диаграмма расщепления энергетических уровней основного состояния геометрии C s с более длинной тиоэфирной связью и последующей более короткой тиолатной связью. Это правильная геометрия белка синей меди. Это показывает отсутствие эффекта Яна-Теллера. Энергетическая диаграмма показывает, что асимметрия короткой связи Cu-S(Cys) и сильно искаженные валентные углы Cu-L приводят к снятию вырождения орбиталей и тем самым к устранению эффекта Яна-Теллера, обусловленного слабой связью Cu-L. донор Cu-S(Met) и сильный донор Cu-S(Met). [11]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Лонти Р., изд. (2018). Медные белки и медные ферменты . Том. III. ЦРК Пресс. ISBN 9781315891798 .
- ^ Члонковская, Анна; Литвин, Томас; Душек, Петр; Ференци, Питер; Луценко Светлана; Медичи, Валентина; Рыбаковский, Януш К.; Вайс, Карл Хайнц; Шильский, Майкл Л. (2018). «Болезнь Вильсона» . Обзоры природы. Учебники по болезням . 4 (1): 21. дои : 10.1038/s41572-018-0018-3 . ПМК 6416051 . ПМИД 30190489 .
- ^ Холм Р.Х. , Кеннеполь П., Соломон Э.И. (ноябрь 1996 г.). «Структурные и функциональные аспекты металлических участков в биологии». Химические обзоры . 96 (7): 2239–2314. дои : 10.1021/cr9500390 . ПМИД 11848828 .
- ^ Аркос-Лопес, Тринидад; Шут, Нильс; Кинтанар, Лилиана (2020), «Глава 3: Сайт синей меди типа 1: от переноса электрона к биологической функции», в Соса Торрес, Марта Э.; Кронек, Питер М.Х. (ред.), Переходные металлы и сера: сильная связь для жизни , Ионы металлов в науках о жизни (редакторы серии Астрид Сигель, Ева Фрейзингер и Роланд К.О. Сигел), том. 20, Берлин/Бостон: де Грюйтер, номер телефона : 10.1515/9783110589757-003.
- ^ Клинман Дж. П. (ноябрь 1996 г.). «Механизмы, посредством которых мононуклеарные медные белки функционализируют органические субстраты». Химические обзоры . 96 (7): 2541–2562. дои : 10.1021/cr950047g . ПМИД 11848836 . .
- ^ Льюис Э.А., Толман В.Б. (2004). «Реакционная способность дикислородно-медных систем». Химические обзоры . 104 (2): 1047–1076. дои : 10.1021/cr020633r . ПМИД 14871149 .
- ^ Соломон Э.И., Сундарам У.М., Мачонкин Т.Е. (ноябрь 1996 г.). «Мультимедные оксидазы и оксигеназы». Химические обзоры . 96 (7): 2563–2606. дои : 10.1021/cr950046o . ПМИД 11848837 .
- ^ Jump up to: а б Мальмстрем Б.Г. (1994). «Связывание, индуцированное стойкой, в белках синей меди». Обзоры EJB, 1994 год . Берлин Гейдельберг: Springer. стр. 157–164. дои : 10.1007/978-3-642-79502-2_12 . ISBN 978-3-540-58830-6 .
- ^ Jump up to: а б Бертини I (1 июля 2007 г.). Биологическая неорганическая химия: строение и реакционная способность . S2CID 93183803 .
- ^ Jump up to: а б Де Риенцо Ф., Габдуллин Р.Р., Мензиани М.К., Уэйд Р.К. (август 2000 г.). «Белки синей меди: сравнительный анализ свойств их молекулярного взаимодействия» . Белковая наука . 9 (8): 1439–54. дои : 10.1110/ps.9.8.1439 . ПМК 2144732 . ПМИД 10975566 .
- ^ Jump up to: а б с д и ж Соломон Э.И., Хадт Р.Г. (апрель 2011 г.). «Последние достижения в понимании белков голубой меди». Обзоры координационной химии . 255 (7–8): 774–789. дои : 10.1016/j.ccr.2010.12.008 .
- ^ Jump up to: а б с Уоррен Дж. Дж., Ланкастер К. М., Ричардс Дж. Х., Грей Х. Б. (октябрь 2012 г.). «Внутренняя и внешняя координация металлов в белках синей меди» . Журнал неорганической биохимии . 115 : 119–26. дои : 10.1016/j.jinorgbio.2012.05.002 . ПМЦ 3434318 . ПМИД 22658756 .
- ^ Комба, Питер (май 2000 г.). «Координационные соединения в энтатическом состоянии» . Обзоры координационной химии . 200–202: 217–245. дои : 10.1016/s0010-8545(00)00265-4 . ISSN 0010-8545 .