Глюкозо-6-фосфат-изомераза
| Глюкозо-6-фосфат-изомераза | |||
|---|---|---|---|
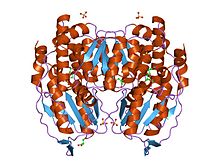
 Димер глюкозо-6-фосфат-изомеразы, Кролик | |||
| Идентификаторы | |||
| Номер ЕС. | 5.3.1.9 | ||
| Номер CAS. | 9001-41-6 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| С-концевая область бактериальной фосфоглюкозоизомеразы | |||
|---|---|---|---|
 кристаллическая структура фосфоглюкозо/фосфоманнозоизомеразы из Pirobaculum aerophilum в комплексе с фруктозо-6-фосфатом | |||
| Идентификаторы | |||
| Символ | bact-PGI_C | ||
| Пфам | ПФ10432 | ||
| ИнтерПро | ИПР019490 | ||
| CDD | cd05016 | ||
| |||
| Изомеры фосфоглюкозы | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ЗГУ | ||
| Пфам | PF00342 | ||
| СКОП2 | 1pgi / SCOPe / СУПФАМ | ||
| CDD | cd05015 | ||
| |||
| ГПИ | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ГФИ , АМФ, ГНПИ, НЛК, ПГИ, ФИ, SA-36, SA36, глюкозо-6-фосфатизомераза | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 172400 ; Гомологен : 145 ; Генные карты : GPI ; ОМА : GPI — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Глюкозо-6-фосфат-изомераза ( GPI ), также известная как фосфоглюкозо-изомераза/фосфоглюкоизомераза ( PGI ) или фосфогексозоизомераза ( PHI ), представляет собой фермент ( EC 5.3.1.9 ), который у людей кодируется GPI геном на хромосоме 19. [4] Этот ген кодирует член семейства белков глюкозо-фосфат-изомеразы. Кодируемый белок был идентифицирован как «подрабатывающий» белок на основании его способности выполнять механически различные функции. В цитоплазме продукт гена действует как гликолитический фермент (глюкозо-6-фосфат-изомераза), который взаимно превращает глюкозо-6-фосфат (G6P) и фруктозо-6-фосфат (F6P). Внеклеточно кодируемый белок (также называемый нейролейкином) действует как нейротрофический фактор, который способствует выживанию скелетных мотонейронов и сенсорных нейронов, а также как лимфокин, индуцирующий секрецию иммуноглобулина . Кодируемый белок также называют фактором аутокринной подвижности (AMF), поскольку он выполняет дополнительную функцию опухолью , секретируемого цитокина , и ангиогенного фактора. Дефекты этого гена являются причиной несфероцитарной гемолитической анемии, а тяжелая недостаточность фермента может быть связана с водянкой плода, немедленной неонатальной смертью и неврологическими нарушениями. Альтернативный сплайсинг приводит к появлению нескольких вариантов транскрипта. [предоставлено RefSeq, январь 2014 г.] [5]
Структура
[ редактировать ]Функциональный GPI представляет собой димер массой 64 кДа, состоящий из двух идентичных мономеров. [6] [7] Два мономера взаимодействуют друг с другом посредством двух выступов, образуя объятие. Активный центр каждого мономера образован щелью между двумя доменами и границей раздела димеров. [6]
Мономеры GPI состоят из двух доменов: один состоит из двух отдельных сегментов, называемых большим доменом, а другой состоит из промежуточного сегмента, называемого малым доменом. [8] Каждый из двух доменов представляет собой αβα-сэндвич: маленький домен содержит пятицепочечный β-лист, окруженный α-спиралями, а большой домен имеет шестицепочечный β-лист. [6] Большой домен, расположенный на N-конце , и C-конце каждого мономера также содержат «рычажные» выступы. [8] [9] Несколько остатков в малом домене служат для связывания фосфата, тогда как другие остатки, особенно His 388 , из больших и С-концевых доменов имеют решающее значение для стадии раскрытия сахарного кольца, катализируемой этим ферментом. Поскольку активность изомеризации происходит на границе раздела димеров, структура димера этого фермента имеет решающее значение для его каталитической функции. [9]
Предполагается, что сериновое фосфорилирование этого белка вызывает конформационные изменения его секреторной формы. [7]
Механизм
[ редактировать ]Механизм, который GPI использует для взаимного превращения глюкозо-6-фосфата и фруктозо-6-фосфата (альдозы в кетозу), состоит из трех основных этапов: раскрытие глюкозного кольца, изомеризация глюкозы во фруктозу через промежуточный эндиол и закрытие фруктозного кольца. [10]
Изомеризация глюкозы
[ редактировать ]| Д – Глюкоза | Фосфоглюкозоизомераза | Д – Фруктоза | |
 |  | ||
 | |||
| Фосфоглюкозоизомераза | |||
| α- D - Глюкозо-6-фосфат | Фосфоглюкозоизомераза | α- D - Фруктозо-6-фосфат | |
 |  | ||
 | |||
| Фосфоглюкозоизомераза | |||
Соединение C00668 в базе данных KEGG Pathway. Фермент 5.3.1.9 в базе данных путей KEGG . Соединение C05345 в базе данных KEGG Pathway. Реакция R00771 в базе данных KEGG Pathway.
Глюкозо-6-фосфат связывается с GPI в форме пиранозы. Кольцо открывается по механизму «тяни-тяни» с помощью His388, который протонирует кислород C5, и Lys518, который депротонирует гидроксильную группу C1. Это создает альдозу с открытой цепью. Затем подложку поворачивают вокруг связи C3-C4, чтобы расположить ее для изомеризации. В этот момент Glu357 депротонирует C2 с образованием цис - эндиолата, стабилизированного Arg272. Для завершения изомеризации Glu357 отдает свой протон C1, гидроксильная группа C2 теряет свой протон и образуется кетозо-фруктозо-6-фосфат с открытой цепью. Наконец, кольцо замыкается путем повторного вращения подложки вокруг связи C3-C4 и депротонирования гидроксила C5 с помощью Lys518. [11]
При переходе от фруктозо-6-фосфата к глюкозо-6-фосфату результатом может быть маннозо -6-фосфат, если углерод C2 имеет неправильную хиральность , но фермент не допускает такого результата, за исключением очень низкой, нефизиологической концентрации. , ставка. [11]
Функция
[ редактировать ]Этот ген принадлежит к семейству GPI. [5] Белок, кодируемый этим геном, представляет собой димерный фермент, катализирующий обратимую изомеризацию G6P и F6P. [12] [13] Поскольку реакция обратима, ее направление определяется концентрациями G6P и F6P. [9]
глюкозо-6-фосфат ↔ фруктозо-6-фосфат
Белок выполняет разные функции внутри и снаружи клетки. В цитоплазме белок участвует в гликолизе и глюконеогенезе , а также пентозофосфатном пути. [9] Вне клетки он действует как нейротрофический фактор для спинальных и сенсорных нейронов, называемый нейролейкином . [13] Тот же белок секретируется раковыми клетками, где он называется аутокринным фактором подвижности. [14] и стимулирует метастазирование . [15] Известно также, что внеклеточный GPI действует как фактор созревания. [9] [13]
нейролейкин
[ редактировать ]Хотя изначально GPI рассматривался как отдельные белки, технология клонирования показала, что GPI практически идентичен белку нейролейкину . [16] Нейролейкин является нейротрофическим фактором для спинальных и сенсорных нейронов. В больших количествах он содержится в мышцах, мозге, сердце и почках. [17] Нейролейкин также действует как лимфокин, секретируемый Т-клетками, стимулируемыми лектином. Он индуцирует секрецию иммуноглобулина в В-клетках как часть ответа, который активирует клетки, секретирующие антитела. [18]
Аутокринный фактор подвижности
[ редактировать ]Эксперименты по клонированию также показали, что GPI идентичен белку, известному как фактор аутокринной подвижности (AMF). [19] АМФ продуцируется и секретируется раковыми клетками и стимулирует рост и подвижность клеток в качестве фактора роста . [20] Считается, что АМФ играет ключевую роль в метастазировании рака , активируя пути MAPK / ERK или PI3K / AKT . [21] [22] [23] В пути PI3K/AKT AMF взаимодействует с gp78/ AMFR , регулируя высвобождение кальция из ER и, следовательно, защищая от апоптоза в ответ на стресс ER. [21]
Прокариотическая бифункциональная глюкозо-6-фосфатизомераза
[ редактировать ]У некоторых архей и бактерий активность глюкозо-6-фосфат-изомеразы осуществляется посредством бифункционального фермента , который также проявляет активность фосфоманнозоизомеразы (PMI). и не тесно связан с эукариотическими Хотя этот бифункциональный фермент GPI, он достаточно похож, и его последовательность включает кластер треонинов и серинов , который образует сайт связывания сахарофосфата в обычном GPI. Считается, что фермент использует одни и те же каталитические механизмы как для глюкозы открытия кольца , так и для изомеризации для взаимного превращения G6P в F6P. [24]
Клиническое значение
[ редактировать ]Дефицит GPI является причиной 4% гемолитических анемий, вызванных недостаточностью гликолитических ферментов. [12] [13] [25] [26] Недавно было выявлено несколько случаев дефицита GPI. [27]
Повышенные уровни GPI в сыворотке использовались в качестве прогностического биомаркера рака колоректального рака , молочной железы , легких , почек , желудочно-кишечного тракта и других видов рака . [7] [13] Как и AMF, GPI регулирует миграцию клеток во время инвазии и метастазирования . [7] Одно исследование показало, что внешние слои сфероидов опухоли молочной железы (BTS) секретируют GPI, который индуцирует эпителиально-мезенхимальный переход (EMT), инвазию и метастазирование в BTS. Было обнаружено, что ингибиторы GPI ERI4P и 6PG блокируют метастазирование BTS, но не гликолиз BTS или жизнеспособность фибробластов. Кроме того, GPI секретируется исключительно опухолевыми клетками, а не нормальными клетками. По этим причинам ингибиторы GPI могут быть более безопасным и целенаправленным подходом к противораковой терапии. [28] GPI также участвует в петле положительной обратной связи с HER2 , основной терапевтической мишенью рака молочной железы, поскольку GPI усиливает экспрессию HER2, а сверхэкспрессия HER2 усиливает экспрессию GPI и так далее. В результате активность GPI, вероятно, обеспечивает устойчивость клеток рака молочной железы к терапии на основе HER2 с использованием Герцептина /Трастузумаба, и ее следует рассматривать как дополнительную мишень при лечении пациентов. [23]
Приложения
[ редактировать ]Человеческий GPI способен вызывать артрит у мышей с различным генетическим фоном посредством внутрикожной инъекции. [29] [30]
См. также
[ редактировать ]- Фермент фруктозо-1-фосфат-альдолаза , превращающий фруктозу в глюкозу.
Взаимодействия
[ редактировать ]Известно, что GPI взаимодействует с:
Интерактивная карта маршрутов
[ редактировать ]Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «Гликолиз-Глюконеогенез_WP534» .
Ссылки
[ редактировать ]- ^ Jump up to: а б с ENSG00000105220 GRCh38: выпуск Ensembl 89: ENSG00000282019, ENSG00000105220 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «UniProtKB: P06744 (G6PI_HUMAN)» .
- ^ Jump up to: а б «Ген Энтрез: глюкозофосфатизомераза GPI» .
- ^ Jump up to: а б с Джеффри С.Дж., Бансон Б.Дж., Чиен В., Ринге Д., Пецко Г.А. (февраль 2000 г.). «Кристаллическая структура кроличьей фосфоглюкозоизомеразы, гликолитического фермента, который подрабатывает нейролейкином, фактором аутокринной подвижности и медиатором дифференцировки». Биохимия . 39 (5): 955–964. дои : 10.1021/bi991604m . ПМИД 10653639 .
- ^ Jump up to: а б с д Хага А., Ниинака Ю., Раз А. (июль 2000 г.). «Фосфогексозоизомераза/фактор аутокринной подвижности/нейролейкин/фактор созревания представляет собой многофункциональный фосфопротеин». Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 1480 (1–2): 235–244. дои : 10.1016/s0167-4838(00)00075-3 . ПМИД 11004567 .
- ^ Jump up to: а б Сунь YJ, Чжоу CC, Чен WS, Ву RT, Мэн М, Сяо CD (май 1999 г.). «Кристаллическая структура многофункционального белка: фосфоглюкозомераза/аутокринный фактор подвижности/нейролейкин» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (10): 5412–5417. Бибкод : 1999PNAS...96.5412S . дои : 10.1073/pnas.96.10.5412 . ПМК 21873 . ПМИД 10318897 .
- ^ Jump up to: а б с д и Кордейро А.Т., Годой П.Х., Сильва CH, Гарратт Р.К., Олива Дж., Тиманн О.Г. (февраль 2003 г.). «Кристаллическая структура фосфоглюкозоизомеразы человека и анализ начальных каталитических этапов». Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1645 (2): 117–122. дои : 10.1016/s1570-9639(02)00464-8 . ПМИД 12573240 .
- ^ Прочтите Дж., Пирса Дж., Ли Икс, Мюрхеда Х., Чиргвина Дж., Дэвиса С. (июнь 2001 г.). «Кристаллическая структура фосфоглюкозоизомеразы человека при разрешении 1,6 А: значение для каталитического механизма, активности цитокинов и гемолитической анемии». Журнал молекулярной биологии . 309 (2): 447–463. дои : 10.1006/jmbi.2001.4680 . ПМИД 11371164 .
- ^ Jump up to: а б Соломонс Дж.Т., Циммерли Э.М., Бернс С., Кришнамурти Н., Свон М.К., Крингс С. и др. (сентябрь 2004 г.). «Кристаллическая структура мышиной фосфоглюкозоизомеразы с разрешением 1,6 А и ее комплекса с глюкозо-6-фосфатом раскрывает каталитический механизм раскрытия сахарного кольца». Журнал молекулярной биологии . 342 (3): 847–860. дои : 10.1016/j.jmb.2004.07.085 . ПМИД 15342241 .
- ^ Jump up to: а б Куглер В., Лакомек М. (март 2000 г.). «Дефицит глюкозо-6-фосфат-изомеразы». Лучшие практики и исследования Байьера. Клиническая гематология . 13 (1): 89–101. дои : 10.1053/beha.1999.0059 . ПМИД 10916680 .
- ^ Jump up to: а б с д и Сомаровту С., Бродкин Х.Р., Д'Акино Дж.А., Ринге Д., Ондречен М.Дж., Бенинг П.Дж. (ноябрь 2011 г.). «История о двух изомеразах: компактные и расширенные активные центры в кетостероид-изомеразе и фосфоглюкозоизомеразе». Биохимия . 50 (43): 9283–9295. дои : 10.1021/bi201089v . ПМИД 21970785 .
- ^ Добаси Ю, Ватанабэ Х, Сато Ю, Хирасима С, Янагава Т, Мацубара Х, Оой А (декабрь 2006 г.). «Дифференциальная экспрессия и патологическое значение экспрессии аутокринного фактора подвижности / глюкозо-6-фосфат-изомеразы при карциномах легких человека». Журнал патологии . 210 (4): 431–440. дои : 10.1002/путь.2069 . ПМИД 17029220 . S2CID 39800980 .
- ^ Ватанабэ Х., Такехана К., Дате М., Шинозаки Т., Раз А. (июль 1996 г.). «Фактор аутокринной подвижности опухолевых клеток представляет собой полипептид нейролейкин/фосфогексозоизомеразы» . Исследования рака . 56 (13): 2960–2963. ПМИД 8674049 .
- ^ Чапут М., Клаас В., Портетель Д., Кладтс И., Кравадор А., Берни А. и др. (март 1988 г.). «Нейротрофический фактор нейролейкин на 90% гомологичен фосфогексозоизомеразе». Природа . 332 (6163): 454–455. Бибкод : 1988Natur.332..454C . дои : 10.1038/332454a0 . ПМИД 3352744 . S2CID 4260489 .
- ^ Герни М.Э., Генрих С.П., Ли М.Р., Инь Х.С. (октябрь 1986 г.). «Молекулярное клонирование и экспрессия нейролейкина, нейротрофического фактора для спинальных и сенсорных нейронов». Наука . 234 (4776): 566–574. Бибкод : 1986Sci...234..566G . дои : 10.1126/science.3764429 . ПМИД 3764429 .
- ^ Герни М.Э., Апатов Б.Р., Спир Г.Т., Баумель М.Дж., Антел Дж.П., Баниа М.Б., Редер А.Т. (октябрь 1986 г.). «Нейролейкин: лимфокиновый продукт стимулированных лектинами Т-клеток». Наука . 234 (4776): 574–581. Бибкод : 1986Sci...234..574G . дои : 10.1126/science.3020690 . ПМИД 3020690 .
- ^ Ватанабэ Х., Такехана К., Дате М., Шинозаки Т., Раз А. (июль 1996 г.). «Фактор аутокринной подвижности опухолевых клеток представляет собой полипептид нейролейкин/фосфогексозоизомеразы» . Исследования рака . 56 (13): 2960–2963. ПМИД 8674049 .
- ^ Силлетти С., Раз А (июль 1993 г.). «Фактор аутокринной моторики является фактором роста». Связь с биохимическими и биофизическими исследованиями . 194 (1): 446–457. дои : 10.1006/bbrc.1993.1840 . ПМИД 8392842 .
- ^ Jump up to: а б с Фу М., Ли Л., Альбрехт Т., Джонсон Дж.Д., Койич Л.Д., Наби И.Р. (июнь 2011 г.). «Фактор аутокринной подвижности/фосфоглюкозоизомераза регулирует стресс ЭР и гибель клеток посредством контроля высвобождения кальция из ЭР» . Смерть клеток и дифференцировка . 18 (6): 1057–1070. дои : 10.1038/cdd.2010.181 . ПМК 3131941 . ПМИД 21252914 .
- ^ Лиотта Л.А., Мандлер Р., Мурано Г., Кац Д.А., Гордон Р.К., Чан П.К., Шиффманн Э. (май 1986 г.). «Фактор аутокринной подвижности опухолевых клеток» . Труды Национальной академии наук Соединенных Штатов Америки . 83 (10): 3302–3306. Бибкод : 1986PNAS...83.3302L . дои : 10.1073/pnas.83.10.3302 . ПМК 323501 . ПМИД 3085086 .
- ^ Jump up to: а б с д Хо Д.Х., Нангия-Маккер П., Балан В., Хоган В., Тейт Л., Ван Й., Раз А. (февраль 2013 г.). «Фактор аутокринной подвижности способствует расщеплению HER2 и передаче сигналов в клетках рака молочной железы» . Исследования рака . 73 (4): 1411–1419. дои : 10.1158/0008-5472.can-12-2149 . ПМК 3577983 . ПМИД 23248119 .
- ^ Свон М.К., Хансен Т., Шёнхайт П., Дэвис С. (сентябрь 2004 г.). «Новая фосфоглюкозоизомераза (PGI)/фосфоманнозоизомераза из кренархеона Pyrobaculum aerophilum является членом суперсемейства PGI: структурные данные с разрешением 1,16-A» . Журнал биологической химии . 279 (38): 39838–39845. дои : 10.1074/jbc.M406855200 . ПМИД 15252053 .
- ^ Уокер Дж.И., Лейтон Д.М., Беллингем А.Дж., Морган М.Дж., Фаик П. (март 1993 г.). «Нарушения последовательности ДНК при дефиците глюкозо-6-фосфатизомеразы человека». Молекулярная генетика человека . 2 (3): 327–329. дои : 10.1093/hmg/2.3.327 . ПМИД 8499925 .
- ^ Канно Х., Фуджи Х., Хироно А., Исида Ю., Ога С., Фукумото Ю. и др. (сентябрь 1996 г.). «Молекулярный анализ дефицита глюкозофосфатизомеразы, связанного с наследственной гемолитической анемией» . Кровь . 88 (6): 2321–2325. doi : 10.1182/blood.V88.6.2321.bloodjournal8862321 . ПМИД 8822954 .
- ^ «Дефицит GPI» . Архивировано из оригинала 17 мая 2014 г. Проверено 23 декабря 2012 г.
- ^ Галлардо-Перес Х.К., Риверо-Сегура Н.А., Марин-Эрнандес А., Морено-Санчес Р., Родригес-Энрикес С. (июнь 2014 г.). «Ингибирование GPI/AMF блокирует развитие метастатического фенотипа зрелых многоклеточных опухолевых сфероидов» . Биохимия и биофизика Acta (BBA) - Исследования молекулярных клеток . 1843 (6): 1043–1053. дои : 10.1016/j.bbamcr.2014.01.013 . ПМИД 24440856 .
- ^ Пиццолла А, Винг К, Холмдал Р. (октябрь 2013 г.). «Пептид глюкозо-6-фосфат-изомеразы индуцирует зависимый от Т- и В-клеток хронический артрит у мышей C57BL/10: артрит без активных форм кислорода и комплемента» . Американский журнал патологии . 183 (4): 1144–1155. дои : 10.1016/j.ajpath.2013.06.019 . ПМИД 23911657 .
- ^ Иноуэ А., Мацумото И., Танака Ю., Иванами К., Канамори А., Отиаи Н. и др. (2009). «Экспрессия белка, связанного с жировой тканью, индуцированная фактором некроза опухоли альфа, при экспериментальном артрите и ревматоидном артрите» . Исследования и терапия артрита . 11 (4): Р118. дои : 10.1186/ar2779 . ПМК 2745801 . ПМИД 19660107 .
Дальнейшее чтение
[ редактировать ]- Уокер Дж.И., Фаик П., Морган М.Дж. (август 1990 г.). «Характеристика 5'-конца гена глюкозофосфатизомеразы человека (GPI)». Геномика . 7 (4): 638–643. дои : 10.1016/0888-7543(90)90212-D . ПМИД 2387591 .
- Браунштейн Б.Х., Сильверман Г.А., Литтл Р.Д., Берк Д.Т., Корсмейер С.Дж., Шлессингер Д., Олсон М.В. (июнь 1989 г.). «Выделение однокопийных генов человека из библиотеки клонов искусственных хромосом дрожжей». Наука . 244 (4910): 1348–1351. Бибкод : 1989Sci...244.1348B . дои : 10.1126/science.2544027 . ПМИД 2544027 .
- Мизрахи Ю. (июнь 1989 г.). «Нейротрофическая активность мономерной глюкофосфоизомеразы блокировалась вирусом иммунодефицита человека (ВИЧ-1) и пептидами из гликопротеина оболочки ВИЧ-1». Журнал нейробиологических исследований . 23 (2): 217–224. дои : 10.1002/jnr.490230212 . ПМИД 2547084 . S2CID 42567893 .
- Герни М.Э., Апатов Б.Р., Спир Г.Т., Баумель М.Дж., Антел Дж.П., Баниа М.Б., Редер А.Т. (октябрь 1986 г.). «Нейролейкин: лимфокиновый продукт стимулированных лектинами Т-клеток». Наука . 234 (4776): 574–581. Бибкод : 1986Sci...234..574G . дои : 10.1126/science.3020690 . ПМИД 3020690 .
- Фаик П., Уокер Дж.И., Редмилл А.А., Морган М.Дж. (март 1988 г.). «Мышиная глюкозо-6-фосфат-изомераза и нейролейкин имеют идентичные 3'-последовательности». Природа . 332 (6163): 455–457. Бибкод : 1988Natur.332..455F . дои : 10.1038/332455a0 . ПМИД 3352745 . S2CID 4306026 .
- Занелла А., Иззо С., Ребулла П., Перрони Л., Мариани М., Канестри Г. и др. (1981). «Первый стабильный вариант глюкозо-фосфат-изомеразы эритроцитов, связанный с тяжелой гемолитической анемией». Американский журнал гематологии . 9 (1): 1–11. дои : 10.1002/ajh.2830090102 . ПМИД 7435496 . S2CID 10479146 .
- Фаик П., Уокер Дж.И., Морган М.Дж. (май 1994 г.). «Идентификация новой тандемно повторяющейся последовательности, присутствующей в интроне гена глюкозо-фосфат-изомеразы (GPI) у мыши и человека». Геномика . 21 (1): 122–127. дои : 10.1006/geno.1994.1233 . ПМИД 7545951 .
- Сюй В., Бейтлер Э. (декабрь 1994 г.). «Характеристика генных мутаций, вызывающих дефицит глюкозофосфатизомеразы человека, связанный с хронической гемолитической анемией» . Журнал клинических исследований . 94 (6): 2326–2329. дои : 10.1172/JCI117597 . ПМК 330061 . ПМИД 7989588 .
- Сюй В., Ли П., Бейтлер Э. (октябрь 1995 г.). «Глюкозофосфатизомераза человека: картирование экзонов и структура гена». Геномика . 29 (3): 732–739. дои : 10.1006/geno.1995.9944 . ПМИД 8575767 .
- Барончиани Л., Занелла А., Бьянки П., Заппа М., Альфинито Ф., Иоласкон А. и др. (сентябрь 1996 г.). «Изучение молекулярных дефектов у пациентов с дефицитом глюкозо-фосфат-изомеразы, страдающих хронической гемолитической анемией» . Кровь . 88 (6): 2306–2310. doi : 10.1182/blood.V88.6.2306.bloodjournal8862306 . ПМИД 8822952 .
- Бейтлер Э., Уэст К., Бриттон Х.А., Харрис Дж., Форман Л. (декабрь 1997 г.). «Мутации дефицита глюкозофосфат-изомеразы (GPI), связанные с наследственной несфероцитарной гемолитической анемией (HNSHA)». Клетки крови, молекулы и болезни . 23 (3): 402–409. дои : 10.1006/bcmd.1997.0157 . ПМИД 9446754 .
- Канно Х., Фуджи Х., Мива С. (март 1998 г.). «Экспрессия и ферментативная характеристика вариантов глюкозофосфатизомеразы человека (GPI) с учетом дефицита GPI». Клетки крови, молекулы и болезни . 24 (1): 54–61. дои : 10.1006/bcmd.1998.0170 . ПМИД 9616041 .
- Куглер В., Брем К., Ласпе П., Мюрхед Х., Дэвис С., Винклер Х. и др. (октябрь 1998 г.). «Молекулярные основы неврологической дисфункции в сочетании с гемолитической анемией при дефиците глюкозо-6-фосфат-изомеразы (ГФИ) человека». Генетика человека . 103 (4): 450–454. дои : 10.1007/s004390050849 . ПМИД 9856489 . S2CID 8313584 .
- Беляева О.В., Балановский О.П., Эшворт Л.К., Лебедев Ю.Б., Спицын В.А., Гусева Н.А. и др. (апрель 1999 г.). «Точное картирование полиморфного маркера повтора CA на хромосоме 19 человека и его использование в популяционных исследованиях». Джин . 230 (2): 259–266. дои : 10.1016/S0378-1119(99)00056-6 . ПМИД 10216265 .
- Якиревич Е, Наот Ю (апрель 2000 г.). «Клонирование глюкозо-фосфат-изомеразы / нейролейкиноподобного антигена спермы, участвующего в агглютинации сперматозоидов». Биология размножения . 62 (4): 1016–1023. дои : 10.1095/biolreprod62.4.1016 . ПМИД 10727272 . S2CID 22985905 .
- Хага А., Ниинака Ю., Раз А. (июль 2000 г.). «Фосфогексозоизомераза/фактор аутокринной подвижности/нейролейкин/фактор созревания представляет собой многофункциональный фосфопротеин». Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 1480 (1–2): 235–244. дои : 10.1016/s0167-4838(00)00075-3 . ПМИД 11004567 .


























