Эксклюзионная хроматография
 Оборудование для проведения эксклюзионной хроматографии. Буфер прокачивается через колонку (слева). | |
| Акроним | SEC |
|---|---|
| Классификация | Хроматография |
| Аналиты | макромолекулы синтетические полимеры биомолекулы |
| Производители | Cytiva, Bio-Rad, Bio-Works, emp Biotech, Knauer, Phenomenex. |
| Другие методы | |
| Связанный | Высокоэффективная жидкостная хроматография Водная нормально-фазовая хроматография Ионообменная хроматография Мицеллярная жидкостная хроматография |
Эксклюзионная хроматография , также известная как молекулярно-ситовая хроматография , [1] Хроматографический метод , при котором молекулы в растворе разделяются по размеру, а в некоторых случаях и по молекулярной массе . [2] Обычно его применяют к большим молекулам или макромолекулярным комплексам, таким как белки и промышленные полимеры . [3] Обычно, когда водный раствор для транспортировки образца через колонку используется , этот метод известен как гель-фильтрационная хроматография , в отличие от гель-проникающей хроматографии , которая используется, когда в качестве подвижной фазы используется органический растворитель. Хроматографическая колонка заполнена тонкими пористыми шариками, которые обычно состоят из декстрановых , агарозных или полиакриламидных полимеров. Размеры пор этих шариков используются для оценки размеров макромолекул . [1] SEC является широко используемым методом определения характеристик полимеров из-за его способности обеспечивать хорошие результаты распределения молярной массы (Mw) полимеров.
Эксклюзионная хроматография (SEC) фундаментально отличается от всех других хроматографических методов тем, что разделение основано на простой процедуре классификации размеров молекул, а не на каком-либо типе взаимодействия. [4]
Приложения
[ редактировать ]Основным применением эксклюзионной хроматографии является фракционирование белков и других водорастворимых полимеров, а гель-проникающая хроматография используется для анализа молекулярно-массового распределения органорастворимых полимеров. Любой метод не следует путать с гель-электрофорезом , где электрическое поле используется для «протягивания» молекул через гель в зависимости от их электрических зарядов. Время, в течение которого растворенное вещество остается внутри поры, зависит от размера пор. Более крупные растворенные вещества будут иметь доступ к меньшему объему и наоборот. Следовательно, растворенное вещество меньшего размера будет оставаться внутри поры в течение более длительного периода времени по сравнению с растворенным веществом большего размера. [5]
Несмотря на то, что эксклюзионная хроматография широко используется для изучения природных органических материалов, существуют ограничения. Одним из этих ограничений является отсутствие стандартного маркера молекулярной массы; [6] таким образом, не с чем сравнивать результаты. Если требуется точная молекулярная масса, следует использовать другие методы.
Преимущества
[ редактировать ]К преимуществам этого метода относятся хорошее отделение крупных молекул от мелких при минимальном объеме элюата, [7] и что различные растворы можно применять, не мешая процессу фильтрации, сохраняя при этом биологическую активность частиц по разделению. Этот метод обычно комбинируется с другими, которые дополнительно разделяют молекулы по другим характеристикам, таким как кислотность, основность, заряд и сродство к определенным соединениям. Эксклюзионная хроматография обеспечивает короткое и четко определенное время разделения и узкие полосы, что обеспечивает хорошую чувствительность. Также не происходит потерь образца, поскольку растворенные вещества не взаимодействуют с неподвижной фазой.
Другим преимуществом этого экспериментального метода является то, что в некоторых случаях можно определить приблизительную молекулярную массу соединения. Форма и размер соединения (элюента) определяют, как соединение взаимодействует с гелем (неподвижной фазой). Для определения приблизительной молекулярной массы получают объемы элюирования соединений с их соответствующими молекулярными массами, а затем график зависимости «K av » от «log(Mw)», где строят Mw – молекулярная масса. Этот график действует как калибровочная кривая, которая используется для аппроксимации молекулярной массы желаемого соединения. Компонент V e представляет собой объем, при котором элюируются промежуточные молекулы, такие как молекулы, которые имеют частичный доступ к гранулам колонки. Кроме того, V t представляет собой сумму общего объема между шариками и объема внутри шариков. Компонент Vo представляет собой объем, при котором элюируются более крупные молекулы, которые элюируются вначале. [8] [9] Недостатки заключаются, например, в том, что может быть учтено только ограниченное количество полос, поскольку временная шкала хроматограммы коротка, и, как правило, для хорошего разрешения должна быть разница в молекулярной массе в 10%. [7]
Открытие
[ редактировать ]Техника была изобретена в 1955 году Грантом Генри Лэтом и Колином Р. Ратвеном, работавшими в больнице королевы Шарлотты в Лондоне. [10] [11] Позже за это изобретение они получили премию Джона Скотта. [12] В то время как Лэйт и Рутвен использовали крахмальные гели в качестве матрицы, Джеркер Порат и Пер Флодин позже представили декстрановые гели; [13] другие гели со свойствами фракционирования по размеру включают агарозу и полиакриламид. Появился краткий обзор этих разработок. [14]
Были также попытки фракционировать синтетические высокомолекулярные полимеры; однако только в 1964 году Дж. К. Мур из Dow Chemical Company опубликовал свою работу по приготовлению колонок для гель-проникающей хроматографии (ГПХ) на основе сшитого полистирола с контролируемым размером пор. [15] начался бурный рост исследовательской деятельности в этой области. Почти сразу было признано, что при правильной калибровке GPC способен предоставить информацию о молярной массе и распределении молярной массы синтетических полимеров. Поскольку последнюю информацию было трудно получить другими методами, метод GPC быстро получил широкое распространение. [16]
Теория и метод
[ редактировать ]
SEC используется в основном для анализа больших молекул, таких как белки или полимеры. SEC работает путем улавливания более мелких молекул в порах адсорбента ( «неподвижная фаза»). Этот процесс обычно выполняется внутри колонны, которая обычно состоит из полой трубки, плотно заполненной полимерными шариками микронного размера, содержащими поры разных размеров. Эти поры могут представлять собой углубления на поверхности или каналы, проходящие через шарик. По мере продвижения раствора по колонне некоторые частицы попадают в поры. Более крупные частицы не могут проникнуть в такое количество пор. Чем крупнее частицы, тем быстрее элюирование. Более крупные молекулы просто проходят мимо пор, потому что эти молекулы слишком велики, чтобы войти в поры. Таким образом, более крупные молекулы проходят через колонку быстрее, чем более мелкие молекулы, то есть чем меньше молекула, тем дольше время удерживания.
Одним из требований для ЭХ является то, что аналит не взаимодействует с поверхностью неподвижных фаз, при этом различия во времени элюирования между аналитами в идеале основаны исключительно на объеме растворенного вещества, в которое могут попасть аналиты, а не на химических или электростатических взаимодействиях с неподвижными фазами. Таким образом, небольшая молекула, способная проникнуть в каждую область пористой системы стационарной фазы, может войти в общий объем, равный сумме всего объема пор и межчастичного объема. Эта небольшая молекула элюируется поздно (после того, как молекула проникла во весь объем пор и межчастиц — примерно 80% объема колонки). С другой стороны, очень большая молекула, которая не может проникнуть в более мелкие поры, может войти только в межчастичный объем (~35% объема колонки) и элюируется раньше, когда этот объем подвижной фазы пройдет через колонку. Основной принцип SEC заключается в том, что частицы разных размеров элюируются (фильтруются) через неподвижную фазу с разной скоростью. Это приводит к разделению раствора частиц по размеру. При условии, что все частицы загружены одновременно или почти одновременно, частицы одинакового размера должны элюироваться вместе.
Однако, поскольку существуют различные меры размера макромолекулы (например, радиус инерции и гидродинамический радиус), фундаментальной проблемой теории СЭК является выбор правильного параметра молекулярного размера, с помощью которого молекулы различных виды разделены. Экспериментально Бенуа и его коллеги обнаружили отличную корреляцию между объемом элюирования и динамически обоснованным размером молекул, гидродинамическим объемом , для нескольких различных архитектур цепей и химических составов. [17] Наблюдаемая корреляция, основанная на гидродинамическом объеме, стала основой универсальной SEC-калибровки.
Тем не менее, использование гидродинамического объема (размера, основанного на динамических свойствах) при интерпретации данных SEC не до конца понятно. [18] Это связано с тем, что SEC обычно работает в условиях низкой скорости потока, когда гидродинамический фактор не должен оказывать незначительного влияния на разделение. Фактически, и теория, и компьютерное моделирование предполагают принцип термодинамического разделения: процесс разделения определяется равновесным распределением (разделением) растворенных макромолекул между двумя фазами: фазой разбавленного объемного раствора, расположенной в межузельном пространстве, и фазами ограниченного раствора внутри пор. набивочного материала колонки. На основе этой теории было показано, что параметром размера, соответствующим распределению полимеров в порах, является средний размер пролета (средняя максимальная проекция на линию). [19] Хотя эта проблема еще не решена полностью, вполне вероятно, что средний размер пролета и гидродинамический объем тесно коррелируют.

Каждая колонка для исключения размера имеет диапазон молекулярных масс, которые можно разделить. Предел исключения определяет молекулярную массу в верхнем конце «рабочего» диапазона колонки и означает, что молекулы слишком велики, чтобы попасть в неподвижную фазу. Нижний конец диапазона определяется пределом проникновения, который определяет молекулярную массу молекулы, которая достаточно мала, чтобы проникнуть во все поры неподвижной фазы. Все молекулы ниже этой молекулярной массы настолько малы, что элюируются одной полосой. [7]
Отфильтрованный раствор, который собирается в конце, известен как элюат . Пустой объем включает в себя любые частицы, слишком большие для попадания в среду, а объем растворителя известен как объем колонны .
Ниже приведены материалы, которые обычно используются для изготовления пористых гелевых шариков при эксклюзионной хроматографии. [20]
| Сэр Нет | Материал И торговое название | Диапазон фракционирования (кДа) |
|---|---|---|
| 1 | Сефадекс G-10 | 0-0.7 |
| 2 | Сефадекс G-25 | 1-5 |
| 3 | Сефадекс G-50 | 1.5-30 |
| 4 | Сефадекс G-75 | 3-70 |
| 5 | Сефадекс G-100 | 4-150 |
| 6 | Сефадекс G-150 | 5-300 |
| 7 | Сефадекс G-200 | 5-8000 |
| 8 | Биогель П-2 | 0.1-1.8 |
| 9 | Биогель П-6 | 1-6 |
| 10 | Биогель П-60 | 3-60 |
| 11 | Биогель П-150 | 1.5-150 |
| 12 | Биогель П-300 | 16-400 |
| 13 | Сефароза 2Б | 2000-25000 |
| 14 | Сефароза 4Б | 300-3000 |
| 15 | Сефароза 6Б | 10-20000 |
Факторы, влияющие на фильтрацию
[ редактировать ]
В реальных ситуациях частицы в растворе не имеют фиксированного размера, что приводит к вероятности того, что частица, которой в противном случае мешала бы пора, пройдет мимо нее. Кроме того, частицы стационарной фазы не определены идеально; как частицы, так и поры могут различаться по размеру. Таким образом, кривые элюирования напоминают распределения Гаусса . Неподвижная фаза также может нежелательным образом взаимодействовать с частицами и влиять на время удерживания, хотя производители колонок уделяют большое внимание использованию инертных неподвижных фаз и минимизации этой проблемы.
Как и в других формах хроматографии, увеличение длины колонки повышает разрешение, а увеличение диаметра колонки увеличивает ее емкость. Правильная упаковка колонки важна для максимального разрешения: колонка с чрезмерной насадкой может схлопнуть поры в гранулах, что приведет к потере разрешения. Колонка с недостаточной насадкой может уменьшить относительную площадь поверхности неподвижной фазы, доступной для более мелких частиц, в результате чего эти частицы проводят меньше времени в порах. В отличие от методов аффинной хроматографии, головка растворителя в верхней части колонки может резко снизить разрешение, поскольку образец диффундирует перед загрузкой, расширяя зону элюирования ниже по потоку.
Анализ
[ редактировать ]В простых колонках с ручным управлением элюент собирается в постоянных объемах, называемых фракциями. Чем более схожи частицы по размеру, тем больше вероятность того, что они принадлежат к одной фракции и не обнаруживаются отдельно. Более продвинутые колонки решают эту проблему за счет постоянного мониторинга элюента.
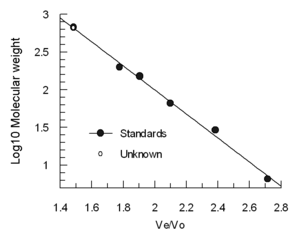

Собранные фракции часто исследуют с помощью спектроскопических методов для определения концентрации элюируемых частиц. Обычными методами обнаружения спектроскопии являются показатель преломления (RI) и ультрафиолет (УФ). При элюировании спектроскопически сходных частиц (например, во время биологической очистки) могут потребоваться другие методы для идентификации содержимого каждой фракции. Также возможно непрерывно анализировать поток элюента с помощью измерений RI, LALLS , многоуглового лазерного рассеяния MALS, УФ и/или измерений вязкости.
Объем элюирования (Ve) уменьшается примерно линейно пропорционально логарифму молекулярного гидродинамического объема . Колонки часто калибруют с использованием 4–5 стандартных образцов (например, свернутых белков с известной молекулярной массой) и образца, содержащего очень большую молекулу, такую как тиреоглобулин, для определения объема пустот . (Синий декстран не рекомендуется использовать для определения Vo, поскольку он гетерогенен и может давать разные результаты.) Объемы элюирования стандартов делятся на объем элюирования тиреоглобулина (Ve/Vo) и наносятся на график зависимости молекулярных масс стандартов. .
Приложения
[ редактировать ]Биохимические применения
[ редактировать ]В целом, SEC считается хроматографией низкого разрешения, поскольку она не очень хорошо распознает сходные виды и поэтому часто используется для заключительного этапа очистки. Этот метод позволяет определить четвертичную структуру очищенных белков, имеющих медленное время обмена, поскольку его можно проводить в условиях нативного раствора, сохраняя макромолекулярные взаимодействия. SEC также может анализировать третичную структуру белка , поскольку он измеряет гидродинамический объем (а не молекулярную массу), позволяя различать свернутые и развернутые версии одного и того же белка. Например, кажущийся гидродинамический радиус типичного белкового домена может составлять 14 Å и 36 Å для свернутой и развернутой форм соответственно. SEC позволяет разделить эти две формы, поскольку сложенная форма элюируется намного позже из-за ее меньшего размера.
Синтез полимеров
[ редактировать ]SEC можно использовать как меру как размера, так и полидисперсности синтезированного полимера , то есть способности находить распределение размеров молекул полимера. Если ранее были протестированы стандарты известного размера, то можно построить калибровочную кривую для определения размеров интересующих молекул полимера в растворителе, выбранном для анализа (часто ТГФ ). Альтернативно, такие методы, как светорассеяние и/или вискозиметрия, можно использовать онлайн с SEC для получения абсолютных молекулярных масс, которые не требуют калибровки со стандартами известной молекулярной массы. Из-за разницы в размерах двух полимеров с одинаковой молекулярной массой абсолютные методы определения, как правило, более желательны. Типичная система SEC может быстро (примерно за полчаса) предоставить химикам-полимерщикам информацию о размере и полидисперсности образца. Препаративную ЭХ можно использовать для фракционирования полимеров в аналитическом масштабе.
Недостатки
[ редактировать ]В SEC измеряется не столько масса, сколько гидродинамический объем молекул полимера, то есть сколько места занимает конкретная молекула полимера, когда она находится в растворе. Однако приблизительную молекулярную массу можно рассчитать на основе данных SEC, поскольку можно найти точную взаимосвязь между молекулярной массой и гидродинамическим объемом полистирола. Для этого в качестве стандарта используется полистирол. Но связь между гидродинамическим объемом и молекулярной массой не одинакова для всех полимеров, поэтому можно получить лишь приблизительное измерение. [21] Другим недостатком является возможность взаимодействия неподвижной фазы и аналита. Любое взаимодействие приводит к более позднему времени элюирования и, таким образом, имитирует меньший размер аналита.
При выполнении этого метода полосы элюирующих молекул могут уширяться. Это может произойти из-за турбулентности, вызванной потоком молекул подвижной фазы, проходящим через молекулы неподвижной фазы. Кроме того, уширению полос способствуют молекулярная термодиффузия и трение между молекулами стенок стекла и молекулами элюента. Помимо расширения, полосы также перекрываются друг с другом. В результате элюент обычно значительно разбавляется. Чтобы предотвратить вероятность расширения полос, можно принять некоторые меры предосторожности. Например, можно нанести образец узкой высококонцентрированной полосой в верхней части колонки. Чем более концентрирован элюент, тем эффективнее будет процедура. Однако не всегда удается сконцентрировать элюент, что можно отнести к еще одному недостатку. [9]
Абсолютная эксклюзионная хроматография
[ редактировать ]Абсолютная эксклюзионная хроматография (ASEC) - это метод, который сочетает в себе прибор светорассеяния, чаще всего многоугловое светорассеяние (MALS) или другую форму статического светорассеяния (SLS), но, возможно, и прибор динамического светорассеяния (DLS). к системе эксклюзионной хроматографии для измерения абсолютной молярной массы и/или размера белков и макромолекул по мере их элюирования из хроматографической системы. [22]
Определение «абсолютного» в данном случае заключается в том, что калибровка времени удерживания на колонке с набором эталонных стандартов не требуется для получения молярной массы или гидродинамического размера, часто называемого гидродинамическим диаметром (D H в единицах нм). . Неидеальные взаимодействия колонок, такие как электростатические или гидрофобные поверхностные взаимодействия, которые модулируют время удерживания относительно стандартов, не влияют на конечный результат. Аналогично, различия между конформацией аналита и стандарта не влияют на абсолютное измерение; например, с помощью MALS-анализа молярная масса изначально неупорядоченных белков характеризуется точно, даже несмотря на то, что они элюируются гораздо раньше, чем глобулярные белки с той же молярной массой, и то же самое верно для разветвленных полимеров, которые элюируются позже по сравнению с линейными эталонными стандартами. с той же молярной массой. [22] [23] [24] Еще одним преимуществом ASEC является то, что молярная масса и/или размер определяются в каждой точке элюирующего пика и, следовательно, указывают на гомогенность или полидисперсность внутри пика. Например, анализ SEC-MALS монодисперсного белка покажет, что весь пик состоит из молекул с одинаковой молярной массой, что невозможно при стандартном анализе SEC.
Определение молярной массы с помощью SLS требует объединения измерений светорассеяния с измерениями концентрации. Поэтому SEC-MALS обычно включает в себя детектор светорассеяния и либо дифференциальный рефрактометр , либо детектор поглощения УФ/Вид. Кроме того, MALS определяет среднеквадратичный радиус R g молекул, превышающих определенный предел размера, обычно 10 нм. Таким образом, SEC-MALS может анализировать конформацию полимеров посредством отношения молярной массы к R g . Для более мелких молекул добавляется либо DLS, либо, что чаще, дифференциальный вискозиметр для определения гидродинамического радиуса и оценки конформации молекул таким же образом.
В SEC-DLS размеры макромолекул измеряются по мере их элюирования в проточную кювету прибора DLS из набора эксклюзионных колонок. Измеряются гидродинамические размеры молекул или частиц, а не их молекулярные массы. Для белков можно использовать расчет типа Марка-Хаувинка для оценки молекулярной массы по гидродинамическому размеру.
Основным преимуществом DLS в сочетании с SEC является возможность получить улучшенное разрешение DLS. [25] Пакетная DLS является быстрой и простой и обеспечивает прямое измерение среднего размера, но базовое разрешение DLS представляет собой соотношение диаметров 3:1. Используя SEC, белки и белковые олигомеры разделяются, что позволяет разделить олигомеры. Агрегационные исследования также можно проводить с использованием ASEC. Хотя концентрацию агрегатов невозможно рассчитать с помощью светорассеяния (онлайн-детектор концентрации, такой как тот, который используется в SEC-MALS для измерения молярной массы, также определяет концентрацию агрегатов), размер агрегата можно измерить, ограничиваясь только максимальным размером элюируемого вещества. из столбцов SEC.
Ограничения ASEC с обнаружением DLS включают скорость потока, концентрацию и точность. Поскольку для правильного построения корреляционной функции требуется от 3 до 7 секунд, на пике можно собрать ограниченное количество точек данных. ASEC с SLS-детектированием не ограничен по скорости потока, время измерения практически мгновенное, а диапазон концентраций на несколько порядков больше, чем для DLS. Однако анализ молярной массы с помощью SEC-MALS требует точных измерений концентрации. Детекторы MALS и DLS часто объединяются в одном приборе для более полного абсолютного анализа после разделения методом SEC.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Гарретт Р.Х., Гришэм К.М. (2013). Биохимия (5-е изд.). Бельмонт, Калифорния: Брукс/Коул, Cengage Learning. п. 108. ИСБН 9781133106296 . OCLC 1066452448 .
- ^ Поль-Дофин, С; Караджа, Ф; Морган, Ти Джей; и др. (6 октября 2007 г.). «Изучение механизмов исключения размеров сложных углеводородных смесей: влияние изменения состава элюентов». Энергетика и топливо . 6. 21 (6): 3484–3489. дои : 10.1021/ef700410e .
- ^ Перейти обратно: а б Кастенхольц, Б. (29 апреля 2008 г.). «Фитохимический подход и биоаналитическая стратегия для разработки препаратов на основе шаперонов» . Открытый биохимический журнал . 2 : 44–48. дои : 10.2174/1874091X00802010044 . ПМК 2570550 . ПМИД 18949074 .
- ^ Мейер, Вероника Р.; Мейер, Вероника Р. (2010). Практическая высокоэффективная жидкостная хроматография (5-е изд.). Чичестер: Уайли. ISBN 978-0-470-68218-0 .
- ^ Брукс Д.Э., Хейнс К.А., Хритку Д. и др. (июнь 2000 г.). «Эксклюзионная хроматография не требует пор» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (13): 7064–7. Бибкод : 2000PNAS...97.7064B . дои : 10.1073/pnas.120129097 . JSTOR 122767 . ПМК 16499 . ПМИД 10852951 .
- ^ Мюллер М.Б., Шмитт Д., Фриммель Ф.Х. (1 декабря 2000 г.). «Фракционирование природных органических веществ методом эксклюзионной хроматографии - свойства и стабильность фракций». Энвайрон Сай Технол . 34 (23): 4867–4872. Бибкод : 2000EnST...34.4867M . дои : 10.1021/es000076v .
- ^ Перейти обратно: а б с Скуг Д.А., Холлер Ф.Дж., Крауч С.Р. (2006). «Гл. 28. Жидкостная хроматография» (PDF) . Принципы инструментального анализа (6-е изд.). Бельмонт, Калифорния: Томсон Брукс/Коул. п. 816. ИСБН 9780495012016 . LCCN 2006926952 . OCLC 77224390 .
- ^ Руссак А, Руссак Ф (2000). Химический анализ: современные инструментальные методы и приемы (англ. изд.). Чичестер: Уайли. С. 101–103 . ISBN 978-0471972617 . OCLC 635171657 .
- ^ Перейти обратно: а б Баллоу Д.П., Бенор М., Нинфа А.Дж. (2008). Фундаментальные лабораторные подходы к биохимии и биотехнологии (2-е изд.). Хобокен, Нью-Джерси: Уайли. стр. 127–129. ISBN 9780470087664 .
- ^ Токарный станок GH, Рутвен CR (август 1955 г.). «Разделение веществ по молекулярной массе с помощью колонок крахмала и воды» . Биохимический журнал . 60 (4): xxxiv. ПМЦ 1216175 . ПМИД 13249976 .
- ^ Токарный станок GH, Рутвен CR (апрель 1956 г.). «Разделение веществ и оценка их относительных молекулярных размеров с помощью столбиков крахмала в воде» . Биохимический журнал . 62 (4): 665–74. дои : 10.1042/bj0620665 . ПМЦ 1215979 . ПМИД 13315231 .
- ^ «Лауреаты премии Джона Скотта с 1822 года по настоящее время» . garfield.library.upenn.edu . Проверено 3 января 2019 г.
- ^ Порат Дж., Флодин П. (июнь 1959 г.). «Гель-фильтрация: метод обессоливания и группового разделения». Природа . 183 (4676): 1657–9. Бибкод : 1959Natur.183.1657P . дои : 10.1038/1831657a0 . PMID 13666849 . S2CID 32287460 .
- ^ Эйзенштейн М (2006). «Приключения в матрице» . Природные методы . 3 (5): 410. doi : 10.1038/nmeth0506-410 . ISSN 1548-7105 . S2CID 37935968 .
- ^ Мур Дж. К. (1964). «Гель-проникающая хроматография. I. Новый метод молекулярно-массового распределения высоких полимеров». J Polym Sci А. 2 (2): 835–843. дои : 10.1002/pol.1964.100020220 . ISSN 1542-6246 .
- ^ Стригель А., Яу В.В., Киркланд Дж.Дж., Блай Д.Д. (2009). Современная эксклюзионная жидкостная хроматография: практика гель-проникающей и гель-фильтрационной хроматографии (2-е изд.). Хобокен, Нью-Джерси: Уайли. ISBN 9780470442876 . OCLC 587401945 .
- ^ Грубишич З., Ремпп П., Бенуа Х. (1967). «Универсальная калибровка для гель-проникающей хроматографии». J Polym Sci B. 5 (9): 753–759. Бибкод : 1967JPoSL...5..753G . дои : 10.1002/pol.1967.110050903 . ISSN 1542-6254 .
- ^ Сан Т., Ченс Р.Р., Грэссли В.В., Лозе DJ (2004). «Исследование принципа разделения в эксклюзионной хроматографии». Макромолекулы . 37 (11): 4304–4312. Бибкод : 2004МаМол..37.4304S . дои : 10.1021/ma030586k . ISSN 0024-9297 .
- ^ Ван Ю, Тераока И, Хансен Ф.Ю. и др. (2010). «Теоретическое исследование принципа разделения в эксклюзионной хроматографии». Макромолекулы . 43 (3): 1651–1659. Бибкод : 2010MaMol..43.1651W . дои : 10.1021/ma902377g . ISSN 0024-9297 .
- ^ Кумар, Пранав (2018). Основы и методы биофизики и молекулярной биологии . Нью-Дели: Публикация Pathfinder. п. 05. ISBN 978-93-80473-15-4 .
- ^ «Эксклюзионная хроматография» . pslc.ws. Учебный центр полимерных наук (PSLC). 2005 . Проверено 3 января 2019 г.
- ^ Перейти обратно: а б Некоторые, Д; Амартели, Х; Цадок, А; Лебендикер, М (2019). «Характеристика белков с помощью эксклюзионной хроматографии в сочетании с многоугловым рассеянием света (SEC-MALS)» . Журнал визуализированных экспериментов . 2019 (148). дои : 10.3791/59615 . ПМИД 31282880 .
- ^ Вятт, Филип Дж. (1 февраля 1993 г.). «Светорассеяние и абсолютная характеристика макромолекул» . Аналитика Химика Акта . 272 (1): 1–40. дои : 10.1016/0003-2670(93)80373-S .
- ^ Подзимек, Степан (5 апреля 2014 г.). «Правда и мифы об определении молярно-массового распределения синтетических и природных полимеров методом эксклюзионной хроматографии» . Журнал прикладной науки о полимерах . 131 (7): 40111. doi : 10.1002/app.40111 .
- ^ Герольд К.Е., Расули А. (2009). Лаборатория на чипе: биомолекулярное разделение и анализ . Том. 2. Норфолк, Великобритания: Horizon Scientific Press. п. 170. ИСБН 9781904455462 . OCLC 430080586 .
