Нуклеозидтрифосфат
Нуклеозидтрифосфат нуклеозид, — это содержащий азотистое основание , связанное с 5-углеродным сахаром ( рибозой или дезоксирибозой ), с тремя фосфатными группами, связанными с сахаром. [1] Они являются молекулярными предшественниками ДНК и РНК , которые представляют собой цепочки нуклеотидов, образующиеся в процессе репликации и транскрипции ДНК . [2] Нуклеозидтрифосфаты также служат источником энергии для клеточных реакций. [3] и участвуют в сигнальных путях. [4]
Нуклеозидтрифосфаты плохо усваиваются, поэтому обычно они синтезируются внутри клетки. [5] Пути синтеза различаются в зависимости от конкретного образующегося нуклеозидтрифосфата, но, учитывая множество важных ролей нуклеозидтрифосфатов, синтез во всех случаях строго регулируется. [6] Аналоги нуклеозидов также можно использовать для лечения вирусных инфекций. [7] Например, азидотимидин (АЗТ) представляет собой аналог нуклеозида, используемый для профилактики и лечения ВИЧ/СПИДа . [8]
Мы
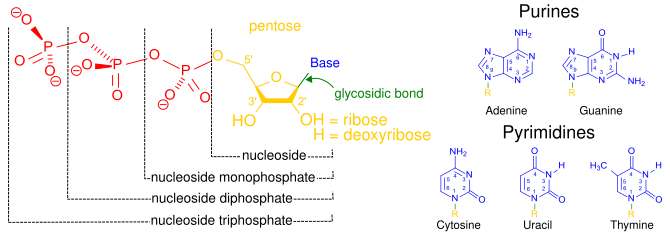
[ редактировать ]Термин нуклеозид относится к азотистому основанию, связанному с 5-углеродным сахаром ( рибозой или дезоксирибозой ). [1] Нуклеотиды — это нуклеозиды, ковалентно связанные с одной или несколькими фосфатными группами . [9] Чтобы предоставить информацию о количестве фосфатов, нуклеотиды можно вместо этого называть нуклеозидными (моно-, ди- или три)фосфатами. [10] Таким образом, нуклеозидтрифосфаты представляют собой разновидность нуклеотидов. [10]
Нуклеотиды обычно обозначаются тремя буквами (4 или 5 в случае дезокси- или дидезокси-нуклеотидов). Первая буква указывает на идентичность азотистого основания (например, А — аденин , G — гуанин ), вторая буква — количество фосфатов (моно, ди, три), а третья буква — Р, обозначающая фосфат. [11] Нуклеозидтрифосфаты, содержащие рибозу в качестве сахара, обычно обозначаются сокращенно NTP, а нуклеозидтрифосфаты, содержащие dNTP . в качестве сахара дезоксирибозу, сокращенно обозначаются как Например, dATP означает дезоксирибозоаденозинтрифосфат. NTPs являются строительными блоками РНК , а dNTPs являются строительными блоками ДНК . [12]
Углероды сахара в нуклеозидтрифосфате пронумерованы вокруг углеродного кольца, начиная с исходного карбонила сахара. Обычно за номерами атомов углерода в сахаре следует штрих ('), чтобы отличить их от атомов углерода азотистого основания. Азотистое основание связано с углеродом 1' посредством гликозидной связи , а фосфатные группы ковалентно связаны с углеродом 5'. [13] Первая фосфатная группа, связанная с сахаром, называется α-фосфатом, вторая — β-фосфатом, а третья — γ-фосфатом; они связаны друг с другом двумя фосфоангидридными связями. [14]
Синтез ДНК и РНК
[ редактировать ]
Клеточные процессы репликации и транскрипции ДНК включают синтез ДНК и РНК соответственно. Синтез ДНК использует dNTP в качестве субстратов, а синтез РНК использует rNTP в качестве субстратов. [2] NTP не могут быть преобразованы непосредственно в dNTP. ДНК содержит четыре различных азотистых основания: аденин , гуанин , цитозин и тимин . РНК также содержит аденин, гуанин и цитозин, но заменяет тимин урацилом . [15] Таким образом, для синтеза ДНК требуются dATP, dGTP, dCTP и dTTP в качестве субстратов, тогда как для синтеза РНК требуются АТФ, GTP, CTP и UTP.
Синтез нуклеиновой кислоты катализируется либо ДНК-полимеразой , либо РНК-полимеразой для синтеза ДНК и РНК соответственно. [16] Эти ферменты ковалентно связывают свободную группу -OH на 3'-углероде растущей цепи нуклеотидов с α-фосфатом на 5'-углероде следующего (d)NTP, высвобождая β- и γ-фосфатные группы в виде пирофосфата ( ПП и ). [17] Это приводит к образованию фосфодиэфирной связи между двумя (d)NTP. Высвобождение PP i обеспечивает энергию, необходимую для протекания реакции. [17] Важно отметить, что синтез нуклеиновых кислот происходит исключительно в направлении от 5’ к 3’ .
Метаболизм нуклеозидтрифосфата
[ редактировать ]Учитывая их важность в клетке, синтез и распад нуклеозидтрифосфатов находятся под строгим контролем. [6] В этом разделе основное внимание уделяется метаболизму нуклеозидтрифосфатов у людей, но этот процесс довольно консервативен среди видов. [18] Нуклеозидтрифосфаты плохо усваиваются, поэтому все нуклеозидтрифосфаты обычно производятся de novo . [19] Синтез АТФ и ГТФ ( пуринов ) отличается от синтеза ЦТФ, ТТФ и УТФ ( пиримидинов ). В синтезе пуринов и пиримидинов используется фосфорибозилпирофосфат (PRPP). в качестве исходной молекулы [20]
Преобразование NTP в dNTP может осуществляться только в дифосфатной форме. Обычно из NTP удаляется один фосфат, чтобы стать NDP, затем он преобразуется в dNDP с помощью фермента, называемого рибонуклеотидредуктазой , затем фосфат добавляется обратно, чтобы получить dNTP. [21]
Синтез пуринов
[ редактировать ]Азотистое основание, называемое гипоксантин, собирается непосредственно на PRPP. [22] В результате образуется нуклеотид, называемый инозинмонофосфатом (ИМФ). Затем IMP преобразуется либо в предшественник AMP, либо в GMP. После образования АМФ или ГМФ они могут фосфорилироваться АТФ до дифосфатной и трифосфатной форм. [23]
Синтез пуринов регулируется аллостерическим ингибированием образования ИМФ адениновыми или гуаниновыми нуклеотидами. [24] АМФ и ГМФ также конкурентно ингибируют образование своих предшественников из ИМФ. [25]
Синтез пиримидина
[ редактировать ]Азотистое основание, называемое оротатом, синтезируется независимо от PRPP. [25] После образования оротата он ковалентно присоединяется к PRPP. В результате образуется нуклеотид, называемый оротатмонофосфатом (OMP). [26] ОМП превращается в УМФ, который затем фосфорилируется АТФ до УДФ и УТФ. Затем UTP можно превратить в CTP с помощью реакции дезаминирования . [27] ТТП не является субстратом для синтеза нуклеиновых кислот, поэтому он не синтезируется в клетке. Вместо этого dTTP производится косвенно из dUDP или dCDP после преобразования в их соответствующие формы дезоксирибозы. [20]
Синтез пиримидина регулируется аллостерическим ингибированием синтеза оротата УДФ и УТФ. PRPP и АТФ также являются аллостерическими активаторами синтеза оротата. [28]
Рибонуклеотидредуктаза
[ редактировать ]Рибонуклеотидредуктаза (RNR) — это фермент, ответственный за преобразование NTP в dNTP. Учитывая, что dNTPs используются при репликации ДНК, активность RNR жестко регулируется. [6] Важно отметить, что RNR может обрабатывать только NDP, поэтому NTP сначала дефосфорилируются до NDP, а затем преобразуются в dNDP. [29] Затем dNDP обычно повторно фосфорилируются. RNR имеет 2 субъединицы и 3 сайта: каталитический сайт, сайт активности (А) и сайт специфичности (S). [29] Каталитический сайт — это место, где происходит реакция NDP с dNDP, сайт активности определяет, активен ли фермент, а сайт специфичности определяет, какая реакция происходит в каталитическом сайте.
Сайт активности может связывать либо АТФ, либо дАТФ. [30] Когда он связан с АТФ, RNR активен. Когда АТФ или дАТФ связаны с S-сайтом, RNR будет катализировать синтез dCDP и dUDP из CDP и UDP. dCDP и dUDP могут косвенно создавать dTTP. dTTP, связанный с сайтом S, будет катализировать синтез dGDP из GDP, а связывание dGDP с сайтом S будет способствовать синтезу dADP из ADP. [31] Затем dADP фосфорилируется с образованием dATP, который может связываться с сайтом A и отключать RNR. [30]
Другие клеточные роли
[ редактировать ]АТФ как источник клеточной энергии
[ редактировать ]
АТФ является основной энергетической валютой клетки. [32] Несмотря на то, что он синтезируется посредством описанного выше метаболического пути, в основном он синтезируется как во время клеточного дыхания, так и в ходе клеточного дыхания. [33] и фотосинтез [34] посредством АТФ-синтазы . АТФ-синтаза связывает синтез АТФ из АДФ и фосфата с электрохимическим градиентом , создаваемым перекачкой протонов через внутреннюю мембрану митохондрий (клеточное дыхание) или через тилакоидную мембрану (фотосинтез). [35] Этот электрохимический градиент необходим, поскольку образование АТФ энергетически невыгодно .
Гидролиз АТФ до АДФ и Р i протекает следующим образом: [36]
Эта реакция энергетически выгодна и выделяет 30,5 кДж/моль энергии. [3] В клетке эта реакция часто сочетается с неблагоприятными реакциями, обеспечивающими энергию для их протекания. [37] GTP иногда используется для энергетической связи аналогичным образом. [38]

Передача сигнала GTP
[ редактировать ]GTP необходим для передачи сигналов , особенно с G-белками . G-белки связаны с рецептором, связанным с клеточной мембраной. [4] Весь этот комплекс называется рецептором, связанным с G-белком (GPCR). G-белки могут связывать либо GDP, либо GTP. Будучи связанными с GDP, G-белки неактивны. Когда лиганд связывает GPCR, запускается аллостерическое изменение в G-белке, в результате чего GDP уходит и заменяется GTP. [39] GTP активирует альфа-субъединицу белка G, заставляя ее диссоциировать от белка G и действовать как нижестоящий эффектор. [39]
Нуклеозидные аналоги
[ редактировать ]Аналоги нуклеозидов можно использовать для лечения вирусных инфекций . [40] Аналоги нуклеозидов — это нуклеозиды, структурно подобные (аналогичные) нуклеозидам, используемым в синтезе ДНК и РНК. [41] Как только эти аналоги нуклеозидов попадают в клетку, они могут фосфорилироваться вирусным ферментом. Полученные нуклеотиды достаточно похожи на нуклеотиды, используемые в синтезе ДНК или РНК, чтобы их можно было включать в растущие цепи ДНК или РНК, но у них нет доступной 3'-ОН-группы для присоединения следующего нуклеотида, что приводит к обрыву цепи . [42] Это можно использовать в терапевтических целях при вирусных инфекциях, поскольку вирусная ДНК-полимераза распознает определенные аналоги нуклеотидов с большей готовностью, чем эукариотическая ДНК-полимераза. [40] Например, азидотимидин используется при лечении ВИЧ/СПИДа . [8] Некоторые менее селективные аналоги нуклеозидов можно использовать в качестве химиотерапевтических средств для лечения рака. [43] такие как цитозин арабиноза (ara-C) при лечении некоторых форм лейкемии . [7]
Устойчивость к аналогам нуклеозидов распространена и часто обусловлена мутацией фермента, который фосфорилирует нуклеозид после проникновения в клетку. [7] Это часто встречается в аналогах нуклеозидов, используемых для лечения ВИЧ/СПИДа. [44]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б «Нуклеотиды и основания – поколение генетики» . Генетическое поколение . Проверено 11 ноября 2017 г.
- ^ Перейти обратно: а б Чаргафф Э (2 декабря 2012 г.). Нуклеиновые кислоты . Эльзевир. ISBN 9780323144773 .
- ^ Перейти обратно: а б «Обзор гидролиза АТФ» . Ханская академия . Архивировано из оригинала 1 декабря 2017 г. Проверено 11 ноября 2017 г.
- ^ Перейти обратно: а б «ГПКР» . Возбудимый . 2014.
- ^ «Употребление ДНК: диетические нуклеотиды в питании» . Вызов Медового гида . 09.04.2014 . Проверено 11 ноября 2017 г.
- ^ Перейти обратно: а б с Вингаарден Дж. Б. (1976). «Регуляция биосинтеза и обмена пуринов». Достижения в регуляции ферментов . 14 : 25–42. дои : 10.1016/0065-2571(76)90006-6 . ПМИД 184697 .
- ^ Перейти обратно: а б с Гальмарини СМ, Макки-младший, Дюмонте С (2001). «Аналоги нуклеозидов: механизмы лекарственной устойчивости и стратегии обращения». Лейкемия . 15 (6): 875–90. дои : 10.1038/sj.leu.2402114 . ПМИД 11417472 . S2CID 760764 .
- ^ Перейти обратно: а б «Монография по зидовудину для профессионалов — Drugs.com» . Наркотики.com . Проверено 30 ноября 2017 г.
- ^ Лодиш Х., Берк А., Зипурски С.Л., Мацудайра П., Балтимор Д., Дарнелл Дж. (2000). Структура нуклеиновых кислот .
- ^ Перейти обратно: а б Секретарь Дж.А. (май 2001 г.). «Номенклатура нуклеозидов и нуклеотидов» (PDF) . Современные протоколы химии нуклеиновых кислот . Приложение 1: A.1D.1–A.1D.3. дои : 10.1002/0471142700.nca01ds00 . hdl : 2027.42/143595 . ПМИД 18428808 . S2CID 205152902 .
- ^ «Номенклатура нуклеозидов» . www.biochem.uthscsa.edu . Проверено 11 ноября 2017 г.
- ^ «От ДНК к РНК и белку, как это работает?» . Объяснение науки . Проверено 11 ноября 2017 г.
- ^ «Соглашение о нумерации нуклеотидов» . www.biosyn.com . Проверено 11 ноября 2017 г.
- ^ «SparkNotes: Репликация и восстановление ДНК: Химия добавления субстратов репликации ДНК» . www.sparknotes.com . Проверено 11 ноября 2017 г.
- ^ «Знаете ли вы разницу между ДНК и РНК?» . МысльКо . Проверено 11 ноября 2017 г.
- ^ «Разница между ДНК-полимеразой и РНК-полимеразой» . 24 декабря 2011 г. Проверено 11 ноября 2017 г.
- ^ Перейти обратно: а б Лодиш Х., Берк А., Зипурски С.Л., Мацудайра П., Балтимор Д., Дарнелл Дж. (2000). Синтез нуклеиновых кислот .
- ^ Самант С., Ли Х., Гассеми М., Чен Дж., Кук Дж.Л., Манкин А.С., Нейфах А.А. (февраль 2008 г.). «Биосинтез нуклеотидов имеет решающее значение для роста бактерий в крови человека» . ПЛОС Патогены . 4 (2): е37. doi : 10.1371/journal.ppat.0040037 . ПМК 2242838 . ПМИД 18282099 .
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2002). Биосинтез нуклеотидов .
- ^ Перейти обратно: а б «Метаболизм нуклеотидов: синтез нуклеиновых кислот» . themedicalbiochemistrypage.org . Проверено 15 ноября 2017 г.
- ^ Стуббе Дж (1990). «Рибонуклеотидредуктазы: удивительно и запутанно» (PDF) . Журнал биологической химии . 265 (10): 5329–32. дои : 10.1016/S0021-9258(19)39357-3 . ПМИД 2180924 .
- ^ Берг Дж., Тимочко Дж.Л., Страйер Л. (2002). Пуриновые основания могут быть синтезированы заново или переработаны путями утилизации .
- ^ «Синтез пуринов: синтез пуриновых рибонуклеотидов» . БиохимДен.com . 16 марта 2016 г. Проверено 15 ноября 2017 г.
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2002). Ключевые этапы биосинтеза нуклеотидов регулируются ингибированием по обратной связи .
- ^ Перейти обратно: а б Нирлих Д.П., Магасаник Б (1965). «Регуляция синтеза пуриновых рибонуклеотидов путем ингибирования конечного продукта. Влияние адениновых и гуанинрибонуклеотидов на 5'-фосфорибозил-пирофосфат-амидотрансферазу aerobacter aerogenes» . Журнал биологической химии . 240 : 358–65. дои : 10.1016/S0021-9258(18)97657-X . ПМИД 14253438 .
- ^ Моффатт Б.А., Ашихара Х (апрель 2002 г.). «Синтез и метаболизм пуриновых и пиримидиновых нуклеотидов» . Книга «Арабидопсис» . 1 : е0018. дои : 10.1199/tab.0018 . ПМЦ 3243375 . ПМИД 22303196 .
- ^ «Пиримидиновый обмен» . www.cliffsnotes.com . Проверено 15 ноября 2017 г.
- ^ Лейн А.Н., Фан Т.В. (февраль 2015 г.). «Регуляция метаболизма и биосинтеза нуклеотидов млекопитающих» . Исследования нуклеиновых кислот . 43 (4): 2466–85. дои : 10.1093/nar/gkv047 . ПМЦ 4344498 . ПМИД 25628363 .
- ^ Перейти обратно: а б Кольберг М., Странд К.Р., Графф П., Андерссон К.К. (июнь 2004 г.). «Структура, функции и механизм рибонуклеотидредуктазы». Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1699 (1–2): 1–34. дои : 10.1016/j.bbapap.2004.02.007 . ПМИД 15158709 .
- ^ Перейти обратно: а б Ахмад М.Ф., Дилвис К.Г. (2013). «Структурная основа аллостерической регуляции рибонуклеотидредуктазы». Олигомеризация в здоровье и болезни . Прогресс молекулярной биологии и трансляционной науки. Том. 117. С. 389–410. дои : 10.1016/B978-0-12-386931-9.00014-3 . ISBN 9780123869319 . ПМК 4059395 . ПМИД 23663976 .
- ^ Фэйрман Дж.В., Виджератна С.Р., Ахмад М.Ф., Сюй Х., Накано Р., Джа С., Прендергаст Дж., Велин Р.М., Флодин С., Роос А., Нордлунд П., Ли З., Уолц Т., Дилвис К.Г. (март 2011 г.). «Структурные основы аллостерической регуляции рибонуклеотидредуктазы человека путем олигомеризации, индуцированной нуклеотидами» . Структурная и молекулярная биология природы . 18 (3): 316–22. дои : 10.1038/nsmb.2007 . ПМК 3101628 . ПМИД 21336276 .
- ^ «АТП» . Возбудимый .
- ^ «Митохондрии, клеточная энергия, АТФ-синтаза» . Возбудимый .
- ^ «Синтез АТФ» . Растения в действии . Проверено 12 ноября 2017 г.
- ^ Йонкхир А.И., Смейтинк Дж.А., Роденбург Р.Дж. (март 2012 г.). «Митохондриальная АТФ-синтаза: архитектура, функции и патология» . Журнал наследственных метаболических заболеваний . 35 (2): 211–25. дои : 10.1007/s10545-011-9382-9 . ПМЦ 3278611 . ПМИД 21874297 .
- ^ Диттрих М., Хаяши С., Шультен К. (октябрь 2003 г.). «О механизме гидролиза АТФ в F1-АТФазе» . Биофизический журнал . 85 (4): 2253–66. Бибкод : 2003BpJ....85.2253D . дои : 10.1016/S0006-3495(03)74650-5 . ПМЦ 1303451 . ПМИД 14507690 .
- ^ «АТФ: аденозинтрифосфат | Безграничная биология» . курсы.lumenlearning.com-США . Проверено 12 ноября 2017 г.
- ^ Карвалью А.Т., Селер К., Вавицас К., Аквист Дж., Камерлин С.С. (сентябрь 2015 г.). «Моделирование механизмов биологического гидролиза ГТФ» . Архив биохимии и биофизики . Специальный выпуск компьютерного моделирования биологических систем. 582 (Приложение С): 80–90. дои : 10.1016/j.abb.2015.02.027 . ПМИД 25731854 .
- ^ Перейти обратно: а б «Рецептор, связанный с G-белком (GPCR) | биохимия» . Британская энциклопедия . Проверено 12 ноября 2017 г.
- ^ Перейти обратно: а б «Аналоги нуклеозидов» . Молекулы . Проверено 13 ноября 2017 г.
- ^ Йордхейм Л.П., Дюрантел Д., Зулим Ф., Дюмонте К. (июнь 2013 г.). «Достижения в разработке аналогов нуклеозидов и нуклеотидов для лечения рака и вирусных заболеваний». Обзоры природы. Открытие наркотиков . 12 (6): 447–64. дои : 10.1038/nrd4010 . ПМИД 23722347 . S2CID 39842610 .
- ^ Эвальд Б., Сампат Д., Планкетт В. (октябрь 2008 г.). «Аналоги нуклеозидов: молекулярные механизмы, сигнализирующие о гибели клеток». Онкоген . 27 (50): 6522–37. дои : 10.1038/onc.2008.316 . ПМИД 18955977 . S2CID 23817516 .
- ^ Гальмарини CM, Макки-младший, Дюмонте C (июль 2002 г.). «Аналоги нуклеозидов и азотистые основания в лечении рака». «Ланцет». Онкология . 3 (7): 415–24. дои : 10.1016/s1470-2045(02)00788-x . ПМИД 12142171 .
- ^ Менендес-Ариас Л. (июнь 2008 г.). «Механизмы устойчивости к нуклеозидным аналогам-ингибиторам обратной транскриптазы ВИЧ-1». Вирусные исследования . 134 (1–2): 124–46. doi : 10.1016/j.virusres.2007.12.015 . ПМИД 18272247 .
