Вибутозин
 | |
| Имена | |
|---|---|
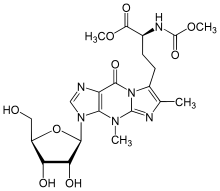
| Название ИЮПАК Метил (2 S )-4-(3,4''-диметил-3 H -имидазо[1'',2'':1,2]инозин-5''-ил)-2-[(метоксикарбонил)амино ]бутаноат | |
| Систематическое название ИЮПАК Метил (2 S )-4-{3-[(2 R ,3 R ,4 S ,5 R )-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-4,6-диметил- 9-оксо-4,9-дигидро- 3H- имидазо[1,2 -а ]пурин-7-ил}-2-[(метоксикарбонил)амино]бутаноат | |
| Идентификаторы | |
3D model ( JSmol ) | |
| Сокращения | yW |
| ЧЭБИ | |
| ХимическийПаук | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 21 Н 28 Н 6 О 9 | |
| Молярная масса | 508.488 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
В биохимии , вибутозин ( yW ) представляет собой сильно модифицированный нуклеозид фенилаланина синтеза транспортной РНК который стабилизирует взаимодействия между кодонами и антикодонами во время белка . [1] [2] Обеспечение точного синтеза белка имеет важное значение для поддержания здоровья, поскольку дефекты модификаций тРНК могут вызывать заболевания. У эукариотических организмов он обнаружен только в положении 37, 3'-смежном с антикодоном фенилаланиновой тРНК. Вибутозин обеспечивает правильную трансляцию за счет стабилизации пары оснований кодон-антикодон во время процесса декодирования. [3]
Биосинтетический путь
[ редактировать ]На модели S. cerevisiae был предложен путь биосинтеза вибутозина. В ходе мультиферментативного процесса на первом этапе синтеза участвует фермент N1-метилтрансфераза TRM5, который метилирует участок G37 фенилаланиновой тРНК и превращает его в m1G37. Затем m1G37 действует как субстрат для фермента TYW1 и, используя пируват в качестве источника C-3, образует трициклическое ядро вибутозина с флавинмононуклеотидом (FMN) в качестве кофактора. Затем фермент TYW2 переносит α-амино-α-карбоксипропильную группу из Ado-Met, обычного субстрата, участвующего в переносе метильных групп, на боковую боковую цепь в положении C-7 yW-187 с образованием yW-86. TYW3 действует как катализатор метилирования N-4 yW-86 с образованием yW-72. TYW4 и Ado-Met-зависимая карбоксиметилтрансфераза затем метилируют α-карбоксигруппу yW-72 с образованием yW-57. Наконец, благодаря предсказанной второй функции TYW4 или других неидентифицированных факторов метоксикарбонилирование α-аминогруппы боковой цепи yW-58 дает вибутозин. [4]

Вибутозин был синтезирован химическим путем. [5] [6]
Гипермодификация и роль в стабилизации РНК
[ редактировать ]Было высказано предположение, что вибутозин и другие неприродные нуклеозиды приводят к единственному результату - гипермодификации. Эта гипермодификация в положении 37 тРНК Пхе может обеспечить взаимодействие базового стека, которое играет ключевую роль в поддержании рамки считывания. [7] Благодаря большим ароматическим группам усиливается взаимодействие с соседними основаниями A36 и A38, что помогает ограничить гибкость антикодона. [8] Было обнаружено, что когда тРНК Пхе отсутствует вибутозин, происходит усиление сдвига рамки считывания. Как правило, модификации в положении 37 предотвращают спаривание оснований с соседними нуклеотидами, помогая поддерживать и открывать конформацию петли, а также создавая петлю антикодона для декодирования. Вибутозиновая модификация тРНК. Пхе обнаружено, что он консервативен у архей и эукариев, но не обнаружен у бактерий.Исследования 1960-х и 1970-х годов показали, что многие мутации могут привести к проблемам с точностью перевода. Дальнейшее изучение механизмов, участвующих в точности трансляции, выявило важность модификаций в положениях 34 и 37 тРНК. Независимо от вида эти участки тРНК почти всегда модифицированы. Тот факт, что вибутозин и его различные производные обнаруживаются только в положении 37, может указывать на природу кодонов фенилаланина, UUU и UUC, и их склонность к проскальзыванию рибосом . [9] Это привело к предположению, что тРНК Пхе модификация в положении 37 коррелирует с количеством полиуридиновых скользких последовательностей, обнаруженных в геномах. [10]
Потенциал смены рамок
[ редактировать ]Роль вибутозина в предотвращении сдвига рамки считывания вызвала некоторые вопросы относительно его важности, поскольку существуют и другие стратегии, помимо модификации с помощью yW, для предотвращения сдвига рамки. У дрозофилы модификация в положении 37 отсутствует, тогда как у млекопитающих там модифицируется yW. Чтобы объяснить эту изменчивость, возникла идея потенциала сдвига рамки. Это означает, что клетки используют сдвиг кадра как механизм саморегуляции, а не пытаются постоянно избегать сдвига кадра. [11] Было высказано предположение, что сдвиг кадра может использоваться программным способом, возможно, для увеличения разнообразия кодирования.
Ссылки
[ редактировать ]- ^ Нома А., Кирино Ю., Икеучи Ю., Сузуки Т. (2006). «Биосинтез вибутозина, гипермодифицированного нуклеозида в эукариотической фенилаланиновой тРНК» . ЭМБО Дж . 25 (10): 2142–54. дои : 10.1038/sj.emboj.7601105 . ПМК 1462984 . ПМИД 16642040 .
- ^ Перш-Летюве, Фанели; Молле, Тибо; Форухар, Фархад; Мулье, Этьен; Атта, Мохамед (2 декабря 2014 г.). «Биосинтез вибутозина: структурный и механистический обзор» . Биология РНК . 11 (12): 1508–1518. дои : 10.4161/15476286.2014.992271 . ПМЦ 4615248 . ПМИД 25629788 .
- ^ Сузуки, Йоко; Нома, Акико; Сузуки, Цутому; Сенда, Мики; Сенда, Тошия; Ишитани, Рюичиро; Нуреки, Осаму (октябрь 2007 г.). «Кристаллическая структура радикального фермента SAM, катализирующего образование трициклических модифицированных оснований в тРНК». Журнал молекулярной биологии . 372 (5): 1204–1214. дои : 10.1016/j.jmb.2007.07.024 . ПМИД 17727881 .
- ^ Jump up to: а б Янг, Энтони П.; Бандарян, Ваге (2018). «TYW1: радикальный фермент SAM, участвующий в биосинтезе оснований вибутозина». Радикальные ферменты SAM . Методы энзимологии. Том. 606. стр. 119–153. дои : 10.1016/bs.mie.2018.04.024 . ISBN 978-0-12-812794-0 . ПМК 6448148 . ПМИД 30097090 .
- ^ Итая Т., Канаи Т., Иида Т. (2002). «Практический синтез вибутозина, гипермодифицированного нуклеозида дрожжей, переносящего фенилаланин рибонуклеиновую кислоту» . хим. Фарм. Бык . 50 (4): 530–3. дои : 10.1248/cpb.50.530 . ПМИД 11964003 .
- ^ Хинцш А., Деймл С., Рейтер В., Карелл Т. (2013). «Полный синтез гипермодифицированных оснований РНК вибутозина и гидроксивибутозина и их количественная оценка вместе с другими модифицированными основаниями РНК в растительных материалах». Химия: Европейский журнал . 19 (13): 4244–8. дои : 10.1002/chem.201204209 . ПМИД 23417961 .
- ^ Хельм, М; Альфонсо, JD (2014). «Посттранскрипционные модификации РНК: метаболические игры в химическом Леголэнде клетки» . хим. Биол . 21 (2): 174–85. doi : 10.1016/j.chembiol.2013.10.015 . ПМК 3944000 . ПМИД 24315934 .
- ^ Стюарт, JW; Кошлап, К.М.; Гюнтер, Р; Агрис, ПФ (2003). «Естественная модификация ограничивает конформационное пространство антикодонового домена тРНК (Phe)». Дж Мол Биол . 334 (5): 901–18. дои : 10.1016/j.jmb.2003.09.058 . ПМИД 14643656 .
- ^ Кристиан, Т; Лахуд, Дж; Лю, С; Хоу, Ю.М. (2010). «Контроль каталитического цикла с помощью пары аналогичных ферментов модификации тРНК» . Дж Мол Биол . 400 (2): 204–17. дои : 10.1016/j.jmb.2010.05.003 . ПМЦ 2892103 . ПМИД 20452364 .
- ^ Джекман, Дж. Э.; Альфонсо, JD (2013). «Модификации транспортной РНК: игровая площадка природы в области комбинаторной химии» . РНК Wiley Interdiscip Rev. 4 (1): 35–48. дои : 10.1002/wrna.1144 . ПМК 3680101 . ПМИД 23139145 .
- ^ Ваас, Уильям Ф.; Друзина, Жанна; Ханан, Мелани; Шиммель, Пол (сентябрь 2007 г.). «Роль модификации основания тРНК и ее предшественников в сдвиге рамки у эукариот» . Журнал биологической химии . 282 (36): 26026–26034. дои : 10.1074/jbc.m703391200 . ПМИД 17623669 .