Биосинтез кобаламина
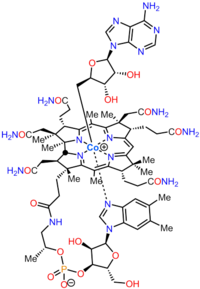

Биосинтез кобаламина – это процесс, посредством которого бактерии и археи производят кобаламин , витамин B12 . Преобразование аминолевулиновой кислоты посредством уропорфириногена III и аденозилкобировой кислоты в конечные формы, в которых она используется ферментами как организмов-продуцентов, так и других видов, включая людей, которые получают ее с пищей, включает множество этапов.
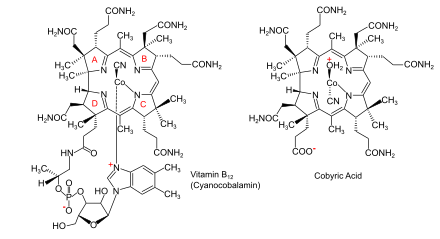
Особенность, которая отличает два основных пути биосинтеза , заключается в том, ли кобальт , находящийся в каталитическом участке кофермента , включается рано (у анаэробных организмов ) или поздно (у аэробных организмов ) и ли кислород требуется . В обоих случаях макроцикл , который образует координационный комплекс кобальта, с ионом представляет собой корриновое кольцо, в частности кольцо с семью карбоксилатными группами, называемое кобириновой кислотой. В дальнейшем лигируется на всех карбоксилатах, кроме одного, образуются амидные группы, образующие кобировую кислоту, а аденозильной группой кобальт . На заключительной стадии биосинтеза, общей для всех организмов, к одной свободной карбоксильной группе присоединяется боковая цепь аминопропанола и завершается сборка нуклеотидной петли, которая обеспечит второй лиганд для кобальта.
Многие виды прокариот не могут биосинтезировать аденозилкобаламин , но могут синтезировать его из кобаламина, который они усваивают из внешних источников. У людей пищевые источники кобаламина после приема внутрь связываются в виде транскобаламинов и преобразуются в коферментные формы, в которых они используются.
Кобаламин
[ редактировать ]Кобаламин (витамин B12 ) — самый крупный и структурно сложный витамин . Он состоит из модифицированного тетрапиррола , коррина, с центрально- хелатным ионом кобальта и обычно встречается в одной из двух биологически активных форм: метилкобаламина и аденозилкобаламина . У большинства прокариот , а также животных есть кобаламин-зависимые ферменты, которые используют его в качестве кофактора , тогда как растения и грибы его не используют. У бактерий и архей эти ферменты включают метионинсинтазу , рибонуклеотидредуктазу и метилмалонил-КоА-мутазы , этаноламинаммиаклиазу и диолдегидратазу , глутаматную . [1] У некоторых млекопитающих кобаламин поступает с пищей и необходим для синтеза метионина и мутазы метилмалонил-КоА . [2] У человека он играет важную роль в метаболизме фолиевой кислоты и в синтезе промежуточного продукта цикла лимонной кислоты , сукцинил-КоА . [3]
Обзор биосинтеза кобаламина
[ редактировать ]существует по крайней мере два различных пути биосинтеза кобаламина У бактерий : [4]
 |  |
- Аэробный путь, которому необходим кислород и в котором кобальт вводится поздно; [6] [7] обнаружен у Pseudomonas denitrificans и Rhodobacter capsulatus .
- Анаэробный путь, при котором введение кобальта является первым важным шагом на пути к синтезу кобаламина; [8] [9] [10] обнаружен у Salmonella typhimurium , Bacillus megaterium и Propionibacterium freudenreichii subsp. шермании .
Любой путь можно разделить на две части:
- Синтез корринового кольца, приводящий к образованию кобириновой кислоты с семью карбоксилатными группами. При анаэробном пути он уже содержит кобальт, но при аэробном пути материал, образующийся на этой стадии, представляет собой гидробириновую кислоту без связанного кобальта. [11] [12] [5]
- Введение кобальта там, где его еще нет; образование амидов по всем карбоксилатным группам, кроме одной, с образованием кобировой кислоты; присоединение аденозильной группы в качестве лиганда к кобальту; присоединение боковой цепи аминопропанола к одной свободной карбоксильной группе и сборка нуклеотидной петли, которая обеспечит второй лиганд для кобальта. [5] [13]
Дальнейший тип синтеза происходит через путь спасения , при котором внешние корриноиды абсорбируются с образованием B 12 . [5] Известно, что виды из следующих родов и следующие отдельные виды синтезируют кобаламин: Propionibacterium shermanii, Pseudomonas denitrificans , Streptomyces griseus , Acetobacterium , Aerobacter , Agrobacterium , Alcaligenes , Azotobacter , Bacillus , Clostridium , Corynebacterium , Flavobacterium , Lactobacillus . , Микромоноспора , Микобактерия , Нокардия , Протей , Ризобиумы , сальмонеллы , серратии , стрептококки и ксантомонады . [14] [15]
Подробности этапов образования уропорфириногена III
[ редактировать ]На ранних стадиях биосинтеза тетрапиррольная структурная основа создается ферментами деаминазой и косинтетазой , которые преобразуют аминолевулиновую кислоту через порфобилиноген и гидроксиметилбилан в уропорфириноген III . Последний является первым макроциклическим промежуточным соединением, общим для гема , хлорофилла , сирогема и самого кобаламина. [7] [16] [17]
Детали этапов от уропорфириногена III до а,с-диамида коб(II)ириновой кислоты в аэробных организмах
[ редактировать ]Биосинтез кобаламина отличается от биосинтеза гема и хлорофилла в уропорфриногене III: его трансформация включает последовательное присоединение метильных (СН 3 ) групп с образованием промежуточных продуктов, которым были даны тривиальные названия в зависимости от количества включенных групп. Следовательно, первый промежуточный продукт — прекоррин-1, следующий — прекоррин-2 и так далее. Включение всех восьми дополнительных метильных групп, встречающихся в кобировой кислоте, исследовали с помощью 13 C- метил-меченный S-аденозилметионин . Только когда ученые из Рон-Пуленк Рорер использовали генетически модифицированный штамм Pseudomonas denitrificans , в котором восемь генов початка , участвующих в биосинтезе витамина, были сверхэкспрессированы , удалось определить полную последовательность метилирования и других этапов. , таким образом полностью устанавливая все промежуточные соединения на пути. [18] [19]
От уропорфириногена III до прекоррина-2
[ редактировать ]Фермент CobA катализирует два метилирования с образованием прекоррина-2 : [20]
- (1a) уропорфириноген III + S-аденозилметионин прекоррин-1 + S-аденозил-L-гомоцистеин
- (1b) прекоррин-1 + S-аденозилметионин прекоррин-2 + S-аденозил-L-гомоцистеин
От прекоррина-2 к прекоррину-3А
[ редактировать ]Затем фермент CobI превращает его в прекоррин-3А: [18]
- прекоррин-2 + S-аденозилметионин прекоррин-3А + S-аденозил-L-гомоцистеин
От прекоррина-3А к прекоррину-3В
[ редактировать ]Далее фермент CobG превращает прекоррин-3A в прекоррин-3B: [18]
- прекоррин-3А + НАДН + Н + + Около 2 прекоррин-3Б + НАД + + Н 2 О
Этот фермент представляет собой оксидоредуктазу , которой необходим кислород, поэтому реакция может происходить только в аэробных условиях. Название этих прекорринов как 3А и 3В отражает тот факт, что каждый из них содержит на три метильные группы больше, чем уропорфириноген III, но с другой структурой: в частности, прекоррин-3В имеет внутреннее γ-лактоновое кольцо, образованное из замыкающейся боковой цепи уксусной кислоты кольца А. переходим к макроциклу.
От прекоррина-3В к прекоррину-4
[ редактировать ]Фермент CobJ продолжает тему внедрения метильной группы. Важно отметить, что на этом этапе макроцикла кольцо сжимается так, что продукт впервые содержит корриновое ядро, которое характеризует кобаламин. [18]
От прекоррина-4 к прекоррину-5
[ редактировать ]Вставки метильной группы продолжаются, поскольку фермент CobM действует на прекоррин-4: [21]
- прекоррин-4 + S-аденозилметионин прекоррин-5 + S-аденозил-L-гомоцистеин
Вновь вставленная метильная группа добавляется к кольцу C по углероду, присоединенному к метиленовому (CH 2 ) мостику кольца B. Это не окончательное ее расположение на кобаламине, поскольку более поздний этап включает ее перегруппировку на соседний углерод кольца.
От прекоррина-5 к прекоррину-6А
[ редактировать ]Фермент CobF теперь удаляет ацетильную группу, расположенную в положении 1 кольцевой системы прекоррина-4, и заменяет ее вновь введенной метильной группой. Название продукта, прекоррин-6А, отражает тот факт, что к этому моменту к уропорфириногену III было добавлено всего шесть метильных групп. Однако, поскольку один из них был экструдирован с ацетатной группой, структура прекоррина-6А содержит только оставшиеся пять. [21]
От прекоррина-6А к прекоррину-6В
[ редактировать ]Фермент CobK теперь восстанавливает двойную связь в кольце D с помощью НАДФН : [21]
- прекоррин-6А + НАДФН + Н + прекоррин-6Б + НАДФ +
Таким образом, прекоррин-6B отличается по структуре от прекоррина-6А только наличием двух дополнительных атомов водорода.
От прекоррина-6В к прекоррину-8
[ редактировать ]Фермент CobL имеет два активных центра: один катализирует присоединение двух метильных групп, а другой - декарбоксилирование группы CH 2 COOH в кольце D, так что этот заместитель становится простой метильной группой: [21]
От прекоррина-8 к гидробириновой кислоте
[ редактировать ]Фермент CobH катализирует реакцию перегруппировки, в результате чего метильная группа, добавленная к кольцу C, изомеризуется до своего конечного местоположения, что является примером внутримолекулярного переноса : [22]
- прекоррин-8X гидробиринат
От гидробириновой кислоты до а,с-диамида гидробириновой кислоты.
[ редактировать ]Следующий фермент этого пути, CobB , избирательно превращает две из восьми групп карбоновых кислот в их первичные амиды. АТФ используется для обеспечения энергии для образования амидной связи, при этом перенос аммиака происходит из глутамина : [23]
- гидробириновая кислота + 2 АТФ + 2 глутамин + 2 H 2 O гидробириновая кислота а,с-диамид + 2 АДФ + 2 фосфат + 2 глутаминовая кислота
От a,c-диамида гидробириновой кислоты до a,c-диамида cob(II)ириновой кислоты.
[ редактировать ]Включение кобальта(II) в макроцикл катализируется ферментом хелатазой кобальта (CobNST): [24]
- а,с-диамид гидробириновой кислоты + Co 2+ + АТФ + Н 2 О a,c-диамид cob(II)ириновой кислоты + АДФ + фосфат + H +
Именно на этом этапе происходит слияние аэробного и анаэробного путей, причем более поздние этапы химически идентичны.
Детали этапов от уропорфириногена III до а,с-диамида коб(II)ириновой кислоты в анаэробных организмах
[ редактировать ]Многие этапы, выходящие за рамки уропорфириногена III, у анаэробных организмов, таких как Bacillus megaterium, включают в себя химически сходные, но генетически отличные трансформации по сравнению с трансформациями аэробного пути. [10] [25]
От прекоррина-2 к кобальт-сирогидрохлорину
[ редактировать ]Ключевое различие в путях заключается в том, что кобальт вводится в анаэробные организмы на ранней стадии путем окисления прекоррина-2 до его полностью ароматизированной формы сирогидрохлорина этого соединения , а затем до комплекса кобальта (II) . [26] Эти реакции катализируются CysG и сирогидрохлорин-кобалтохелатазой . [27]
От кобальт-сирогидрохлорина к кобальт-фактору III
[ редактировать ]Как и при аэробном пути, третья метильная группа вводится ферментом метилтрансферазой CbiL : [26]
- кобальт-сирогидрохлорин + S-аденозилметионин кобальт-фактор III + S-аденозил-L-гомоцистеин
От кобальт-фактора III к кобальт-прекоррину-4
[ редактировать ]Затем происходит метилирование и сжатие кольца с образованием макроцикла коррина, катализируемое ферментом метилтрансферазой кобальт-фактора III (CbiH, EC 2.1.1.272 ). [28]
В этом пути полученный материал содержит δ-лактон, шестичленное кольцо, а не γ-лактон (пятичленное кольцо) прекоррина-3B.
От кобальт-прекоррина-4 к кобальт-прекоррину-5А
[ редактировать ]Введение метильной группы у C-11 на следующем этапе катализируется метилтрансферазой кобальт-прекоррин-4 (CbiF, EC 2.1.1.271 ). [29]
- кобальт-прекоррин-4 + S-аденозилметионин кобальт-прекоррин-5 + S-аденозил-L-гомоцистеин
От кобальт-прекоррина-5А к кобальт-прекоррину-5В
[ редактировать ]Теперь все готово для экструзии двухуглеродного фрагмента, соответствующего ацетату, высвобождаемому при образовании прекоррина-6А аэробным путем. В этом случае высвобождаемый фрагмент представляет собой ацетальдегид , который катализируется CbiG : [29]
- кобальт-прекоррин-5А + H 2 O кобальт-прекоррин-5Б + ацетальдегид + 2 Н +
От кобальт-прекоррина-5В до а,с-диамида коб(II)ириновой кислоты.
[ редактировать ]Стадии от кобальт-прекоррина-5B до a,c-диамида коб(II)ириновой кислоты в анаэробном пути по существу химически идентичны стадиям в аэробном пути. Промежуточные соединения называются кобальт-прекоррин-6А, кобальт-прекоррин-6В, кобальт-прекоррин-8 и кобириновая кислота. Ферменты в последовательности: CbiD ; [30] кобальт-прекоррин-6А редуктаза (CbiJ, EC 1.3.1.106 ); [31] CbiT , метилмутаза кобальт-прекоррин-8 (CbiC, EC 5.4.99.60 ) и CbiA . Конечный фермент образует a,c-диамид cob(II)ириновой кислоты по мере сближения двух путей. [5]
Подробности этапов от a,c-диамида cob(II)ириновой кислоты до аденозилкобаламина
[ редактировать ]Аэробные и анаэробные организмы имеют один и тот же химический путь, за исключением a,c-диамида ириновой кислоты cob(II), и это проиллюстрировано на примере продуктов гена cob .
От a,c-диамида cob(II)ириновой кислоты до аденозилкобировой кислоты.
[ редактировать ]Кобальт(II) восстанавливается до кобальта(I) ферментом CobR , а затем фермент CobO присоединяет аденозильный лиганд к металлу. Затем фермент CobQ превращает все карбоновые кислоты, за исключением пропионовой кислоты в кольце D, в их первичные амиды. [7] [21]
От аденозилкобировой кислоты до аденозилкобинамидфосфата.
[ редактировать ]В аэробных организмах фермент CobCD теперь присоединяет (R)-1-амино-2-пропанол (полученный из треонина ) к пропионовой кислоте, образуя аденозилкобинамид, а фермент CobU фосфорилирует концевую гидроксильную группу с образованием аденозилкобинамидфосфата. [21] Тот же конечный продукт образуется в анаэробных организмах путем прямой реакции аденозилкобировой кислоты с (R)-1-амино-2-пропанол О-2-фосфатом (полученным из треонин-О-фосфата ферментом CobD ), катализируемой ферментом CbiB . . [5]
От аденозилкобинамидфосфата до аденозилкобаламина
[ редактировать ]В отдельной ветви пути 5,6-диметилбензимидазол биосинтезируется из флавинмононуклеотида ферментом 5,6-диметилбензимидазолсинтазой и превращается с помощью CobT в альфа-рибазол-5'-фосфат. Затем фермент CobU активирует аденозилкобинамидфосфат путем образования аденозилкобинамид-GDP, а CobV связывает два субстрата с образованием аденозилкобаламин-5'-фосфата. На последнем этапе взаимодействия с коферментом CobC удаляет 5'-фосфатную группу: [32] [33]
- Аденозилкобаламин-5'-фосфат + H 2 O аденозилкобаламин + фосфат
Полный путь биосинтеза включает в себя длинный линейный путь, требующий около 25 этапов ферментации.
Другие пути метаболизма кобаламина
[ редактировать ]Пути спасения у прокариот
[ редактировать ]Многие виды прокариот не могут биосинтезировать аденозилкобаламин, но могут производить его из кобаламина. Эти организмы способны транспортировать кобаламин в клетку и превращать его в необходимую форму кофермента. [34] Даже такие организмы, как Salmonella typhimurium , которые могут вырабатывать кобаламин, также усваивают его из внешних источников, если они доступны. [5] [35] [36] [37] Поглощение в клетки облегчается транспортерами ABC , которые поглощают кобаламин через клеточную мембрану. [38]
Метаболизм кобаламина у человека
[ редактировать ]У людей пищевые источники кобаламина после приема внутрь связываются в виде транскобаламинов . [39] Затем они преобразуются в коферментные формы, в которых они используются. Белок типа C метилмалоновой ацидурии и гомоцистинурии представляет собой фермент, который катализирует децианирование цианокобаламина , а также деалкилирование алкилкобаламинов, включая метилкобаламин и аденозилкобаламин. [40] [41] [42]
Дальнейшее чтение
[ редактировать ]- Слой G, Ян Д., Дири Э., Лоуренс А.Д., Уоррен М.Дж. (2010). «Биосинтез гема и витамина B12». Комплексные натуральные продукты II . стр. 445–499. дои : 10.1016/B978-008045382-8.00144-1 . ISBN 9780080453828 .
Ссылки
[ редактировать ]- ^ Родионов Д.А., Витрещак А.Г., Миронов А.А., Гельфанд М.С. (2003). «Сравнительная геномика метаболизма и регуляции витамина B12 у прокариот» . Журнал биологической химии . 278 (42): 41148–41159. дои : 10.1074/jbc.M305837200 . ПМИД 12869542 .
- ^ Банерджи Р. (2006). «Торговля млекопитающими B12: аргументы в пользу службы сопровождения коэнзима». АКС Химическая биология . 1 (3): 149–159. дои : 10.1021/cb6001174 . ПМИД 17163662 .
- ^ «Витамин В12» . Информационный центр по микроэлементам, Институт Лайнуса Полинга, Университет штата Орегон, Корваллис, Орегон. 4 июня 2015 г. Проверено 20 апреля 2020 г.
- ^ Росснер К.А., Сантандер П.Дж., Скотт А. (2001). «Множественные пути биосинтеза витамина B12: вариации на центральную тему». Биосинтез кофактора . Витамины и гормоны. Том. 61. С. 267–297. дои : 10.1016/s0083-6729(01)61009-4 . ISBN 9780127098616 . ПМИД 11153269 .
- ^ Перейти обратно: а б с д и ж г Фанг Х., Кан Дж., Чжан Д. (30 января 2017 г.). «Микробное производство витамина B 12 : обзор и перспективы на будущее» . Заводы по производству микробных клеток . 16 (1): 15. дои : 10.1186/s12934-017-0631-y . ПМК 5282855 . ПМИД 28137297 .
- ^ Хелдт Д., Лоуренс А., Линденмейер М., Дири Э., Хиткот П., Ригби С., Уоррен М. (2005). «Аэробный синтез витамина B12: сокращение кольца и хелатирование кобальта». Труды Биохимического общества . 33 (4): 815–819. дои : 10.1042/BST0330815 . ПМИД 16042605 . S2CID 37362827 .
- ^ Перейти обратно: а б с Р. Каспи (25 сентября 2013 г.). «Путь: биосинтез аденозилкобаламина II (аэробный)» . База данных метаболических путей MetaCyc . Проверено 24 апреля 2020 г.
- ^ Росснер К.А., Хуанг К.Х., Уоррен М.Дж., Ро Э., Скотт А.И. (июнь 2002 г.). «Выделение и характеристика 14 дополнительных генов, определяющих анаэробный биосинтез кобаламина (витамина B12) у Propionibacterium freudenreichii (P. shermanii)» . Микробиология . 148 (Часть 6): 1845–1853. дои : 10.1099/00221287-148-6-1845 . ПМИД 12055304 .
- ^ Фрэнк С., Бриндли А., Дири Э., Хиткот П., Лоуренс А., Лич Х., Пикерсгилл Р., Уоррен М. (2005). «Анаэробный синтез витамина B12: характеристика ранних этапов пути». Труды Биохимического общества . 33 (4): 811–814. дои : 10.1042/BST0330811 . ПМИД 16042604 .
- ^ Перейти обратно: а б Р. Каспи (25 сентября 2013 г.). «Путь: биосинтез аденозилкобаламина I (анаэробный)» . База данных метаболических путей MetaCyc . Проверено 24 апреля 2020 г.
- ^ Баттерсби, АР (1993). «Как природа создает пигменты жизни» (PDF) . Чистая и прикладная химия . 65 (6): 1113–1122. дои : 10.1351/pac199365061113 . S2CID 83942303 .
- ^ Баттерсби, Арканзас (2000). «Тетрапирролы: пигменты жизни. Обзор тысячелетия». Нат. Прод. Представитель . 17 (6): 507–526. дои : 10.1039/B002635M . ПМИД 11152419 .
- ^ Ро Э., Шуберт Х.Л., Уоррен М.Дж. (декабрь 2000 г.). «Биосинтез кобаламина (витамина B12): бактериальная загадка» . Клетка. Мол. Наука о жизни . 57 (13–14): 1880–1893. дои : 10.1007/PL00000670 . ПМЦ 11147154 . ПМИД 11215515 . S2CID 583311 .
- ^ Перлман Д. (1959). «Микробный синтез кобамидов». Достижения прикладной микробиологии . 1 : 87–122. дои : 10.1016/S0065-2164(08)70476-3 . ISBN 9780120026012 . ПМИД 13854292 .
- ^ Мартенс Дж. Х., Барг Х., Уоррен М. Дж., Ян Д. (март 2002 г.). «Микробное производство витамина В12». Прикладная микробиология и биотехнология . 58 (3): 275–285. дои : 10.1007/s00253-001-0902-7 . ПМИД 11935176 . S2CID 22232461 .
- ^ Баттерсби А.Р., Фукс С.Дж., Мэтчем Г.В., Макдональд Э. (май 1980 г.). «Биосинтез пигментов жизни: образование макроцикла» . Природа . 285 (5759): 17–21. Бибкод : 1980Natur.285...17B . дои : 10.1038/285017a0 . ПМИД 6769048 . S2CID 9070849 .
- ^ Фрэнк С., Бриндли А.А., Дири Э., Хиткот П., Лоуренс А.Д., Лич Х.К. и др. (август 2005 г.). «Анаэробный синтез витамина B12: характеристика ранних этапов пути». Труды Биохимического общества . 33 (Часть 4): 811–814. дои : 10.1042/BST0330811 . ПМИД 16042604 .
- ^ Перейти обратно: а б с д Дебюше Л., Тибо Д., Кэмерон Б., Крузе Дж., Бланш Ф. (1993). «Биосинтез корринового макроцикла кофермента B12 у Pseudomonas denitrificans» . Журнал бактериологии . 175 (22): 7430–7440. дои : 10.1128/jb.175.22.7430-7440.1993 . ПМК 206888 . ПМИД 8226690 .
- ^ Баттерсби А. (2005). «Глава 11: Открытие чуда того, как природа строит свои молекулы». В Archer MD, Haley CD (ред.). Кафедра химии в Кембридже 1702 года: трансформация и перемены . Издательство Кембриджского университета. стр. xvi, 257–282. ISBN 0521828732 .
- ^ Уоррен М.Дж., Росснер К.А., Сантандер П.Дж., Скотт А.И. (1990). «Ген cysG Escherichia coli кодирует S-аденозилметионин-зависимую уропорфириноген III метилазу» . Биохимический журнал . 265 (3): 725–729. дои : 10.1042/bj2650725 . ПМЦ 1133693 . ПМИД 2407234 .
- ^ Перейти обратно: а б с д и ж Уоррен М.Дж., Ро Э., Шуберт Х.Л., Эскаланте-Семерена Дж.К. (2002). «Биосинтез аденозилкобаламина (витамина B12)». Отчеты о натуральных продуктах . 19 (4): 390–412. дои : 10.1039/b108967f . ПМИД 12195810 .
- ^ Тибо Д., Кудер М., Фамечон А., Дебюше Л., Кэмерон Б., Крузе Дж., Бланш Ф. (1992). «Последний этап биосинтеза гидробириновой кислоты катализируется продуктом гена cobH с прекоррином-8x в качестве субстрата» . Журнал бактериологии . 174 (3): 1043–1049. дои : 10.1128/jb.174.3.1043-1049.1992 . ПМК 206186 . ПМИД 1732194 .
- ^ Дебюше Л., Тибо Д., Кэмерон Б., Крузе Дж., Бланш Ф. (1990). «Очистка и характеристика а, с-диамидсинтазы кобириновой кислоты из Pseudomonas denitrificans» . Журнал бактериологии . 172 (11): 6239–6244. дои : 10.1128/jb.172.11.6239-6244.1990 . ПМК 526805 . ПМИД 2172209 .
- ^ Дебюше Л., Кудер М., Тибо Д., Кэмерон Б., Крузе Дж., Бланш Ф. (1992). «Анализ, очистка и характеристика кобальтохелатазы, уникального сложного фермента, катализирующего вставку кобальта в a,c-диамид гидробириновой кислоты во время биосинтеза кофермента B12 у Pseudomonas denitrificans» . Журнал бактериологии . 174 (22): 7445–7451. дои : 10.1128/JB.174.22.7445-7451.1992 . ПМК 207441 . ПМИД 1429466 .
- ^ Росснер Калифорния, Скотт А.И. (2006). «Точная настройка наших знаний об анаэробном пути получения кобаламина (витамина B12)» . Журнал бактериологии . 188 (21): 7331–7334. дои : 10.1128/JB.00918-06 . ПМЦ 1636268 . ПМИД 16936030 .
- ^ Перейти обратно: а б Мур С.Дж., Уоррен М.Дж. (2012). «Анаэробный биосинтез витамина В12». Труды Биохимического общества . 40 (3): 581–586. дои : 10.1042/BST20120066 . ПМИД 22616870 . S2CID 26057998 .
- ^ Инь Дж., Сюй LX, Черный М.М., Ро-Дири Э., Биндли А.А., Савченко А., Уокер Дж.Р., Кафф М.Э., Уоррен М.Дж., Джеймс М.Н. (2006). «Кристаллическая структура биосинтетической кобальтохелатазы витамина B12, CbiXS, из Archaeoglobus Fulgidus». Журнал структурной и функциональной геномики . 7 (1): 37–50. дои : 10.1007/s10969-006-9008-x . ПМИД 16835730 . S2CID 6613060 .
- ^ Мур С.Дж., Бидендик Р., Лоуренс А.Д., Дири Э., Ховард М.Дж., Ригби С.Э., Уоррен М.Дж. (2013). «Характеристика фермента CbiH60, участвующего в анаэробном сокращении колец пути биосинтеза кобаламина (витамина B12)» . Журнал биологической химии . 288 (1): 297–305. дои : 10.1074/jbc.M112.422535 . ПМК 3537027 . ПМИД 23155054 .
- ^ Перейти обратно: а б Кадзивара И., Сантандер П.Дж., Росснер К.А., Перес Л.М., Скотт А.И. (2006). «Генетически-инженерный синтез и структурная характеристика кобальт-прекоррина 5A и -5B, двух новых промежуточных продуктов на анаэробном пути к витамину B12: определение роли ферментов CbiF и CbiG». Журнал Американского химического общества . 128 (30): 9971–9978. дои : 10.1021/ja062940a . ПМИД 16866557 .
- ^ Росснер К.А., Уильямс Х.Дж., Скотт А.И. (2005). «Генетически-инженерное производство 1-десметилкобириновой кислоты, 1-десметилкобириновой кислоты,c-диамида и кобириновой кислоты,c-диамида в Escherichia coli предполагает роль CbiD в метилировании C-1 на анаэробном пути к кобаламину» . Журнал биологической химии . 280 (17): 16748–16753. дои : 10.1074/jbc.M501805200 . ПМИД 15741157 .
- ^ Ким В., Майор Т.А., Уитмен В.Б. (2005). «Роль гена прекоррин 6-X редуктазы в биосинтезе кобамида у Methanococcus maripaludis» . Архея . 1 (6): 375–384. дои : 10.1155/2005/903614 . ПМЦ 2685584 . ПМИД 16243778 .
- ^ Р. Каспи (23 апреля 2007 г.). «Путь: биосинтез аденозилкобаламина из аденозилкобинамида-GDP I» . База данных метаболических путей MetaCyc . Проверено 24 апреля 2020 г.
- ^ Заяс КЛ, Эскаланте-Семерена ХК (2007). «Переоценка поздних этапов синтеза коэнзима B12 у Salmonella enterica: доказательства того, что дефосфорилирование аденозилкобаламин-5'-фосфата фосфатазой CobC является последним шагом на пути» . Журнал бактериологии . 189 (6): 2210–2218. дои : 10.1128/jb.01665-06 . ПМК 1899380 . ПМИД 17209023 .
- ^ Р. Каспи (25 сентября 2013 г.). «Путь: спасение аденозилкобаламина из кобаламина» . База данных метаболических путей MetaCyc . Проверено 24 апреля 2020 г.
- ^ Эскаланте-Семерена Дж.К., Су С.Дж., Рот-младший (1990). «Функция CobA необходима как для биосинтеза кобаламина de novo, так и для ассимиляции экзогенных корриноидов у Salmonella typhimurium» . Журнал бактериологии . 172 (1): 273–280. дои : 10.1128/jb.172.1.273-280.1990 . ПМК 208428 . ПМИД 2403541 .
- ^ Вудсон Дж.Д., Заяс К.Л., Эскаланте-Семерена Дж.К. (2003). «Новый путь спасения кобинамида-предшественника коэнзима B12 у архей требует фермента кобинамид -фосфатсинтазы (CbiB) активности » . Журнал бактериологии . 185 (24): 7193–7201. дои : 10.1128/jb.185.24.7193-7201.2003 . ПМЦ 296239 . PMID 14645280 .
- ^ Вудсон Дж.Д., Эскаланте-Семерена Дж.К. (2004). «CbiZ, фермент амидогидролазы, необходимый для спасения кобинамида, предшественника кофермента B12, у архей» . Труды Национальной академии наук . 101 (10): 3591–3596. Бибкод : 2004PNAS..101.3591W . дои : 10.1073/pnas.0305939101 . ПМК 373507 . ПМИД 14990804 .
- ^ Вудсон Дж.Д., Рейнольдс А.А., Эскаланте-Семерена Дж.К. (2005). «ABC-транспортер корриноидов в штамме Halobacterium sp. NRC-1» . Журнал бактериологии . 187 (17): 5901–5909. дои : 10.1128/JB.187.17.5901-5909.2005 . ПМК 1196138 . ПМИД 16109931 .
- ^ Р. Каспи (25 сентября 2013 г.). «Путь: спасение кобаламина (эукариотический)» . База данных метаболических путей MetaCyc . Проверено 24 апреля 2020 г.
- ^ Ганнибал Л., Ким Дж., Браш Н.Е., Ван С., Розенблатт Д.С., Банерджи Р., Якобсен Д.В. (2009). «Процессинг алкилкобаламинов в клетках млекопитающих: роль продукта гена MMACHC (CBLC)» . Молекулярная генетика и обмен веществ . 97 (4): 260–266. дои : 10.1016/j.ymgme.2009.04.005 . ПМК 2709701 . ПМИД 19447654 .
- ^ Банерджи Р., Герасим С., Падовани Д. (2009). «Ремесленник, портной, солдат во внутриклеточной торговле B12» . Современное мнение в области химической биологии . 13 (4): 484–491. дои : 10.1016/j.cbpa.2009.07.007 . ПМК 5750051 . ПМИД 19665918 .
- ^ Квадрос EV (2010). «Достижения в понимании ассимиляции и метаболизма кобаламина» . Британский журнал гематологии . 148 (2): 195–204. дои : 10.1111/j.1365-2141.2009.07937.x . ПМК 2809139 . ПМИД 19832808 .
Внешние ссылки
[ редактировать ]- Профессор сэр Алан Баттерсби: биосинтез витамина B 12 Колледж Св. Катарины, Кембридж, видео





