хлорофиллид
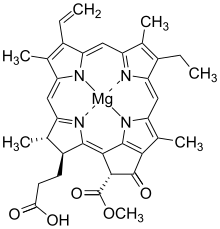 Хлорофиллид а | |
| Имена | |
|---|---|
| Название ИЮПАК Магний ( 3S , 4S , 21R )-3-(2-карбоксиэтил)-14-этил-21-(метоксикарбонил)-4,8,13,18-тетраметил-20-оксо-9-винил-23, 25-дидегидрофорбин-23,25-диид | |
| Идентификаторы | |
| |
| |
3D model ( JSmol ) | |
| КЭБ |
|
| ХимическийПаук | |
ПабХим CID | |
| Характеристики | |
| С 35 Н 34 MgN 4 О 5 | |
| Молярная масса | 614.973 g/mol |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлорофиллид а и хлорофиллид b являются биосинтетическим предшественниками хлорофилла а и хлорофилла b соответственно. Их группы пропионовой кислоты превращаются в фитиловые эфиры под действием фермента хлорофиллсинтазы на заключительном этапе пути. Таким образом, основной интерес к этим химическим соединениям связан с изучением биосинтеза хлорофилла в растениях , водорослях и цианобактериях . Хлорофиллид А также является промежуточным продуктом биосинтеза бактериохлорофиллов . [1] [2]
Структуры
[ редактировать ]
Хлорофиллид а представляет собой карбоновую кислоту (R=H). В хлорофиллиде b метильная группа в положении 13 ( нумерация хлорофиллида a по ИЮПАК ), выделенная в зеленом поле, заменена формильной группой .
Биосинтез переходит к образованию протопорфирина IX.
[ редактировать ]На ранних стадиях биосинтеза, который начинается с глутаминовой кислоты , тетрапиррол создается ферментами деаминазой и косинтетазой, которые преобразуют аминолевулиновую кислоту через порфобилиноген и гидроксиметилбилан в уропорфириноген III . Последний является первым макроциклическим промежуточным соединением, общим для гема , сирогема , кофактора F 430 , кобаламина и самого хлорофилла. [3] Следующими промежуточными продуктами являются копропорфириноген III и протопорфириноген IX , который окисляется до полностью ароматического протопорфирина IX . Вставка железа в протопорфирин IX, например, у млекопитающих дает гем, кофактор, переносящий кислород в крови, но растения вместо этого комбинируют магний , чтобы дать после дальнейших преобразований хлорофилл для фотосинтеза. [4]
Биосинтез хлорофиллидов из протопорфирина IX.
[ редактировать ]Детали поздних стадий пути биосинтеза хлорофилла различаются в зависимости от растений (например, Arabidopsis thaliana , Nicotiana tabacum и Triticum aestivum ) и бактерий (например, Rubrivivax gelatinosus и Synechocystis ), на которых он был изучен. Однако, хотя гены и ферменты различаются, химические реакции при этом идентичны. [1] [5]
Введение магния
[ редактировать ]
Хлорофилл характеризуется наличием иона магния, координированного внутри лиганда, называемого хлорином . Металл встраивается в протопорфирин IX с помощью фермента хелатазы магния. [1] который катализирует реакцию EC 6.6.1.1
Этерификация пропионатной группы кольца C
[ редактировать ]Следующим шагом на пути к хлорофиллидам является образование метилового (СН 3 ) эфира на одной из пропионатных групп, которое катализируется ферментом магнийпротопорфирин IX метилтрансферазой. [6] в метилирования реакции EC 2.1.1.11
- Mg-протопорфирин IX + S-аденозилметионин 13-метиловый эфир Mg-протопорфирина IX + S-аденозил-L-гомоцистеин
От порфирина к хлорину
[ редактировать ]
В кольцевой системе хлорина пятичленное углеродное кольцо E образуется, когда одна из пропионатных групп порфирина циклизуется с атомом углерода, связывающим исходные пиррольные кольца C и D. Ряд химических стадий катализируется ферментом магний-протопорфирин. IX монометиловый эфир (окислительная)циклаза [7] дает общую реакцию EC 1.14.13.81
- Mg-протопорфирин IX 13-монометиловый эфир + 3 НАДФН + 3 H + + 3 О 2 дивинилпротохлорофиллид + 3 НАДФ + + 5 Н 2 О
В ячмене электроны обеспечиваются восстановленным ферредоксином , который может получать их от фотосистемы I или, в темноте, от ферредоксина — НАДФ(+) редуктазы : белок циклаза называется XanL и кодируется геном Xantha-1 . [8] В анаэробных организмах, таких как Rhodobacter sphaeroides, происходит такая же общая трансформация, но кислород, включенный в 13-монометиловый эфир магния-протопорфирина IX, поступает из воды в реакции EC 1.21.98.3 . [9]
Этапы восстановления до хлорофиллида а
[ редактировать ]необходимы еще два превращения Для получения хлорофиллида а . Обе реакции являются реакциями восстановления : одна превращает винильную группу в этильную группу , а вторая присоединяет два атома водорода к пиррольному кольцу D, хотя общая ароматичность макроцикла сохраняется.Эти реакции протекают независимо, а у некоторых организмов последовательность обратная. [1] Фермент дивинилхлорофиллид и 8-винилредуктаза. [10] превращает 3,8-дивинилпротохлорофиллид в протохлорофиллид в реакции EC 1.3.1.75
- 3,8-дивинилпротохлорофиллид + НАДФН + Н + протохлорофиллид + НАДФ +

Далее следует реакция EC 1.3.1.33 , в которой пиррольное кольцо D восстанавливается ферментом протохлорофиллидредуктазой. [11]
- протохлорофиллид + НАДФН + H + хлорофиллид а + НАДФ +
Эта реакция светозависима, но существует альтернативный фермент: ферредоксин:протохлорофиллидредуктаза (АТФ-зависимая) . [12] который использует восстановленный ферредоксин в качестве кофактора и не зависит от света; он проводит аналогичную реакцию EC 1.3.7.7 , но с альтернативным субстратом 3,8-дивинилпротохлорофиллидом.
- 3,8-дивинилпротохлорофиллид + восстановленный ферредоксин + 2 АТФ + 2 H 2 O 3,8-дивинилхлорофиллид а + окисленный ферредоксин + 2 АДФ + 2 фосфат
В организмах, которые используют эту альтернативную последовательность стадий восстановления, процесс завершается реакцией EC 1.3.7.13, катализируемой ферментом, который может брать различные субстраты и выполнять необходимое восстановление винильной группы, например, в этом случае.
- 3,8-дивинилхлорофиллид а + 2 восстановленный ферредоксин + 2 Н + хлорофиллид а + 2 окисленный ферредоксин
От хлорофиллида а к хлорофиллиду b
[ редактировать ]Хлорофиллид- — оксигеназа фермент, превращающий хлорофиллид а в хлорофиллид b. [13] катализируя общую реакцию EC 1.3.7.13
- хлорофиллид а + 2 О 2 + 2 НАДФН + 2 Н + хлорофиллид b + 3 H 2 O + 2 НАДФ +
Использование в биосинтезе хлорофиллов.
[ редактировать ]
Хлорофиллсинтаза [14] завершает биосинтез хлорофилла а, катализируя реакцию EC 2.5.1.62
- хлорофиллид а + фитилдифосфат хлорофилл а + дифосфат
При этом образуется сложный эфир группы карбоновой кислоты в хлорофиллиде а с 20-углеродным дитерпеновым спиртом фитолом .Хлорофилл b производится тем же ферментом, который действует на хлорофиллид b . То же самое известно о хлорофиллах d и f , которые оба состоят из соответствующих хлорофиллидов, в конечном итоге полученных из хлорофиллида а . [15]
Использование в биосинтезе бактериохлорофиллов.
[ редактировать ]Бактериохлорофиллы — это светособирающие пигменты, обнаруженные в фотосинтезирующих бактериях: они не производят кислород в качестве побочного продукта. Таких структур много, но все они биосинтетически связаны, поскольку происходят из хлорофиллида а . [1] [16]
BChl a : бактериохлориновое кольцо и боковые цепи.
[ редактировать ]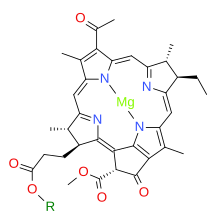
Бактериохлорофилл а является типичным примером; его биосинтез изучен у Rhodobacter capsulatus и Rhodobacter sphaeroides . Первым шагом является восстановление (с транс-стереохимией ) пиррольного кольца B, в результате чего образуется характерная 18-электронная ароматическая система многих бактериохлорофиллов. Это осуществляется ферментом хлорофилл а-редуктазой , катализирующим реакцию EC 1.3.7.15 .
- хлорофиллид а + 2 восстановленный ферредоксин + АТФ + Н 2 О + 2 Н + 3-деацетил-3-винилбактериохлорофиллид а + 2-окисленный ферредоксин + АДФ + фосфат
Следующие два этапа превращают винильную группу сначала в 1-гидроксиэтильную группу, а затем в ацетильную группу бактериохлорофиллида а . Реакции катализируются хлорофиллидом а 3 1 -гидратаза ( EC 4.2.1.165 ) и бактериохлорофиллид-а-дегидрогеназа ( EC 1.1.1.396 ) следующим образом: [2] [17]
- 3-деацетил-3-винилбактериохлорофиллид а + H 2 O 3-деацетил-3-(1-гидроксиэтил)бактериохлорофиллид а
- 3-деацетил-3-(1-гидроксиэтил)бактериохлорофиллид а + НАД + бактериохлорофиллид а + НАДН + Н +
Эти три ферментативно-катализируемые реакции могут происходить в разных последовательностях с образованием бактериохлорофиллида, готового к этерификации в конечные пигменты для фотосинтеза. Фитиловый эфир бактериохлорофилла а не присоединяется напрямую: скорее, исходным промежуточным соединением является сложный эфир с R = геранилгеранил (из геранилгеранилпирофосфата ), который затем подвергается дополнительным стадиям по мере трех алкеновых связей боковой цепи. восстановления [17]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и Уиллоуз, Роберт Д. (2003). «Биосинтез хлорофиллов из протопорфирина IX». Отчеты о натуральных продуктах . 20 (6): 327–341. дои : 10.1039/B110549N . ПМИД 12828371 .
- ^ Перейти обратно: а б Болливар, Дэвид В. (2007). «Последние достижения в биосинтезе хлорофилла». Исследования фотосинтеза . 90 (2): 173–194. дои : 10.1007/s11120-006-9076-6 . ПМИД 17370354 . S2CID 23808539 .
- ^ Баттерсби А.Р., Фукс С.Дж., Мэтчем Г.В., Макдональд Э. (май 1980 г.). «Биосинтез пигментов жизни: образование макроцикла» . Природа . 285 (5759): 17–21. Бибкод : 1980Natur.285...17B . дои : 10.1038/285017a0 . ПМИД 6769048 . S2CID 9070849 .
- ^ Баттерсби, Арканзас (2000). «Тетрапирролы: пигменты жизни. Обзор тысячелетия». Отчеты о натуральных продуктах . 17 (6): 507–526. дои : 10.1039/B002635M . ПМИД 11152419 .
- ^ Р. Каспи (18 июля 2007 г.). «3,8-дивинилхлорофиллид биосинтез I (аэробный, светозависимый)» . База данных метаболических путей MetaCyc . Проверено 4 июня 2020 г.
- ^ Пастух, Марк; Рид, Джеймс Д.; Хантер, К. Нил (2003). «Очистка и кинетическая характеристика метилтрансферазы протопорфирина IX магния из Synechocystis PCC6803» . Биохимический журнал . 371 (2): 351–360. дои : 10.1042/BJ20021394 . ПМЦ 1223276 . ПМИД 12489983 .
- ^ Болливар Д.В., Бил С.И. (сентябрь 1996 г.). «Фермент биосинтеза хлорофилла Mg-протопорфирин IX монометиловый эфир (окислительная) циклаза (характеристика и частичная очистка от Chlamydomonas reinhardtii и Synechocystis sp. PCC 6803)» . Физиология растений . 112 (1): 105–114. дои : 10.1104/стр.112.1.105 . ПМК 157929 . ПМИД 12226378 .
- ^ Стюарт, Дэвид; Сандстрем, Малин; Юсеф, Хелми М.; Захрабекова, Шахира; Дженсен, Пол Эрик; Болливар, Дэвид В.; Ханссон, Матс (08 сентября 2020 г.). «Аэробный ячменный магний-протопорфирин IX монометилэфирциклаза питается электронами ферредоксина» . Растения . 9 (9): 1157. doi : 10.3390/plants9091157 . ПМК 7570240 . ПМИД 32911631 .
- ^ Порра, Роберт Дж.; Шафер, Вольфрам; Гад'Он, Наср; Катедер, Ингрид; Дрюс, Герхарт; Шеер, Хьюго (1996). «Происхождение двух карбонильных кислородов бактериохлорофилла а. Демонстрация двух различных путей образования кольца е у Rhodobacter sphaeroides и Roseobacter denitrificans, а также общего гидратазного механизма образования 3-ацетильной группы» . Европейский журнал биохимии . 239 (1): 85–92. doi : 10.1111/j.1432-1033.1996.0085u.x . ПМИД 8706723 .
- ^ Пархэм, Рамин; Ребейс, Константин А. (1992). «Биогенез хлоропластов: [4-винил] хлорофиллид-а-редуктаза представляет собой дивинилхлорофиллид-специфичный, НАДФН-зависимый фермент». Биохимия . 31 (36): 8460–8464. дои : 10.1021/bi00151a011 . ПМИД 1390630 .
- ^ Апель, Клаус; Сантель, Ханс-Иоахим; Редлинджер, Том Э.; Фальк, Хайнц (2005). «Протохлорофиллидный голохром ячменя (Hordeum vulgare L.)» . Европейский журнал биохимии . 111 (1): 251–258. дои : 10.1111/j.1432-1033.1980.tb06100.x . ПМИД 7439188 .
- ^ Мураки Н., Номата Дж., Эбата К., Мизогути Т., Шиба Т., Тамиаки Х., Курису Г., Фудзита Ю. (май 2010 г.). «Рентгеновская кристаллическая структура светонезависимой протохлорофиллидредуктазы». Природа . 465 (7294): 110–4. Бибкод : 2010Natur.465..110M . дои : 10.1038/nature08950 . ПМИД 20400946 . S2CID 4427639 .
- ^ Эггинка, Лаура Л.; Лобрутто, Рассел; Брюн, Дэниел К.; Брюсслан, Джуди; Ямасато, Акихиро; Танака, Аюми; Хубер, Дж. Кеннет (2004). «Синтез хлорофилла b: локализация хлорофиллида оксигеназы и открытие стабильного радикала в каталитической субъединице» . Биология растений BMC . 4 :5. дои : 10.1186/1471-2229-4-5 . ПМК 406501 . ПМИД 15086960 .
- ^ Шмид, ХК; Рассадина, В.; Остер, У.; Шох, С.; Рюдигер, В. (2002). «Предварительная загрузка хлорофиллсинтазы тетрапренилдифосфатом является обязательным этапом биосинтеза хлорофилла» (PDF) . Биологическая химия . 383 (11): 1769–78. дои : 10.1515/BC.2002.198 . ПМИД 12530542 . S2CID 3099209 .
- ^ Цузуки, Юки; Цукатани, Юсуке; Ямакава, Хисанори; Ито, Сигеру; Фудзита, Юичи; Ямамото, Харуки (29 марта 2022 г.). «Влияние света и кислорода на биосинтез хлорофилла d у морской цианобактерии Acaryochromis marina» . Растения . 11 (7): 915. doi : 10.3390/plants11070915 . ПМК 9003380 . ПМИД 35406896 .
- ^ Сенге, Матиас О.; Смит, Кевин М. (2004). «Биосинтез и структура бактериохлорофиллов». Аноксигенные фотосинтезирующие бактерии . Достижения в области фотосинтеза и дыхания. Том. 2. С. 137–151. дои : 10.1007/0-306-47954-0_8 . ISBN 0-7923-3681-Х .
- ^ Перейти обратно: а б Р. Каспи (08 декабря 2015 г.). «Путь: биосинтез бактериохлорофилла» . База данных метаболических путей MetaCyc . Проверено 4 июня 2020 г.
