Фосфатидовая кислота
Фосфатидные кислоты представляют собой анионные фосфолипиды, важные для передачи сигналов в клетках и прямой активации липид-управляемых ионных каналов . Гидролиз фосфатидной кислоты дает по одной молекуле глицерина и фосфорной кислоты и две молекулы жирных кислот. Они составляют около 0,25% фосфолипидов бислоя. [1]
Структура
[ редактировать ]
Фосфатидовая кислота состоит из глицериновой основной цепи, обычно насыщенной жирной кислоты, связанной с углеродом -1, ненасыщенной жирной кислоты, связанной с углеродом -2, и фосфатной группы, связанной с углеродом -3. [2] [3]
Формирование и деградация
[ редактировать ]Помимо синтеза de novo, ПА может образовываться тремя способами:
- Под действием фосфолипазы D (PLD) посредством гидролиза PO-связи фосфатидилхолина (PC) с образованием PA и холина . [4]
- Путем фосфорилирования диацилглицерина (DAG) киназой DAG (DAGK).
- Путем ацилирования лизофосфатидной кислоты лизоПА-ацилтрансферазой (LPAAT); это самый распространенный путь . [5]
Здесь показан глицерин-3-фосфатный путь синтеза PA de novo:
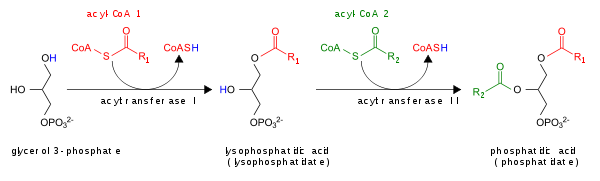
Кроме того, ПА может превращаться в ДАГ с помощью липидфосфатфосфогидролаз (ЛФП). [6] [7] или в лизо-ПА с помощью фосфолипазы А (PLA).
Роли в клетке
[ редактировать ]Роль ПА в клетке можно разделить на три категории:
- ПА является предшественником биосинтеза многих других липидов.
- Физические свойства PA влияют на кривизну мембраны.
- PA действует как сигнальный липид, рекрутируя цитозольные белки на соответствующие мембраны (например, сфингозинкиназу 1 [8] ).
- ПА играет очень важную роль в фототрансдукции у дрозофилы . [9]
- PA представляет собой липидный лиганд, закрывающий ионные каналы. [10] См. также липидозависимые ионные каналы .
Первые три роли не являются взаимоисключающими. Например, PA может участвовать в формировании пузырьков, способствуя искривлению мембраны и рекрутируя белки для выполнения гораздо более энергетически невыгодной задачи формирования и сжатия шейки.
Роли в биосинтезе
[ редактировать ]PA представляет собой жизненно важный клеточный липид, который действует как биосинтетический предшественник образования (прямого или косвенного) всех ацилглицериновых липидов в клетке. [11]
В клетках млекопитающих и дрожжей известны два разных пути синтеза PA de novo: путь глицерин-3-фосфата или путь дигидроксиацетонфосфата. У бактерий присутствует только первый путь, а мутации, блокирующие этот путь, смертельны, что демонстрирует важность PA. В клетках млекопитающих и дрожжей, где ферменты в этих путях дублируются, мутация любого фермента не является смертельной. Однако стоит отметить, что in vitro различные ацилтрансферазы проявляют различную субстратную специфичность по отношению к ацил-КоА, которые включены в PA. Различные ацилтрансферазы также имеют различное внутриклеточное распределение, например, в эндоплазматическом ретикулуме (ЭР), митохондриях или пероксисомах, а также локальные концентрации активированных жирных кислот. Это предполагает, что различные ацилтрансферазы, присутствующие в клетках млекопитающих и дрожжей, могут быть ответственны за продукцию разных пулов ПА. [11]
Превращение PA в диацилглицерин (DAG) с помощью LPP является обязательным этапом производства фосфатидилхолина (PC), фосфатидилэтаноламина (PE) и фосфатидилсерина (PS). Кроме того, DAG также превращается в CDP-DAG, который является предшественником фосфатидилглицерина (PG), фосфатидилинозитола (PI) и фосфоинозитидов (PIP, PIP 2 , PIP 3 ). [11]
Концентрации ПА поддерживаются в клетке на чрезвычайно низком уровне за счет активности мощных ЛПП. [6] Они очень быстро превращают PA в DAG, и, поскольку DAG является предшественником многих других липидов, он также вскоре метаболизируется в другие мембранные липиды. Это означает, что любое усиление продукции PA со временем может сопровождаться соответствующим усилением LPP и ферментов, метаболизирующих DAG.
Таким образом, PA необходим для синтеза липидов и выживания клеток, однако в нормальных условиях поддерживается в клетке на очень низких уровнях.
Биофизические свойства
[ редактировать ]PA является уникальным фосфолипидом, поскольку он имеет небольшую высокозаряженную головную группу, которая очень близка к основной цепи глицерина. Известно, что PA играет роль как в делении пузырьков , так и в делении пузырьков. [12] и слияние, [13] и эти роли могут быть связаны с биофизическими свойствами PA.
В местах отпочкования или слияния мембран мембрана становится или сильно изогнута. Главным событием в отпочковании везикул, таких как транспортные носители из Гольджи , является создание и последующее сужение шейки мембраны. Исследования предположили, что этот процесс может быть обусловлен липидами, и установили центральную роль ДАГ из-за его уникальной молекулярной формы. Наличие двух ацильных цепей, но отсутствие головной группы, приводит к большой отрицательной кривизне мембран. [14]
LPAAT BARS-50 также участвует в почковании из Гольджи. [12] Это предполагает, что превращение лизоПА в ПА может влиять на кривизну мембраны. Активность LPAAT удваивает количество ацильных цепей, значительно увеличивая площадь поперечного сечения липида, который находится «внутри» мембраны, в то время как поверхностная головная группа остается неизменной. Это может привести к более отрицательной кривизне мембраны. Исследователи из Утрехтского университета изучили влияние лизоПА по сравнению с ПА на кривизну мембраны, измерив их влияние на температуру перехода ПЭ из липидных бислоев в неламеллярные фазы, используя 31 П-ЯМР. [15] Было показано, что кривизна, индуцированная этими липидами, зависит не только от структуры лизоПА по сравнению с ПА, но также от динамических свойств, таких как гидратация головных групп и меж- и внутримолекулярные взаимодействия. Например, Ка 2+ может взаимодействовать с двумя ПА с образованием нейтрального, но сильно изогнутого комплекса. Нейтрализация отталкивающих зарядов головных групп и отсутствие каких-либо стерических препятствий обеспечивает сильные межмолекулярные взаимодействия между ацильными цепями, что приводит к образованию микродоменов, богатых PA. Таким образом , in vitro физиологические изменения pH, температуры и концентрации катионов оказывают сильное влияние на кривизну мембраны, индуцированную PA и lysoPA. [15] Взаимное превращение лизоПА, ПА и ДАГ, а также изменения pH и концентрации катионов могут вызывать изгиб и дестабилизацию мембраны, играя непосредственную роль в делении мембраны просто в силу своих биофизических свойств. Однако, хотя было показано, что PA и lysoPA влияют на кривизну мембраны in vitro ; их роль in vivo неясна.
Роль lysoPA, PA и DAG в обеспечении искривления мембраны не исключает их роли в рекрутировании белков на мембрану. Например, Ca 2+ Добавление аннексина I не сильно влияет на потребность в слиянии сложных липосом, хотя она снижается под действием PLD. Однако при использовании аннексина I и PLD степень слияния значительно увеличивается, и Ca 2+ потребность снижается почти в 1000 раз до почти физиологического уровня. [13]
Таким образом, метаболическая, биофизическая, рекрутинговая и сигнальная роли PA могут быть взаимосвязаны.
Роль в передаче сигналов
[ редактировать ]PA поддерживается на низком уровне в объеме мембраны, чтобы временно взорваться и подать локальный сигнал в высокой концентрации. [16] Например, каналы TREK-1 активируются местной ассоциацией с PLD и производством PA. [17] Константа диссоциации ПА для TREK-1 составляет примерно 10 микромолярных. [18] Относительно слабое связывание в сочетании с низкой концентрацией ПА в мембране позволяет каналу отключиться. Локальная высокая концентрация активации предполагает, по крайней мере, некоторые ограничения местной диффузии липидов. Низкая основная концентрация PA в сочетании с высокими локальными выбросами является противоположностью передаче сигналов PIP2. PIP2 сохраняется на относительно высоком уровне в мембране, а затем временно гидролизуется вблизи белка, чтобы временно снизить передачу сигналов PIP2. [19] Передача сигналов PA отражает передачу сигналов PIP2 в том смысле, что основная концентрация сигнального липида не должна меняться, чтобы оказывать мощное локальное воздействие на целевой белок.
Как описано выше, PLD гидролизует PC с образованием PA и холина . Поскольку холина в клетке очень много, активность PLD существенно не влияет на уровни холина; и холин вряд ли будет играть какую-либо роль в передаче сигналов. [ нужна ссылка ]
Роль активации PLD во многих контекстах передачи сигналов в сочетании с отсутствием роли холина указывает на то, что PA важен в передаче сигналов. Однако PA быстро превращается в DAG, а DAG также известен как сигнальная молекула. Это поднимает вопрос о том, играет ли PA какую-либо прямую роль в передаче сигналов или он просто действует как предшественник продукции DAG. [20] [21] Если будет обнаружено, что PA действует только как предшественник DAG, то можно поставить вопрос, почему клетки должны производить DAG с использованием двух ферментов, когда они содержат PLC , который может производить DAG за один этап.
ПА, полученные ПЛД или ДАГК, можно отличить по добавлению [γ- 32 П]АТФ. Это покажет, возникла ли фосфатная группа вновь в результате активности киназы или она возникла из ПК. [22]
Хотя PA и DAG взаимопревращаются, они действуют по-разному. Стимулы, активирующие PLD, не активируют ферменты, расположенные ниже DAG, и наоборот. Например, было показано, что добавление ПЛД к мембранам приводит к образованию [ 32 P]-меченные PA и [ 32 P]-меченные фосфоинозитиды. [23] Добавление ингибиторов ДАГК исключает продукцию [ 32 P]-меченный PA, но не PLD-стимулируемая продукция фосфоинозитидов.
Возможно, что, хотя PA и DAG взаимопревращаются, могут сохраняться отдельные пулы сигнальных и несигнальных липидов. Исследования показали, что передача сигналов DAG опосредуется полиненасыщенным DAG, тогда как PA, полученный из PLD, является мононенасыщенным или насыщенным. Таким образом, функциональная насыщенная/мононенасыщенная PA может быть разложена путем ее гидролиза с образованием нефункционального насыщенного/мононенасыщенного DAG, тогда как функциональный полиненасыщенный DAG может быть разложен путем превращения его в нефункциональную полиненасыщенную PA. [20] [24]
Эта модель предполагает, что эффекторы PA и DAG должны быть способны различать липиды с одинаковыми головными группами, но с разными ацильными цепями. Хотя некоторые липидсвязывающие белки способны внедряться в мембраны и гипотетически могут распознавать тип ацильной цепи или результирующие свойства мембраны, многие липидсвязывающие белки являются цитозольными и локализуются на мембране, связывая только головные группы липидов. Возможно, разные ацильные цепи могут влиять на угол головной группы в мембране. Если это так, то это предполагает, что PA-связывающий домен должен быть не только способен специфически связывать PA, но также должен быть способен идентифицировать те головные группы, которые находятся под правильным углом. Каким бы ни был механизм, такая специфичность возможна. В семенниках свиней обнаружена ДАГК, специфичная для полиненасыщенного ДАГ. [25] и в двух ЛПП гепатоцитов крысы, которые дефосфорилируют разные виды ПА с разной активностью. [26] Более того, было показано, что стимуляция активности SK1 ФС in vitro сильно варьирует в зависимости от того, использовались ли диолеоильные (С18:1), дистеароильные (С18:0) или 1-стеароильные, 2-олеоильные виды ФС. [27] Таким образом, кажется, что, хотя PA и DAG взаимопревращаются, разные виды липидов могут иметь разную биологическую активность; и это может позволить двум липидам поддерживать отдельные сигнальные пути.
Измерение производства ПА
[ редактировать ]Поскольку PA быстро превращается в DAG, он очень недолговечен в клетке. Это означает, что трудно измерить выработку ПА и, следовательно, изучить роль ПА в клетке. Однако активность PLD можно измерить путем добавления в клетку первичных спиртов. [28] Затем PLD вместо гидролиза проводит реакцию трансфосфатидилирования, образуя фосфатидиловые спирты вместо PA. Фосфатидиловые спирты являются метаболическими тупиками, и их можно легко извлечь и измерить. Таким образом, можно измерить активность PLD и продукцию PA (если не самого PA), и, блокируя образование PA, можно сделать вывод об участии PA в клеточных процессах.
Белковые интеракторы
[ редактировать ]- СК1
- PDE4A1
- Раф1
- мТОР [29]
- ПП1
- ШП1
- Спо20п
- p47phox
- ПКСε
- ПЛК б
- ПИП5К
- Опи1
- ТРЕК-1 [30]
- К в [31]
- Глава 2.2 [32]
Ссылки
[ редактировать ]- ^ Велти, Р; Ли, В; Ли, М; Санг, Ю; Бесяда, Х; Чжоу, ХЭ; Раджашекар, CB; Уильямс, Т.Д.; Ван, X (30 августа 2002 г.). «Профилирование мембранных липидов в ответах растений на стресс. Роль фосфолипазы D альфа в изменениях липидов, вызванных замораживанием, у арабидопсиса» . Журнал биологической химии . 277 (35): 31994–2002. дои : 10.1074/jbc.M205375200 . ПМИД 12077151 .
- ^ Уильям В. Кристи. «Фосфатидная кислота, лизофосфатидная кислота и родственные липиды» . Архивировано из оригинала 23 октября 2004 года . Проверено 5 ноября 2009 г.
- ^ Шредер, Р.; Лондон, Э.; Браун, Д. (декабрь 1994 г.). «Взаимодействия между насыщенными ацильными цепями придают липидам и гликозилфосфатидилинозитол (GPI)-заякоренным белкам устойчивость к детергентам: GPI-заякоренные белки в липосомах и клетках демонстрируют сходное поведение» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (25): 12130–12134. Бибкод : 1994PNAS...9112130S . дои : 10.1073/pnas.91.25.12130 . ПМК 45390 . ПМИД 7991596 .
- ^ Лискович М., Чарни М., Фиуччи Дж., Тан Икс (февраль 2000 г.). «Фосфолипаза D: молекулярная и клеточная биология нового семейства генов» . Биохим. Дж . 345 (3): 401–15. дои : 10.1042/0264-6021:3450401 . ПМК 1220771 . ПМИД 10642495 .
- ^ Девлин, ТМ 2004. Биохимия , 4-е издание. Реверте, Барселона. ISBN 84-291-7208-4
- ^ Перейти обратно: а б Бриндли Д.Н., Вагонер Д.В. (май 1996 г.). «Фосфатидатфосфогидролаза и передача сигнала». хим. Физ. Липиды . 80 (1–2): 45–57. дои : 10.1016/0009-3084(96)02545-5 . ПМИД 8681429 .
- ^ Бриндли Д.Н., Вагонер Д.В. (сентябрь 1998 г.). «Липидфосфатфосфогидролазы млекопитающих» . Ж. Биол. Хим . 273 (38): 24281–4. дои : 10.1074/jbc.273.38.24281 . ПМИД 9733709 .
- ^ Делон С., Манифава М., Вуд Е. и др. (октябрь 2004 г.). «Сфингозинкиназа 1 является внутриклеточным эффектором фосфатидной кислоты» . Ж. Биол. Хим . 279 (43): 44763–74. дои : 10.1074/jbc.M405771200 . ПМИД 15310762 .
- ^ П. Рагху (август 2012 г.). «Передача липидных сигналов в фоторецепторах дрозофилы». Биохим Биофиз Акта . 1821 (8): 1154–1165. дои : 10.1016/j.bbalip.2012.03.008 . ПМИД 22487656 .
- ^ Робинсон, CV; Рохач, Т; Хансен, SB (сентябрь 2019 г.). «Инструменты для понимания наномасштабной липидной регуляции ионных каналов» . Тенденции биохимических наук . 44 (9): 795–806. дои : 10.1016/j.tibs.2019.04.001 . ПМК 6729126 . ПМИД 31060927 .
- ^ Перейти обратно: а б с Афинштадт К., Даум Г. (ноябрь 1999 г.). «Фосфатидовая кислота, ключевое промежуточное соединение в обмене липидов» . Евро. Дж. Биохим . 266 (1): 1–16. дои : 10.1046/j.1432-1327.1999.00822.x . ПМИД 10542045 .
- ^ Перейти обратно: а б Вейгерт Р., Силлетта М.Г., Спано С. и др. (ноябрь 1999 г.). «CtBP/BARS вызывает деление мембран Гольджи путем ацилирования лизофосфатидной кислоты». Природа . 402 (6760): 429–33. Бибкод : 1999Natur.402..429W . дои : 10.1038/46587 . PMID 10586885 . S2CID 4423468 .
- ^ Перейти обратно: а б Блэквуд Р.А., Смолен Дж.Э., Трансью А. и др. (апрель 1997 г.). «Активность фосфолипазы D облегчает Ca2+-индуцированную агрегацию и слияние сложных липосом». Являюсь. Дж. Физиол . 272 (4 ч. 1): C1279–85. дои : 10.1152/ajpcell.1997.272.4.C1279 . ПМИД 9142853 .
- ^ Шемеш Т., Луини А., Малхотра В., Бургер К.Н., Козлов М.М. (декабрь 2003 г.). «Предделительное сужение носителей трубочек Гольджи, вызванное локальным метаболизмом липидов: теоретическая модель» . Биофиз. Дж . 85 (6): 3813–27. Бибкод : 2003BpJ....85.3813S . дои : 10.1016/S0006-3495(03)74796-1 . ПМК 1303683 . ПМИД 14645071 . Архивировано из оригинала 7 мая 2008 г.
- ^ Перейти обратно: а б Койман Э.Э., Чупин В., де Круйфф Б., Бургер К.Н. (март 2003 г.). «Модуляция кривизны мембраны фосфатидной кислотой и лизофосфатидной кислотой» . Трафик . 4 (3): 162–74. дои : 10.1034/j.1600-0854.2003.00086.x . ПМИД 12656989 .
- ^ Робинсон, CV; Рохач, Т; Хансен, SB (сентябрь 2019 г.). «Инструменты для понимания наномасштабной липидной регуляции ионных каналов» . Тенденции биохимических наук . 44 (9): 795–806. дои : 10.1016/j.tibs.2019.04.001 . ПМК 6729126 . ПМИД 31060927 .
- ^ Комольо, Ю; Левитц, Дж; Кинцлер, Массачусетс; Лесаж, Ф; Исаков, EY; Сандоз, Г. (16 сентября 2014 г.). «Фосфолипаза D2 специфически регулирует калиевые каналы TREK посредством прямого взаимодействия и локального производства фосфатидной кислоты» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (37): 13547–52. Бибкод : 2014PNAS..11113547C . дои : 10.1073/pnas.1407160111 . ПМК 4169921 . ПМИД 25197053 .
- ^ Кабанос, К; Ван, М; Хан, Х; Хансен, С.Б. (8 августа 2017 г.). «Анализ растворимого флуоресцентного связывания выявляет антагонизм PIP 2 каналов TREK-1» . Отчеты по ячейкам . 20 (6): 1287–1294. дои : 10.1016/j.celrep.2017.07.034 . ПМЦ 5586213 . ПМИД 28793254 .
- ^ Павел, М.А.; Чунг, Х.В.; Петерсен, Э.Н.; Хансен, С.Б. (октябрь 2019 г.). «Полимодальный механизм ингибирования K+-канала, связанного с TWIK, местным анестетиком» . Анестезия и анальгезия . 129 (4): 973–982. дои : 10.1213/ANE.0000000000004216 . ПМИД 31124840 .
- ^ Перейти обратно: а б Ходжкин М.Н., Петтит Т.Р., Мартин А., Мичелл Р.Х., Пембертон А.Дж., Уэйкелам М.Дж. (июнь 1998 г.). «Диацилглицерины и фосфатидаты: какие молекулярные виды являются внутриклеточными мессенджерами?». Тенденции биохимии. Наука . 23 (6): 200–4. дои : 10.1016/S0968-0004(98)01200-6 . ПМИД 9644971 .
- ^ Вакелам MJ (декабрь 1998 г.). «Диацилглицерин - когда он является внутриклеточным посланником?». Биохим. Биофиз. Акта . 1436 (1–2): 117–26. дои : 10.1016/S0005-2760(98)00123-4 . ПМИД 9838074 .
- ^ Кокрофт С., Болдуин Дж. М., Аллан Д. (июль 1984 г.). «Са2+-активированная полифосфоинозитидфосфодиэстераза мембран нейтрофилов человека и кролика» . Биохим. Дж . 221 (2): 477–82. дои : 10.1042/bj2210477 . ПМК 1144062 . ПМИД 6089740 .
- ^ Мориц А., Де Граан П.Н., Гиспен В.Х., Вирц К.В. (апрель 1992 г.). «Фосфатидовая кислота является специфическим активатором фосфатидилинозитол-4-фосфаткиназы» . Ж. Биол. Хим . 267 (11): 7207–10. дои : 10.1016/S0021-9258(18)42504-5 . ПМИД 1313792 .
- ^ Бокино С.Б., Блэкмор П.Ф., Уилсон П.Б., Экстон Дж.Х. (ноябрь 1987 г.). «Накопление фосфатидатов в обработанных гормонами гепатоцитах по механизму фосфолипазы D» . Ж. Биол. Хим . 262 (31): 15309–15. дои : 10.1016/S0021-9258(18)48176-8 . ПМИД 3117799 .
- ^ Ходжкин М.Н., Гарднер С.Д., Роуз С., Патерсон А., Мартин А., Уэйкелам М.Дж. (март 1997 г.). «Очистка и характеристика sn-1-стеароил-2-арахидоноилглицеринкиназы из семенников свиней» . Биохим. Дж . 322 (Часть 2): 529–34. дои : 10.1042/bj3220529 . ПМЦ 1218222 . ПМИД 9065773 .
- ^ Флеминг И.Н., Йеман С.Дж. (июнь 1995 г.). «Очистка и характеристика нечувствительной к N-этилмалеимиду фосфогидролазы фосфатидной кислоты (PAP2) из печени крыс» . Биохим. Дж . 308 (Часть 3): 983–9. дои : 10.1042/bj3080983 . ПМЦ 1136819 . ПМИД 8948459 .
- ^ Оливера А., Розенталь Дж., Шпигель С. (март 1996 г.). «Влияние кислых фосфолипидов на сфингозинкиназу». Дж. Селл. Биохим . 60 (4): 529–37. doi : 10.1002/(SICI)1097-4644(19960315)60:4<529::AID-JCB9>3.0.CO;2-U . ПМИД 8707892 . S2CID 34752646 .
- ^ Моррис А.Дж., Фроман М.А., Энгебрехт Дж. (октябрь 1997 г.). «Измерение активности фосфолипазы D». Анальный. Биохим . 252 (1): 1–9. дои : 10.1006/abio.1997.2299 . ПМИД 9324933 .
- ^ Вицер, Брайан М; Томас, Джордж (27 марта 2012 г.). «Фосфолипаза D и mTORC1: питательные вещества - это то, что объединяет их». наук. Сигнал . 5 (217): пе13. дои : 10.1126/scisignal.2003019 . ПМИД 22457329 . S2CID 206671479 .
- ^ Кабанос, К; Ван, М; Хан, Х; Хансен, С.Б. (8 августа 2017 г.). «Анализ растворимого флуоресцентного связывания выявляет антагонизм PIP 2 каналов TREK-1» . Отчеты по ячейкам . 20 (6): 1287–1294. дои : 10.1016/j.celrep.2017.07.034 . ПМЦ 5586213 . ПМИД 28793254 .
- ^ Хайт, РК; Баттервик, Дж.А.; Маккиннон, Р. (6 октября 2014 г.). «Модуляция фосфатидной кислотой функции датчика напряжения Kv-канала» . электронная жизнь . 3 . doi : 10.7554/eLife.04366 . ПМК 4212207 . ПМИД 25285449 .
- ^ Хансен, С.Б.; Тао, Х; Маккиннон, Р. (28 августа 2011 г.). «Структурная основа активации PIP2 классического внутреннего выпрямителя K+ канала Kir2.2» . Природа . 477 (7365): 495–8. Бибкод : 2011Natur.477..495H . дои : 10.1038/nature10370 . ПМК 3324908 . ПМИД 21874019 .