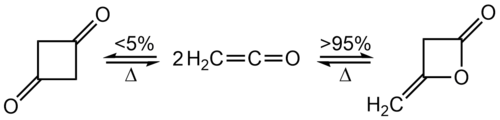Кетене

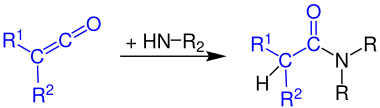
В органической химии кетен — это органическое соединение формы RR'C=C=O , где R и R' — две произвольные одновалентные химические группы (или два отдельных сайта замещения в одной и той же молекуле). [ 1 ] Название может также относиться к конкретному соединению этенону. H 2 C=C=O , простейший кетен. [ 2 ]
Хотя они очень полезны, большинство кетенов нестабильны . При использовании в качестве реагентов в химической процедуре они обычно генерируются при необходимости и расходуются сразу же (или во время) их производства. [ 1 ]
История
[ редактировать ]Кетены были впервые изучены как класс Германом Штаудингером до 1905 года. [ 3 ]
Кетены систематически исследовались Германом Штаудингером в 1905 году в форме дифенилкетена (превращение -хлордифенилацетилхлорид с цинком). Штаудингера вдохновили первые примеры реакционноспособных органических промежуточных продуктов и стабильных радикалов, открытых Мозесом Гомбергом в 1900 году (соединения с трифенилметильной группой). [ 4 ]
Характеристики
[ редактировать ]Кетены обладают высокой электрофильностью по атому углерода, связанному с гетероатомом, из-за своего sp- характера. Кетен может быть образован с различными гетероатомами, связанными с атомом углерода sp , такими как O , S или Se , которые называются соответственно кетеном, тиокетеном и селенокетеном.
Этенон , простейший кетен, имеет разную экспериментальную длину каждой из двойных связей; связь C=O составляет 1160 Å , а связь C=C составляет 1314 Å. Угол между двумя атомами H составляет 121,5 °, что аналогично теоретически идеальному углу, образующемуся в алкенах между sp 2 атом углерода и заместители H. [ 5 ]
Кетены нестабильны и не могут храниться. В отсутствие нуклеофилов, с которыми можно было бы вступить в реакцию, этенон димеризуется с образованием β- лактона , циклического сложного эфира . Если кетен двузамещен, продукт димеризации представляет собой замещенный циклобутадион. Для монозамещенных кетенов димеризация может дать либо сложный эфир, либо дикетоновый продукт.
Синтез
[ редактировать ]Кетен в промышленных масштабах получают путем термической дегидратации уксусной кислоты . Замещенные кетены можно получить из ацилхлоридов реакцией элиминирования , при которой HCl теряется :
В этой реакции основание, обычно триэтиламин , отщепляет кислый альфа -протон до карбонильной группы, вызывая образование двойной связи углерод-углерод и потерю хлорид- иона:
Кетены также могут быть образованы из α- диазокетонов путем перегруппировки Вольфа и из виниленкарбоната путем сульфида фосфора (V) и облучения. [ 6 ]
Другой способ получения кетенов — флэш-вакуумный термолиз (FVT) с 2- пиридиламинами . В 1997 году Плюг и Вентрап разработали метод, который улучшил реакции FVT для получения кетенов со стабильным FVT, нечувствительным к влаге, в мягких условиях (480 ° C). N-пиридиламины получают конденсацией с R- малонатами с N-амино( пириденом ) и DCC в качестве растворителя. [ 7 ]
Более надежным методом получения кетенов является карбонилирование карбенов металлов и реакция in situ полученных таким образом высокореактивных кетенов с подходящими реагентами, такими как имины , амины или спирты . [ 8 ] Этот метод представляет собой эффективный тандемный протокол карбонилирования α-диазокарбонильных соединений и различных N -тозилгидразонов, катализируемый Co(II) -порфириновыми металлорадикалами, приводящий к образованию кетенов, которые впоследствии реагируют с различными нуклеофилами и Имины образуют сложные эфиры , амиды и β-лактамы . Эта система имеет широкую область применения и может быть применена к различным комбинациям предшественников карбенов , нуклеофилов и иминов. [ 9 ]
Реакции и применение
[ редактировать ]Из-за наличия кумулятивных двойных связей кетены очень реакционноспособны. [ 10 ]
Образование эфиров карбоновых кислот
[ редактировать ]При реакции со спиртами эфиры карбоновых кислот образуются :
Образование ангидридов карбоновых кислот
[ редактировать ]Кетены реагируют с карбоновыми кислотами с образованием ангидридов карбоновых кислот :
Образование амидов
[ редактировать ]Кетены реагируют с аммиаком и аминами с образованием соответствующих амидов :
Гидролиз
[ редактировать ]При реакции с водой из кетенов образуются карбоновые кислоты.
Образование еноловых эфиров
[ редактировать ]Эфиры енолов образуются из кетенов с енолизируемыми карбонильными соединениями . В следующем примере показана реакция этенона с ацетоном с образованием пропен-2-илацетата:
Димеризация
[ редактировать ]При комнатной температуре кетен быстро димеризуется до дикетена , но кетен можно восстановить нагреванием:
[2+2]-циклоприсоединение
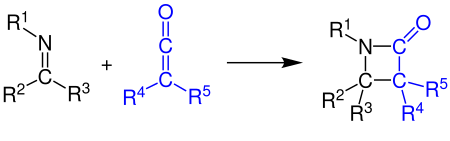
[ редактировать ]Кетены могут реагировать с алкенами , карбонильными соединениями, карбодиимидами и иминами в виде [2+2]-циклоприсоединения . В примере показан синтез β-лактама реакцией кетена с имином (см. Синтез Штаудингера ): [ 11 ] [ 12 ]
Приложения
[ редактировать ]Кетены, как правило, очень реакционноспособны и участвуют в различных циклоприсоединениях . Одним из важных процессов является димеризация с образованием пропиолактонов . Конкретным примером является димеризация кетена стеариновой кислоты с получением димеров алкилкетена , которые широко используются в бумажной промышленности. [ 1 ] AKD реагируют с гидроксильными группами целлюлозы посредством реакции этерификации .
Они также будут подвергаться реакциям [2+2] циклоприсоединения с богатыми электронами алкинами с образованием циклобутенонов или карбонильными группами с образованием бета- лактонов . С иминами образуются бета-лактамы. Это синтез Штаудингера, простой путь к этому важному классу соединений. С ацетоном кетен реагирует с образованием изопропенилацетата . [ 1 ]
Различные гидроксильные соединения могут присоединяться в качестве нуклеофилов, образуя либо енолы , либо сложноэфирные продукты. Например, молекула воды легко присоединяется к кетену с образованием 1,1-дигидроксиэтена , а уксусный ангидрид получается в результате реакции уксусной кислоты с кетеном. Реакции между диолами ( HO-R-OH ) и бис-кетоны ( O=C=CH-R'-CH=C=O ) дает полиэфиры с повторяющейся единицей ( −O-R-O-CO-R'-CO ).
Этилацетоацетат , важный исходный материал в органическом синтезе, можно получить, используя дикетен в реакции с этанолом . Они непосредственно образуют этилацетоацетат, и выход высок при проведении в контролируемых условиях; поэтому этот метод используется в промышленности.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д Миллер Р., Абечерли С., Саид А., Джексон Б. (2001). «Кетенес». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a15_063 . ISBN 978-3527306732 .
- ^ Сол Патай, изд. (1980). Кетены, аллены и родственные соединения: Часть 1, Том 1 . Химия функциональных групп ПАТАИ. Джон Уайли и сыновья. дои : 10.1002/9780470771600 . ISBN 9780470771600 . Сол Патай, изд. (1980). Кетены, аллены и родственные соединения: Часть 2, Том 2 . Химия функциональных групп ПАТАИ. Джон Уайли и сыновья. дои : 10.1002/9780470771617 . ISBN 9780471276708 .
- ^ Штаудингер Х (1905). «Кетены, новый класс веществ» [Кетены, новый класс веществ]. Отчеты Немецкого химического общества . 38 (2): 1735–1739. дои : 10.1002/cber.19050380283 .
- ^ Томас Т. Тидвелл, Первый век кетенесов (1905-2005): рождение семейства реактивных промежуточных продуктов, Angewandte Chemie, Int. Издание, Группа 44, 2005 г., С. 5778–5785.
- ^ Ма Н.Л., Вонг М. (2000). «Теоретическое исследование свойств и реакционной способности кетена, тиокетена и селенокетена» . Европейский журнал органической химии . 2000 (8): 1411_1421. doi : 10.1002/(SICI)1099-0690(200004)2000:8<1411::AID-EJOC1411>3.0.CO;2-N .
- ^ Справочник реагентов для органического синтеза, Серосодержащие реагенты , изд. Л.А. Пакетт, Wiley-VCH, 2010 г., ISBN 978-0-470-74872-5 , с. 535.
- ^ Карстен Плюг, Хусейн Канаани и Курт Вентруп (12 февраля 2015 г.). «Кетены из N-(2-пиридил)амидов». Австралийский химический журнал . 68 (4): 687. дои : 10.1071/CH14714 .
- ^ Пол Н.Д., Кирила А., Лу Х., Чжан Х.Р., де Брюин Б. (сентябрь 2013 г.). «Карбеновые радикалы в реакциях карбенилирования, катализируемых кобальтом (II)-порфирином; каталитический подход к кетенам» . Химия: Европейский журнал . 19 (39): 12953–8. дои : 10.1002/chem.201301731 . ПМЦ 4351769 . ПМИД 24038393 .
- ^ Кирила А., ван Влит К.М., Пол Н.Д., де Брюин Б. (2018). «[Co(MeTAA)] Металлорадикальный каталитический путь к кетенам посредством карбонилирования карбеновых радикалов» (PDF) . Европейский журнал неорганической химии . 2018 (20–21): 2251–2258. дои : 10.1002/ejic.201800101 . ISSN 1099-0682 .
- ^ Зигфрид Гауптманн (1985), Органическая химия: с 65 таблицами (на немецком языке), Лейпциг: Deutscher Verlag für Grundstoffindustrie, стр. 410–412, ISBN 3871449024
- ^ Цзе Джек Ли (2006), Назовите реакцию. Сборник подробных механизмов реакций (на немецком языке) (3-е изд.), Берлин: Springer-Verlag, стр. 561-562, doi : 10.1007/3-540-30031-7 , ISBN. 9783540300304
- ^ Герман Штаудингер (1907), «О знаниях кетенов. Дифенилкетен» , «Анналы химии» Юстуса Либиха (на немецком языке), том. 356, № 1–2, John Wiley & Sons, Inc., стр. 51–123, номер документа : 10.1002/jlac.19073560106.
Внешние ссылки
[ редактировать ] медиафайлы по теме: Кетенес Викискладе есть
медиафайлы по теме: Кетенес Викискладе есть