сера
 | ||||||||||||||||||||||||||||||||||||
| сера | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Альтернативное название | Сульфур (британское написание) | |||||||||||||||||||||||||||||||||||
| Аллотропы | см . Аллотропы серы | |||||||||||||||||||||||||||||||||||
| Появление | лимонно-желтого цвета. Спеченные микрокристаллы | |||||||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(С) | ||||||||||||||||||||||||||||||||||||
| Sulfur in the periodic table | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 16 | |||||||||||||||||||||||||||||||||||
| Group | group 16 (chalcogens) | |||||||||||||||||||||||||||||||||||
| Period | period 3 | |||||||||||||||||||||||||||||||||||
| Block | p-block | |||||||||||||||||||||||||||||||||||
| Electron configuration | [Ne] 3s2 3p4 | |||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 6 | |||||||||||||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | |||||||||||||||||||||||||||||||||||
| Melting point | alpha (α-S8): 388.36 K (115.21 °C, 239.38 °F) | |||||||||||||||||||||||||||||||||||
| Boiling point | 717.8 K (444.6 °C, 832.3 °F) | |||||||||||||||||||||||||||||||||||
| Density (near r.t.) | alpha (α-S8): 2.07 g/cm3 beta (β-S8): 1.96 g/cm3 gamma (γ-S8): 1.92 g/cm3 | |||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 1.819 g/cm3 | |||||||||||||||||||||||||||||||||||
| Critical point | 1314 K, 20.7 MPa | |||||||||||||||||||||||||||||||||||
| Heat of fusion | beta (β-S8): 1.727 kJ/mol | |||||||||||||||||||||||||||||||||||
| Heat of vaporization | beta (β-S8): 45 kJ/mol | |||||||||||||||||||||||||||||||||||
| Molar heat capacity | 22.75 J/(mol·K) | |||||||||||||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, −1, 0, +1, +2, +3, +4, +5, +6 (a strongly acidic oxide) | |||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.58 | |||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||
| Covalent radius | 105±3 pm | |||||||||||||||||||||||||||||||||||
| Van der Waals radius | 180 pm | |||||||||||||||||||||||||||||||||||
| Other properties | ||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | |||||||||||||||||||||||||||||||||||
| Crystal structure | alpha (α-S8): orthorhombic (oF128) | |||||||||||||||||||||||||||||||||||
| Lattice constants | a = 1.0460 nm b = 1.2861 nm c = 2.4481 nm (at 20 °C)[3] | |||||||||||||||||||||||||||||||||||
| Crystal structure | beta (β-S8): monoclinic (mP48) | |||||||||||||||||||||||||||||||||||
| Lattice constants | a = 1.0923 nm b = 1.0851 nm c = 1.0787 nm β = 95.905° (at 20 °C)[3] | |||||||||||||||||||||||||||||||||||
| Thermal conductivity | 0.205 W/(m⋅K) (amorphous) | |||||||||||||||||||||||||||||||||||
| Electrical resistivity | 2×1015 Ω⋅m (at 20 °C) (amorphous) | |||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[4] | |||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | alpha (α-S8): −15.5×10−6 cm3/mol (298 K)[5] | |||||||||||||||||||||||||||||||||||
| Bulk modulus | 7.7 GPa | |||||||||||||||||||||||||||||||||||
| Mohs hardness | 2.0 | |||||||||||||||||||||||||||||||||||
| CAS Number | 7704-34-9 | |||||||||||||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||||||||||||
| Discovery | before 2000 BCE[6] | |||||||||||||||||||||||||||||||||||
| Recognized as an element by | Antoine Lavoisier (1777) | |||||||||||||||||||||||||||||||||||
| Isotopes of sulfur | ||||||||||||||||||||||||||||||||||||
34S abundances vary greatly (between 3.96 and 4.77 percent) in natural samples. | ||||||||||||||||||||||||||||||||||||
Сера (также пишется «сера» на британском английском языке ) — химический элемент ; он имеет символ S и атомный номер 16. Он широко распространен , многовалентен и неметаллический . В обычных условиях атомы серы образуют циклические восьмиатомные молекулы с химической формулой S 8 . Элементарная сера представляет собой ярко-желтое кристаллическое твердое вещество при комнатной температуре .
Сера — десятый по массе элемент во Вселенной и пятый по распространенности на Земле. Хотя сера иногда встречается в чистой, самородной форме, на Земле она обычно встречается в виде сульфидных и сульфатных минералов . Будучи в изобилии в самородной форме, сера была известна еще в древние времена, ее использование упоминалось в древней Индии , древней Греции , Китае и древнем Египте . Исторически и в литературе серу еще называют серой . [7] что означает «горящий камень». [8] Сегодня почти вся элементарная сера производится как побочный продукт удаления серосодержащих примесей из природного газа и нефти . [9] [10] Наибольшее коммерческое использование элемента — производство серной кислоты для сульфатных и фосфорных удобрений и другие химические процессы. Сера используется в спичках , инсектицидах и фунгицидах . Многие соединения серы имеют запах, а запахи одорированного природного газа , запаха скунса , неприятного запаха изо рта , грейпфрута и чеснока обусловлены сероорганическими соединениями. Сероводород придает характерный запах гниению яиц и другим биологическим процессам.
Sulfur is an essential element for all life, almost always in the form of organosulfur compounds or metal sulfides. Amino acids (two proteinogenic: cysteine and methionine, and many other non-coded: cystine, taurine, etc.) and two vitamins (biotin and thiamine) are organosulfur compounds crucial for life. Many cofactors also contain sulfur, including glutathione, and iron–sulfur proteins. Disulfides, S–S bonds, confer mechanical strength and insolubility of the (among others) protein keratin, found in outer skin, hair, and feathers. Sulfur is one of the core chemical elements needed for biochemical functioning and is an elemental macronutrient for all living organisms.
Characteristics
[edit]Physical properties
[edit]
Sulfur forms several polyatomic molecules. The best-known allotrope is octasulfur, cyclo-S8. The point group of cyclo-S8 is D4d and its dipole moment is 0 D.[11] Octasulfur is a soft, bright-yellow solid that is odorless.[a] It melts at 115.21 °C (239.38 °F),[b] boils at 444.6 °C (832.3 °F).[7] At 95.2 °C (203.4 °F), below its melting temperature, cyclo-octasulfur begins slow changing from α-octasulfur to the β-polymorph.[13] The structure of the S8 ring is virtually unchanged by this phase change, which affects the intermolecular interactions. Cooling of molten sulfur gives freezing point in 119.6 °C (247.3 °F),[14] as it predominantly consists of the β-S8 molecules.[c] Between its melting and boiling temperatures, octasulfur changes its allotrope again, turning from β-octasulfur to γ-sulfur, again accompanied by a lower density but increased viscosity due to the formation of polymers.[13] At higher temperatures, the viscosity decreases as depolymerization occurs. Molten sulfur assumes a dark red color above 200 °C (392 °F). The density of sulfur is about 2 g/cm3, depending on the allotrope; all of the stable allotropes are excellent electrical insulators.
Sulfur sublimes more or less between 20 °C (68 °F) and 50 °C (122 °F).[18]
Sulfur is insoluble in water but soluble in carbon disulfide and, to a lesser extent, in other nonpolar organic solvents, such as benzene and toluene.
Chemical properties
[edit]Under normal conditions, sulfur hydrolyzes very slowly to mainly form hydrogen sulfide and sulfuric acid:
8 + 4 H
2O → 3 H
2S + H
2SO
4
The reaction involves adsorption of protons onto S
8 clusters, followed by disproportionation into the reaction products.[19]
The second, fourth and sixth ionization energies of sulfur are 2252 kJ/mol, 4556 kJ/mol and 8495.8 kJ/mol, respectively. A composition of products of sulfur's reactions with oxidants (and its oxidation state) depends on that whether releasing out of a reaction energy overcomes these thresholds. Applying catalysts and / or supply of outer energy may vary sulfur's oxidation state and a composition of reaction products. While reaction between sulfur and oxygen at normal conditions gives sulfur dioxide (oxidation state +4), formation of sulfur trioxide (oxidation state +6) requires temperature 400–600 °C (750–1,100 °F) and presence of a catalyst.
In reactions with elements of lesser electronegativity, it reacts as an oxidant and forms sulfides, where it has oxidation state −2.
Sulfur reacts with nearly all other elements with the exception of the noble gases, even with the notoriously unreactive metal iridium (yielding iridium disulfide).[20] Some of those reactions need elevated temperatures.[21]
Allotropes
[edit]
Sulfur forms over 30 solid allotropes, more than any other element.[22] Besides S8, several other rings are known.[23] Removing one atom from the crown gives S7, which is of a deeper yellow than S8. HPLC analysis of "elemental sulfur" reveals an equilibrium mixture of mainly S8, but with S7 and small amounts of S6.[24] Larger rings have been prepared, including S12 and S18.[25][26]
Amorphous or "plastic" sulfur is produced by rapid cooling of molten sulfur—for example, by pouring it into cold water. X-ray crystallography studies show that the amorphous form may have a helical structure with eight atoms per turn. The long coiled polymeric molecules make the brownish substance elastic, and in bulk this form has the feel of crude rubber. This form is metastable at room temperature and gradually reverts to the crystalline molecular allotrope, which is no longer elastic. This process happens within a matter of hours to days, but can be rapidly catalyzed.
Isotopes
[edit]Sulfur has 23 known isotopes, four of which are stable: 32S (94.99%±0.26%), 33S (0.75%±0.02%), 34S (4.25%±0.24%), and 36S (0.01%±0.01%).[27][28] Other than 35S, with a half-life of 87 days, the radioactive isotopes of sulfur have half-lives less than 3 hours.
The preponderance of 32S is explained by its production in the so-called alpha-process (one of the main classes of nuclear fusion reactions) in exploding stars. Other stable sulfur isotopes are produced in the bypass processes related with 34Ar, and their composition depends on a type of a stellar explosion. For example, proportionally more 33S comes from novae than from supernovae.[29]
On the planet Earth the sulfur isotopic composition was determined by the Sun. Though it is assumed that the distribution of different sulfur isotopes should be more or less equal, it has been found that proportions of two most abundant sulfur isotopes 32S and 34S varies in different samples. Assaying of these isotopes ratio (δ34S) in the samples allows to make suggestions about their chemical history, and with support of other methods, it allows to age-date the samples, estimate temperature of equilibrium between ore and water, determine pH and oxygen fugacity, identify the activity of sulfate-reducing bacteria in the time of formation of the sample, or suggest the main sources of sulfur in ecosystems.[30] However, there are ongoing discussions about what is the real reason of the δ34S shifts, biological activity or postdeposital alteration.[31]
For example, when sulfide minerals are precipitated, isotopic equilibration among solids and liquid may cause small differences in the δ34S values of co-genetic minerals. The differences between minerals can be used to estimate the temperature of equilibration. The δ13C and δ34S of coexisting carbonate minerals and sulfides can be used to determine the pH and oxygen fugacity of the ore-bearing fluid during ore formation.
Scientists measure the sulfur isotopes of minerals in rocks and sediments to study the redox conditions in the oceans in the past. Sulfate-reducing bacteria in marine sediment fractionate sulfur isotopes as they take in sulfate and produce sulfide. Prior to the 2010s, it was thought that sulfate reduction could fractionate sulfur isotopes up to 46 permil[32] and fractionation larger than 46 permil recorded in sediments must be due to disproportionation of sulfur compounds in the sediment. This view has changed since the 2010s as experiments show that sulfate-reducing bacteria can fractionate to 66 permil.[33] As substrates for disproportionation are limited by the product of sulfate reduction, the isotopic effect of disproportionation should be less than 16 permil in most sedimentary settings.[34]
In most forest ecosystems, sulfate is derived mostly from the atmosphere; weathering of ore minerals and evaporites contribute some sulfur. Sulfur with a distinctive isotopic composition has been used to identify pollution sources, and enriched sulfur has been added as a tracer in hydrologic studies. Differences in the natural abundances can be used in systems where there is sufficient variation in the 34S of ecosystem components. Rocky Mountain lakes thought to be dominated by atmospheric sources of sulfate have been found to have measurably different 34S values than lakes believed to be dominated by watershed sources of sulfate.
The radioactive 35S is formed in cosmic ray spallation of the atmospheric 40Ar. This fact may be used for proving the presence of recent (not more than 1 year) atmospheric sediments in various things. This isotope may be obtained artificially by different ways. In practice, the reaction 35Cl + n → 35S + p is used by irradiating potassium chloride with neutrons.[35] The isotope 35S is used in various sulfur-containing compounds as a radioactive tracer for many biological studies, for example, the Hershey-Chase experiment.
Because of the weak beta activity of 35S, its compounds are relatively safe as long as they are not ingested or absorbed by the body.[36]
Natural occurrence
[edit]



32S is created inside massive stars, at a depth where the temperature exceeds 2.5×109 K, by the fusion of one nucleus of silicon plus one nucleus of helium.[37] As this nuclear reaction is part of the alpha process that produces elements in abundance, sulfur is the 10th most common element in the universe.
Sulfur, usually as sulfide, is present in many types of meteorites. Ordinary chondrites contain on average 2.1% sulfur, and carbonaceous chondrites may contain as much as 6.6%. It is normally present as troilite (FeS), but there are exceptions, with carbonaceous chondrites containing free sulfur, sulfates and other sulfur compounds.[38] The distinctive colors of Jupiter's volcanic moon Io are attributed to various forms of molten, solid, and gaseous sulfur.[39] In July 2024, elemental sulfur was confirmed to exist on Mars by surprise, after the Curiosity rover ran over and crushed a rock revealing sulfur crystals inside it.[40]
It is the fifth most common element by mass in the Earth. Elemental sulfur can be found near hot springs and volcanic regions in many parts of the world, especially along the Pacific Ring of Fire; such volcanic deposits are currently mined in Indonesia, Chile, and Japan. These deposits are polycrystalline, with the largest documented single crystal measuring 22 cm × 16 cm × 11 cm (8.7 in × 6.3 in × 4.3 in).[41] Historically, Sicily was a major source of sulfur in the Industrial Revolution.[42] Lakes of molten sulfur up to about 200 m (660 ft) in diameter have been found on the sea floor, associated with submarine volcanoes, at depths where the boiling point of water is higher than the melting point of sulfur.[43]
Native sulfur is synthesised by anaerobic bacteria acting on sulfate minerals such as gypsum in salt domes.[44][45] Significant deposits in salt domes occur along the coast of the Gulf of Mexico, and in evaporites in eastern Europe and western Asia. Native sulfur may be produced by geological processes alone. Fossil-based sulfur deposits from salt domes were once the basis for commercial production in the United States, Russia, Turkmenistan, and Ukraine.[46] Currently, commercial production is still carried out in the Osiek mine in Poland. Such sources are now of secondary commercial importance, and most are no longer worked.
Common naturally occurring sulfur compounds include the sulfide minerals, such as pyrite (iron sulfide), cinnabar (mercury sulfide), galena (lead sulfide), sphalerite (zinc sulfide), and stibnite (antimony sulfide); and the sulfate minerals, such as gypsum (calcium sulfate), alunite (potassium aluminium sulfate), and barite (barium sulfate). On Earth, just as upon Jupiter's moon Io, elemental sulfur occurs naturally in volcanic emissions, including emissions from hydrothermal vents.
The main industrial source of sulfur is now petroleum and natural gas.[9]
Compounds
[edit]Common oxidation states of sulfur range from −2 to +6. Sulfur forms stable compounds with all elements except the noble gases.
Electron transfer reactions
[edit]
3)
Sulfur polycations, S2+8, S2+4 and S2+16 are produced when sulfur is reacted with oxidising agents in a strongly acidic solution.[47] The colored solutions produced by dissolving sulfur in oleum were first reported as early as 1804 by C. F. Bucholz, but the cause of the color and the structure of the polycations involved was only determined in the late 1960s. S2+8 is deep blue, S2+4 is yellow and S2+16 is red.[13]
Reduction of sulfur gives various polysulfides with the formula S2−
x, many of which have been obtained in crystalline form. Illustrative is the production of sodium tetrasulfide:
Some of these dianions dissociate to give radical anions, such as S−3 gives the blue color of the rock lapis lazuli.

This reaction highlights a distinctive property of sulfur: its ability to catenate (bind to itself by formation of chains). Protonation of these polysulfide anions produces the polysulfanes, H2Sx, where x = 2, 3, and 4.[49] Ultimately, reduction of sulfur produces sulfide salts:
The interconversion of these species is exploited in the sodium–sulfur battery.
Hydrogenation
[edit]Treatment of sulfur with hydrogen gives hydrogen sulfide. When dissolved in water, hydrogen sulfide is mildly acidic:[7]
Hydrogen sulfide gas and the hydrosulfide anion are extremely toxic to mammals, due to their inhibition of the oxygen-carrying capacity of hemoglobin and certain cytochromes in a manner analogous to cyanide and azide (see below, under precautions).
Combustion
[edit]The two principal sulfur oxides are obtained by burning sulfur:
Many other sulfur oxides are observed including the sulfur-rich oxides include sulfur monoxide, disulfur monoxide, disulfur dioxides, and higher oxides containing peroxo groups.
Halogenation
[edit]Sulfur reacts with fluorine to give the highly reactive sulfur tetrafluoride and the highly inert sulfur hexafluoride.[50] Whereas fluorine gives S(IV) and S(VI) compounds, chlorine gives S(II) and S(I) derivatives. Thus, sulfur dichloride, disulfur dichloride, and higher chlorosulfanes arise from the chlorination of sulfur. Sulfuryl chloride and chlorosulfuric acid are derivatives of sulfuric acid; thionyl chloride (SOCl2) is a common reagent in organic synthesis.[51] Bromine also oxidizes sulfur to form sulfur dibromide and disulfur dibromide.[51]
Pseudohalides
[edit]Sulfur oxidizes cyanide and sulfite to give thiocyanate and thiosulfate, respectively.
Metal sulfides
[edit]Sulfur reacts with many metals. Electropositive metals give polysulfide salts. Copper, zinc, and silver are attacked by sulfur; see tarnishing. Although many metal sulfides are known, most are prepared by high temperature reactions of the elements.[52] Geoscientists also study the isotopes of metal sulfides in rocks and sediment to study environmental conditions in the Earth's past.[53]
Organic compounds
[edit]- Illustrative organosulfur compounds
- (L)-cysteine, an amino acid containing a thiol group
- Methionine, an amino acid containing a thioether
- Thiamine or vitamin B1
- Biotin or vitamin B7
- Penicillin, an antibiotic ("R" is the variable group)
- Allicin, a chemical compound in garlic
- Diphenyl disulfide, a representative disulfide
- Dibenzothiophene, a component of crude oil
- Perfluorooctanesulfonic acid (PFOS), a surfactant
Some of the main classes of sulfur-containing organic compounds include the following:[54]
- Thiols or mercaptans (so called because they capture mercury as chelators) are the sulfur analogs of alcohols; treatment of thiols with base gives thiolate ions.
- Thioethers are the sulfur analogs of ethers.
- Sulfonium ions have three groups attached to a cationic sulfur center. Dimethylsulfoniopropionate (DMSP) is one such compound, important in the marine organic sulfur cycle.
- Sulfoxides and sulfones are thioethers with one and two oxygen atoms attached to the sulfur atom, respectively. The simplest sulfoxide, dimethyl sulfoxide, is a common solvent; a common sulfone is sulfolane.
- Sulfonic acids are used in many detergents.
Compounds with carbon–sulfur multiple bonds are uncommon, an exception being carbon disulfide, a volatile colorless liquid that is structurally similar to carbon dioxide. It is used as a reagent to make the polymer rayon and many organosulfur compounds. Unlike carbon monoxide, carbon monosulfide is stable only as an extremely dilute gas, found between solar systems.[55]
Organosulfur compounds are responsible for some of the unpleasant odors of decaying organic matter. They are widely known as the odorant in domestic natural gas, garlic odor, and skunk spray, as well as a component of bad breath odor. Not all organic sulfur compounds smell unpleasant at all concentrations: the sulfur-containing monoterpenoid grapefruit mercaptan in small concentrations is the characteristic scent of grapefruit, but has a generic thiol odor at larger concentrations. Sulfur mustard, a potent vesicant, was used in World War I as a disabling agent.[56]
Sulfur–sulfur bonds are a structural component used to stiffen rubber, similar to the disulfide bridges that rigidify proteins (see biological below). In the most common type of industrial "curing" or hardening and strengthening of natural rubber, elemental sulfur is heated with the rubber to the point that chemical reactions form disulfide bridges between isoprene units of the polymer. This process, patented in 1843, made rubber a major industrial product, especially in automobile tires. Because of the heat and sulfur, the process was named vulcanization, after the Roman god of the forge and volcanism.
History
[edit]Antiquity
[edit]
Being abundantly available in native form, sulfur was known in ancient times and is referred to in the Torah (Genesis). English translations of the Christian Bible commonly referred to burning sulfur as "brimstone", giving rise to the term "fire-and-brimstone" sermons, in which listeners are reminded of the fate of eternal damnation that await the unbelieving and unrepentant. It is from this part of the Bible[57] that Hell is implied to "smell of sulfur" (likely due to its association with volcanic activity). According to the Ebers Papyrus, a sulfur ointment was used in ancient Egypt to treat granular eyelids. Sulfur was used for fumigation in preclassical Greece;[58] this is mentioned in the Odyssey.[59] Pliny the Elder discusses sulfur in book 35 of his Natural History, saying that its best-known source is the island of Melos. He mentions its use for fumigation, medicine, and bleaching cloth.[60]
A natural form of sulfur known as shiliuhuang (石硫黄) was known in China since the 6th century BC and found in Hanzhong.[61] By the 3rd century, the Chinese had discovered that sulfur could be extracted from pyrite.[61] Chinese Daoists were interested in sulfur's flammability and its reactivity with certain metals, yet its earliest practical uses were found in traditional Chinese medicine.[61] The Wujing Zongyao of 1044 AD described various formulas for Chinese black powder, which is a mixture of potassium nitrate (KNO
3), charcoal, and sulfur.[62]
Indian alchemists, practitioners of the "science of chemicals" (Sanskrit: रसशास्त्र, romanized: rasaśāstra), wrote extensively about the use of sulfur in alchemical operations with mercury, from the eighth century AD onwards.[64] In the rasaśāstra tradition, sulfur is called "the smelly" (गन्धक, gandhaka).
Early European alchemists gave sulfur a unique alchemical symbol, a triangle atop a cross (🜍). (This is sometimes confused with the astronomical crossed-spear symbol ⚴ for 2 Pallas.) The variation known as brimstone has a symbol combining a two-barred cross atop a lemniscate (🜏). In traditional skin treatment, elemental sulfur was used (mainly in creams) to alleviate such conditions as scabies, ringworm, psoriasis, eczema, and acne. The mechanism of action is unknown—though elemental sulfur does oxidize slowly to sulfurous acid, which is (through the action of sulfite) a mild reducing and antibacterial agent.[65][66][67]
Modern times
[edit]
Sulfur appears in a column of fixed (non-acidic) alkali in a chemical table of 1718.[69] Antoine Lavoisier used sulfur in combustion experiments, writing of some of these in 1777.[70]
Sulfur deposits in Sicily were the dominant source for more than a century. By the late 18th century, about 2,000 tonnes per year of sulfur were imported into Marseille, France, for the production of sulfuric acid for use in the Leblanc process. In industrializing Britain, with the repeal of tariffs on salt in 1824, demand for sulfur from Sicily surged upward. The increasing British control and exploitation of the mining, refining, and transportation of the sulfur, coupled with the failure of this lucrative export to transform Sicily's backward and impoverished economy, led to the Sulfur Crisis of 1840, when King Ferdinand II gave a monopoly of the sulfur industry to a French firm, violating an earlier 1816 trade agreement with Britain. A peaceful solution was eventually negotiated by France.[71][72]
In 1867, elemental sulfur was discovered in underground deposits in Louisiana and Texas. The highly successful Frasch process was developed to extract this resource.[73]
In the late 18th century, furniture makers used molten sulfur to produce decorative inlays.[74] Molten sulfur is sometimes still used for setting steel bolts into drilled concrete holes where high shock resistance is desired for floor-mounted equipment attachment points. Pure powdered sulfur was used as a medicinal tonic and laxative.[46]
With the advent of the contact process, the majority of sulfur today is used to make sulfuric acid for a wide range of uses, particularly fertilizer.[75]
In recent times, the main source of sulfur has become petroleum and natural gas. This is due to the requirement to remove sulfur from fuels in order to prevent acid rain, and has resulted in a surplus of sulfur.[9]
Spelling and etymology
[edit]Sulfur is derived from the Latin word sulpur, which was Hellenized to sulphur in the erroneous belief that the Latin word came from Greek. This spelling was later reinterpreted as representing an /f/ sound and resulted in the spelling sulfur, which appears in Latin toward the end of the Classical period. The true Ancient Greek word for sulfur, θεῖον, theîon (from earlier θέειον, théeion), is the source of the international chemical prefix thio-. The Modern Standard Greek word for sulfur is θείο, theío.
In 12th-century Anglo-French, it was sulfre. In the 14th century, the erroneously Hellenized Latin -ph- was restored in Middle English sulphre. By the 15th century, both full Latin spelling variants sulfur and sulphur became common in English. The parallel f~ph spellings continued in Britain until the 19th century, when the word was standardized as sulphur.[76] On the other hand, sulfur was the form chosen in the United States, whereas Canada uses both.
The IUPAC adopted the spelling sulfur in 1990[77][78] as did the Nomenclature Committee of the Royal Society of Chemistry in 1992, restoring the spelling sulfur to Britain.[79] Oxford Dictionaries note that "in chemistry and other technical uses ... the -f- spelling is now the standard form for this and related words in British as well as US contexts, and is increasingly used in general contexts as well."[80]
Production
[edit]

Серу можно найти саму по себе, и исторически ее обычно получали именно в этой форме; пирит также был источником серы. [81] В вулканических районах Сицилии в древние времена ее находили на поверхности Земли, при этом использовали « сицилийский процесс »: залежи серы складывали и укладывали в кирпичные печи, построенные на наклонных склонах холмов, с воздушным пространством между ними. Затем часть серы была распылена, распределена по сложенной руде и подожжена, в результате чего свободная сера растаяла с холмов. В конце концов поверхностные отложения иссякли, и горняки начали выкапывать жилы, которые в конечном итоге усеяли сицилийский ландшафт лабиринтными шахтами. Горное дело было немеханизированным и трудоемким: пикники вытаскивали руду из камня, а горняки или карузи выносили корзины с рудой на поверхность, часто через туннели длиной в милю или более. Как только руда оказывалась на поверхности, ее измельчали и извлекали в плавильных печах. Условия на сицилийских серных рудниках были ужасающими, что побудило Букера Т. Вашингтона написать: «Я не готов прямо сейчас сказать, до какой степени я верю в физический ад на том свете, но серные рудники на Сицилии — это самое близкое к этому. в ад, который я ожидаю увидеть в этой жизни». [82] Серу до сих пор добывают из поверхностных месторождений в более бедных странах с вулканами, таких как Индонезия , и условия труда не сильно улучшились со времен Букера Т. Вашингтона. [83]
Элементарную серу добывали из соляных куполов (в которых она иногда встречается почти в чистом виде) до конца 20 века. Сера теперь производится как побочный продукт других промышленных процессов, например, при нефтепереработке, где сера нежелательна. Считается, что самородная сера под соляными куполами является минералом ископаемого минерального ресурса, образующегося в результате действия анаэробных бактерий на сульфатные отложения. Его удаляли из таких шахт с соляными куполами в основном с помощью процесса Фраша . [46] В этом методе перегретая вода закачивалась в месторождение самородной серы для плавления серы, а затем сжатый воздух возвращал расплавленный продукт чистотой 99,5% на поверхность. На протяжении всего ХХ века в результате этой процедуры производилась элементарная сера, не требующая дальнейшей очистки. Из-за ограниченного количества таких месторождений серы и высокой стоимости их разработки этот процесс добычи серы широко не использовался нигде в мире с 2002 года. [84] [85]

Сегодня сера производится из нефти, природного газа и связанных с ними ископаемых ресурсов, из которых ее получают главным образом в виде сероводорода . [9] Сероорганические соединения , нежелательные примеси в нефти, можно улучшить, подвергнув их гидрообессериванию , которое расщепляет связи C–S: [84] [85]
Образующийся в результате этого процесса сероводород, а также, как он встречается в природном газе, преобразуется в элементарную серу с помощью процесса Клауса . Этот процесс влечет за собой окисление некоторого количества сероводорода до диоксида серы, а затем пропорциональное соотношение : их [84] [85]
Из-за высокого содержания серы в нефтеносных песках Атабаски запасы элементарной серы, образующейся в результате этого процесса, теперь существуют по всей Альберте , Канада. [86] Другой способ хранения серы — использование ее в качестве связующего вещества для бетона, при этом полученный продукт обладает некоторыми желаемыми свойствами (см. серный бетон ). [87]
Мировое производство серы в 2011 году составило 69 миллионов тонн (Мт), причем более 15 стран внесли более 1 Мт каждая. Странами, производящими более 5 млн тонн, являются Китай (9,6), США (8,8), Канада (7,1) и Россия (7,1). [88] Производство медленно увеличивалось с 1900 по 2010 год; цена была нестабильной в 1980-х годах и примерно в 2010 году. [89]
Приложения
[ редактировать ]Серная кислота
[ редактировать ]Элементарная сера используется главным образом в качестве прекурсора для других химических веществ. Примерно 85% (1989 г.) переводится в серную кислоту (H 2 SO 4 ):

В 2010 году в США было произведено больше серной кислоты, чем любого другого неорганического промышленного химиката. [89] Основное применение кислоты – добыча фосфоритных руд для производства удобрений. Другие области применения серной кислоты включают нефтепереработку, переработку сточных вод и добычу полезных ископаемых. [46]
Другой важный химический состав серы
[ редактировать ]Сера вступает в непосредственную реакцию с метаном с образованием сероуглерода , который используется для производства целлофана и вискозы . [46] Одним из применений элементарной серы является вулканизация каучука, при которой полисульфидные цепи сшивают органические полимеры. Большие количества сульфитов используются для отбеливания бумаги и консервирования сухофруктов . Многие поверхностно-активные вещества и моющие средства (например , лаурилсульфат натрия ) являются производными сульфатов. Сульфат кальция и гипс (CaSO 4 ·2H 2 добываются в объеме 100 миллионов тонн O) ежегодно для использования в портландцементе и удобрениях.
на основе серебра Когда фотография натрия и аммония тиосульфаты была широко распространена, в качестве «фиксаторов» широко использовались . Сера входит в состав пороха («черный порох»).
Удобрения
[ редактировать ]Аминокислоты, синтезируемые живыми организмами, такие как метионин и цистеин, содержат сероорганические группы ( тиоэфирные и тиоловые соответственно). Антиоксидант защищающий глутатион, многие живые организмы от свободных радикалов и окислительного стресса, также содержит органическую серу. Некоторые культуры, такие как лук и чеснок, также производят различные сероорганические соединения , такие как син -пропанетиал- S -оксид, вызывающий раздражение слез (лук), или диаллилдисульфид и аллицин (чеснок). Сульфаты , обычно встречающиеся в почвах и грунтовых водах, часто являются достаточным естественным источником серы для растений и бактерий. Атмосферные выпадения диоксида серы (SO 2 ) также являются распространенным искусственным источником ( сжигание угля ) серы для почв. В обычных условиях в большинстве сельскохозяйственных почв сера не является лимитирующим питательным веществом для растений и микроорганизмов (см. бочку Либиха ). Однако при некоторых обстоятельствах почвы могут быть обеднены сульфатами , например, если они позже выщелачиваются метеоритными водами ( дождями ) или если потребность в сере для некоторых типов сельскохозяйственных культур высока. Это объясняет, что сера все чаще признается и используется в качестве компонента удобрения . Наиболее важной формой серы для удобрений является сульфат кальция , обычно встречающийся в природе в виде минерального гипса (CaSO 4 ·2H 2 O). Элементарная сера гидрофобна (не растворяется в воде) и не может использоваться непосредственно растениями. Элементарную серу (ES) иногда смешивают с бентонитом , чтобы улучшить истощенные почвы для культур с высокой потребностью в органической сере. Со временем окисления абиотические процессы воздуха кислородом и почвенными бактериями могут окислять и превращать элементарную серу в растворимые производные, которые затем могут быть использованы микроорганизмами и растениями. Сера повышает эффективность других важных питательных веществ для растений, особенно азота и фосфора. [90] Частицы серы, полученные биологическим путем, естественным образом гидрофильны благодаря биополимерному покрытию, и их легче рассеивать по земле при распылении разбавленной навозной жижи, что приводит к более быстрому поглощению растениями.
Потребность растений в сере равна или превышает потребность растений в фосфоре . Это важное питательное вещество для роста растений, образования корневых клубеньков бобовых, а также иммунитета и защитных систем. Дефицит серы получил широкое распространение во многих странах Европы. [91] [92] [93] Поскольку поступления серы в атмосферу продолжают снижаться, дефицит поступления/выведения серы, вероятно, будет увеличиваться, если не будут использоваться серные удобрения. Поступление серы в атмосферу снижается благодаря действиям, предпринятым для ограничения кислотных дождей . [94] [90]
Фунгициды и пестициды
[ редактировать ]
Элементарная сера — один из старейших фунгицидов и пестицидов . «Дустрирующая сера», элементарная сера в порошкообразной форме, является распространенным фунгицидом для винограда, клубники, многих овощей и ряда других культур. Обладает хорошей эффективностью против широкого спектра заболеваний мучнистой росы , а также черной пятнистости. В органическом производстве сера является наиболее важным фунгицидом. Это единственный фунгицид, используемый при выращивании яблок в органических хозяйствах против основного заболевания парши яблонь в более холодных условиях. Биосера (биологически полученная элементарная сера с гидрофильными характеристиками) также может использоваться для этих целей.
Сера для опудривания стандартной рецептуры вносится в посевы с помощью сероопылителя или с помощью самолета для опудривания . Смачиваемая сера – это коммерческое название пылеобразной серы, в состав которой входят дополнительные ингредиенты, обеспечивающие смешивание с водой . [87] [95] Он имеет аналогичное применение и используется в качестве фунгицида против плесени и других проблем, связанных с плесенью растений и почвы.
Порошок элементарной серы используется как « органический «зеленый») инсектицид (фактически акарицид против клещей ) » (то есть . Распространенный метод применения — припудривание одежды или конечностей порошком серы.
Разбавленный раствор извести-серы (полученный путем соединения гидроксида кальция с элементарной серой в воде) используется в качестве ванночки для домашних животных для уничтожения стригущего лишая (грибка) , чесотки и других дерматозов и паразитов .
Серные свечи из почти чистой серы сжигались для окуривания построек и винных бочек, но теперь считаются слишком токсичными для жилых домов.
Фармацевтика
[ редактировать ]Сера (в частности, октасульфур , S 8 ) используется в фармацевтических препаратах для кожи для лечения прыщей и других состояний. Он действует как кератолитический агент, а также убивает бактерии, грибки, чесоточных клещей и других паразитов. [96] Осажденная сера и коллоидная сера используются в виде лосьонов , кремов, порошков, мыла и добавок для ванн для лечения обыкновенных угрей , розовых угрей и себорейного дерматита . [97]
Многие лекарства содержат серу. [98] Ранние примеры включают антибактериальные сульфаниламиды , известные как сульфамидные препараты . Более свежий пример — муколитический ацетилцистеин . Сера входит в состав многих защитных молекул бактерий. Большинство β-лактамных антибиотиков, включая пенициллины , цефалоспорины и монобактамы , содержат серу. [54]
Батареи
[ редактировать ]Из-за их высокой плотности энергии и наличия серы продолжаются исследования по созданию перезаряжаемых литий-серных батарей . До сих пор карбонатные электролиты вызывали выходы из строя таких аккумуляторов после одного цикла. В феврале 2022 года исследователи из Университета Дрекселя не только создали прототип батареи, выдержавшей 4000 циклов перезарядки, но и обнаружили первую моноклинную гамма-серу, которая оставалась стабильной при температуре ниже 95 градусов по Цельсию. [99]
Биологическая роль
[ редактировать ]Сера является важным компонентом всех живых клеток . Это восьмой по распространенности элемент в организме человека по весу. [100] примерно равен по содержанию калию и немного больше, чем натрию и хлору . [101] Человеческое тело массой 70 кг (150 фунтов) содержит около 140 граммов (4,9 унции) серы. [102] Основным пищевым источником серы для человека являются серосодержащие аминокислоты. [103] которые содержатся в растительных и животных белках. [104]
Перенос серы между неорганическими и биомолекулами
[ редактировать ]В 1880-х годах, изучая Beggiatoa (бактерию, живущую в богатой серой среде), Сергей Виноградский обнаружил, что она окисляет сероводород (H 2 S) в качестве источника энергии, образуя внутриклеточные капли серы. Эту форму обмена Виноградский назвал инороксидацией (окислением неорганических соединений). [105] Другим автором, который продолжил его изучение, был Селман Ваксман . [106] Примитивные бактерии, обитающие вокруг глубоких океанских вулканических жерл, окисляют сероводород для питания, как обнаружил Роберт Баллард . [10]
Окислители серы могут использовать в качестве источников энергии восстановленные соединения серы, в том числе сероводород, элементарную серу, сульфит , тиосульфат и различные политионаты (например, тетратионаты ). [107] Они зависят от таких ферментов, как серная оксигеназа и сульфитоксидаза, которые окисляют серу до сульфата. Некоторые литотрофы могут даже использовать энергию, содержащуюся в соединениях серы, для производства сахаров — процесс, известный как хемосинтез . Некоторые бактерии и археи используют сероводород вместо воды в качестве донора электронов при хемосинтезе — процессе, похожем на фотосинтез , при котором образуются сахара и используется кислород в качестве акцептора электронов . Хемосинтез на основе серы можно упрощенно сравнить с фотосинтезом:
Существуют бактерии, сочетающие эти два способа питания: зеленые серобактерии и пурпурные серобактерии . [108] Также сероокисляющие бактерии могут вступать в симбиоз с более крупными организмами, позволяя последним использовать сероводород в качестве пищи для окисления. Пример: гигантский трубчатый червь . [109]
Существуют сульфатредуцирующие бактерии , которые, напротив, «дышат сульфатом» вместо кислорода. В качестве источника энергии они используют органические соединения или молекулярный водород. Они используют серу в качестве акцептора электронов и восстанавливают различные окисленные соединения серы обратно в сульфид, часто в сероводород. Они могут расти на других частично окисленных соединениях серы (например, тиосульфатах, тионатах, полисульфидах, сульфитах).
Есть исследования, указывающие на то, что многие месторождения самородной серы в местах, бывших дном древних океанов, имеют биологическое происхождение. [110] [111] [112] Эти исследования показывают, что эта самородная сера была получена в результате биологической активности, но что за это отвечает (сероокисляющие бактерии или сульфатредуцирующие бактерии) до сих пор точно неизвестно.
Сера поглощается растений корнями из почвы в виде сульфата и транспортируется в виде эфира фосфорной кислоты. Сульфат восстанавливается до сульфида через сульфит, прежде чем он включается в цистеин и другие сераорганические соединения. [113]
В то время как роль растений в передаче серы животным по пищевым цепям более или менее понятна, роль серобактерий только исследуется. [114] [115]
Белок и органические метаболиты
[ редактировать ]У всех форм жизни большая часть серы содержится в двух протеиногенных аминокислотах ( цистеине и метионине ), поэтому элемент присутствует во всех белках , содержащих эти аминокислоты, а также в соответствующих пептидах . [116] Часть серы содержится в некоторых метаболитах, многие из которых являются кофакторами , и сульфатированных полисахаридах соединительной ткани ( хондроитинсульфаты , гепарин ).
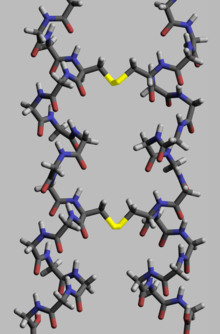
Белкам для выполнения своей биологической функции необходима определенная пространственная геометрия. Формирование этой геометрии осуществляется в процессе, называемом сворачиванием белка , и обеспечивается внутри- и межмолекулярными связями. Процесс имеет несколько этапов. Если на начальных стадиях полипептидная цепь сворачивается за счет водородных связей , то на более поздних стадиях сворачивание обеспечивается (помимо водородных связей) ковалентными связями между двумя атомами серы двух остатков цистеина (так называемые дисульфидные мостики) в разных местах цепи (третичные связи). структура белка), а также между двумя остатками цистеина в двух отдельных субъединицах белка (четвертичная структура белка). Обе структуры легко можно увидеть в инсулине . Поскольку энергия связи ковалентного дисульфидного мостика выше, чем энергия координационной связи или гидрофобного взаимодействия, более высокое содержание дисульфидных мостиков приводит к более высокой энергии, необходимой для денатурации белка . В целом дисульфидные связи необходимы в белках, функционирующих вне клеточного пространства, и они не меняют конформацию (геометрию) белка, а служат его стабилизаторами. [117] В цитоплазме цистеиновые остатки белков сохраняются в восстановленном состоянии (т.е. в форме -SH) тиоредоксинами . [118]
Это свойство проявляется в следующих примерах. Лизоцим достаточно стабилен, чтобы его можно было применять в качестве лекарственного средства. [119] Перья и волосы обладают относительной прочностью, а содержащийся в них кератин считается неперевариваемым большинством организмов. Однако существуют грибы и бактерии, содержащие кератиназу и способные разрушать кератин.
Многие важные клеточные ферменты используют простетические группы, оканчивающиеся на фрагменты -SH, для проведения реакций с участием ацилсодержащих биохимических веществ: двумя распространенными примерами основного метаболизма являются коэнзим А и альфа-липоевая кислота . [120] Связанные с цистеином метаболиты гомоцистеин и таурин — другие серосодержащие аминокислоты, сходные по строению, но не кодируемые ДНК и не входящие в первичную структуру белков, принимают участие в различных местах физиологии млекопитающих. [121] [122] Два из 13 классических витаминов, биотин и тиамин , содержат серу и служат кофакторами нескольких ферментов. [123] [124] Во внутриклеточной химии сера действует как переносчик восстанавливающего водорода и его электронов для клеточного восстановления окисления. Восстановленный глутатион , серосодержащий трипептид, является восстановителем благодаря своей сульфгидрильной (–SH) части, полученной из цистеина .
Метаногенез , путь к большей части метана в мире, представляет собой многоступенчатую биохимическую трансформацию углекислого газа . Для этого преобразования требуется несколько сераорганических кофакторов. К ним относятся коэнзим М , CH 3 SCH 2 CH 2 SO - 3 , непосредственный предшественник метана . [125]
Металлопротеины и неорганические кофакторы
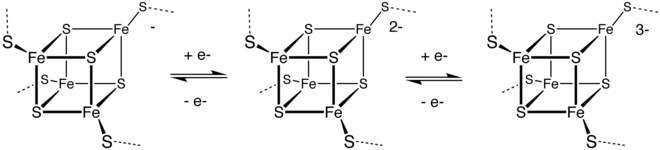
[ редактировать ]Металлопротеины, в которых активным центром является ион переходного металла (или кластер сульфида металла), часто координируемый атомами серы остатков цистеина. [126] — являются важными компонентами ферментов, участвующих в процессах переноса электрона. Примеры включают пластоцианин (Cu 2+ ) и редуктаза закиси азота (Cu–S). Функция этих ферментов зависит от того, что ион переходного металла может подвергаться окислительно-восстановительным реакциям . Другие примеры включают многие белки цинка, [127] а также железо-серные кластеры . Наиболее распространенными являются ферродоксины , которые служат переносчиками электронов в клетках. У бактерий важные ферменты нитрогеназы содержат кластер Fe-Mo-S и являются катализатором , выполняющим важную функцию фиксации азота , превращая атмосферный азот в аммиак, который может быть использован микроорганизмами и растениями для создания белков, ДНК, РНК, алкалоидов. и другие органические соединения азота, необходимые для жизни. [128]
Сера также присутствует в кофакторе молибдена . [129]
Сульфат
[ редактировать ]Дефицит
[ редактировать ]Для человека метионин является незаменимой аминокислотой ; цистеин является условно незаменимым и может быть синтезирован из заменимого серина (донором серы в данном случае будет метионин). Диетическая недостаточность редко случается в обычных условиях. Искусственный дефицит метионина пытаются применить в лечении рака. [130] но метод все еще потенциально опасен. [131]
Изолированный дефицит сульфитоксидазы — редкое смертельное генетическое заболевание, препятствующее выработке сульфитоксидазы , необходимой для метаболизма сульфитов до сульфатов. [132]
Меры предосторожности
[ редактировать ]| Опасности | |
|---|---|
| СГС Маркировка : | |
  | |
| Предупреждение | |
| H315 [133] | |
| NFPA 704 (огненный алмаз) | |

Хотя элементарная сера лишь минимально впитывается через кожу и малотоксична для человека, вдыхание серной пыли или контакт с глазами или кожей может вызвать раздражение. Чрезмерное употребление серы может вызвать ощущение жжения или диарею. [135] Сообщалось о случаях опасного для жизни метаболического ацидоза после того, как пациенты намеренно употребляли серу в качестве народного средства. [136] [137]
Токсичность соединений серы
[ редактировать ]Когда сера сгорает на воздухе, образуется диоксид серы . В воде этот газ образует сернистую кислоту и сульфиты; сульфиты — антиоксиданты, подавляющие рост аэробных бактерий и полезная пищевая добавка в небольших количествах. В высоких концентрациях эти кислоты повреждают легкие , глаза и другие ткани . [138] У организмов без легких, таких как насекомые, сульфит в высокой концентрации препятствует дыханию . [139]
Триоксид серы (полученный в результате катализа диоксида серы) и серная кислота также обладают высокой кислотностью и коррозионной активностью в присутствии воды. Концентрированная серная кислота является сильным дегидратирующим агентом, который удаляет доступные молекулы воды и ее компоненты из сахара и органических тканей. [140]
При сжигании угля и/или нефти в промышленности и на электростанциях образуется диоксид серы (SO 2 ), который вступает в реакцию с атмосферной водой и кислородом с образованием сернистой кислоты (H 2 SO 3 ). [141] Эти кислоты являются компонентами кислотных дождей , снижающих и пресноводных pH почвы водоемов, что иногда приводит к существенному ущербу окружающей среде и химическому выветриванию статуй и сооружений. Топливные стандарты все чаще требуют, чтобы производители топлива извлекали серу из ископаемого топлива, чтобы предотвратить образование кислотных дождей. Эта добытая и очищенная сера составляет большую часть производства серы. На угольных электростанциях дымовые газы иногда очищают. Более современные электростанции, использующие синтез-газ, извлекают серу перед сжиганием газа.
Сероводород примерно вдвое менее токсичен, чем цианистый водород , и отравляет по тому же механизму (ингибирование дыхательного фермента цитохромоксидазы ). [142] хотя сероводород с меньшей вероятностью вызовет внезапное отравление при вдыхании небольших количеств (около допустимого предела воздействия (ПДК) 20 частей на миллион) из-за его неприятного запаха. [143] Однако его присутствие в окружающем воздухе в концентрации более 100–150 ppm быстро притупляет обоняние, [144] и жертва может вдыхать все больше и больше, не замечая этого, пока серьезные симптомы не приведут к смерти. Растворенные сульфидные и гидросульфидные соли токсичны по тому же механизму.
Примечания
[ редактировать ]- ^ Но нечистые образцы имеют запах, похожий на запах спичек . Сильный запах, называемый «запах серы», на самом деле исходит от некоторых соединений серы, таких как сероводород и сераорганические соединения.
- ^ Показатель температуры плавления серы в 115,21°C был определен двумя лабораториями Министерства энергетики США (Лаборатория Джефферсона и Национальная лаборатория Лос-Аламоса). [12] Гринвуд и Эрншоу говорят, что при быстром нагревании для микрокристаллического α-S 8 указана температура плавления в 115,1°С (239,2°F). [7]
- ^ Исторически сложилось так, что определить точную температуру плавления серы было довольно сложной задачей. [15] При медленном нагревании фактическая температура плавления может находиться в диапазоне от 114,6 °C (238,3 °F) или даже ниже до 120,4 °C (248,7 °F). [7] (факторы, препятствующие установлению определенной температуры плавления, - полимероподобная природа серы [16] и большое количество аллотропов. [17] ) Точку плавления можно представить как температурный интервал, зависящий от аллотропного состава образца в момент плавления.
См. также
[ редактировать ]- Голубая лава
- Стратосферные аэрозоли серы
- Ассимиляция серы
- Биогеохимия изотопов серы
- Дизель со сверхнизким содержанием серы
Ссылки
[ редактировать ]- ^ «Стандартные атомные массы: сера» . ЦИАВ . 2009.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные массы элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Jump up to: а б Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Лиде, Д.Р., изд. (2005). «Магнитная восприимчивость элементов и неорганических соединений». Справочник CRC по химии и физике (PDF) (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5 .
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4 .
- ^ «История серы» . Georgiagulfsulfur.com . Проверено 12 февраля 2022 г.
- ^ Jump up to: а б с д и Гринвуд, штат Нью-Йорк; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4 .
- ^ Чисхолм, Хью , изд. (1911). . Британская энциклопедия . Том. 4 (11-е изд.). Издательство Кембриджского университета. п. 571.
- ^ Jump up to: а б с д Лоуренс Найт (19 июля 2014 г.). «Излишек серы: по шею в дьявольской стихии» . Би-би-си.
- ^ Jump up to: а б «Сера» . Элементы . Би-би-си. 11 октября 2014 г. . Скачать здесь .
- ^ Реттиг, С.Дж.; Троттер, Дж. (15 декабря 1987 г.). «Уточнение структуры ромбической серы α-S8» (PDF) . Acta Crystallographica Раздел C. 43 (12): 2260–2262. Бибкод : 1987AcCrC..43.2260R . дои : 10.1107/S0108270187088152 .
- ^ «Сера | С (Элемент) — ПабХим» . pubchem.ncbi.nlm.nih.gov . Проверено 15 апреля 2024 г.
- ^ Jump up to: а б с Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 645–665. ISBN 978-0-08-037941-8 .
- ^ Полинг, Брюс Э.; Праусниц, Джон М.; О'Коннелл, Джон П. (27 ноября 2000 г.). Свойства газов и жидкостей 5Е . МакГроу Хилл Профессионал. ISBN 978-0-07-149999-6 .
- ^ «7.5: Изменения состояния» . Химия LibreTexts . 3 октября 2013 года . Проверено 15 апреля 2024 г.
- ^ Кожевников В.Ф.; Пейн, ВБ; Олсон, Дж. К.; Макдональд, CL; Инглфилд, CE (15 октября 2004 г.). «Физические свойства серы вблизи полимеризационного перехода» . Журнал химической физики . 121 (15): 7379–7386. arXiv : физика/0405012 . Бибкод : 2004JChPh.121.7379K . дои : 10.1063/1.1794031 . ISSN 0021-9606 . ПМИД 15473808 .
- ^ Иностроза, Мануэль; Фернандес, Барбара; Агилера, Фелипе; Лаяна, Сусана; Уолтер, Томас Р.; Циммер, Мартин; Родригес-Диас, Аугусто; Ольце, Маркус (2023). «Физические и химические характеристики активных потоков серы, наблюдавшихся у вулкана Ластаррия (север Чили) в январе 2019 года» . Границы в науках о Земле . 11 . Бибкод : 2023FrEaS..1197363I . дои : 10.3389/feart.2023.1197363 . ISSN 2296-6463 .
- ^ Такер, Рой П. (1 января 1929 г.). «Заметки о сублимации серы при температуре от 25 до 50 °C» . Промышленная и инженерная химия . 21 (1): 44–47. дои : 10.1021/ie50229a014 . ISSN 0019-7866 .
- ^ Мальдонадо-Сагал, СБ; Боден, П.Дж. (1 января 1982 г.). «Гидролиз элементарной серы в воде и его влияние на коррозию мягкой стали» . Британский журнал по коррозии . 17 (3): 116–120. дои : 10.1179/000705982798274336 . ISSN 0007-0599 . Проверено 23 июня 2022 г.
- ^ Мансон, Рональд А. (февраль 1968 г.). «Синтез дисульфида иридия и диарсенида никеля, имеющих структуру пирита» (PDF) . Неорганическая химия . 7 (2): 389–390. дои : 10.1021/ic50060a047 . Архивировано из оригинала (PDF) 12 апреля 2019 года . Проверено 19 января 2019 г.
- ^ Эгон Виберг; Нильс Виберг (2001). Неорганическая химия . Академическая пресса. стр. 513–. ISBN 978-0-12-352651-9 .
- ^ Штойдель, Ральф; Эккерт, Бодо (2003). Твердые аллотропы серы Аллотропы серы . Темы современной химии. Том. 230. стр. 1–80. дои : 10.1007/b12110 . ISBN 978-3-540-40191-9 .
- ^ Стодель, Р. (1982). «Гомоциклические молекулы серы». Неорганические кольцевые системы . Темы современной химии. Том. 102. С. 149–176. дои : 10.1007/3-540-11345-2_10 . ISBN 978-3-540-11345-4 .
- ^ Теббе, Фред Н.; Вассерман Э.; Пит, Уильям Г.; Ватварс, Артурс; Хейман, Алан К. (1982). «Состав элементарной серы в растворе: равновесие S
6 , S 7 и S 8 при температуре окружающей среды». Журнал Американского химического общества . 104 (18): 4971–4972. doi : 10.1021/ja00382a050 . - ^ Мейер, Бит (1964). «Твердые аллотропы серы». Химические обзоры . 64 (4): 429–451. дои : 10.1021/cr60230a004 .
- ^ Мейер, Бит (1976). «Элементарная сера». Химические обзоры . 76 (3): 367–388. дои : 10.1021/cr60301a003 .
- ^ Сера . Комиссия по изотопному содержанию и атомному весу
- ^ Хейнс, Уильям М., изд. (2011). Справочник CRC по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press . п. 1.14. ISBN 1-4398-5511-0 .
- ^ «В поисках происхождения досолнечных зерен» . Energy.gov.ru . Проверено 4 февраля 2023 г.
- ^ Пайтан, Адина; Яо, Вэйци; Фаул, Кристина; Грей, ET (2020). «Стратиграфия изотопов серы» . Геологическая шкала времени . стр. 259–278. дои : 10.1016/B978-0-12-824360-2.00009-7 . ISBN 9780128243602 .
- ^ «Астробиология НАСА» . astrobiology.nasa.gov . Проверено 4 февраля 2023 г.
- ^ Гольдхабер, МБ; Каплан, ИК (апрель 1980 г.). «Механизмы включения серы и фракционирования изотопов в период раннего диагенеза в отложениях Калифорнийского залива» . Морская химия . 9 (2): 95–143. Бибкод : 1980Март...9...95Г . дои : 10.1016/0304-4203(80)90063-8 .
- ^ Сим, Мин Саб; Босак, Таня; Оно, Шухэй (июль 2011 г.). «Фракционирование крупных изотопов серы не требует диспропорционирования» . Наука . 333 (6038): 74–77. Бибкод : 2011Sci...333...74S . дои : 10.1126/science.1205103 . ISSN 0036-8075 . ПМИД 21719675 . S2CID 1248182 .
- ^ Цанг, Мань-Инь; Бетчер, Михаэль Эрнст; Вортманн, Ульрих Георг (август 2023 г.). «Оценка влияния диспропорции элементарной серы на сигнатуры изотопов серы в отложениях» . Химическая геология . 632 : 121533. doi : 10.1016/j.chemgeo.2023.121533 . S2CID 258600480 .
- ^ Ким, Ик Су; Квак, Сын Им; Пак, Уль Джэ; Банг, Хон Сик; Хан, Хён Су (1 июля 2005 г.). Производство серы-35 катионообменным процессом . Осеннее заседание КНС 2005 г., Пусан (Корея, Республика), 27–28 октября 2005 г.
- ^ «Информация о безопасности серы-35 (35 S) и особые меры предосторожности при обращении» (PDF) . Йельский университет, экологическая безопасность и гигиена .
- ^ Кэмерон, AGW (1957). «Звездная эволюция, ядерная астрофизика и нуклеогенез» (PDF) . КРЛ-41 .
- ^ Мейсон, Б. (1962). Метеориты . Нью-Йорк: Джон Уайли и сыновья. п. 160 . ISBN 978-0-908678-84-6 .
- ^ Лопес, Розали MC; Уильямс, Дэвид А. (2005). «Ио после Галилея». Отчеты о прогрессе в физике . 68 (2): 303–340. Бибкод : 2005РПФ...68..303Л . дои : 10.1088/0034-4885/68/2/R02 . S2CID 44208045 .
- ^ Стрикленд, Эшли (20 июля 2024 г.). «Марсоход НАСА Curiosity совершил «самую неожиданную» находку на Марсе» . CNN . Проверено 21 июля 2024 г.
- ^ Риквуд, ПК (1981). «Самые крупные кристаллы» (PDF) . Американский минералог . 66 : 885–907.
- ^ Катни, Джеральд (2007). Сера: история, технология, применение и промышленность . Торонто: ChemTec. п. 43. ИСБН 978-1-895198-37-9 . OCLC 79256100 .
- ^ де Ронд, CEJ; Чедвик, WW младший; Дитчберн, Р.Г.; Эмбли, RW; Танниклифф, В.; Бейкер, ET; Уокер, СЛ; Феррини, ВЛ; Мерл, С.М. (2015). «Озера расплавленной серы внутриокеанических дуговых вулканов». Вулканические озера . Спрингер. стр. 261–288. Бибкод : 2015vola.book.....R . дои : 10.1007/978-3-642-36833-2 . ISBN 978-3-642-36832-5 . S2CID 199492543 .
- ^ Кляйн, Корнелис; Херлбат, Корнелиус С. младший (1985). Руководство по минералогии (20-е изд.). Уайли. стр. 265–66. ISBN 0-471-80580-7 .
- ^ «Сера: информация о минералах, данные и местонахождение» . www.mindat.org .
- ^ Jump up to: а б с д и Нехб, Вольфганг; Выдра, Карел (2006). «Сера». Энциклопедия промышленной химии Ульмана . Вайли-ВЧ Верлаг. дои : 10.1002/14356007.a25_507.pub2 . ISBN 978-3-527-30673-2 .
- ^ Шрайвер, Аткинс. Неорганическая химия, пятое издание. WH Freeman and Company, Нью-Йорк, 2010 г.; стр. 416
- ^ Фухимори, Тошихико; Морелос-Гомес, Аарон; Чжу, Чжэнь; Мурамацу, Хироюки; Футамура, Рюсуке; Урита, Коки; Терронес, Маурисио; Хаяси, Такуя; Эндо, Моринобу; Янг Хонг, Санг; Чул Чой, Янг; Томанек, Дэвид; Канеко, Кацуми (2013). «Проведение линейных цепочек серы внутри углеродных нанотрубок» . Природные коммуникации . 4 : 2162. Бибкод : 2013NatCo...4.2162F . дои : 10.1038/ncomms3162 . ПМЦ 3717502 . ПМИД 23851903 .
- ^ Брауэр, Г., изд. (1963). Справочник по препаративной неорганической химии . Том. 1 (2-е изд.). Нью-Йорк: Академическая пресса. п. 421.
- ^ Гашек, WR (1961). «1,1,1-Трифторгептан». Органические синтезы . 41 : 104. дои : 10.1002/0471264180.os041.28 .
- ^ Jump up to: а б Лаусс, Х.-Д.; Стеффенс, В. «Галогениды серы». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a25_623 . ISBN 978-3527306732 .
- ^ Воган, диджей; Крейг, младший (1978). Минеральная химия сульфидов металлов . Кембридж: Издательство Кембриджского университета. ISBN 0-521-21489-0 .
- ^ Цанг, Мань-Инь; Инагаки, Фумио (29 мая 2020 г.). «Микробная жизнь глубоко под морским дном — история о том, как не сдаваться» . Границы для молодых умов . 8:70 . дои : 10.3389/фрим.2020.00070 . ISSN 2296-6846 .
- ^ Jump up to: а б Кремлин, Р.Дж. (1996). Введение в сероорганическую химию . Чичестер: Джон Уайли и сыновья. ISBN 0-471-95512-4 .
- ^ Уилсон, RW ; Пензиас, АА ; Ваннье, П.Г.; Линке, РА (15 марта 1976 г.). «Содержание изотопов в межзвездном моносульфиде углерода» . Астрофизический журнал . 204 : Л135–Л137. Бибкод : 1976ApJ...204L.135W . дои : 10.1086/182072 .
- ^ Бануб, Джозеф (2011). Обнаружение биологических агентов для предотвращения биотерроризма . Наука НАТО ради мира и безопасности. Серия A: Химия и биология. п. 183. Бибкод : 2011dbap.book.....B . дои : 10.1007/978-90-481-9815-3 . ISBN 978-90-481-9815-3 . OCLC 697506461 .
- ^ «Сера в Библии (14 случаев)» . bible.knowing-jesus.com . Проверено 19 мая 2022 г.
- ^ Рэпп, Джордж Роберт (4 февраля 2009 г.). Археоминералогия . Спрингер. п. 242. ИСБН 978-3-540-78593-4 .
- ↑ Одиссея , книга 22, строки 480–495 . www.perseus.tufts.edu. Проверено 16 августа 2012 г.
- ^ Плиний Старший о науке и технике , Джон Ф. Хили, Oxford University Press, 1999, ISBN 0-19-814687-6 , стр. 247–249.
- ^ Jump up to: а б с Чжан, Юньмин (1986). «История научного общества: древние китайские процессы производства серы». Исида . 77 (3): 487. дои : 10.1086/354207 . S2CID 144187385 .
- ^ Нидэм, Джозеф; Йейтс, Робин (1994). Наука и цивилизация в Китае, Том 5: Химия и химические технологии, Часть 6, Военные технологии: Ракеты и осады . Кембридж: Издательство Кембриджского университета. п. 120. ИСБН 9780521327275 . OCLC 489677531 .
- ^ Кох, Рудольф (1955). Книга знаков: содержит всевозможные символы, использовавшиеся с древнейших времен до средневековья первобытными народами и ранними христианами . Нью-Йорк: Dover Publications. ISBN 0-486-20162-7 .
- ^ Уайт, Дэвид Гордон (1996). Алхимическое тело — традиции сиддхов в средневековой Индии . Чикаго: Издательство Чикагского университета. пп. пассим. ISBN 978-0-226-89499-7 .
- ^ Лин, АН; Реймер, Р.Дж.; Картер, DM (1988). «Возвращение к сере». Журнал Американской академии дерматологии . 18 (3): 553–558. дои : 10.1016/S0190-9622(88)70079-1 . ПМИД 2450900 .
- ^ Майбах, Гавайи; Сурбер, К.; Оркин, М. (1990). «Возвращение к сере» . Журнал Американской академии дерматологии . 23 (1): 154–156. doi : 10.1016/S0190-9622(08)81225-X . ПМИД 2365870 .
- ^ Гупта, АК; Никол, К. (2004). «Применение серы в дерматологии». Журнал лекарств в дерматологии . 3 (4): 427–31. ПМИД 15303787 .
- ^ Гупта, Адитья К; Никол, Карин (июль – август 2004 г.). «Использование серы в дерматологии» . Журнал лекарств в дерматологии . 3 (4): 427–431. ПМИД 15303787 .
- ^ Донован, Артур (1996). Антуан Лавуазье: Наука, управление и революция . Издательство Кембриджского университета. п. 66. ИСБН 978-0-521-56672-8 .
- ^ Пуарье, Жан-Пьер (1998). Лавуазье: химик, биолог, экономист . Издательство Пенсильванского университета. стр. 107–8. ISBN 978-0-8122-1649-3 .
- ^ Риалл, Люси (1998). Сицилия и объединение Италии: либеральная политика и местная власть, 1859–1866 гг . Издательство Оксфордского университета. ISBN 9780191542619 . Проверено 7 февраля 2013 г.
- ^ Томсон, Д.В. (апрель 1995 г.). «Прелюдия к серной войне 1840 года: неаполитанская перспектива». Ежеквартальный журнал европейской истории . 25 (2): 163–180. дои : 10.1177/026569149502500201 . S2CID 145807900 .
- ^ Ботч, Уолтер (2001). «Химики, техники, предприниматели: К 150-летию со дня рождения Германа Фраша». Химия в наше время (на немецком языке). 35 (5): 324–331. doi : 10.1002/1521-3781(200110)35:5<324::AID-CIUZ324>3.0.CO;2-9 .
- ^ Масс, Дженнифер Л.; Андерсон, Марк Дж (2003). «Немецкая мебель из Пенсильвании, инкрустированная серой: характеристика, воспроизведение и явления старения инкрустаций». Измерительная наука и технология . 14 (9): 1598. doi : 10.1088/0957-0233/14/9/311 . ISSN 0957-0233 . S2CID 250882259 .
- ^ Когель, Джессика (2006). Промышленные минералы и горные породы: товары, рынки и использование (7-е изд.). Колорадо: Литтлтон. п. 935. ИСБН 978-0-87335-233-8 . OCLC 62805047 .
- ^ «сера» . Оксфордский словарь английского языка (онлайн-изд.). Издательство Оксфордского университета . (Требуется подписка или членство участвующей организации .)
- ^ «Прощай, сера» . Природная химия . 1 (5): 333. 4 августа 2009 г. Бибкод : 2009NatCh...1Q.333. . дои : 10.1038/nchem.301 . ПМИД 21378874 .
- ^ Международный союз теоретической и прикладной химии: Отдел неорганической химии, Комиссия по номенклатуре неорганической химии (1990). Номенклатура неорганической химии (Рекомендации 1990 г.) . Оксфорд, Великобритания: Научные публикации Блэквелла. С. 39, 40, 41, 240, 247.
- ^ Макнот, Алан (1991). «Обновление стиля журнала». Аналитик . 116 (11): 1094. Бибкод : 1991Ана...116.1094М . дои : 10.1039/AN9911601094 .
- ^ «сера – определение серы на английском языке» . Оксфордские словари . Архивировано из оригинала 20 ноября 2016 года . Проверено 19 ноября 2016 г.
- ^ Ригель, Эмиль; Кент, Джеймс (2007). Справочник Кента и Ригеля по промышленной химии и биотехнологии . Том. 1. Спрингер. п. 1171. Бибкод : 2007карх.книга...... . ISBN 978-0-387-27842-1 . OCLC 74650396 .
- ^ Вашингтон, Букер Т. (1912). Человек, самый дальний вниз: отчет о наблюдениях и исследованиях в Европе . Даблдэй, Пейдж. п. 214.
- ^ МакЭлвани, Кевин (25 февраля 2015 г.). «Люди, которые добывают вулканы» . Атлантика . Проверено 26 февраля 2015 г.
- ^ Jump up to: а б с Оу, Джон С. (2002). «Извлечение серы из кислого газа: обзор технологии». Экологический прогресс . 21 (3): 143–162. Бибкод : 2002EnvPr..21..143E . дои : 10.1002/эп.670210312 .
- ^ Jump up to: а б с Шрайнер, Бернхард (2008). «Суд над Клаусом. Насыщенный годами и более важный, чем когда-либо». Химия в наше время . 42 (6): 378–392. дои : 10.1002/ciuz.200800461 .
- ^ Гайндман, AW; Лю, Дж. К.; Денни, Д.В. (1982). «Извлечение серы из нефтеносных песков». Сера: новые источники и использование . Серия симпозиумов ACS. Том. 183. стр. 69–82. дои : 10.1021/bk-1982-0183.ch005 . ISBN 978-0-8412-0713-4 .
- ^ Jump up to: а б Мохамед, Абдель-Мохсен Онси; Эль-Гамаль, Майса М. (2010). Серобетон для строительной отрасли: подход к устойчивому развитию . Форт-Лодердейл : Дж. Росс. стр. 104–105, 109. ISBN. 978-1-60427-005-1 . OCLC 531718953 .
- ^ Аподака, Лори Э. (2012) «Сера» . Обзоры минеральных товаров. Геологическая служба США .
- ^ Jump up to: а б Аподака, Лори Э. «Ежегодник минералов 2010: Сера» (PDF) . Геологическая служба США.
- ^ Jump up to: а б «Часто задаваемые вопросы – Институт серы» . ulfurinstitute.org . Институт серы . 2020 . Проверено 27 февраля 2020 г.
- ^ Чжао, Ф.; Хоксфорд, MJ; МакГрат, СП (1999). «Ассимиляция серы и влияние на урожайность и качество пшеницы». Журнал зерновых наук . 30 (1): 1–17. дои : 10.1006/jcrs.1998.0241 .
- ^ Блейк-Калфф, ММА (2000). «Диагностика дефицита серы у выращиваемого в полевых условиях рапса (Brassica napus L.) и пшеницы (Triticum aestivum L.)». Растение и почва . 225 (1/2): 95–107. дои : 10.1023/A:1026503812267 . S2CID 44208638 .
- ^ Чеккотти, СП (1996). «Питательная сера для растений - обзор баланса питательных веществ, воздействия на окружающую среду и удобрений». Исследования удобрений . 43 (1–3): 117–125. дои : 10.1007/BF00747690 . S2CID 42207099 .
- ^ Глоссарий , США: Земная обсерватория НАСА , кислотный дождь, заархивировано из оригинала 13 декабря 2011 г. , получено 15 февраля 2013 г.
- ^ Эвери, Ричард Л.; и др. (20 августа 1968 г.). «Способ получения смачиваемой серы» (PDF) . Проверено 20 мая 2010 г.
- ^ Справочник Хагера по фармацевтической практике (на немецком языке). Том 6Б (4-е изд.). Берлин – Гейдельберг – Нью-Йорк: Springer. 1978. стр. 672–9. ISBN 978-3-540-07738-1 .
- ^ Фармакопейный комментарий. Научные пояснения Европейской Фармакопеи и Немецкой Фармакопеи [ Комментарий к Фармакопее. Научные аннотации к Европейской фармакопее и Немецкой фармакопее ] (на немецком языке) (23-е изд.). Штутгарт: Научное издательство. 2004. для наружного применения» Монография «Сера . ISBN 978-3-8047-2575-1 .
- ^ Скотт, Кевин А.; Ньярдарсон, Джон Т. (2019), Цзян, Сюэфэн (ред.), «Анализ одобренных FDA США препаратов, содержащих атомы серы» (PDF) , Химия серы , Темы в текущих сборниках химии , Springer International Publishing, стр. 1– 34, номер домена : 10.1007/978-3-030-25598-5_1 , ISBN 978-3-030-25598-5 , получено 8 марта 2023 г.
- ^ Пай, Рахул (10 февраля 2022 г.). «Стабилизация гамма-серы при комнатной температуре для использования карбонатного электролита в литий-S аккумуляторах» . Химия связи . 5 (1): 17. дои : 10.1038/s42004-022-00626-2 . ПМЦ 9814344 . ПМИД 36697747 . S2CID 246704531 .
- ^ «Сера и организм человека» . Институт серы . Проверено 3 апреля 2021 г.
- ^ «Из чего сделано тело?» . Новый учёный . Архивировано из оригинала 3 ноября 2021 года . Проверено 9 ноября 2021 г.
- ^ Хельменстин, Энн (3 февраля 2019 г.). «Элементный состав человеческого тела по массе» . МысльКо. Архивировано из оригинала 13 апреля 2021 года . Проверено 21 ноября 2021 г.
- ^ Парселл, Стивен (февраль 2002 г.). «Сера в питании человека и применение в медицине» . Обзор альтернативной медицины . 7 (1): 22–44. ISSN 1089-5159 . ПМИД 11896744 .
- ^ Ингенблеек, Ив; Кимура, Хидео (июль 2013 г.). «Пищевая ценность серы для здоровья и болезней» . Обзоры питания . 71 (7): 413–432. дои : 10.1111/нуре.12050 . ISSN 1753-4887 . ПМИД 23815141 .
- ^ Дворкин, Мартин (март 2012 г.). «Сергей Виноградский: основоположник современной микробиологии и первый микробный эколог» . Обзоры микробиологии FEMS . 36 (2): 364–379. дои : 10.1111/j.1574-6976.2011.00299.x . ISSN 1574-6976 . ПМИД 22092289 .
- ^ Ваксман, SA; Старки, Р.Л. (20 января 1923 г.). «О росте и дыхании сероокисляющих бактерий» . Журнал общей физиологии . 5 (3): 285–310. дои : 10.1085/jgp.5.3.285 . ISSN 0022-1295 . ПМК 2140527 . ПМИД 19871997 .
- ^ Пронк Дж.Т.; Мейленберг Р; Хазеу В; Бос П; Куэнен Дж.Г. (1990). «Окисление восстановленных неорганических соединений серы ацидофильными тиобациллами» . Письма FEMS по микробиологии . 75 (2–3): 293–306. дои : 10.1111/j.1574-6968.1990.tb04103.x .
- ^ Фригаард, Нильс-Ульрик; Даль, Кристиан (1 января 2008 г.), Пул, Роберт К. (редактор), Метаболизм серы в фототрофных серных бактериях , Достижения в микробной физиологии, том. 54, Academic Press, стр. 103–200, номер документа : 10.1016/S0065-2911(08)00002-7 , ISBN. 9780123743237 , PMID 18929068 , получено 17 мая 2022 г.
- ^ Кавано, Коллин М. (1994). «Микробный симбиоз: закономерности разнообразия морской среды» . Американский зоолог . 34 : 79–89. дои : 10.1093/icb/34.1.79 .
- ^ Джонс, Гален Э.; Старки, Роберт Л.; Фили, Герберт В.; Кулп, Дж. Лоуренс (22 июня 1956 г.). «Биологическое происхождение самородной серы в соляных куполах Техаса и Луизианы» . Наука . 123 (3208): 1124–1125. Бибкод : 1956Sci...123.1124J . дои : 10.1126/science.123.3208.1124 . ISSN 0036-8075 . ПМИД 17793426 .
- ^ Филип, Г.; Вали, АМА; Ареф, МАМ (1 сентября 1994 г.). «О происхождении месторождений самородной серы в Гебель-эль-Зейте, Суэцкий залив, Египет» . Карбонаты и эвапориты . 9 (2): 223–232. Бибкод : 1994CarEv...9..223P . дои : 10.1007/BF03175232 . ISSN 1878-5212 . S2CID 128827551 .
- ^ «Петрография и минералогия кристаллического известняка формации Фатха из района Мишрак, Ирак» . Исследовательские ворота . Проверено 15 апреля 2022 г.
- ^ Хельдт, Ганс Вальтер (1996). Биохимия растений (на немецком языке). Гейдельберг: Академическое издательство «Спектр». стр. 321–333. ISBN 978-3-8274-0103-8 .
- ^ Куэнен, Дж.Г.; Бедекер, РФ (13 сентября 1982 г.). «Микробиология тиобацилл и других сероокисляющих автотрофов, миксотрофов и гетеротрофов» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 298 (1093): 473–497. Бибкод : 1982РСПТБ.298..473К . дои : 10.1098/rstb.1982.0093 . ISSN 0962-8436 . ПМИД 6127737 .
- ^ Васмунд, Кеннет; Муссманн, Марк; Лой, Александр (август 2017 г.). «Жизнь серных: микробная экология круговорота серы в морских отложениях: Микробный круговорот серы в морских отложениях» . Отчеты по экологической микробиологии . 9 (4): 323–344. дои : 10.1111/1758-2229.12538 . ПМЦ 5573963 . ПМИД 28419734 .
- ^ Гутьеррес-Пресиадо, А.; Ромеро, Х.; Пеймберт, М. (2010). «Эволюционный взгляд на аминокислоты» . Природное образование . 3 (9): 29.
- ^ Альбертс, Брюс; Джонсон, Александр; Льюис, Джулиан; Рафф, Мартин; Робертс, Кейт; Уолтер, Питер (2002). Молекулярная биология клетки. 4-е издание . Нью-Йорк: Garland Science. ISBN 978-0-8153-3218-3 .
- ^ Арнер, Элиас С.Дж.; Холмгрен, Арне (25 декабря 2001 г.). «Физиологические функции тиоредоксина и тиоредоксинредуктазы: Тиоредоксин и тиоредоксинредуктаза» . Европейский журнал биохимии . 267 (20): 6102–6109. дои : 10.1046/j.1432-1327.2000.01701.x . ПМИД 11012661 .
- ^ «Лизоцим» . Наркотики.com . Проверено 19 мая 2022 г.
- ^ Нельсон, Д.Л.; Кокс, ММ (2000). Ленинджер, Принципы биохимии (3-е изд.). Нью-Йорк: Стоит публикации. ISBN 978-1-57259-153-0 .
- ^ Селхуб, Дж. (1 июля 1999 г.). «Метаболизм гомоцистеина» . Ежегодный обзор питания . 19 (1): 217–246. дои : 10.1146/annurev.nutr.19.1.217 . ISSN 0199-9885 . ПМИД 10448523 .
- ^ Хакстейбл, Р.Дж. (1 января 1992 г.). «Физиологические действия таурина» . Физиологические обзоры . 72 (1): 101–163. дои : 10.1152/physrev.1992.72.1.101 . ISSN 0031-9333 . ПМИД 1731369 .
- ^ «Функция биотина» . www.chem.uwec.edu . Проверено 10 июня 2022 г.
- ^ Эдвардс, Кэти А. «Биохимия тиамина» . тиамин.dnr.cornell.edu . Проверено 10 июня 2022 г.
- ^ Тауэр, РК (1998). «Биохимия метаногенеза: дань уважения Марджори Стивенсон: лекция о премии Марджори Стивенсон 1998 года» . Микробиология . 144 (9): 2377–2406. дои : 10.1099/00221287-144-9-2377 . ПМИД 9782487 .
- ^ Пейс, Николас Дж.; Вирапана, Эранти (17 апреля 2014 г.). «Цинксвязывающие цистеины: разнообразные функции и структурные мотивы» . Биомолекулы . 4 (2): 419–434. дои : 10.3390/biom4020419 . ISSN 2218-273X . ПМК 4101490 . ПМИД 24970223 .
- ^ Джайлз, Нирошини М; Уоттс, Аарон Б; Джайлз, Грегори I; Фрай, Фиона Х; Литлчайлд, Дженнифер А; Джейкоб, Клаус (1 августа 2003 г.). «Металлическая и окислительно-восстановительная модуляция функции белка-цистеина» . Химия и биология . 10 (8): 677–693. дои : 10.1016/S1074-5521(03)00174-1 . ISSN 1074-5521 . ПМИД 12954327 .
- ^ Липпард, С.Дж.; Берг, Дж. М. (1994). Основы бионеорганической химии . Университетские научные книги. ISBN 978-0-935702-73-6 .
- ^ Шварц, Гюнтер; Мендель, Ральф Р. (2006). «Биосинтез молибденового кофактора и молибденовые ферменты». Ежегодный обзор биологии растений . 57 (1): 623–647. doi : 10.1146/annurev.arplant.57.032905.105437 . ISSN 1543-5008 . ПМИД 16669776 .
- ^ Младенович, Душан; Радосавлевич, Татьяна; Хрнчич, Драган; Расич-Маркович, Александра; Станойлович, Оливера (26 июля 2019 г.). «Влияние диетического ограничения метионина на функцию и метаболическое перепрограммирование печени и мозга – последствия для долголетия» . Обзоры в области нейронаук . 30 (6): 581–593. дои : 10.1515/revneuro-2018-0073 . ISSN 2191-0200 . ПМИД 30817309 . S2CID 73470156 .
- ^ Бинц, Регина Л.; Садухан, Ратан; Миус, Изабель Р.; Гарг, Сарита; Котурбаш, Игорь; Чжоу, Даохун; Хауэр-Йенсен, Мартин; Патак, Рупак (27 февраля 2021 г.). «Дефицит метионина в рационе усиливает генетическую нестабильность иммунных клеток мышей» . Международный журнал молекулярных наук . 22 (5): 2378. doi : 10.3390/ijms22052378 . ISSN 1422-0067 . ПМЦ 7956689 . ПМИД 33673497 .
- ^ Каракас, Эркан; Кискер, Кэролайн (18 октября 2005 г.). «Структурный анализ миссенс-мутаций, вызывающих изолированный дефицит сульфитоксидазы» . Далтон Транзакции (21): 3459–3463. дои : 10.1039/B505789M . ISSN 1477-9234 . ПМИД 16234925 .
- ^ «Сера 84683» . С.
- ^ «Химический паспорт. СЕРА РАСПЛАВЛЕННАЯ» .
- ^ «Общие сведения о сере» . npic.orst.edu . Проверено 2 сентября 2022 г.
- ^ Шварц, Стивен М.; Кэрролл, Хью М.; Шаршмидт, Линда А. (1 июля 1986 г.). «Прием сублимированной (неорганической) серы: причина опасного для жизни метаболического ацидоза с высоким анионным разрывом» . Архив внутренней медицины . 146 (7): 1437–1438. дои : 10.1001/archinte.1986.00360190229034 . ISSN 0003-9926 . ПМИД 3718141 .
- ^ Блюм, Дж. Эрик; Коу, Фредрик Л. (13 января 2010 г.). «Метаболический ацидоз после приема серы» . Медицинский журнал Новой Англии . 297 (16): 869–870. дои : 10.1056/nejm197710202971606 . ПМИД 904661 . Проверено 2 сентября 2022 г.
- ^ «Диоксид серы | Токсикологический профиль | ATSDR» . Центры по контролю и профилактике заболеваний . 26 марта 2014 года . Проверено 24 октября 2023 г.
- ^ «Общие сведения о сере» . npic.orst.edu . Проверено 20 января 2024 г.
- ^ Бейкер, Колин (1 марта 2007 г.). «Обезвоживание сахарозы» . Химическое образование . Королевское химическое общество . Проверено 14 июня 2018 г.
- ^ «4.1: Ископаемое топливо и продукты сгорания» . Инженерные библиотеки LibreTexts . 28 февраля 2021 г. Проверено 24 октября 2023 г.
- ^ «Токсичность сероводорода: основы практики, патофизиология, этиология» . Медскейп . 30 марта 2017 г. – через eMedicine.
- ^ Саммерс, Винсент (8 апреля 2017 г.). «Сероводород или цианистый водород: что опаснее?» . Необычная наука . Проверено 23 августа 2022 г.
- ^ «Сероводород – опасности | Управление по охране труда» . www.osha.gov . Проверено 23 августа 2022 г.
Дальнейшее чтение
[ редактировать ]Сигел, Астрид; Фрейзингер, Ева; Сигел, Роланд КО, ред. (2020). Переходные металлы и сера: прочная связь на всю жизнь . Приглашенные редакторы Марта Э. Соса Торрес и Питер М. Х. Кронек. Берлин/Бостон: де Грюйтер. стр. xlv+455. ISBN 978-3-11-058889-7 .
Внешние ссылки
[ редактировать ]- Сера в Периодической таблице видео (Ноттингемский университет)
- Атомные данные по сере , NIST Лаборатория физических измерений
- Фазовая диаграмма серы. Архивировано 23 февраля 2010 г. в Wayback Machine , «Введение в химию для детей 13–17 лет».
- Кристаллическая, жидкая и полимеризация серы на острове Вулкано, Италия.
- Сера и ее использование в качестве пестицида
- Институт серы
- Управление питательными веществами и Институт серы
- сера
- Химические элементы
- Халькогены
- Реактивные неметаллы
- Многоатомные неметаллы
- Сельскохозяйственные химикаты
- Препараты против прыщей
- Диетические минералы
- Промышленные минералы
- Неорганические полимеры
- Минералы самородных элементов
- Орторомбические минералы
- Минералы пространственной группы 70
- Пиротехническое топливо
- Химические элементы с примитивной ромбической структурой