полумиминальный
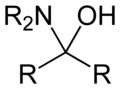
В органической химии гемиаминал , (также карбиноламин ) представляет собой функциональную группу или тип химического соединения которое имеет гидроксильную группу и амин, присоединенные к одному и тому же атому углерода : -C(OH)(NR 2 )- . R может представлять собой водород или алкильную группу. Гемиаминалы являются промежуточными продуктами образования имина из амина и карбонила путем алкилимино-де-оксо-бизамещения . [1] Гемиаминалы можно рассматривать как смесь аминалей и геминального диола . Они представляют собой частный случай аминоспиртов .
Классификация по предшественнику амина
[ редактировать ]Полуаминалы образуются в результате реакции амина и кетона или альдегида. Гемиаминали иногда можно выделить, но часто они спонтанно дегидратируются с образованием иминов. [2]
Добавление аммиака
[ редактировать ]
Аддукты , образующиеся при присоединении аммиака к альдегидам, изучаются давно. [3] Соединения, содержащие как первичную аминогруппу , так и гидроксильную группу, связанную с одним и тем же атомом углерода, редко бывают стабильными, поскольку они имеют тенденцию к дегидратации с образованием иминов , которые полимеризуются с образованием гексаметилентетрамина . Редким стабильным примером является аддукт аммиака и гексафторацетона . (CF 3 ) 2 C(OH)NH 2 . [4]
С-замещенные производные получают реакцией альдегидов и аммиака: [5]
Добавление первичных аминов
[ редактировать ]N-замещенные производные относительно стабильны. Их вызывают, но редко наблюдают в качестве промежуточных продуктов реакции Манниха . Эти N,N',N''-тризамещенные гексагидро-1,3,5-триазины возникают в результате конденсации амина и формальдегида, как показано на примере получения 1,3,5-триметил-1,3,5-триазациклогексана. :
Хотя аддукты, образующиеся из первичных аминов или аммиака, обычно нестабильны, полуаминалы задерживаются в полости. [6]
Добавление вторичных аминов: карбиноламинов (гемиаминалов) и бисаминометанов.
[ редактировать ]Одна из простейших реакций влечет за собой конденсацию формальдегида и диметиламина. В результате этой реакции сначала образуются карбиноламин (полуаминаль) и бис (диметиламино) метан ( Я = СН 3 ): [7] [8]
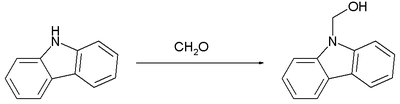
Реакция формальдегида с карбазолом , который является слабоосновным, протекает аналогично: [9]
Опять же, этот карбинол легко превращается в связанный метиленом бис (карбазол).
Гемиаминные эфиры
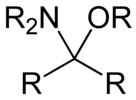
[ редактировать ]Полуаминальные эфиры имеют следующую структуру: R‴-C(NR' 2 )(OR")-R⁗. Гликозиламины являются примерами циклических полуаминальных эфиров.
- Гемиаминалы и эфиры
- метаноламин , промежуточный продукт реакции аммиака с формальдегидом.
- Бис(гидроксиметил)мочевина представляет собой коммерчески полезный полуаминный препарат.
- Необычный пример выделяемого ациклического полуамина: аддукта аммиака и гексафторацетона.
- Полуаминальный эфир, полученный из альдегида
- Гемиаминаловый эфир, полученный из кетона
Использование в полном синтезе
[ редактировать ]этапом асимметричного тотального синтеза сакситоксина Образование гемиаминов является ключевым : [10]
На этой стадии реакции алкеновая группа сначала окисляется до промежуточного ацилоина под действием хлорида осмия (III), оксона ( жертвенный катализатор ) и карбоната натрия (основание).
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Урбанский, Эдвард Т. (2000). «Карбиноламины и геминальные диолы в органической химии водной окружающей среды». Журнал химического образования . 77 (12): 1644. Бибкод : 2000ЖЧЭд..77.1644У . дои : 10.1021/ed077p1644 .
- ^ Габбат, Кристофер Д.; Хепворт, Джон Д. (1995). «Функции, включающие халькоген и элемент группы 15». Комплексные преобразования органических функциональных групп . стр. 293–349. дои : 10.1016/B0-08-044705-8/00206-5 . ISBN 9780080447056 .
- ^ Юстус Либих «Ueber die Producte der Oxydation des Alkohols» Annalen der Pharmacie 1835, том 14, стр. 133–167. два : 10.1002/jlac.18350140202
- ^ У. Дж. Миддлтон, HD Карлсон (1970). «Гексафторацетонимин». Орг. Синтезы . 50 : 81–3. дои : 10.15227/orgsyn.050.0081 . .
- ^ Нильсен, Арнольд Т.; Аткинс, Рональд Л.; Мур, Дональд В.; Скотт, Роберт; Мэллори, Дэниел; Лаберж, Жанна М. (1973). «Структура и химия альдегид-аммиаков. 1-амино-1-алканолы, 2,4,6-триалкил-1,3,5-гексагидротриазины и N,N-диалкилиден-1,1-диаминоалканы». Дж. Орг. Хим . 38 (19): 3288–3295. дои : 10.1021/jo00959a010 .
- ^ Ивасава, Т.; Хули, Р.Дж.; Ребек, Дж. (2007). «Стабилизация лабильных промежуточных карбонильных соединений синтетическим рецептором». Наука . 317 (5837): 493–496. Бибкод : 2007Sci...317..493I . дои : 10.1126/science.1143272 . ПМИД 17656719 . S2CID 37292853 .
- ^ Хеллманн Генрих, Гюнтер Опиц (1960). Аминоалкилирование . Вайнхайм.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Роджерс, FE; Рапейко, Р.Дж. (1974). «Термохимия реакций присоединения карбонила. II. Энтальпия присоединения диметиламина к формальдегиду». Журнал физической химии . 78 (6): 599–603. дои : 10.1021/j100599a008 .
- ^ Карбазол-9-ил-метанол Милата Виктора, Када Рудольфа, Локай J¨¢nb Molbank 2004, M354 в открытом доступе публикация [1]. Архивировано 26 сентября 2018 г. на Wayback Machine.
- ^ Флеминг, Джеймс Дж.; Макрейнольдс, Мэтью Д.; Дюбуа, Ж. (2007). «(+)-Сакситоксин: стереоселективный синтез первого и второго поколения». Журнал Американского химического общества . 129 (32): 9964–9975. дои : 10.1021/ja071501o . PMID 17658800 .