N -Сульфинилимин
Судя по всему, основной автор этой статьи тесно связан с ее предметом. ( Июль 2021 г. ) |

N -Сульфинилимины ( N -сульфинилимины , сульфинимины , тиооксим S -оксиды ) — класс иминов , несущих сульфинильную группу, присоединенную к азоту. [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ] [ 8 ] Эти имины проявляют полезную стереоселективную реакционную способность благодаря присутствию хиральной электроноакцепторной N - сульфинильной группы. Они допускают 1,2-присоединение металлоорганических реагентов к иминам. N асимметричной -сульфинильная группа оказывает мощное и предсказуемое стереонаправленное действие, приводящее к высоким уровням индукции . Рацемизация вновь созданного углерод-азотного стереоцентра предотвращается, поскольку анионы стабилизируются по азоту (т.е. сульфинильная группа является универсальной защитной группой для аминов). Сульфинилхиральное вспомогательное вещество легко удаляется простым кислотным гидролизом . Добавление металлоорганических реагентов к N -сульфинилиминам является наиболее надежным и универсальным методом асимметрического синтеза производных аминов . Эти строительные блоки использовались в асимметричном синтезе многочисленных биологически активных соединений. [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ] [ 8 ]
Синтез
[ редактировать ]Первые N -сульфинилимины в рацемической форме были образованы окислением п -толуолсульфенилиминов м-ХПБА . [ 9 ] Энантиочистые п -толуол-сульфинилимины возникают реакцией коммерчески доступного реагента Андерсена (ментил- п -толуолсульфината). [ 10 ] с металлокетиминами, но ограничивается производными кетонов N -сульфинилиминами. [ 11 ] Более общий метод получения N -сульфинилиминов — асимметричное окисление ахиральных сульфенилиминов хиральным оксазиридином . [ 12 ] Полезность этого метода ограничена доступностью N -сульфонилоксазиридина, который трудно получить. [ 13 ] Более практичным является однореакторный метод с использованием реактива Андерсена, позволяющий получить различные п -толуол-сульфинилимины, доступные как из ароматических, так и из алифатических альдегидов. [ 14 ]
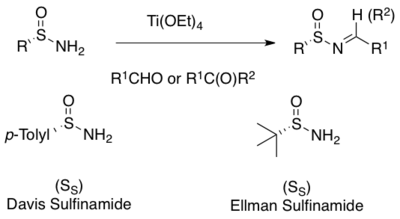
Широко применяемым методом асимметричного синтеза N -сульфинилиминов является конденсация энантиочистых первичных сульфинамидов с альдегидом или кетонами. [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ] Мягкие дегидратирующие реагенты кислоты Льюиса, такие как этоксид титана, облегчают конденсацию. [ 15 ] [ 16 ] Многие сульфинамиды коммерчески доступны как в ( R )-, так и ( S )-формах. Двумя наиболее часто используемыми являются п Эллмана. -толуолсульфинамид Дэвиса и трет- бутансульфинамид [ 8 ] [ 15 ] [ 16 ]
Приложения
[ редактировать ]
п - толуол-сульфинилимины использовались для высокодиастереоселективного асимметричного синтеза α- аминокислот . [ 18 ] [ 19 ] β-аминокислоты, [ 20 ] [ 21 ] син- и анти-2,3-диаминоэфиры, [ 22 ] α-аминоальдегиды и кетоны, [ 23 ] [ 24 ] β-аминокетоны, [ 25 ] [ 26 ] α-аминофосфонаты, [ 27 ] [ 28 ] азиридин-2-карбоксилаты, [ 29 ] [ 30 ] и азиридин-2-фосфонаты. [ 31 ] Многие из этих же превращений можно провести с трет-бутилсульфинилиминами. [ 8 ] Для асимметричного синтеза аминов необходимы трет-бутилсульфинилимины, поскольку литий и реактивы Гриньяра реагируют с сульфинилсерой в п -толуолсульфинилиминах. [ 8 ] Мягкая кислотная обработка легко удаляет N -сульфинильную группу в сульфинамидных продуктах с образованием свободных производных амина. Преимуществом трет-бутилсульфинилиминов является то, что кислотная обработка соответствующих сульфинамидов приводит к легкому удалению побочных продуктов. [ 8 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Дэвис, Франклин А; Чжоу, Пин; Чен, Банг-Чи (1998). «Асимметричный синтез аминокислот с использованием сульфиниминов (тиооксим S-оксидов)». Обзоры химического общества . 27:13 . дои : 10.1039/A827013Z .
- ^ Перейти обратно: а б с Дэвис, Франклин А; Чжоу, Пин; Чен, Банг-Чи (2004). «Последние достижения в асимметричных реакциях с использованием сульфиниминов ( N -сульфинилиминов)». Тетраэдр . 60 (37): 8003–8030. дои : 10.1016/j.tet.2004.06.071 .
- ^ Перейти обратно: а б с Сенанаяке, Крис Х; Кришнамурти, Дхилипкумар; Луй, Чжи-Хуэй; Галлоу, я (2005). «Энантиочистые сульфоксиды и сульфинамиды: последние разработки в области их стереоселективного синтеза и применения в асимметричном синтезе». Альдрихимика Акта . 38 (40): 93. дои : 10.1002/chin.200640264 .
- ^ Перейти обратно: а б с Мортон, Дэниел; Стокман, Роберт А. (2006). «Хиральные нерацемические сульфинимины: универсальные реагенты для асимметричного синтеза». Тетраэдр . 62 (38): 8869–8905. дои : 10.1016/j.tet.2006.06.107 .
- ^ Перейти обратно: а б с Дэвис, Франклин А. (2006). «Приключения в серо-азотной химии». Журнал органической химии . 71 (24): 8993–9003. дои : 10.1021/jo061027p . ПМИД 17109522 .
- ^ Перейти обратно: а б с Эдупуганти, Рамакришна; Дэвис, Франклин А. (2012). «Синтез и применение замаскированных оксосульфинамидов в асимметричном синтезе». Органическая и биомолекулярная химия . 10 (26): 5021–31. дои : 10.1039/c2ob25345c . ПМИД 22576951 .
- ^ Перейти обратно: а б с Дэвис, Франклин А; Фридман, Артур Дж.; Клюгер, Эдвард В. (1974). «Химия связи сера-азот. VIII. N -алкилиденсульфинамиды». Журнал Американского химического общества . 96 (15): 5000–5001. дои : 10.1021/ja00822a055 .
- ^ Перейти обратно: а б с д и ж Эллман, Джонатан; Робак, Мэриэнн Т.; Трава, Мелисса А. (2010). «Синтез и применение трет-бутансульфинамида». Химические обзоры . 110 (6): 3600–740. дои : 10.1021/cr900382t . ПМИД 20420386 .
- ^ Халс, Мартин; Малломо, Джон П.; Фрай, Лия Л.; Коган, Тимоти П.; Познер Гэри Х (1990). Органические синтезы, Сборник . 7 : 495.
{{cite journal}}: Отсутствует или пусто|title=( помощь ) - ^ Чинквини, Мауро; Коцци, Франко (1977). «Синтез оптически активных N -алкилиденсульфинамидов». Журнал Химического общества, Chemical Communications (14): 502. doi : 10.1039/c3977000502b .
- ^ Дэвис, Франклин А.; Редди, Тимма Р.; Редди, Раджаратнам Э. (1992). «Асимметричный синтез сульфиниминов: применение к синтезу нерацемических β-аминокислот и α-гидрокси-β-аминокислот». Журнал органической химии . 57 (24): 6387–6389. дои : 10.1021/jo00050a007 .
- ^ Дэвис, Франклин А; Редди, Тимма Р.; Хан, Вэй; Кэрролл, П.Дж. (1992). «Химия оксазиридинов. 17. N- (Фенилсульфонил)(3,3-дихлоркамфорил)оксазиридин: высокоэффективный реагент для асимметричного окисления сульфида до сульфоксидов». Журнал Американского химического общества . 114 (4): 1428–1437. дои : 10.1021/ja00030a045 .
- ^ Дэвис, Франклин А.; Редди, Раджхаратнам Э.; Шевчик, Джоанна М.; Редди, Г. Венкат; Портоново, Падма С.; Чжан, Хуэймин; Фанелли, Дин; Редди, Р. Тимма; Чжоу, Пин; Кэрролл, Патрик Дж. (1997). «Асимметричный синтез и свойства сульфиниминов (тиооксимных S-оксидов)». Журнал органической химии . 62 (8): 2555–2563. дои : 10.1021/jo970077e . ПМИД 11671597 .
- ^ Лю, Гуанчэн; Коган, Дерек. А.; Оуэнс, Тимоти Д.; Тан, Тони П.; Эллман, Джонатан А. (1999). «Синтез энантиомерно чистых N -трет-бутансульфинилиминов (трет-бутансульфиниминов) путем прямой конденсации трет-бутансульфинамида с альдегидами и кетонами». Журнал органической химии . 64 (4): 1278–1284. дои : 10.1021/jo982059i .
- ^ Перейти обратно: а б Дэвис, Франклин А.; Чжан Юлянь; Андемихаэль, Йеман; Фанг, Тяньань; Фанелли, Дин Л.; Чжан, Хуэймин (1999). «Улучшенный синтез энантиочистых сульфиниминов (тиооксим-S-оксидов) из п -толуолсульфинамидов, альдегидов и кетонов». Журнал органической химии . 64 (4): 1403–1406. дои : 10.1021/jo9820622 .
- ^ Перейти обратно: а б Дэвис, Франклин А.; Портоново, Падма С.; Редди, Раджаратнам Э.; Чиу, Ю-хун (1996). «Асимметричный синтез Стрекера с использованием энантиочистых сульфиниминов и цианида диэтилалюминия: эффект алкоголя». Журнал органической химии . 61 (2): 440–441. дои : 10.1021/jo9519928 . ПМИД 11666956 .
- ^ Го, Тао; Сонг, Ран; Юань, Бинь-Хуа; Чен, Сяо-Ян; Сунь, Син-Вэнь; Линь, Го-Цян (2013). «Высокоэффективная асимметричная конструкция четвертичных углеродсодержащих гомоаллильных и гомопропаргиловых аминов». Химические коммуникации . 49 (47): 5402–5404. дои : 10.1039/C3CC42481B . ПМИД 23657470 .
- ^ Дэвис, Франклин А; Шрираджан, Вайдьянатан; Титус, Дональд Д. (1999). «Эффективный асимметричный синтез β-фтор-α-аминокислот». Журнал органической химии . 64 (18): 6931–6934. дои : 10.1021/jo990947n . ПМИД 11674714 .
- ^ Дэвис, Франклин А; Редди, Раджаратнам Э.; Шевчик, Джоанна М. (1995). «Асимметричный синтез (R)-(+)-β-фенилаланина из (S)-(+)-бензилиден- п -толуолсульфинамида. Регенерация предшественника сульфинимина». Журнал органической химии . 60 (21): 7037–7039. дои : 10.1021/jo00126a070 .
- ^ Дэвис, Франклин А; Шевчик, Джоанна М.; Редди, Раджаратнам Э (1996). «Эффективный синтез (+)-(S)-этил-β-амино-3-пиридинпропаноата с использованием энантиочистых сульфиниминов». Журнал органической химии . 61 (6): 2222–2225. дои : 10.1021/jo951917x .
- ^ Дэвис, Франклин А; Чжан, Яньфэн; Цю, Хуэй (2007). «Асимметричный синтез анти- и син-2,3-диаминоэфиров с использованием сульфиниминов. Эффекты воды и концентрации» . Органические письма . 9 (5): 833–836. дои : 10.1021/ol063058c . ПМЦ 2533706 . ПМИД 17261004 .
- ^ Дэвис, Франклин А.; Рамачандар, Токала; Лю Ху (2004). «Асимметричный синтез α-амино-1,3-дитиокеталей из сульфиниминов ( N -сульфинилиминов). Синтез (2S,3R)-(-)-3-гидрокси-3-метилпролина». Органические письма . 6 (19): 3393–5. дои : 10.1021/ol0485971 . ПМИД 15355060 .
- ^ Дэвис, Франклин А; Рамачандар, Токала; Чай, Цзин; Скукас, Эдуардас (2006). «Асимметричный синтез α-аминоальдегидов из α-амино-1,3-дитианов, полученных из сульфинимина ( N -сульфинилимина). Формальный синтез (-)-2,3-транс-3,4-цис-дигидроксипролина». Буквы тетраэдра . 47 : 2743. doi : 10.1016/j.tetlet.2006.02.092 .
- ^ Дэвис, Франклин А; Нолт, М. Брэд; Ву, Юнчжун; Прасад, Кавираяни Р.; Ли, Даньян; Ян, Бин; Боуэн, Кериша; Ли, Сын Х.; Эрдли, Джон Х. (2005). «Асимметричный синтез β-аминокарбонильных соединений с N -сульфинилβ-аминоамидами Вайнреба». Журнал органической химии . 70 (6): 2184–2190. дои : 10.1021/jo0402780 . ПМИД 15760203 .
- ^ Дэвис, Франклин А; Сон Минсу (2007). «Асимметричный синтез син-α-замещенных β-аминокетонов с использованием сульфиниминов и прохиральных енолятов амида Вайнреба». Органические письма . 9 (12): 2413–2416. дои : 10.1021/ol0708166 . ПМИД 17497798 .
- ^ Дэвис, Франклин А; Ли, Сын; Ян, Хунсин; Титус, Дональд Д. (2001). «Асимметричный синтез четвертичных α-аминофосфонатов с использованием сульфиниминов». Органические письма . 3 (11): 1757–1760. дои : 10.1021/ol015945f . ПМИД 11405704 .
- ^ Дэвис, Франклин А.; Ли, Сын; Сюй, Хэ (2004). «Асимметричный синтез циклических α-аминофосфонатов с использованием замаскированных оксосульфиниминов ( N -сульфинилиминов)». Журнал органической химии . 69 (11): 3777. doi : 10.1021/jo040127x . ПМИД 15153008 .
- ^ Дэвис, Франклин А.; Чжоу, Пин; Редди, Г. Венкат (1994). «Асимметричный синтез и реакции цис- N- ( п -толуолсульфинил)азиридин-2-карбоновых кислот». Журнал органической химии . 59 (12): 3243–3245. дои : 10.1021/jo00091a001 .
- ^ Дэвис, Франклин А.; Лю, Ху; Чжоу, Пин; Фанг, Тяньань; Редди, Г. Венкат; Чжан, Юлиан (1999). «Асимметричный синтез Аза-Дарценса N - p- (толуолсульфинил)азиридин-2-карбоксилатных эфиров из сульфиниминов ( N -сульфинилиминов)». Журнал органической химии . 64 (20): 7559–7567. дои : 10.1021/jo990907j .
- ^ Дэвис, Франклин А; МакКолл, Уильям; Титус, Дональд Д. (1999). «Асимметричный синтез производных α-метилфосфофенилаланина с использованием хиральных энантиочистых азиридинил-2-фосфонатов, полученных из сульфинимина». Органические письма . 1 (7): 1053–5. дои : 10.1021/ol990855k . ПМИД 10825956 .
- ^ Дэвис, Франклин А.; Ву, Юнчжун; Ян, Хунсин; МакКолл, Уильям; Прасад, Кавираяни Р. (2003). «Асимметричный синтез азиридин-2-фосфонатов из энантиочистых сульфиниминов ( N -сульфинилиминов). Синтез α-аминофосфонатов». Журнал органической химии . 68 (6): 2410–2419. дои : 10.1021/jo020707z . ПМИД 12636410 .