Ядерная организация
Эта статья может быть слишком технической для понимания большинства читателей . ( Май 2016 г. ) |
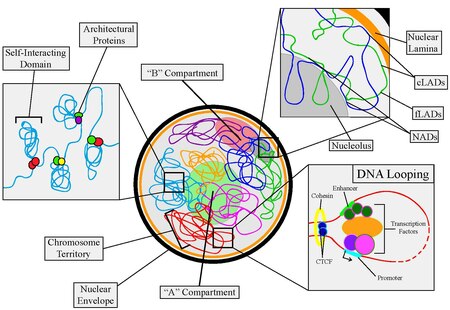
Ядерная организация относится к пространственному распределению хроматина внутри клетки ядра . Существует множество различных уровней и масштабов ядерной организации. Хроматин представляет собой структуру ДНК более высокого порядка.
В наименьшем масштабе ДНК упакована в единицы , называемые нуклеосомами . Количество и организация этих нуклеосом могут влиять на доступность локального хроматина. Это оказывает влияние на экспрессию близлежащих генов , дополнительно определяя, могут ли они регулироваться транскрипционными факторами .
В немного больших масштабах петлеобразование ДНК может физически объединить элементы ДНК, которые в противном случае были бы разделены большими расстояниями. Эти взаимодействия позволяют регуляторным сигналам пересекать большие геномные расстояния, например, от энхансеров к промоторам .
Напротив, в больших масштабах расположение хромосом может определять их свойства. Хромосомы разделены на два отсека, обозначенных A («активный») и B («неактивный»), каждый из которых имеет разные свойства. Более того, целые хромосомы разделяются на отдельные области, называемые хромосомными территориями .
Важность
[ редактировать ]Каждая человеческая клетка содержит около двух метров ДНК , которая должна быть плотно свернута, чтобы поместиться внутри ядра клетки . Однако для того, чтобы клетка могла функционировать, белки должны иметь доступ к информации о последовательности, содержащейся в ДНК, несмотря на ее плотно упакованную природу. Следовательно, в клетке имеется ряд механизмов, контролирующих организацию ДНК. [1]
Более того, ядерная организация может играть роль в установлении идентичности клеток. Клетки внутри организма имеют почти идентичные последовательности нуклеиновых кислот , но часто демонстрируют разные фенотипы . Один из способов проявления этой индивидуальности — изменения в архитектуре генома , которые могут изменить экспрессию различных наборов генов . [2] Эти изменения могут иметь последующий эффект на клеточные функции, такие как облегчение клеточного цикла , репликация ДНК , ядерный транспорт и изменение ядерной структуры. Контролируемые изменения в ядерной организации необходимы для правильного функционирования клеток.
История и методология
[ редактировать ]Организация хромосом в отдельные области внутри ядра была впервые предложена в 1885 году Карлом Раблем . Позже, в 1909 году, с помощью тогдашней технологии микроскопии Теодор Бовери ввел термин «хромосомные территории» после того, как заметил, что хромосомы занимают отдельные отдельные ядерные области. [3] С тех пор картирование архитектуры генома стало основной темой интереса.
За последние десять лет быстрое методологическое развитие значительно продвинуло понимание в этой области. [1] Крупномасштабную организацию ДНК можно оценить с помощью визуализации ДНК с использованием флуоресцентных меток, таких как флуоресцентная гибридизация ДНК in situ (FISH), и специализированных микроскопов. [4] Кроме того, высокопроизводительные технологии секвенирования, такие как методы, основанные на захвате конформации хромосом, могут измерять, как часто участки ДНК находятся в непосредственной близости. [5] В то же время прогресс в методах редактирования генома (таких как CRISPR/Cas9 , ZFN и TALEN ) облегчил тестирование организационных функций определенных участков ДНК и белков. [6] Растет также интерес к реологическим свойствам межхромосомного пространства, изучаемым методами флуоресцентной корреляционной спектроскопии и ее вариантов. [7] [8]
Архитектурные белки
[ редактировать ]Архитектурные белки регулируют структуру хроматина, устанавливая физические взаимодействия между элементами ДНК. [9] Эти белки имеют тенденцию быть высококонсервативными у большинства видов эукариот. [10] [11]
У млекопитающих ключевые архитектурные белки включают:
- Гистоны : ДНК обертывается вокруг гистонов, образуя нуклеосомы , которые являются основными единицами структуры хроматина. Каждая нуклеосома состоит из 8 субъединиц белка-гистона, вокруг которых примерно 147 пар оснований ДНК завернуты в 1,67 левых витка. В общей сложности нуклеосомы упаковывают примерно 2 метра двухцепочечной ДНК в ядро диаметром 10 мкм. [12] Концентрация и специфический состав используемых гистонов могут определять локальную структуру хроматина. Например, эухроматин — это форма хроматина с низкой концентрацией нуклеосом — здесь ДНК подвергается воздействию, способствуя взаимодействию с экспрессией генов, репликацией и организационными механизмами. Напротив, гетерохроматин имеет высокую концентрацию нуклеосом и связан с репрессией экспрессии и репликации генов, поскольку необходимые белки не могут взаимодействовать с ДНК.
- Ферменты ремоделирования хроматина . Эти ферменты ответственны за содействие образованию эухроматина или гетерохроматина посредством ряда процессов, в частности, модификации гистоновых хвостов или физического перемещения нуклеосом. Это, в свою очередь, помогает регулировать экспрессию генов, репликацию и взаимодействие хроматина с архитектурными факторами. [13] Список ферментов, ремоделирующих хроматин, обширен, и многие из них играют специфическую роль в ядре. Например, в 2016 г. Wiechens et al. идентифицировали два человеческих фермента, SNF2H и SNF2L, которые активны в регуляции связывания CTCF и, следовательно, влияют на организацию генома и транскрипцию многих генов. [14]
- CCCTC-связывающий фактор (CTCF) , или белок 11-цинковых пальцев, считается наиболее важным игроком, связывающим организацию генома с экспрессией генов. [11] CTCF взаимодействует со специфическими последовательностями ДНК и множеством других архитектурных белков, главным образом с когезином. [15] - такое поведение позволяет ему опосредовать закольцовывание ДНК, действуя таким образом как репрессор транскрипции, активатор и изолятор . Более того, CTCF часто обнаруживается на границах самодействующих доменов и может прикреплять хроматин к ядерной пластинке. [16] CTCF также участвует в рекомбинации V(D)J . [17]
- Когезин : комплекс когезина изначально был обнаружен как ключевой игрок в митозе , связывающий сестринские хроматиды вместе для обеспечения правильного разделения. Однако с тех пор когезин был связан со многими другими функциями внутри клетки. [18] Было обнаружено, что он способствует восстановлению и рекомбинации ДНК, спариванию и ориентации мейотических хромосом, конденсации хромосом, репликации ДНК, экспрессии генов и архитектуре генома. [19] Когезин представляет собой гетеродимер, состоящий из белков SMC1 и SMC3 в сочетании с белками SCC1 и SCC3. Весь комплекс загружается в ДНК комплексом NIPBL-MAU2 в виде кольца. [20]
Уровни ядерной организации
[ редактировать ]Основы линейной ДНК и хромосом
[ редактировать ]
Первый уровень организации генома касается линейного расположения ДНК и ее упаковки в хромосомы . ДНК состоит из двух антипараллельных цепей нуклеиновых кислот, причем две связанные и противоположные нуклеиновые кислоты называются парами оснований ДНК. Чтобы ДНК упаковалась внутри крошечного ядра клетки, каждая нить обертывается вокруг гистонов , образуя нуклеосомные структуры. Эти нуклеосомы собираются вместе, образуя хромосомы . В зависимости от эукариота в каждом ядре имеется несколько независимых хромосом разного размера — например, у человека их 46, а у жирафов — 30. [21]
Внутри участков хромосомы порядок пар оснований ДНК образует специфические элементы для экспрессии генов и репликации ДНК. Некоторые из наиболее распространенных элементов включают гены, кодирующие белки (содержащие экзоны и интроны), некодирующую ДНК, энхансеры, промоторы, операторы, точки начала репликации, теломеры и центромеры. На данный момент не так много доказательств важности определенного порядка этих элементов вдоль или между отдельными хромосомами. Например, расстояние между энхансером и промотором, взаимодействующими элементами, которые составляют основу экспрессии генов, может варьироваться от нескольких сотен пар оснований до сотен тысяч пар оснований. [22] Кроме того, отдельные энхансеры могут взаимодействовать с несколькими различными промоторами, и то же самое справедливо для одного промотора, взаимодействующего с множеством различных энхансеров.
Однако в более широком масштабе хромосомы гетерогенны по составу эухроматина и гетерохроматина. Кроме того, имеются данные о богатых и бедных генами регионах и различных доменах, связанных с дифференцировкой клеток, активной или подавленной экспрессией генов, репликацией ДНК, а также рекомбинацией и репарацией ДНК. [23] Все это помогает определить хромосомные территории.
петля ДНК
[ редактировать ]
Петлеобразование ДНК — это первый уровень ядерной организации, который включает в себя сворачивание хромосом. В процессе образования петель ДНК хроматин образует физические петли, приводя области ДНК в тесный контакт. Таким образом, даже участки, находящиеся далеко друг от друга по линейной хромосоме, можно объединить в трехмерном пространстве. Этому процессу способствует ряд факторов, включая архитектурные белки (в первую очередь CTCF и Cohesin), факторы транскрипции, коактиваторы и нкРНК. Важно отметить, что закольцовывание ДНК можно использовать для регуляции экспрессии генов — события закольцовывания могут подавлять или активировать гены, в зависимости от задействованных элементов. Считается, что около 50% человеческих генов участвуют в дальних взаимодействиях хроматина посредством процесса образования петель ДНК. [24]
Петлеобразование впервые наблюдал Вальтер Флемминг в 1878 году, когда изучал ооциты амфибий. Лишь в конце 20 века петлеобразование ДНК стало коррелировать с экспрессией генов. [1] Например, в 1990 году Мандал и его коллеги показали важность образования петель ДНК для подавления оперонов галактозы и лактозы в E coli . В присутствии галактозы или лактозы белки-репрессоры образуют взаимодействия белок-белок и белок-ДНК, образуя петлю ДНК. Это, в свою очередь, соединяет промоторы гена с вышестоящими и нижестоящими операторами, эффективно подавляя экспрессию генов путем блокирования сборки комплекса преинициации транскрипции (PIC) на промоторе и, следовательно, предотвращая инициацию транскрипции. [25]
При активации генов закручивание петель ДНК обычно объединяет дистальные промоторы и энхансеры генов. Энхансеры могут рекрутировать большой комплекс белков, таких как медиаторный комплекс , PIC и другие клеточно-специфичные факторы транскрипции, участвующие в инициации транскрипции гена. [26]
Хромосомные домены
[ редактировать ]Самодействующие домены
[ редактировать ]Самовзаимодействующие (или самоассоциирующиеся) домены обнаружены во многих организмах: у бактерий они называются хромосомными взаимодействующими доменами (CID), тогда как в клетках млекопитающих они называются топологически ассоциированными доменами (TAD). Размер самодействующих доменов может варьироваться от 1 до 2 МБ в более крупных организмах. [27] до десятков т.п.н. в одноклеточных организмах. [28] Что характеризует самовзаимодействующую область, так это набор общих характеристик. Во-первых, самодействующие домены имеют более высокое соотношение хромосомных контактов внутри домена, чем за его пределами. Они образуются с помощью архитектурных белков и содержат внутри себя множество петель хроматина. Эта характеристика была обнаружена с помощью Hi-C . методов [24] Во-вторых, самодействующие домены коррелируют с регуляцией экспрессии генов. Существуют определенные домены, связанные с активной транскрипцией, и другие домены, подавляющие транскрипцию. То, что определяет, принимает ли домен конкретную форму, зависит от того, какие связанные гены должны быть активными/неактивными во время определенной фазы роста, стадии клеточного цикла или внутри определенного типа клеток. Клеточная дифференциация определяется включением или выключением определенных наборов генов, что соответствует уникальному составу самодействующих доменов отдельной клетки. [29] Наконец, внешние границы этих доменов содержат более высокую частоту сайтов связывания архитектурных белков, регионов и эпигенетических меток, коррелирующих с активной транскрипцией, генами домашнего хозяйства и короткими вкраплениями ядерных элементов (SINE). [24]
Примером подмножества самовзаимодействующих доменов являются активные концентраторы хроматина (ACH). Эти хабы были обнаружены при наблюдении за активированными локусами альфа- и бета-глобина. [30] ACH образуются посредством обширного закольцовывания ДНК, образуя «концентратор» регуляторных элементов для координации экспрессии подмножества генов. [31]
Домены, ассоциированные с пластинками, и домены, ассоциированные с ядрышками
[ редактировать ]Домены, ассоциированные с ламиной (LAD) и домены, ассоциированные с ядрышком (NAD), представляют собой области хромосомы, которые взаимодействуют с ядерной пластинкой и ядрышком соответственно.
Составляя примерно 40% генома, LAD состоят в основном из бедных генами областей и имеют размер от 40 КБ до 30 МБ. [16] Существует два известных типа LAD: конститутивные LAD (cLAD) и факультативные LAD (fLAD). cLAD представляют собой богатые АТ области гетерохроматина, которые остаются на пластинке и наблюдаются во многих типах клеток и видов. Есть доказательства того, что эти регионы важны для структурного формирования интерфазной хромосомы. С другой стороны, fLADs имеют различные взаимодействия пластинок и содержат гены, которые либо активируются, либо репрессируются между отдельными клетками, что указывает на специфичность клеточного типа. [32] Границы LAD, как и самодействующие домены, обогащены транскрипционными элементами и сайтами связывания архитектурных белков. [16]
НАД, составляющие 4% генома, имеют почти все те же физические характеристики, что и ЛАД. Фактически, анализ ДНК этих двух типов доменов показал, что многие последовательности перекрываются, указывая на то, что определенные области могут переключаться между связыванием пластинки и связыванием ядрышка. [33] НАД связаны с функцией ядрышка. Ядрышко является крупнейшей суборганеллой ядра и основным местом транскрипции рРНК. Он также участвует в биосинтезе частиц, распознавании сигналов, секвестрации белков и репликации вируса. [34] Ядрышко формируется вокруг генов рДНК из разных хромосом. Однако одновременно транскрибируется только часть генов рДНК, и это происходит путем закольцовывания во внутренней части ядрышка. Остальные гены лежат на периферии субъядерной органеллы в состоянии молчащего гетерохроматина. [33]
отсеки A/B
[ редактировать ]Компартменты A/B были впервые обнаружены в ранних Hi-C . исследованиях [35] [36] Исследователи заметили, что весь геном можно разделить на два пространственных отсека, обозначенных «A» и «B», где области в отсеке A имеют тенденцию преимущественно взаимодействовать с областями, связанными с отсеком A, чем с областями, связанными с отсеком B. Аналогичным образом, регионы в компартменте B имеют тенденцию ассоциироваться с другими регионами, связанными с компартментом B.
Области, связанные с компартментами A/B, находятся на шкале мульти-Mb и коррелируют либо с открытым и экспрессионно-активным хроматином (отделения A), либо с закрытым и неактивным по экспрессии хроматином (отделения B). [35] Компартменты A, как правило, богаты генами, имеют высокое содержание GC , содержат гистоновые маркеры для активной транскрипции и обычно смещают внутреннюю часть ядра. Кроме того, они обычно состоят из самодействующих доменов и содержат источники ранней репликации. С другой стороны, компартменты B, как правило, бедны генами, компактны , содержат гистоновые маркеры для подавления генов и расположены на периферии ядра. Они состоят в основном из LAD и содержат точки начала поздней репликации. [35] Кроме того, Hi-C с более высоким разрешением в сочетании с методами машинного обучения показал, что отсеки A/B можно разделить на подотделения. [37] [38]
Тот факт, что компартменты самовзаимодействуют, согласуется с идеей о том, что ядро локализует белки и другие факторы, такие как длинные некодирующие РНК (днРНК), в областях, подходящих для их индивидуальных ролей. [ нужна ссылка ] Примером этого является наличие множества фабрик транскрипции внутри ядра. [39] Эти фабрики связаны с повышенным уровнем транскрипции из-за высокой концентрации факторов транскрипции (таких как аппарат транскрипционных белков, активные гены, регуляторные элементы и возникающая РНК). Около 95% активных генов транскрибируются на фабриках транскрипции. Каждая фабрика может транскрибировать несколько генов — эти гены не обязательно должны иметь схожие функции продукта и не обязательно лежать в одной хромосоме. Наконец, известно, что совместная локализация генов внутри фабрик транскрипции зависит от типа клеток. [40]
Хромосомные территории
[ редактировать ]
Последний уровень организации касается четкого расположения отдельных хромосом внутри ядра. Область, занимаемая хромосомой, называется хромосомной территорией (СТ). [41] Среди эукариот CT имеют несколько общих свойств. Во-первых, хотя расположение хромосом в клетках популяции неодинаково, между отдельными хромосомами имеются некоторые предпочтения в отношении определенных участков. Например, крупные хромосомы с бедным генами обычно располагаются на периферии возле ядерной пластинки, тогда как более мелкие хромосомы с богатым генами группируются ближе к центру ядра. [42] Во-вторых, индивидуальные предпочтения хромосом варьируются в зависимости от типа клеток. Например, было показано, что Х-хромосома чаще локализуется на периферии в клетках печени, чем в клетках почек. [43] Другое консервативное свойство хромосомных территорий состоит в том, что гомологичные хромосомы имеют тенденцию находиться далеко друг от друга во время интерфазы клеток. Последней характеристикой является то, что положение отдельных хромосом в течение каждого клеточного цикла остается относительно одинаковым до начала митоза. [44] Механизмы и причины, лежащие в основе характеристик хромосомной территории, до сих пор неизвестны, и необходимы дальнейшие эксперименты.
Ссылки
[ редактировать ]- ^ Jump up to: а б с Фрейзер Дж., Уильямсон И., Бикмор В.А., Дости Дж. (сентябрь 2015 г.). «Обзор организации генома и как мы туда попали: от FISH к Hi-C» . Обзоры микробиологии и молекулярной биологии . 79 (3): 347–72. дои : 10.1128/MMBR.00006-15 . ПМК 4517094 . ПМИД 26223848 .
- ^ Помбо А., Диллон Н. (апрель 2015 г.). «Трехмерная архитектура генома: игроки и механизмы». Обзоры природы. Молекулярно-клеточная биология . 16 (4): 245–57. дои : 10.1038/nrm3965 . ПМИД 25757416 . S2CID 6713103 .
- ^ Кремер Т. , Кремер М., Хюбнер Б., Стрикфаден Х., Смитс Д., Попкен Дж. и др. (октябрь 2015 г.). «4D-нуклеом: свидетельства динамического ядерного ландшафта, основанного на совмещенных активных и неактивных ядерных отсеках» . Письма ФЭБС . 589 (20 ч. А): 2931–43. Бибкод : 2015FEBSL.589.2931C . дои : 10.1016/j.febslet.2015.05.037 . ПМИД 26028501 . S2CID 10254118 .
- ^ Риска VI, Greenleaf WJ (июль 2015 г.). «Раскрытие трехмерного генома: инструменты геномики для многомасштабных исследований» . Тенденции в генетике . 31 (7): 357–72. дои : 10.1016/j.tig.2015.03.010 . ПМК 4490074 . ПМИД 25887733 .
- ^ де Вит Э, де Лаат В (январь 2012 г.). «Десятилетие технологий 3C: взгляд на ядерную организацию» . Гены и развитие . 26 (1): 11–24. дои : 10.1101/gad.179804.111 . ПМЦ 3258961 . ПМИД 22215806 .
- ^ Гай Т., Герсбах Калифорния, Барбас КФ (июль 2013 г.). «Методы геномной инженерии на основе ZFN, TALEN и CRISPR/Cas» . Тенденции в биотехнологии . 31 (7): 397–405. дои : 10.1016/j.tibtech.2013.04.004 . ПМЦ 3694601 . ПМИД 23664777 .
- ^ Бубак Г., Квапишевска К., Калварчик Т., Белец К., Андришевски Т., Иван М. и др. (январь 2021 г.). «Количественная оценка наномасштабной вязкости и структуры ядра живых клеток на основе измерений подвижности» . Журнал физической химии . 12 (1): 294–301. doi : 10.1021/acs.jpclett.0c03052 . ПМИД 33346672 . S2CID 229342582 .
- ^ Баум М., Эрдель Ф., Ваксмут М., Риппе К. (июль 2014 г.). «Извлечение внутриклеточной топологии на основе многомасштабного картирования подвижности белков в живых клетках» . Природные коммуникации . 5 (1): 4494. Бибкод : 2014NatCo...5.4494B . дои : 10.1038/ncomms5494 . ПМК 4124875 . ПМИД 25058002 .
- ^ Гомес-Диас Э., Корсес В.Г. (ноябрь 2014 г.). «Архитектурные белки: регуляторы трехмерной организации генома в судьбах клеток» . Тенденции в клеточной биологии . 24 (11): 703–11. дои : 10.1016/j.tcb.2014.08.003 . ПМЦ 4254322 . ПМИД 25218583 .
- ^ Кампос Э.И., Рейнберг Д. (декабрь 2009 г.). «Гистоны: аннотирующий хроматин». Ежегодный обзор генетики . 43 (1): 559–99. дои : 10.1146/annurev.genet.032608.103928 . ПМИД 19886812 .
- ^ Jump up to: а б Онг КТ, Корсес В.Г. (апрель 2014 г.). «CTCF: архитектурный белок, соединяющий топологию и функцию генома» . Обзоры природы. Генетика . 15 (4): 234–46. дои : 10.1038/nrg3663 . ПМЦ 4610363 . ПМИД 24614316 .
- ^ Люгер К., Мэдер А.В., Ричмонд Р.К., Сарджент Д.Ф., Ричмонд Т.Дж. (сентябрь 1997 г.). «Кристаллическая структура ядра нуклеосомы при разрешении 2,8 А». Природа . 389 (6648): 251–60. Бибкод : 1997Natur.389..251L . дои : 10.1038/38444 . ПМИД 9305837 . S2CID 4328827 .
- ^ Филлипс, Т. и Шоу, К. (2008) Ремоделирование хроматина у эукариот. Природное образование 1(1):209
- ^ Вихенс Н., Сингх В., Гкикопулос Т., Шофилд П., Роча С., Оуэн-Хьюз Т. (март 2016 г.). «Ферменты ремоделирования хроматина SNF2H и SNF2L позиционируют нуклеосомы рядом с CTCF и другими факторами транскрипции» . ПЛОС Генетика . 12 (3): e1005940. дои : 10.1371/journal.pgen.1005940 . ПМЦ 4809547 . ПМИД 27019336 .
- ^ Рубио Э.Д., Рейсс Д.Д., Уэлч П.Л., Дистече К.М., Филиппова Г.Н., Балига Н.С. и др. (июнь 2008 г.). «CTCF физически связывает когезин с хроматином» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (24): 8309–14. Бибкод : 2008PNAS..105.8309R . дои : 10.1073/pnas.0801273105 . ПМЦ 2448833 . ПМИД 18550811 .
- ^ Jump up to: а б с Гелен Л., Пейги Л., Брассет Э., Меулеман В., Фаза М.Б., Талхаут В. и др. (июнь 2008 г.). «Доменная организация хромосом человека, выявленная путем картирования взаимодействий ядерных пластинок». Природа . 453 (7197): 948–51. Бибкод : 2008Natur.453..948G . дои : 10.1038/nature06947 . ПМИД 18463634 . S2CID 4429401 .
- ^ Шомей Дж., Скок Дж. А. (апрель 2012 г.). «Роль CTCF в регуляции рекомбинации V(D)J» . Современное мнение в иммунологии . 24 (2): 153–9. дои : 10.1016/j.coi.2012.01.003 . ПМЦ 3444155 . ПМИД 22424610 .
- ^ Петерс Дж. М., Тедески А., Шмитц Дж. (ноябрь 2008 г.). «Комплекс когезина и его роль в биологии хромосом» . Гены и развитие . 22 (22): 3089–114. дои : 10.1101/gad.1724308 . ПМИД 19056890 .
- ^ Мехта Г.Д., Кумар Р., Шривастава С., Гош С.К. (август 2013 г.). «Когезин: функции, выходящие за рамки слипания сестринских хроматид» . Письма ФЭБС . 587 (15): 2299–312. Бибкод : 2013FEBSL.587.2299M . дои : 10.1016/j.febslet.2013.06.035 . ПМИД 23831059 . S2CID 39397443 .
- ^ Нэсмит К., Херинг CH (2009). «Когезин: его роли и механизмы». Ежегодный обзор генетики . 43 : 525–58. doi : 10.1146/annurev-genet-102108-134233 . ПМИД 19886810 .
- ^ Хуан Л., Нестеренко А., Не В., Ван Дж., Су В., Графодатский А.С., Ян Ф. Кариотипическая эволюция жирафов (Giraffa Camelopardalis), выявленная с помощью межвидовой окраски хромосом с китайским мунтжаком (Muntiacus reevesi) и человеком (Homo sapiens) краски. Цитогенетический геном Рез. 2008, 122: 132–138.
- ^ Мэтьюз К.С. (март 1992 г.). «Петля ДНК» . Микробиологические обзоры . 56 (1): 123–36. дои : 10.1128/MMBR.56.1.123-136.1992 . ПМЦ 372857 . ПМИД 1579106 .
- ^ Федерико С, Скаво С, Кантарелла С.Д., Мотта С., Сакконе С., Бернарди Г. (апрель 2006 г.). «Богатые генами и бедные генами хромосомные области имеют разные местоположения в интерфазных ядрах хладнокровных позвоночных». Хромосома . 115 (2): 123–8. дои : 10.1007/s00412-005-0039-z . ПМИД 16404627 . S2CID 9543558 .
- ^ Jump up to: а б с Джин Ф., Ли Ю., Диксон Дж.Р., Сельварадж С., Йе З., Ли А.Ю. и др. (ноябрь 2013 г.). «Карта трехмерного интерактома хроматина в клетках человека» . Природа . 503 (7475): 290–4. Бибкод : 2013Natur.503..290J . дои : 10.1038/nature12644 . ПМЦ 3838900 . ПМИД 24141950 .
- ^ Мандал Н., Су В., Хабер Р., Адхья С., Эколс Х. (март 1990 г.). «Петля ДНК при клеточной репрессии транскрипции оперона галактозы» . Гены и развитие . 4 (3): 410–8. дои : 10.1101/gad.4.3.410 . ПМИД 2186968 .
- ^ Лю З., Меркурьев Д., Ян Ф., Ли В., О С., Фридман М.Дж. и др. (октябрь 2014 г.). «Активация энхансера требует транс-рекрутирования комплекса мегатранскрипционных факторов» . Клетка . 159 (2): 358–73. дои : 10.1016/j.cell.2014.08.027 . ПМЦ 4465761 . ПМИД 25303530 .
- ^ Диксон Дж.Р., Сельварадж С., Юэ Ф., Ким А., Ли Ю., Шен Ю. и др. (апрель 2012 г.). «Топологические домены в геномах млекопитающих, выявленные путем анализа взаимодействий хроматина» . Природа . 485 (7398): 376–80. Бибкод : 2012Natur.485..376D . дои : 10.1038/nature11082 . ПМЦ 3356448 . ПМИД 22495300 .
- ^ Ле ТБ, Имакаев М.В., Мирный Л.А., Лауб М.Т. (ноябрь 2013 г.). «Картирование пространственной организации бактериальной хромосомы высокого разрешения» . Наука . 342 (6159): 731–4. Бибкод : 2013Sci...342..731L . дои : 10.1126/science.1242059 . ПМЦ 3927313 . ПМИД 24158908 .
- ^ Ли Г, Руан Х, Ауэрбах Р.К., Сандху К.С., Чжэн М., Ван П. и др. (январь 2012 г.). «Обширные хроматиновые взаимодействия, центрированные промотором, обеспечивают топологическую основу регуляции транскрипции» . Клетка . 148 (1–2): 84–98. дои : 10.1016/j.cell.2011.12.014 . ПМК 3339270 . ПМИД 22265404 .
- ^ Толуис Б., Палстра Р.Дж., Сплинтер Э., Гросвельд Ф., де Лаат В. (декабрь 2002 г.). «Петля и взаимодействие между сверхчувствительными сайтами в активном локусе бета-глобина» . Молекулярная клетка . 10 (6): 1453–65. дои : 10.1016/S1097-2765(02)00781-5 . ПМИД 12504019 .
- ^ де Лаат В., Гросвельд Ф (2003). «Пространственная организация экспрессии генов: активный центр хроматина». Хромосомные исследования . 11 (5): 447–59. дои : 10.1023/а:1024922626726 . ПМИД 12971721 . S2CID 23558157 .
- ^ Меулеман В., Перик-Хупкес Д., Кинд Дж., Бодри Дж.Б., Пейги Л., Келлис М. и др. (февраль 2013 г.). «Конститутивные взаимодействия ядерной пластинки и генома высококонсервативны и связаны с последовательностями, богатыми A/T» . Геномные исследования . 23 (2): 270–80. дои : 10.1101/гр.141028.112 . ПМК 3561868 . ПМИД 23124521 .
- ^ Jump up to: а б ван Конингсбрюгген С., Герлински М., Шофилд П., Мартин Д., Бартон Г.Дж., Ариюрек Ю. и др. (ноябрь 2010 г.). «Полногеномное секвенирование с высоким разрешением показывает, что специфические домены хроматина большинства хромосом человека связаны с ядрышками» . Молекулярная биология клетки . 21 (21): 3735–48. doi : 10.1091/mbc.E10-06-0508 . ПМЦ 2965689 . ПМИД 20826608 .
- ^ Мэтисон Т.Д., Кауфман П.Д. (июнь 2016 г.). «Захват генома НАДами» . Хромосома . 125 (3): 361–71. дои : 10.1007/s00412-015-0527-8 . ПМЦ 4714962 . ПМИД 26174338 .
- ^ Jump up to: а б с Либерман-Эйден Э. , ван Беркум Н.Л., Уильямс Л., Имакаев М., Рагочи Т., Теллинг А. и др. (октябрь 2009 г.). «Комплексное картирование долгосрочных взаимодействий раскрывает принципы свертывания человеческого генома» . Наука . 326 (5950): 289–93. Бибкод : 2009Sci...326..289L . дои : 10.1126/science.1181369 . ПМЦ 2858594 . ПМИД 19815776 .
- ^ Фортин Дж. П., Хансен К. Д. (август 2015 г.). «Реконструкция отсеков A/B, выявленных с помощью Hi-C, с использованием долгосрочных корреляций в эпигенетических данных» . Геномная биология . 16 (1): 180. дои : 10.1186/s13059-015-0741-y . ПМЦ 4574526 . ПМИД 26316348 .
- ^ Рао С.С., Хантли М.Х., Дюран Н.К., Стаменова Е.К., Бочков И.Д., Робинсон Дж.Т. и др. (декабрь 2014 г.). «Трехмерная карта человеческого генома с разрешением в тысячных базах раскрывает принципы образования петель хроматина» . Клетка . 159 (7): 1665–80. дои : 10.1016/j.cell.2014.11.021 . ПМК 5635824 . ПМИД 25497547 .
- ^ Сюн К., Ма Дж (ноябрь 2019 г.). «Выявление субкомпартментов Hi-C путем определения межхромосомных взаимодействий хроматина» . Природные коммуникации . 10 (1): 5069. Бибкод : 2019NatCo..10.5069X . дои : 10.1038/s41467-019-12954-4 . ПМЦ 6838123 . ПМИД 31699985 .
- ^ Кук PR (январь 2010 г.). «Модель для всех геномов: роль фабрик транскрипции». Журнал молекулярной биологии . 395 (1): 1–10. дои : 10.1016/j.jmb.2009.10.031 . ПМИД 19852969 .
- ^ Бакли М.С., Лис Дж.Т. (апрель 2014 г.). «Визуализация сайтов транскрипции РНК-полимеразы II в живых клетках» . Текущее мнение в области генетики и развития . 25 : 126–30. дои : 10.1016/j.где.2014.01.002 . ПМК 5497218 . ПМИД 24794700 .
- ^ Кремер Т. , Кремер М. (март 2010 г.). «Хромосомные территории» . Перспективы Колд-Спринг-Харбор в биологии . 2 (3): а003889. doi : 10.1101/cshperspect.a003889 . ПМЦ 2829961 . ПМИД 20300217 .
- ^ Крофт Дж.А., Бриджер Дж.М., Бойл С., Перри П., Тиг П., Бикмор В.А. (июнь 1999 г.). «Различия в локализации и морфологии хромосом в ядре человека» . Журнал клеточной биологии . 145 (6): 1119–31. дои : 10.1083/jcb.145.6.1119 . ПМК 2133153 . PMID 10366586 .
- ^ Парада Л.А., МакКуин П.Г., Мистели Т. (2004). «Тканеспецифическая пространственная организация геномов» . Геномная биология . 5 (7): Р44. дои : 10.1186/gb-2004-5-7-r44 . ПМЦ 463291 . ПМИД 15239829 .
- ^ Уолтер Дж., Шермелле Л., Кремер М., Таширо С., Кремер Т. (март 2003 г.). «Порядок хромосом в клетках HeLa меняется во время митоза и раннего G1, но стабильно сохраняется на последующих интерфазных стадиях» . Журнал клеточной биологии . 160 (5): 685–97. дои : 10.1083/jcb.200211103 . ПМК 2173351 . ПМИД 12604593 .
Внешние ссылки
[ редактировать ] СМИ, связанные с ядерной организацией, на Викискладе?
СМИ, связанные с ядерной организацией, на Викискладе?