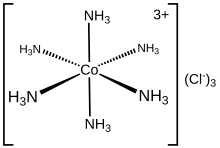
Хлорид гексаамминкобальта(III)
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Хлорид гексаамминкобальта(III) | |
| Другие имена Хлорид гексаммин кобальта, хлорид гексаамминкобальта(III) | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.991 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Н 18 Н 6 Cl 3 Со | |
| Молярная масса | 267.48 g/mol |
| Появление | желтые или оранжевые кристаллы |
| Плотность | 1,71 г/см 3 , |
| Температура плавления | разлагается |
| 0,26 М (20 °С) трибромид: 0,04 М (18 °С) | |
| Растворимость | растворим в NH 3 |
| Структура | |
| октаэдрический | |
| 0 Д | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | яд |
| СГС Маркировка : | |
 | |
| Предупреждение | |
| Х315 , Х319 , Х335 | |
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332+P313, P337+P313 P362 , P403 , P301 , P403+P233 , P405, P5013 +P233, P405, P501, P501, P501 , , P362 , P403+P233, P3 | |
| Родственные соединения | |
Другие анионы | [Co(NH 3 ) 6 ]Br 3 [Co(NH 3 ) 6 ](OAc) 3 |
Другие катионы | [Cr(NH 3 ) 6 ]Cl 3 [Ni(NH 3 ) 6 ]Cl 2 |
Родственные соединения | [Co(H 2 NCH 2 CH 2 NH 2 ) 3 ]Cl 3 [Co(NH 3 ) 5 (H 2 O)]Cl 3 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлорид гексаамминкобальта(III) представляет собой химическое соединение формулы [Co(NH 3 ) 6 ]Cl 3 . Это хлоридная соль координационного комплекса [Co(NH 3 ) 6 ] 3+ , который считается архетипическим «комплексом Вернера», названным в честь пионера координационной химии Альфреда Вернера . Сам катион представляет собой аммиачный комплекс металла с шестью аммиачными лигандами , присоединенными к иону кобальта (III).
Свойства и структура
[ редактировать ][Со( NH3 ) 6 ] 3+ диамагнитен, с низкоспиновым 3d 6 октаэдрический центр Co(III). Катион подчиняется правилу 18 электронов и считается классическим примером обменного инертного металлокомплекса. Ввиду своей инертности [Co(NH 3 ) 6 ]Cl 3 можно перекристаллизовать в неизмененном виде из концентрированной соляной кислоты : NH 3 настолько прочно связан с центрами Co(III), что не может диссоциировать, допуская его протонирование. [1] Напротив, лабильные металламминные комплексы, такие как [Ni(NH 3 ) 6 ]Cl 2 , быстро реагируют с кислотами, что отражает лабильность связей Ni(II)–NH 3 . При нагревании гексамминкобальт(III) начинает терять часть своих амминных лигандов, в конечном итоге образуя более сильный окислитель.
Хлорид-ионы в [Co(NH 3 ) 6 ]Cl 3 можно заменить множеством других анионов, таких как нитрат , бромид , йодид , сульфамат , с получением соответствующего производного [Co(NH 3 ) 6 ]X 3 . Такие соли имеют оранжевый или ярко-желтый цвет и обладают различной степенью растворимости в воде. Хлорид-ион также может быть заменен на более сложные анионы, такие как гексатиоцианатохромат (III), с образованием розового соединения с формулой [Co(NH 3 ) 6 ] [Cr(SCN) 6 ] или феррицианид- иона. [ нужна ссылка ]
Подготовка
[ редактировать ][Co(NH 3 ) 6 ]Cl 3 получают обработкой хлорида кобальта(II) и аммиаком хлоридом аммония с последующим окислением. Окислители включают перекись водорода или кислород в присутствии угольного катализатора. [1] Об этой соли, по-видимому, впервые сообщил Фреми. [2]
Ацетатную соль можно получить аэробным окислением ацетата кобальта (II) , ацетата аммония и аммиака в метаноле. [3] Ацетатная соль хорошо растворима в воде до уровня 1,9 М (20 ° C) по сравнению с 0,26 М трихлорида.
Использование в лаборатории
[ редактировать ][Со( NH3 ) 6 ] 3+ является компонентом некоторых методов структурной биологии (особенно для ДНК или РНК , где положительные ионы стабилизируют третичную структуру фосфатного остова), чтобы помочь определить их структуру с помощью рентгеновской кристаллографии. [4] или методом ядерного магнитного резонанса . [5] В биологической системе противоионами, скорее всего, будут Mg. 2+ , но тяжелые атомы кобальта (или иногда иридия , как в PDB : 2GIS ) обеспечивают аномальное рассеяние для решения фазовой проблемы и создания карты электронной плотности структуры. [6]
[Со( NH3 ) 6 ] 3+ используется для исследования ДНК . Катион индуцирует переход структуры ДНК из классической B-формы в Z-форму. [7]
Родственные соединения
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Бьеррум, Дж.; Макрейнольдс, JP (1946). «Соли гексаминкобальта(III)». Неорг. Синтез. 2 : 216–221. дои : 10.1002/9780470132333.ch69 .
- ^ Фреми, Мэн (1852 г.). «Исследование кобальта» . Энн. Сказать. Физ. 35 : 257–312.
- ^ Линдхольм, РД; Баузе, Дэниел Э. (1978). «Комплексы кобальтсодержащих аммиака или этилендиамина: соли гексаамминкобальта (III)». Неорг. Синтез. 18 : 67–69. дои : 10.1002/9780470132494.ch14 .
- ^ Рамакришнан, Б.; Сехаруду, К.; Пан, Б.; Сундаралингам, М. (2003). «Кристаллическая структура декамера А-ДНК d (CCCGATCGGG) с почти атомным разрешением: взаимодействие гексаммина кобальта с А-ДНК». Акта Кристаллогр . Д59 (Часть 1): 67–72. Бибкод : 2003AcCrD..59...67R . дои : 10.1107/s0907444902018917 . ПМИД 12499541 .
- ^ Рудиссер, С.; Тиноко, И. младший (2000). «Структура раствора гексаммина кобальта (III), образующего комплекс с тетрапетлей GAAA, и связывание ионов металла с несоответствиями GA». Дж. Мол. Биол . 295 (5): 1211–1232. дои : 10.1006/jmbi.1999.3421 . ПМИД 10653698 .
- ^ Макферсон, Александр (2002). Введение в макромолекулярную кристаллографию . Джон Уайли и сыновья. ISBN 0-471-25122-4 .
- ^ Бреннант, Р.Г.; Вестхоф, Э.; Сундаралингам, М. (1986). «Структура Z-ДНК с двумя различными конформациями основной цепи. Стабилизация декадезоксиолигонуклеотида d (CGTACGTACG) с помощью [CO(NH 3 ) 6 ] 3+ Связывание с гуанином». Журнал биомолекулярной структуры и динамики . 3 (4): 649–665. doi : 10.1080/07391102.1986.10508453 . PMID 3271042 .