Тиоцианат ртути(II)
 | |
 | |
| Имена | |
|---|---|
| Другие имена Тиоцианат ртути Сульфоцианат ртути | |
| Идентификаторы | |
3D model ( JSmol ) | |
| Информационная карта ECHA | 100.008.886 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Hg(SCN) 2 | |
| Молярная масса | 316.755 g/mol |
| Появление | Белый моноклинный порошок |
| Запах | без запаха |
| Плотность | 3,71 г/см 3 , твердый |
| Температура плавления | 165 ° C (329 ° F, 438 К) (разлагается) |
| 0,069 г/100 мл | |
| Растворимость | Растворим в разбавленной соляной кислоте , KCN , аммиаке. мало растворим в спирте , эфире |
| −96.5·10 −6 см 3 /моль | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | высокотоксичный |
| СГС Маркировка : [1] | |
   | |
| Опасность | |
| Х300 , Х310 , Х330 , Х373 , Х410 | |
| P260 , P262 , P270 , P271 , P273 , P280 , P284 , P301+P316 , P302+P352 , P304+P340 , P316 , P319 , P320 , P321 , P330 , P361 , P364 , P391 , П403+П233 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 46 мг/кг (крыса, перорально) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Тиоцианат ртути(II) (Hg(SCN) 2 ) — неорганическое химическое соединение , координационный комплекс Hg 2+ и тиоцианат- анион . Это белый порошок. При поджоге он создаст большую извилистую «змею» — эффект, известный как змея фараона . [2]
Синтез и структура
[ редактировать ]Первый синтез тиоцианата ртути, вероятно, был завершен в 1821 году Йёнсом Якобом Берцелиусом :
- HgO + 2 HSCN → Hg(SCN) 2 + H 2 O
Доказательства существования первого чистого образца были представлены в 1866 году химиком по имени Отто Гермес. [2] Его получают путем обработки растворов, содержащих ионы ртути (II) и роданида. Продукт низкой растворимости тиоцианата ртути приводит к его осаждению из раствора. [3] Большинство синтезов достигается путем осаждения:
- Hg(NO 3 ) 2 + 2 KSCN → Hg(SCN) 2 + 2KNO 3
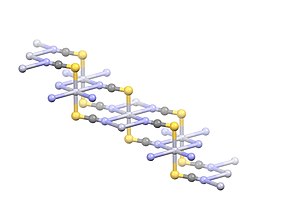
Соединение имеет полимерную структуру с Hg. 2+ центры линейно координированы с двумя атомами S на расстоянии 2,381 Å. Четыре слабых ртути 2+ --N-взаимодействия указаны с расстояниями 2,81 Å. [4]
Использование
[ редактировать ]Тиоцианат ртути находит несколько применений в химическом синтезе. Он является предшественником других роданиатных комплексов, таких как трис(тиоцианато)меркурат(II) калия (K[Hg(SCN) 3 ]) и трис(тиоцианато)меркурат(II) цезия (Cs[Hg(SCN) 3 ]). Hg(SCN) 3 − ион также может существовать независимо и легко генерируется, среди прочего, из вышеуказанных соединений. [5]
Его реакции с органическими галогенидами дают два продукта: один с серой, связанной с органическим соединением, и другой с азотом, связанным с органическим соединением. [6]
Использование в анализе хлоридов
[ редактировать ]Было обнаружено, что тиоцианат ртути может улучшить пределы обнаружения при определении ионов хлорида в воде методом УФ-видимой спектроскопии . Этот метод был впервые предложен в 1952 году и с тех пор является стандартным методом определения ионов хлорида в лабораториях по всему миру. , США) представила коммерческий анализатор цвета Автоматизированная система была изобретена в 1964 году, а затем в 1974 году компания Technicon ( Тэрритаун, штат Нью-Йорк . Основной механизм заключается в добавлении роданида ртути к раствору с неизвестной концентрацией хлорид-ионов и железа в качестве реагента . Ионы хлорида вызывают диссоциацию роданидной соли ртути, а ион роданида связывает Fe(III), который интенсивно поглощает при 450 нм. Это поглощение позволяет измерить концентрацию комплекса железа. Эта величина позволяет рассчитать концентрацию хлорида. [7]
Он может определять концентрацию ионов хлорида в водном растворе. Тиоцианат ртути без железа (III) добавляют к раствору с неизвестной концентрацией ионов хлорида, образуя комплекс роданида ртути и иона хлорида, который поглощает свет с длиной волны 254 нм, что позволяет более точно измерить внимание, чем вышеупомянутый метод с использованием железо. [7]
Змей фараона
[ редактировать ]
Тиоцианат ртути раньше использовался в пиротехнике, вызывая эффект, известный как змей фараона или змея фараона. Когда соединение находится в присутствии достаточно сильного источника тепла, начинается быстрая экзотермическая реакция , в результате которой образуется большая масса свернувшегося змееподобного твердого вещества. Горение сопровождает незаметное пламя, которое часто бывает синим, но может быть и желтым/оранжевым. Цвет полученного твердого вещества может варьироваться от темно-графитово-серого до светло-коричневого, причем внутренняя часть обычно намного темнее внешней. [2]
Реакция имеет несколько стадий: [8] При воспламенении роданида ртути образуется нерастворимая коричневая масса, состоящая в основном из нитрида углерода C 3 N 4 . Также производятся сульфид ртути и сероуглерод.
Ссылки
[ редактировать ]- ^ «Ртутитиоцианат (Соединение)» . pubchem.ncbi.nlm.nih.gov . Проверено 31 мая 2023 г.
- ^ Jump up to: а б с Дэвис, ТЛ (1940). «Пиротехнические змеи». Журнал химического образования . 17 (6): 268–270. дои : 10.1021/ed017p268 .
- ^ Секин, Т.; Исии, Т. (1970). «Исследование систем разделения жидкость-жидкость. VIII. Экстракция хлорида, бромида, йодида и тиоцианата ртути (II) некоторыми органическими растворителями» . Бюллетень Химического общества Японии . 43 (8): 2422–2429. дои : 10.1246/bcsj.43.2422 .
- ^ Бошан, Алабама; Гутье, Д. «Кристаллическая структура и молекула тиоцианата ртути», Канадский химический журнал, 1972, том 50, стр. 977–стр. 981. два : 10.1139/v72-153
- ^ Боумейкер, Джорджия; Чураков А.В.; Харрис, РК; Ховард, JAK; Апперли, округ Колумбия (1998). «Твердотельный 199 Hg MAS ЯМР исследование тиоцианатных комплексов ртути(II) и родственных соединений. Кристаллическая структура Hg(SeCN) 2 ". Неорганическая химия . 37 (8): 1734–1743. doi : 10.1021/ic9700112 .
- ^ Китамура, Т.; Кобаяши, С.; Танигучи, Х. (1990). «Фотолиз винилгалогенидов. Реакция фотогенерированных виниловых катионов с цианатными и тиоцианатными ионами». Журнал органической химии . 55 (6): 1801–1805. дои : 10.1021/jo00293a025 .
- ^ Jump up to: а б Чирелло-Эгамино, Дж.; Бриндл, ID (1995). «Определение хлорид-ионов по реакции с роданидом ртути в отсутствие железа(III) УФ-фотометрическим методом проточной инжекции». Аналитик . 120 (1): 183–186. дои : 10.1039/AN9952000183 .
- ^ «Сделай фейерверк в виде фараоновой змеи» . О сайте Образование . Архивировано из оригинала 1 февраля 2012 г. Проверено 8 февраля 2016 г.
Внешние ссылки
[ редактировать ]- «Фараонова змея» . Ютуб . 2 сентября 2008 г.
- «Как сделать фараонову змею (тиоцианат ртути (II)» . Ютуб . 24 марта 2014 г.
