гремучая ртуть(II)
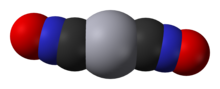 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК гремучая ртуть(II) | |
| Систематическое название ИЮПАК Диоксицианортуть | |
| Другие имена Громовой Меркурий | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.010.053 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 2 N 2 O 2 Ртуть | |
| Молярная масса | 284.624 g/mol |
| Появление | Серое, бледно-коричневое или белое кристаллическое твердое вещество. |
| Плотность | 4,42 г/см 3 |
| Температура плавления | 160 ° С (320 ° F; 433 К) |
| Точка кипения | 356,6 ° С (673,9 ° F; 629,8 К) |
| слабо растворим | |
| Растворимость | растворим в этаноле , аммиаке |
| Взрывоопасные данные | |
| Чувствительность к ударам | Высокий |
| Чувствительность к трению | Высокий |
| Скорость детонации | 4250 м/с |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Высокотоксичное, чувствительное к удару взрывчатое вещество |
| NFPA 704 (огненный алмаз) | |
| 170 ° С (338 ° F; 443 К) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гремучая ртуть(II) , или Hg(CNO) 2 , является первичным взрывчатым веществом . Он очень чувствителен к трению , теплу и ударам и в основном используется в качестве спускового крючка для других взрывчатых веществ в капсюлях и детонаторах . Цианат ртути (II), хотя его химическая формула идентична, имеет другое расположение атомов; цианатный и гремучий анионы являются изомерами .
Гремучая ртуть, впервые использованная в качестве капсюля в небольших медных капсюлях начиная с 1820-х годов, быстро заменила кремни в качестве средства для воспламенения зарядов черного пороха в дульнозарядном огнестрельном оружии . Позже, в конце 19 века и на протяжении большей части 20 века, гремучая ртуть стала широко использоваться в капсюлях для автономных винтовочных и пистолетных боеприпасов ; это был единственный практический детонатор для стрельбы снарядами до начала 20 века. [1] Гремучая ртуть имеет явное преимущество перед хлоратом калия , поскольку не вызывает коррозии, но известно, что со временем она ослабевает из-за разложения на составные элементы. Восстановленная ртуть образует амальгаму с латунью патрона, что также ослабляет ее. Сегодня гремучая ртуть заменена в капсюлях более эффективными химическими веществами. Они не вызывают коррозии, менее токсичны и более стабильны с течением времени; к ним относятся азид свинца , стифнат свинца и производные тетразена . Кроме того, ни одно из этих соединений не требует для производства ртути , поставки которой в военное время могут быть ненадежными.
Подготовка
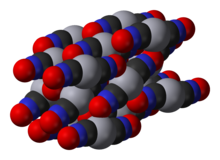
[ редактировать ]Гремучую ртуть(II) получают растворением ртути в азотной кислоте и добавлением этанола к раствору . Впервые он был подготовлен Эдвардом Чарльзом Говардом в 1800 году. [2] [1] Кристаллическая структура этого соединения была определена только в 2007 году. [3]
гремучее серебро Аналогичным способом можно получить , но эта соль еще более нестабильна, чем гремучая ртуть; он может взорваться даже под водой, и его невозможно накопить в больших количествах, поскольку он детонирует под собственным весом. [4]
Разложение
[ редактировать ]Термическое разложение гремучей ртути (II) может начаться уже при температуре 100 ° C, хотя с повышением температуры оно протекает с гораздо большей скоростью. [5]
Возможная реакция разложения гремучей ртути (II) дает углекислый газ, газообразный азот и комбинацию относительно стабильных солей ртути.
- 4 Hg(CNO) 2 → 2 CO 2 + N 2 + HgO + 3 Hg(OCN)CN
- Hg(CNO) 2 → 2 CO + N 2 + Hg
- Hg(CNO) 2 → :Hg(OCN) 2 ( цианат или/и изоцианат )
- 2 Hg(CNO) 2 → 2 CO 2 + N 2 + Hg + Hg(CN) 2 ( цианид ртути(II) )
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Вишняк, Хайме (2012). «Эдвард Чарльз Ховард. Взрывчатка, метеориты и сахар» . Химическое образование . 23 (2). Национальный автономный университет Мексики: 230–239. дои : 10.1016/s0187-893x(17)30114-3 . ISSN 0187-893X .
- ^ Эдвард Ховард (1800). «На новом сверкающем Меркурии». Философские труды Лондонского королевского общества . 90 (1): 204–238. дои : 10.1098/rstl.1800.0012 . S2CID 138658702 .
- ^ В. Бек; Дж. Эверс; М. Гебель; Г. Олингер; ТМ Клапотке (2007). «Кристаллическая и молекулярная структура гремучей ртути» . Журнал неорганической и общей химии . 633 (9): 1417–1422. дои : 10.1002/zaac.200700176 .
- ^ «Науки – гремящие вещества» . Научный американец . 11 июня 1853 г.
- ^ МЫ Гарнер и Х.Р. Хейлз (1933). «Термическое разложение и детонация гремучей ртути» . Труды Лондонского королевского общества . 139 (1–3): 1–40. Бибкод : 1933CP....334..128S . дои : 10.1098/rspa.1933.0040 .

