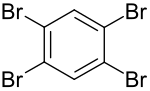
1,2,4,5-Тетрабромбензол
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
1,2,4,5-Тетрабромбензол | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Информационная карта ECHA | 100.010.231 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 6 Ч 2 Бр 4 | |
| Молярная масса | 393.70 g/mol |
| Появление | белое твердое вещество |
| Плотность | 2,518 г/см 3 |
| Температура плавления | 180–182 ° C (356–360 ° F; 453–455 К) |
| Опасности | |
| СГС Маркировка : | |

| |
| Предупреждение | |
| Х315 , Х319 , Х335 , Х413 | |
| P261 , P264 , P271 , P273 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332+P313 , P337+P313 , P362 , P403+P233 , П405 , П501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
1,2,4,5-Тетрабромбензол представляет собой арилбромид и четырехзамещенный бромбензол формулы C 6 H 2 Br 4 . Это один из трех изомеров тетрабромбензола. Соединение представляет собой белое твердое вещество. Тетрабромбензол является важным метаболитом огнестойкого 1,2,4,5 - гексабромбензола . [ 1 ]
Подготовка
[ редактировать ]Уже в 1865 г. сообщалось о синтезе 1,2,4,5-тетрабромбензола из бензола и избытка брома в запаянной трубке при 150 °С. [ 2 ] Однако явно пониженная температура плавления (около 160 °C) указывает на наличие примесей в конечном продукте. В своей диссертации 1885 года Адольф Шойфелен опубликовал синтез более чистого образца с использованием хлорида железа (III) FeCl 3 в качестве катализатора , выделенного в виде «красивых иголок» («schönen Nadeln»). [ 3 ]
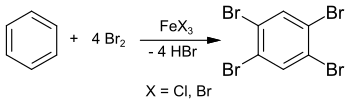
Синтез также можно проводить в растворе в хлороформе или тетрахлорметане и дает 1,2,4,5-тетрабромбензол с выходом 89%. [ 4 ] Эту реакцию можно провести и в лабораторном эксперименте с избытком брома и железными гвоздями (в качестве исходного материала для бромида железа (III) FeBr 3 ). [ 5 ] Промежуточной стадией является 1,4-дибромбензол , который далее реагирует с избытком брома с образованием 1,2,4,5-тетрабромбензола.
Реакции
[ редактировать ]Строительный блок для жидких кристаллов и флуоресцентных красителей.
[ редактировать ]Благодаря своей симметричной структуре и реакционной способности 1,2,4,5-тетрабромбензол является предшественником нематических жидких кристаллов. [ 6 ] со скрещенными мезогенами и для столбчатых (дискотических) жидких кристаллов [ 7 ] [ 8 ] с обширным плоским «достовидным» тетрабензоантраценовым ядром.

В однореакторной реакции 1,2,4,5-тетрабромбензол реагирует с 4-гидроксибензальдегидом , алкилирующим агентом 1-бромпентаном, реагентом Виттига метилтрифенилфосфоний иодидом, основным карбонатом калия , катализатором фазового переноса бромидом тетрабутиламмония , реактивом Хека. ацетат палладия (II) Хека и сокатализатор 1,3-бис(дифенилфосфино)пропан (dppp) в диметилацетамиде с получением непосредственно симметричного тетраалкоксилстильбена в виде E-изомера с выходом 17%. [ 9 ]
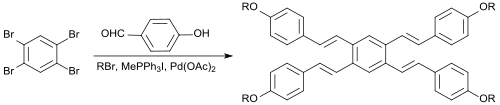
Благодаря выраженному π-сопряжению такие соединения потенциально могут применяться в качестве оптических отбеливателей , материалов OLED или жидких кристаллов.
N -алкилтетрааминобензолы с высокими выходами получают из 1,2,4,5-тетрабромбензола, который можно циклизировать с триэтилортоформиатом и кислотами до солей бензобис(имидазолия) (соли BBI) и окислять кислородом с образованием 1,4- бензохинондиимины. [ 10 ]
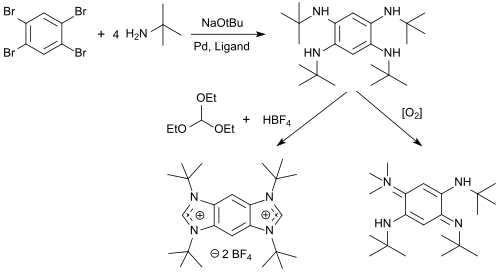
Соли BBI представляют собой универсальные флуоресцентные красители с длиной волны излучения λ em от 329 до 561 нм, выраженным сольватохромизмом и сильным зависящим от растворителя сдвигом Стокса , которые можно использовать в качестве белковой метки для флуоресцентного мечения белков. [ 11 ]
Исходный материал для аринов
[ редактировать ]Из 1,2,4,5-тетрабромбензола можно получить in-situ 1,4-моноарин с одним эквивалентом н- бутиллития путем отрыва брома, который немедленно реагирует с фураном с образованием 6,7-дибром-1,4. -эпокси-1,4-дигидронафталин (6,7-дибромнафталин-1,4-эндоксид) с выходом 70%. [ 12 ]

При использовании 2,5-диалкилфуранов (например, 2,5-(ди-н-октил)фурана) образуется дибромированный моноэндоксид с выходом 64%, из которого образуется дибром-5,8-ди-н-октилнафталин с цинковый порошок/ тетрахлорид титана с выходом 88%. [ 13 ]

При обработке тетрахлоридом титана и цинковой пылью эндооксид дезоксигенируется с образованием 2,3-дибромнафталина. [ 14 ]
Эноксид реагирует с 3-сульфоленом по реакции Дильса-Альдера после удаления диоксида серы . Полученный трициклический аддукт с хорошим выходом превращается в 2,3-дибромантрацен. [ 15 ]
Если оксиду диброма позволить продолжить реакцию с фураном в присутствии н -бутиллития [ 12 ] или амид калия [ 16 ] или через промежуточный 1,4-арин трициклический 1,4-аддукт 1,4:5,8-диэпокси-1,4,5,8-тетрагидроантрацен. [ 17 ] образуется с выходом 71% в виде син-антисмеси . Однако с амидом натрия в диметиловом эфире этиленгликоля (ДМЭ) дибромоксид ведет себя как эквивалент 1,3-арина и образует с фураном фенантреноподобный трициклический 1,3-аддукт, который может реагировать с фураном и амидом натрия с образованием производное трифенилена (1,3,5-трис-арен). [ 16 ]
[2+4]-циклоприсоединения с 1,2,4,5-тетрабромбензолом иногда протекают с очень высокими выходами, например, реакция дигалогензамещенного 1,3-дифенилизобензофурана с тетрагалогенированным производным антрацена (98%), которая далее последовательно преобразуется с помощью 1,3-дифенилизобензофурана с выходом 65% в производное пентацена и с фураном в гексацена. производное (67%). [ 18 ]

Сшивка , модифицированных бензимидазолом, полимеров позволяет получить материалы с высокой поглощающей способностью по диоксиду углерода , которые могут быть пригодны для отделения CO 2 от газовых смесей. [ 19 ]

Это исходный материал для моно- и бис-ариинов. [ 12 ]
Безопасность
[ редактировать ]1,2,4,5-Тетрабромбензол представляет собой токсичный для печени продукт разложения антипирена гексабромбензола и уже в 1987 году был обнаружен в Японии в образцах материнского молока. [ 20 ]
Ссылки
[ редактировать ]- ^ Э. Бручайзер; Б. Фридрих; JA Szymanska (2004), "Влияние повторного введения гексабромбензола и 1,2,4,5-тетрабромбензола на уровни выбранных цитохромов в печени крыс", Int. Дж. Оккуп. Мед. Окружающая среда. Здоровье , вып. 17, нет. 3, стр. 347–353, doi : 10.1016/S0040-4020(01)87581-5 , PMID 15683155
- ^ А. Риш, П. Берар (1865), «О бромсодержащих производных бензола и его гомологов» , Liebigs Ann. Chem (на немецком языке), том. 133, № 1, стр. 51–54, номер документа : 10.1002/jlac.18651330106.
- ^ А. Шойфелен (1885), «О соединениях железа как передатчиках брома» , Liebigs Ann. Chem (на немецком языке), том. 231, № 2, стр. 152–195, номер документа : 10.1002/jlac.18852310204.
- ^ США 0
- ^ Б. Кокс; Д.Г. Кублер; CA Wilson (1977), "Эксперименты с реакциями электрофильного ароматического замещения", J. Chem. Образование. , том. 54, нет. 6, с. 379, номер документа : 10.1021/ed054p379
- ^ Х.-Х. Чен; и др. (2012), «Энантиотропные нематики из крестообразных 1,2,4,5-тетракис(4'-алкил-4-этинилбифенил)бензолов и исследования их двуосности», Chem. Евро. Дж. , вып. 18, нет. 31, стр. 9543–9551, номер документа : 10.1002/chem.201103453 , PMID 22745006.
- ^ С. Кумар (2011), Химия дискотических жидких кристаллов: от мономеров к полимерам , Бока-Ратон, Флорида, США: CRC Press, с. 200, ISBN 978-1-4398-1145-0
- ^ МК Артал; К. Дж. Тойн; Дж. У. До свидания; Дж. Барбера; DJ Photinos (2011), «Синтез и мезогенные свойства новых жидких кристаллов в форме досок», J. Mater. хим. , том. 11, нет. 11, стр. 2801–2807, doi : 10.1039/B105351P.
- ^ К. Н. Патель; Б.В. Камат; А. В. Бедекар (2013), «Синтез алкилоксистильбенов с помощью однореакторной последовательности реакций O-алкилирования-Виттига и O-алкилирования-Виттига-Хека», Tetrahedron Lett. , том. 54, нет. 1, стр. 80–84, номер документа : 10.1016/j.tetlet.2012.10.102.
- ^ Д.М. Храмов; Эй Джей Бойдстон; CW Bielawski (2006), «Высокоэффективный синтез и определение характеристик в твердом состоянии 1,2,4,5-тетракис(алкил- и ариламино)бензолов и циклизация до их соответствующих солей бензобис(имидазолия), Org. Летт. , том. 8, нет. 9, стр. 1831–1834, doi : 10.1021/ol060349c , PMID 16623562
- ^ А. Дж. Бойдстон (2008), «Модульные флуоресцентные соли бензобис (имидазолия): синтезы, фотофизический анализ и применение», J. Am. хим. Соц. , том. 130, нет. 10, стр. 3143–3156, номер документа : 10.1021/ja7102247 , PMID 18271588.
- ^ Jump up to: а б с К. Шахлай; ТАК Акваа; Х. Харт (1998). «ИСПОЛЬЗОВАНИЕ 1,2,4,5-тетрабромбензола в качестве 1,4-бензадиинового эквивалента: анти- и син-1,4,5,8-тетрагидроантрацен 1,4:5,8-диэпоксид». Органические синтезы . 75 : 201. дои : 10.15227/orgsyn.075.0201 .
- ^ З. Чен; П. Мюллер; TM Swager (2006), «Синтез растворимых производных тетрацена с π-складкой», Org. Летт. , том. 8, нет. 2, стр. 273–276, номер документа : 10.1021/ol0526468 , PMID 16408893.
- ^ Х. Харт; К.-Ю. Лай; ГК Нвокогу; С. Шамуилян (1987), «Тетрагалогенбензолы как диариновые эквиваленты в синтезе полициклических аренов», Tetrahedron , vol. 43, нет. 22, стр. 5203–5224, номер документа : 10.1016/S0040-4020(01)87696-1.
- ^ К.-Т. Лин; Т.-Ц. Чжоу (1988), «Синтез 2,3-дибромантрацена», Synthesis , vol. 1988, нет. 8, стр. 628–630, doi : 10.1055/s-1988-27659 , S2CID 93109532.
- ^ Jump up to: а б Ф. Раймо; Ф. Х. Конке; Ф. Кардулло (1992), «Региоселективное получение аринов из полигалогенбензолов. Улучшенный синтез син- и анти -1,4,5,8,9,12-гексагидро-1,4:5,8:9,12». -триэпокситрифенилен», Tetrahedron (на немецком языке), т. 48, нет. 33, стр. 6827–6838, номер документа : 10.1016/S0040-4020(01)89874-4.
- ^ Х. Харт; Н. Раджу; М. А. Мидор; DL Ward (1983), «Синтез гептиптиценов с обращенными друг к другу ареновыми кольцами через 2,3:6,7-антрадииновый эквивалент», J. Org. хим. , том. 48, нет. 23, стр. 4357–4360, doi : 10.1021/jo00171a039.
- ^ С. Эда, Т. Хамура (2015), «Селективный галоген-литиевый обмен 1,2-дигалоаренов для последовательных [2+4] циклоприсоединения аринов и изобензофуранов», Molecules , vol. 20, нет. 10, стр. 19449–19462, doi : 10.3390/molecules201019449 , PMC 6331892 , PMID 26512641
- ^ С. Алтарауна; С. Бехера; П. Йена; HM Эль-Кадери (2014), «Новый взгляд на взаимодействие диоксида углерода с полимерами, связанными с бензимидазолом», Chem. Коммун. , том. 50, нет. 27, стр. 3571–3574, doi : 10.1039/C3CC45901B , PMID 24567950
- ^ Т. Миядзаки; Т. Ямагиши; М. Мацумото (1987), «Определение и остаточные уровни 1,2,4,5-тетрабромбензола и мирекса в образцах женского молока», Food Hygiene and Safety Science , vol. 28, нет. 2, стр. 125–129, дои : 10.3358/shokueishi.28.125