Аналог переходного состояния
Аналоги переходного состояния ( аналоги переходного состояния ) — это химические соединения которых , химическая структура напоминает переходное состояние молекулы субстрата в , катализируемой ферментами химической реакции . Ферменты взаимодействуют с субстратом посредством напряжений или искажений, переводя субстрат в переходное состояние. [ 1 ] Аналоги переходного состояния можно использовать в качестве ингибиторов ферментативно-катализируемых реакций путем блокирования активного центра фермента. Теория предполагает, что ингибиторы фермента , напоминающие структуру переходного состояния, будут связываться с ферментом более прочно, чем реальный субстрат. [ 2 ] Примеры лекарств , которые являются аналогами-ингибиторами переходного состояния, включают лекарства от гриппа, такие как ингибитор нейраминидазы осельтамивир и ингибиторы протеазы ВИЧ саквинавир при лечении СПИДа.
Аналог переходного состояния
[ редактировать ]
Переходное состояние структуры лучше всего можно описать с точки зрения статистической механики , где энергии разрыва и образования связей имеют равную вероятность перемещения из переходного состояния назад к реагентам или вперед к продуктам. В реакциях, катализируемых ферментами, общая энергия активации реакции снижается, когда фермент стабилизирует высокоэнергетическое промежуточное состояние переходного состояния. Аналоги переходного состояния имитируют этот высокоэнергетический промежуточный продукт, но не вступают в катализируемую химическую реакцию и поэтому могут гораздо сильнее связываться с ферментом, чем простые аналоги субстрата или продукта.
Проектирование аналога переходного состояния
[ редактировать ]Для разработки аналога переходного состояния ключевым этапом является определение структуры переходного состояния субстрата для конкретного интересующего фермента с помощью экспериментального метода, например, кинетического изотопного эффекта . Кроме того, структуру переходного состояния также можно предсказать с помощью вычислительных подходов, дополняющих KIE. Мы кратко объясним эти два метода.
Кинетический изотопный эффект
[ редактировать ]Кинетический изотопный эффект (КИЭ) — это измерение скорости реакции реагентов, меченных изотопами, с более распространенным природным субстратом. Величины кинетического изотопного эффекта представляют собой отношение числа оборотов и включают все стадии реакции. [ 3 ] Собственные кинетические значения изотопов возникают из-за различия в колебательном окружении атома в реагентах в основном состоянии и в окружении переходного состояния атома. [ 3 ] Благодаря кинетическому изотопному эффекту можно получить большое представление о том, как выглядит переходное состояние реакции, катализируемой ферментами, и направить разработку аналогов переходного состояния.
Компьютерное моделирование
[ редактировать ]Вычислительные подходы рассматривались как полезный инструмент для выяснения механизма действия ферментов. [ 4 ] Молекулярная механика сама по себе не может предсказать перенос электронов , который является основой органических реакций , но моделирование молекулярной динамики предоставляет достаточную информацию, учитывая гибкость белка во время каталитической реакции. Дополнительным методом будет объединение методов молекулярной механики и квантовой механики ( QM/MM ). [ 5 ] При таком подходе только атомы, ответственные за ферментативную реакцию в каталитической области, будут обработаны квантовой механикой , а остальные атомы обработаны молекулярной механикой . [ 6 ]
Примеры аналоговой конструкции переходного состояния
[ редактировать ]После определения структур переходного состояния с использованием KIE или компьютерного моделирования ингибитор может быть разработан в соответствии с определенными структурами переходного состояния или промежуточными продуктами. Следующие три примера иллюстрируют, как ингибиторы имитируют структуру переходного состояния путем изменения функциональных групп, соответствующих геометрии и электростатическому распределению структур переходного состояния.
Ингибитор метилтиоаденозиннуклеозидазы
[ редактировать ]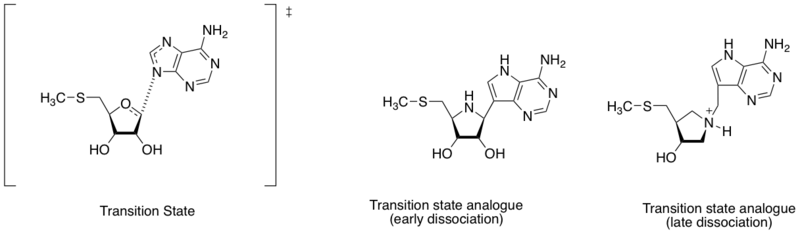
Метилтиоаденозиннуклеозидазы представляют собой ферменты, катализирующие реакцию гидролитического деаденилирования 5'-метилтиоаденозина и S-аденозилгомоцистеина. Он также считается важной мишенью для открытия антибактериальных препаратов, поскольку он важен для метаболической системы бактерий и вырабатывается только бактериями. [ 7 ] Учитывая различное расстояние между атомом азота аденина и аномерным углеродом рибозы (см. схему в этом разделе), структура переходного состояния может определяться ранней или поздней стадией диссоциации. Основываясь на открытии различных структур переходного состояния, Шрамм и его коллеги разработали два аналога переходного состояния, имитирующие раннее и позднее диссоциативное переходное состояние. Аналог раннего и позднего переходного состояния показал аффинность связывания (Kd) 360 и 140 пМ соответственно. [ 8 ]
Ингибитор термолизина
[ редактировать ]
Термолизин — фермент, продуцируемый Bacillus thermoproteolyticus , который катализирует гидролиз пептидов, содержащих гидрофобные аминокислоты. [ 9 ] Следовательно, он также является мишенью для антибактериальных средств. Механизм ферментативной реакции начинается с небольшой молекулы пептида и заменяет цинк-связывающую молекулу воды на Glu143 термолизина. Молекула воды затем активируется как ионом цинка, так и остатком Glu143 и атакует карбонильный углерод, образуя тетраэдрическое переходное состояние (см. Рисунок). Затем Холден и его коллеги имитировали это тетраэдрическое переходное состояние, чтобы разработать серию аналогов фосфонамидатных пептидов. Среди синтезированных аналогов R = L наиболее мощной ингибирующей активностью обладает -Leu ( K i = 9,1 нМ). [ 10 ]
Ингибитор аргиназы
[ редактировать ]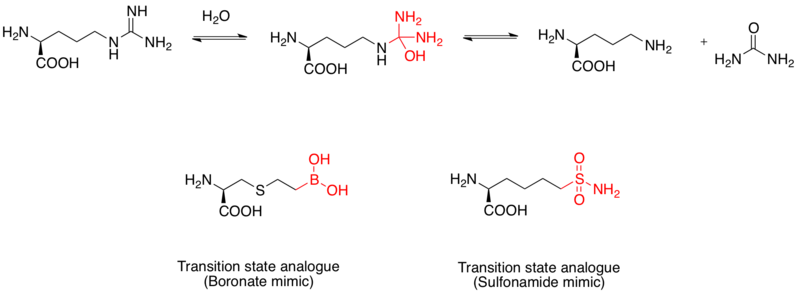
Аргиназа представляет собой биядерный марганцевый металлопротеин , который катализирует гидролиз L- аргинина до L- орнитина и мочевины . Он также рассматривается как лекарственное средство для лечения астмы . [ 11 ] Механизм гидролиза L-аргинина осуществляется посредством нуклеофильной атаки воды на гуанидиногруппу с образованием тетраэдрического интермедиата. Исследования показали, что фрагмент бороновой кислоты принимает тетраэдрическую конфигурацию и служит ингибитором. Кроме того, функциональная группа сульфонамида также может имитировать структуру переходного состояния. [ 12 ] Доказательства того, что имитаторы бороновой кислоты являются аналогами переходного состояния человеческой аргиназы I, были подтверждены с помощью рентгеновских кристаллических структур. [ 13 ]
См. также
[ редактировать ]- Фермент
- Структурный аналог , соединения со схожей химической структурой.
- Ингибитор ферментов
- Аналог подложки
- Ингибитор самоубийства
- Субстрат
Ссылки
[ редактировать ]- ^ Сильверман РБ (2004). Органическая химия дизайна и действия лекарств . Сан-Диего, Калифорния: Elsevier Academic Press. ISBN 0-12-643732-7 .
- ^ Дэвис Дж. П., Кейн Г. А., Питтс В. Дж., Маголда Р. Л., Коупленд Р. А. (январь 1996 г.). «Иммуносупрессивный метаболит лефлуномида является мощным ингибитором дигидрооротатдегидрогеназы человека». Биохимия . 35 (4): 1270–1273. дои : 10.1021/bi952168g . ПМИД 8573583 .
- ^ Перейти обратно: а б Шрамм В.Л. (2011). «Ферментативные переходные состояния, аналоги переходных состояний, динамика, термодинамика и время жизни» . Ежегодный обзор биохимии . 80 (1): 703–732. doi : 10.1146/annurev-biochem-061809-100742 . ПМК 5502542 . ПМИД 21675920 .
- ^ Коллман П., Кун Б., Перякюля М. (2002). «Вычислительные исследования реакций, катализируемых ферментами: где мы находимся в прогнозировании механизмов и понимании природы ферментативного катализа?». Дж. Физ. хим. Б. 106 (7): 1537–1542. дои : 10.1021/jp012017p .
- ^ Хоу Джи, Цуй Ц (январь 2012 г.). «Анализ QM/MM показывает, что щелочная фосфатаза (AP) и нуклеотид-пирофосфатаза/фосфодиэстераза слегка сужают переходное состояние гидролиза диэфира фосфата по сравнению с раствором: последствия каталитической распущенности в суперсемействе AP» . Журнал Американского химического общества . 134 (1): 229–246. дои : 10.1021/ja205226d . ПМК 3257412 . ПМИД 22097879 .
- ^ Саен-Ун С., Квайтман-Махледер С., Шрамм В.Л., Шварц С.Д. (октябрь 2008 г.). «Атомные детали химического превращения в переходном состоянии ферментативной реакции» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (43): 16543–16548. Бибкод : 2008PNAS..10516543S . дои : 10.1073/pnas.0808413105 . ПМЦ 2575456 . ПМИД 18946041 .
- ^ Сингх В., Ли Дж.Э., Нуньес С., Хауэлл П.Л., Шрамм В.Л. (сентябрь 2005 г.). «Структура переходного состояния 5'-метилтиоаденозин/S-аденозилгомоцистеин нуклеозидазы из Escherichia coli и ее сходство с аналогами переходного состояния». Биохимия . 44 (35): 11647–11659. дои : 10.1021/bi050863a . ПМИД 16128565 .
- ^ Гутьеррес Дж.А., Луо М., Сингх В., Ли Л., Браун Р.Л., Норрис Дж.Е. и др. (ноябрь 2007 г.). «Пикомолярные ингибиторы как зонды переходного состояния 5'-метилтиоаденозиннуклеозидазы». АКС Химическая биология . 2 (11): 725–734. дои : 10.1021/cb700166z . ПМИД 18030989 .
- ^ Эндо С (1962). «Исследование протеаз, продуцируемых термофильными бактериями». Дж. Фермент. Технол . 40 : 346–353.
- ^ Холден Х.М., Тронруд Д.Э., Монзинго А.Ф., Уивер Л.Х., Мэтьюз Б.В. (декабрь 1987 г.). «Ингибиторы термолизина с медленным и быстрым связыванием демонстрируют разные способы связывания: кристаллографический анализ расширенных аналогов переходного состояния фосфонамидатов». Биохимия . 26 (26): 8542–8553. дои : 10.1021/bi00400a008 . ПМИД 3442675 .
- ^ Маарсингх Х., Заагсма Дж., Мерс Х. (октябрь 2009 г.). «Аргиназа: ключевой фермент в патофизиологии аллергической астмы, открывающий новые терапевтические перспективы» . Британский журнал фармакологии . 158 (3): 652–664. дои : 10.1111/j.1476-5381.2009.00374.x . ПМЦ 2765587 . ПМИД 19703164 .
- ^ Кама Э., Шин Х., Кристиансон Д.В. (октябрь 2003 г.). «Разработка сульфонамидов аминокислот как аналоговых ингибиторов аргиназы в переходном состоянии». Журнал Американского химического общества . 125 (43): 13052–13057. дои : 10.1021/ja036365b . ПМИД 14570477 .
- ^ Шишова Е.Ю., Ди Костанцо Л., Эмиг Ф.А., Эш Д.Е., Кристиансон Д.В. (январь 2009 г.). «Изучение детерминант специфичности распознавания аминокислот аргиназой» . Биохимия . 48 (1): 121–131. дои : 10.1021/bi801911v . ПМК 2665027 . ПМИД 19093830 .