Реакция присоединения Майкла
| Майкл Аддишн | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Тип реакции | Реакция присоединения | ||||||||||
| Реакция | |||||||||||
| |||||||||||
| Идентификаторы | |||||||||||
| Портал органической химии | Майкл-дополнение | ||||||||||
| RSC Идентификатор онтологии | RXNO: 0000009 | ||||||||||
В органической химии реакция Михаэля или присоединение Михаэля 1,4 представляет собой реакцию между донором Михаэля ( енолятом или другим нуклеофилом ) и акцептором Михаэля (обычно α,β-ненасыщенный карбонил ) с образованием аддукта Михаэля путем создания углеродного атома. акцептора -углеродная связь у β-углерода . [1] [2] Он принадлежит к более широкому классу сопряженных присоединений и широко используется для мягкого образования углерод-углеродных связей. [3]
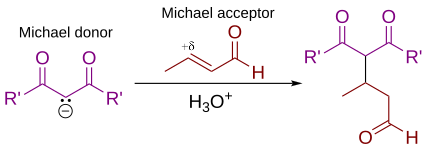
Присоединение Михаэля является важным атомосберегающим методом диастереоселективного и энантиоселективного образования связей C–C, и множество асимметричных вариантов. существует [4] [5] [6]
В этой общей схеме присоединения Михаэля один или оба из R и R' на нуклеофиле (доноре Михаэля) представляют собой электроноакцепторные заместители, такие как ацильные , циано , нитро или сульфоновые группы, которые делают соседний метиленовый водород достаточно кислым для образования карбанион : при реакции с основанием , B . Для алкена (акцептора Михаэля) заместителем R" обычно является карбонил , что делает соединение α,β-ненасыщенным карбонильным соединением (еноном ) или еналем , или R" может быть любой электроноакцепторной группой.
Определение
[ редактировать ]Как первоначально определил Артур Майкл , [7] [8] реакция представляет собой присоединение енолята кетона или альдегида к α,β-ненасыщенному карбонильному соединению по β-углероду. Текущее определение реакции Михаэля расширилось и теперь включает нуклеофилы, отличные от енолятов . [9] Некоторые примеры нуклеофилов включают углеродные нуклеофилы с двойной стабилизацией, такие как бета-кетоэфиры, малонаты и бета-цианоэфиры. Полученный продукт содержит очень полезный 1,5-диоксигенированный образец. Неуглеродные нуклеофилы, такие как вода, спирты , амины и енамины , также могут реагировать с α,β-ненасыщенным карбонилом в виде 1,4-присоединения. [10]
Некоторые авторы расширили определение присоединения Михаэля, чтобы по существу относиться к любой реакции 1,4-присоединения α,β-ненасыщенных карбонильных соединений. Другие, однако, настаивают на том, что такое использование является злоупотреблением терминологией, и ограничивают присоединение Михаэля образованием углерод-углеродных связей за счет добавления углеродных нуклеофилов. Термины окса-реакция Михаэля и реакция аза-Майкла. [2] использовались для обозначения 1,4-присоединения кислородных и азотных нуклеофилов соответственно. Реакция Михаэля также связана с реакциями 1,6-присоединения. [11]
Механизм
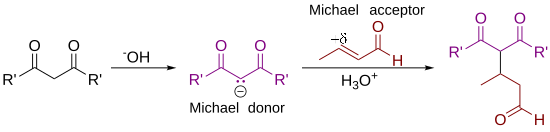
[ редактировать ]В механизме реакции является 1 : нуклеофилом [3]
Депротонирование 1 2 основанием приводит к карбаниону , стабилизированному электроноакцепторными группами. Структуры 2a–2c представляют собой три резонансные структуры , которые можно нарисовать для этого вида, две из которых содержат енолят -ионы. Этот нуклеофил реагирует с электрофильным алкеном 3 с образованием 4 в реакции сопряженного присоединения . Наконец, енолят 4 отрывает протон от протонированного основания (или растворителя) с образованием 5 .
В реакции преобладают орбитальные, а не электростатические соображения. ВЗМО имеет большой коэффициент при центральном атоме углерода , стабилизированных енолятов тогда как НСМО многих альфа-, бета-ненасыщенных карбонильных соединений имеет большой коэффициент при бета-углероде. Таким образом, оба реагента можно считать мягкими . Эти поляризованные граничные орбитали имеют одинаковую энергию и эффективно реагируют с образованием новой связи углерод-углерод. [12]
Как и альдольное присоединение , реакция Михаэля может протекать через енол , силиленоловый эфир при присоединении Мукаямы-Майкла или, что чаще, через енолят-нуклеофил. В последнем случае стабилизированное карбонильное соединение депротонируется сильным основанием (жесткая енолизация) или кислотой Льюиса и слабым основанием (мягкая енолизация). Образующийся енолят атакует активированный олефин с 1,4- региоселективностью , образуя углерод-углеродную связь. При этом енолят также передается электрофилу . Поскольку электрофил гораздо менее кислый, чем нуклеофил, быстрый перенос протона обычно передает енолят обратно нуклеофилу, если продукт поддается енолизу; однако можно воспользоваться преимуществами нового локуса нуклеофильности, если имеется подходящий электрофил. В зависимости от относительной кислотности нуклеофила и продукта реакция может быть каталитической по основанию. В большинстве случаев реакция необратима при низкой температуре.
История
[ редактировать ]Исследование, проведенное Артуром Майклом в 1887 году в Университете Тафтса, было вызвано публикацией Conrad & Kuthzeit в 1884 году о реакции этил-2,3-дибромпропионата с диэтил-натрийомалонатом с образованием циклопропана. производного [13] (теперь признано, что это включает две последовательные реакции замещения).
Майкл смог получить тот же продукт, заменив пропионат этиловым эфиром 2-бромакриловой кислоты , и понял, что эта реакция может работать, только если предположить реакцию присоединения к двойной связи акриловой кислоты . Затем он подтвердил это предположение, проведя реакцию диэтилмалоната и этилового эфира коричной кислоты, образовав первый аддукт Михаэля: [14]
В том же году Райнер Людвиг Клайзен заявил о приоритете изобретения. [15] Он и Т. Комненос наблюдали продукты присоединения к двойным связям в качестве побочных продуктов ранее в 1883 году, исследуя реакции конденсации малоновой кислоты с альдегидами . [16] Однако, по мнению биографа Такаси Токороямы, это утверждение необоснованно. [14]
Асимметричная реакция Михаэля
[ редактировать ]Исследователи расширили сферу применения добавок Майкла, включив в него элементы хиральности посредством асимметричных версий реакции. Наиболее распространенные методы включают хиральный катализ фазового переноса , такой как четвертичные аммониевые соли, полученные из хинного дерева алкалоидов ; или органокатализ , который активируется енамином или иминием с помощью хиральных вторичных аминов, обычно полученных из пролина . [17]
В реакции между циклогексаноном и β-нитростиролом, изображенной ниже, основной пролин превращается в производное и работает в сочетании с протонной кислотой, такой как п -толуолсульфоновая кислота : [18]
Син-присоединение предпочтительно при 99% ее . В переходном состоянии, которое, как полагают, отвечает за эту селективность, енамин ( образующийся между азотом пролина и циклокетоном) и β-нитростирол находятся на одной стороне с нитрогруппой, связанной водородом с протонированным амином в боковой группе пролина.
Хорошо известная реакция Михаэля — это синтез варфарина из 4-гидроксикумарина и бензилиденацетона, о котором впервые сообщил Линк в 1944 году: [19]
Существует несколько асимметричных версий этой реакции с использованием хиральных катализаторов. [20] [21] [22] [23] [24] [25]
Примеры
[ редактировать ]Классическими примерами реакции Михаэля являются реакции между диэтилмалонатом (донор Михаэля) и диэтилфумаратом (акцептор Михаэля). [26] диэтилмалонат и мезитилоксид (образующие димедон ), [27] диэтилмалоната и метилкротоната , [28] что из 2-нитропропана и метилакрилата , [29] что из этилфенилцианоацетата и акрилонитрила [30] и нитропропана и метилвинилкетона . [31]
Классической тандемной последовательностью присоединения Михаэля и альдолов является кольцеобразование Робинсона .
Дополнение Мукаямы-Майкла
[ редактировать ]В реакции Мукаямы-Майкла нуклеофилом является эфир силилинола , а катализатором обычно является тетрахлорид титана : [32] [33]

Реакция 1,6-Майкла
[ редактировать ]Реакция 1,6-Майкла протекает посредством нуклеофильной атаки 𝛿 углерода α,β- , 𝛿 -диненасыщенный акцептор Михаэля. [34] [35] Механизм присоединения 1,6 аналогичен механизму присоединения 1,4, за одним исключением — нуклеофильная атака, происходящая по углероду 𝛿 акцептора Михаэля. [35] Однако исследования показывают, что органокатализ часто благоприятствует 1,4-присоединению. [34] Во многих синтезах, где было предпочтительно 1,6-присоединение, субстрат имел определенные структурные особенности. [35] Исследования показали, что катализаторы также могут влиять на региоселективность и энантиоселективность реакции 1,6-присоединения. [35]
Например, на изображении ниже показано присоединение этилмагнийбромида к этилсорбату 1 с использованием медного катализатора с обратным йозифосным ( R,S )-(–)-3-лигандом. [35] В результате этой реакции был получен продукт 1,6-присоединения 2 с выходом 0%, продукт 1,6-присоединения 3 с выходом примерно 99% и продукт 1,4-присоединения 4 с выходом менее 2%. Этот конкретный катализатор и набор условий реакции привели к преимущественно региоселективному и энантиоселективному присоединению 1,6-Майкла этилсорбата 1 к продукту 3 .

Приложения
[ редактировать ]Фармацевтика
[ редактировать ]Реакция Михаэля используется в качестве механистического этапа во многих препаратах- ингибиторах ковалентной связи . Противораковые препараты, такие как ибрутиниб, осимертиниб и рокилетиниб, имеют функциональную группу акриламида в качестве акцептора Михаэля. Донор Михаэля в препарате реагирует с акцептором Михаэля в центре фермента активном . Это жизнеспособное лечение рака, поскольку целевой фермент ингибируется в результате реакции Михаэля. [36]
Реакции полимеризации
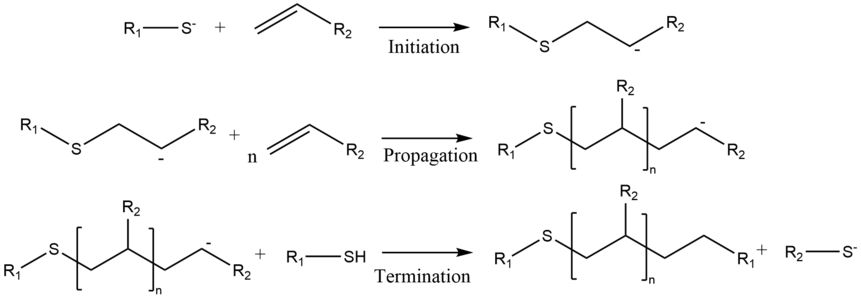
[ редактировать ]Механизм [2]
[ редактировать ]Все реакции полимеризации имеют три основные стадии: инициирование, распространение и завершение. Стадией инициирования является присоединение нуклеофила к мономеру по Михаэлю . Полученная разновидность подвергается присоединению по Михаэлю с другим мономером, причем последний действует как акцептор. Это удлиняет цепь за счет образования еще одной нуклеофильной разновидности, которая будет выступать в качестве донора для следующего добавления. Этот процесс повторяется до тех пор, пока реакция не завершится обрывом цепи. [37] Первоначальный донор Михаэля может быть нейтральным донором, таким как амины , тиолы и алкоксиды или алкиллиганды, связанные с металлом. [38]
Примеры
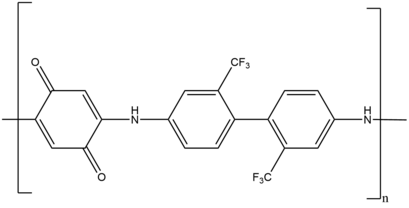
[ редактировать ]с линейным Полимеризация ступенчатым ростом - одно из первых применений реакции Михаэля в полимеризации. Для синтеза широкого спектра полимеров использовалось множество доноров и акцепторов Михаэля. Примеры таких полимеров включают поли(амидоамин), поли(аминоэфир), поли(имидосульфид ) , поли( эфирсульфид ), поли(аспартамид), поли(имидоэфир ) , поли(аминохинон ) , поли(енонсульфид). ) и поли(енаминкетон ) .
Например, в результате линейно-ступенчатой ростовой полимеризации образуется окислительно-восстановительный поли(аминохинон), который служит антикоррозийным покрытием на различных металлических поверхностях. [39] Другой пример включает сетчатые полимеры , которые используются для доставки лекарств, высокоэффективных композитов и покрытий. Эти сетчатые полимеры синтезируются с использованием системы присоединения Михаэля с двойным ростом цепи, фотоиндуцированного радикала и ступенчатого роста.

Ссылки
[ редактировать ]- ^ Литтл, Р.Д.; Масджедизаде, г-н; Уоллквист, О.; Маклафлин, Дж.И. (1995). «Внутримолекулярная реакция Майкла». Орг. Реагируйте . Том. 47. С. 315–552. дои : 10.1002/0471264180.или047.02 . ISBN 978-0-471-26418-7 .
- ^ Перейти обратно: а б с Мэзер, Б.; Вишванатан, К.; Миллер, К.; Лонг, Т. (2006). «Реакции присоединения Майкла в дизайне макромолекул для новых технологий». Прогресс в науке о полимерах . 31 (5): 487–531. doi : 10.1016/j.progpolymsci.2006.03.001 .
- ^ Перейти обратно: а б Майкл Дополнение | PharmaXChange.info
- ^ Хант, И. «Глава 18: Энолы и еноляты - реакция присоединения Майкла» . Университет Калгари.
- ^ Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850346-0 .
- ^ Тиано, Мартин (2020). «Энантиоселективное присоединение Михаэля: экспериментальное введение в асимметричный синтез». Журнал химического образования . 97 (8): 2291–2295. Бибкод : 2020JChEd..97.2291T . doi : 10.1021/acs.jchemed.0c00164 .
- ^ Майкл, А. (1887). «О добавлении ацетоацетата натрия и эфиров малоновой кислоты натрия к эфирам ненасыщенных кислот». Журнал практической химии . 2-я серия. 35 :349-356. дои : 10.1002/prac.18870350136 .
- ^ Майкл, А. (1894). «О добавлении ацетоацетата натрия и эфиров малоновой кислоты натрия к эфирам ненасыщенных кислот». Журнал практической химии . 2-я серия. 49 :20-25. дои : 10.1002/prac.18940490103 .
- ^ Мэзер, Брайан Д.; Вишванатан, Калпана; Миллер, Кевин М.; Лонг, Тимоти Э. (1 мая 2006 г.). «Реакции присоединения Майкла в макромолекулярном дизайне для новых технологий» . Прогресс в науке о полимерах . 31 (5): 487–531. doi : 10.1016/j.progpolymsci.2006.03.001 . ISSN 0079-6700 .
- ^ Браун, Уильям Генри (2018). Органическая химия . Брент Л. Айверсон, Эрик В. Анслин, Кристофер С. Фут (Восьмое изд.). Бостон, Массачусетс. ISBN 978-1-337-51640-2 . OCLC 1200494733 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Гуин, Сумитра; Саха, Хемонт К.; Патель, Ашвани К.; Гудимелла, Сантош К.; Бисвас, Субханкар; Саманта, Сэм (17 июля 2020 г.). «Присоединение 1,6-аза-Майкла парахинонметидов к N-гетероциклам, катализируемое Zn(OTf)2: региоселективный подход к N-диарилметилзамещенным гетероциклам» . Тетраэдр 76 (28):131338.doi : 10.1016 /j.tet.2020.131338 . ISSN 0040-4020 . S2CID 225589003 .
- ^ Перлмуттер, П., изд. (1 января 1992 г.), «Глава первая - Введение» , Серия «Тетраэдр по органической химии» , Реакции сопряженного присоединения в органическом синтезе, том. 9, Elsevier, стр. 1–61, номер документа : 10.1016/b978-0-08-037067-5.50007-2 , получено 7 октября 2022 г.
- ^ Конрад, М.; Гутцайт, М. (1884). «О реакции 2,3-дибромпропионовой кислоты с эфиром [диэтил] малоновой кислоты». Отчеты Немецкого химического общества . 17 (1): 1185–1188. дои : 10.1002/cber.188401701314 .
- ^ Перейти обратно: а б Токорояма, Т. (2010). «Открытие реакции Майкла». Европейский журнал органической химии . 2010 (10): 2009–2016. дои : 10.1002/ejoc.200901130 .
- ^ Клайзен, Л. (1887). «Наблюдение за присоединением [ди]этилмалоната к веществам с двойной углеродной связью». Журнал практической химии . 2-я серия. 35 (1): 413–415. дои : 10.1002/prac.18870350144 .
- ^ Комненос, Т. (1883). «О реакции алифатических альдегидов с малоновой кислотой и [ди] этилмалонатом». «Анналы химии» Юстуса Либиха . 218 (2): 145–167. дои : 10.1002/jlac.18832180204 .
- ^ Рейес, Э.; Урия, У.; Викарий, Дж.Л.; Каррильо, Л. (2016). «Каталитическая энантиоселективная реакция Майкла». Органические реакции . 90 :1–898. дои : 10.1002/0471264180.или090.01 . ISBN 9780471264187 .
- ^ Пансаре, СВ; Пандия, К. (2006). «Простые катализаторы диамин- и триамин-протоновых кислот для энантиоселективного присоединения по Михаэлю циклических кетонов к нитроалкенам». Журнал Американского химического общества . 128 (30): 9624–9625. дои : 10.1021/ja062701n . ПМИД 16866504 .
- ^ Икава, М.; Стаманн, Массачусетс; Линк, КП (1944). «Исследования 4-гидроксикумаринов. V. Конденсация α,β-ненасыщенных кетонов с 4-гидроксикумарином». Журнал Американского химического общества . 66 (6): 902. дои : 10.1021/ja01234a019 .
- ^ Халланд, Н.; Хансен, Т.; Йоргенсен, К. (2003). «Органокаталитическая асимметричная реакция Михаэля циклических 1,3-дикарбонильных соединений и α,β-ненасыщенных кетонов - каталитическое одностадийное образование оптически активного варфаринового антикоагулянта с высокой атомной экономичностью». Ангеванде Хеми . 42 (40): 4955–4957. дои : 10.1002/anie.200352136 . ПМИД 14579449 .
- ^ Ким, Х.; Йен, К.; Престон, П.; Чин, Дж. (2006). «Субстратно-направленная стереоселективность в вицинальном диамин-катализируемом синтезе варфарина». Органические письма . 8 (23): 5239–5242. дои : 10.1021/ol062000v . ПМИД 17078687 .
- ^ Се, Дж.; Юэ, Л.; Чен, В.; Ду, В.; Чжу, Дж.; Дэн, Дж.; Чен, Ю. (2007). «Высокоэнантиоселективное присоединение по Михаэлю циклических 1,3-дикарбонильных соединений к α,β-ненасыщенным кетонам». Органические письма . 9 (3): 413–415. дои : 10.1021/ol062718a . ПМИД 17249775 .
- ^ Кристенсен, TE; Вестли, К.; Хансен, ФК; Хансен, Т. (2009). «Новые первичные аминоорганические катализаторы на основе фенилглицина для получения оптически активного варфарина» . Европейский журнал органической химии . 2009 (30): 5185. doi : 10.1002/ejoc.200900664 .
- ^ Донг, З.; Ван, Л.; Чен, X.; Лю, X.; Лин, Л.; Фэн, X. (2009). «Органокаталитическое энантиоселективное добавление Михаэля 4-гидроксикумарина к α,β-ненасыщенным кетонам: простой синтез варфарина». Европейский журнал органической химии . 2009 (30): 5192. doi : 10.1002/ejoc.200900831 .
- ^ Вонг, ТК; Султана, CM; Восбург, Д.А. (2010). «Зеленый энантиоселективный синтез варфарина для студенческой органической лаборатории». Журнал химического образования . 87 (2): 194. Бибкод : 2010JChEd..87..194W . дои : 10.1021/ed800040m .
- ^ Кларк, ХТ; Мюррей, Т.Ф. (1941). «Тетраэтиловый эфир 1,1,2,3-пропантетракарбоновой кислоты» . Органические синтезы ; Сборник томов , т. 1, с. 272 .
- ^ Шрайнер, РЛ; Тодд, HR (1943). «1,3-Циклогександион, 5,5-диметил-» . Органические синтезы ; Сборник томов , т. 2, с. 200 .
- ^ Джеймс Кейсон (1963). «β-Метилглутаровый ангидрид» . Органические синтезы ; Сборник томов , т. 4, с. 630 .
- ^ Моффетт, РБ (1963). «Метил γ-Метил-γ-нитровалерат» . Органические синтезы ; Сборник томов , т. 4, с. 652 .
- ^ Хорнинг, ЕС; Финелли, А.Ф. (1963). «α-фенил-α-карбэтоксиглутаронитрил» . Органические синтезы ; Сборник томов , т. 4, с. 776 .
- ^ Макмерри, Дж. Э.; Мелтон, Дж. (1988). «Превращение нитро в карбонил путем озонолиза нитронатов: 2,5-гептандион» . Органические синтезы ; Сборник томов , т. 6, с. 648 .
- ^ Мукаяма, Т. (1977). «Тетрахлорид титана в органическом синтезе [Новые методы синтеза (21)]». Энджью. хим. Межд. Эд. англ. 16 (12): 817–826. дои : 10.1002/anie.197708171 .
- ^ Липперт, Арканзас; Каеобамрунг, Дж.; Боде, JW (2006). «Синтез олигозамещенных буллвалонов: изменение формы молекул в основных условиях». Журнал Американского химического общества . 128 (46): 14738–14739. дои : 10.1021/ja063900+ . ПМИД 17105247 .
- ^ Перейти обратно: а б Хаяси, Юджиро; Окамура, Даичи; Умемия, Сигенобу; Учимару, Тадафуми (июль 2012 г.). «Органокаталитическая реакция 1,4-присоединения α,β-γ,δ-диненасыщенных альдегидов в сравнении с реакцией 1,6-присоединения» . ChemCatChem . 4 (7): 959–962. дои : 10.1002/cctc.201200161 . S2CID 98643888 .
- ^ Перейти обратно: а б с д и ден Хартог, Тим; Арутюнян Сюзанна Р.; Фонт, Дэниел; Миннаард, Адриан Дж.; Феринга, Бен Л. (январь 2008 г.). «Каталитическое энантиоселективное 1,6-конъюгатное добавление реагентов Гриньяра к линейным диеноатам» . Angewandte Chemie, международное издание . 47 (2): 398–401. дои : 10.1002/anie.200703702 . ПМИД 18041800 .
- ^ Бойке, Лидия; Хеннинг, Натаниэль Дж.; Номура, Дэниел К. (25 августа 2022 г.). «Достижения в области открытия ковалентных лекарств» . Nature Reviews Открытие лекарств . 21 (12): 881–898. дои : 10.1038/s41573-022-00542-z . ISSN 1474-1776 . ПМЦ 9403961 . ПМИД 36008483 .
- ^ Хуан, Сидзя; Синха, Жасмин; Подгорский, Мацей; Чжан, Синьпэн; Клаудино, Мауро; Боуман, Кристофер Н. (14 августа 2018 г.). «Механистическое моделирование кинетики аддитивной полимеризации тиол-Майкл: структурные эффекты тиоловых и виниловых мономеров» . Макромолекулы . 51 (15): 5979–5988. Бибкод : 2018MaMol..51.5979H . doi : 10.1021/acs.macromol.8b01264 . ISSN 0024-9297 . S2CID 105834506 .
- ^ Юнг, Хёк-Джун; Ю, Инсун; Ньямаяро, Кудзанай; Мехрходаванди, Парижа (5 июня 2020 г.). «Индий-катализируемая блок-сополимеризация лактида и метилметакрилата путем последовательного добавления» . АКС-катализ . 10 (11): 6488–6496. дои : 10.1021/acscatal.0c01365 . ISSN 2155-5435 . S2CID 219762406 .
- ^ Фам, MC; Юбер, С; Пиро, Б; Морель, Ф; Ле Дао, Х; Такеноути, Х. (февраль 2004 г.). «Исследование окислительно-восстановительного процесса проводящей пленки поли(2-метил-5-амино-1,4-нафтохинона) (ПМАНХ)» . Синтетические металлы . 140 (2–3): 183–197. дои : 10.1016/S0379-6779(03)00373-4 .






