Ингибитор β-лактамаз
Бета-лактамазы представляют собой семейство ферментов бактерий , участвующих в устойчивости к бета-лактамным антибиотикам . При бактериальной резистентности к бета-лактамным антибиотикам у бактерий есть бета-лактамазы, которые разрушают бета-лактамные кольца, делая антибиотик неэффективным. Однако при использовании ингибиторов бета-лактамаз эти ферменты бактерий ингибируются, что позволяет антибиотику подействовать. Стратегии борьбы с этой формой резистентности включают разработку новых бета-лактамных антибиотиков, более устойчивых к расщеплению, а также разработку класса ингибиторов ферментов, называемых ингибиторами бета-лактамаз . [1] Хотя ингибиторы β-лактамаз сами по себе обладают небольшой антибиотической активностью, [2] они предотвращают бактериальную деградацию бета-лактамных антибиотиков и, таким образом, расширяют круг бактерий, против которых эффективны эти препараты.
Медицинское использование
[ редактировать ]Наиболее важным применением ингибиторов бета-лактамаз является лечение инфекций, которые, как известно или предположительно, вызваны грамотрицательными бактериями , поскольку выработка бета-лактамаз является важным фактором, способствующим устойчивости этих патогенов к бета-лактамам. Напротив, большая часть устойчивости к бета-лактамам у грамположительных бактерий обусловлена изменениями в пенициллин-связывающих белках , которые приводят к снижению связывания с бета-лактамами. [3] [4] Грамположительный возбудитель Staphylococcus aureus продуцирует бета-лактамазы, но ингибиторы бета-лактамаз играют меньшую роль в лечении этих инфекций, поскольку наиболее устойчивые штаммы ( метициллин-резистентный Staphylococcus aureus ) также используют варианты пенициллинсвязывающих белков. [5] [6]
Механизм действия
[ редактировать ]Система классификации Эмблера группирует известные ферменты бета-лактамаз в четыре группы в соответствии с гомологией последовательностей и предполагаемыми филогенетическими отношениями. Классы A, C и D расщепляют бета-лактамы по многоступенчатому механизму, аналогичному механизму сериновых протеаз . При связывании гидроксильная группа серина в активном сайте бета-лактамазы образует временную ковалентную связь с карбонильной группой бета-лактамного кольца, при этом расщепляя бета-лактамное кольцо. На втором этапе нуклеофильная атака молекулы воды разрывает ковалентную связь между ферментом и карбонильной группой бывшего бета-лактама. Это позволяет разложившемуся бета-лактаму диффундировать и высвобождает фермент для обработки дополнительных молекул бета-лактама. [ нужна ссылка ]
Доступные в настоящее время ингибиторы бета-лактамаз эффективны против бета-лактамаз Ambler класса A (тазобактам, клавуланат и сульбактам) или против бета-лактамаз класса A, C и некоторых классов D (авибактам). Как и бета-лактамные антибиотики, они обрабатываются бета-лактамазами с образованием исходного ковалентного промежуточного продукта. В отличие от бета-лактамных антибиотиков, ингибиторы действуют как субстраты суицида (тазобактам и сульбактам), что в конечном итоге приводит к деградации бета-лактамазы. [7] С другой стороны, авибактам не содержит бета-лактамного кольца (небета-лактамного ингибитора бета-лактамаз) и вместо этого связывается обратимо . [8] [9]
Бета-лактамазы Ambler класса B расщепляют бета-лактамы по механизму, аналогичному механизму металлопротеаз . Поскольку ковалентное промежуточное соединение не образуется, механизм действия имеющихся в продаже ингибиторов бета-лактамаз неприменим. Таким образом, распространение бактериальных штаммов, экспрессирующих металло-бета-лактамазы, таких как металло-бета-лактамазы 1 из Нью-Дели, вызвало значительную обеспокоенность. [10]
Часто используемые агенты
[ редактировать ]Ингибиторы β-лактамаз, имеющиеся в настоящее время на рынке, не продаются как отдельные препараты. Вместо этого они созданы совместно с β-лактамными антибиотиками с аналогичным периодом полувыведения из сыворотки. Это делается не только для удобства дозирования, но и для минимизации развития резистентности, которая может возникнуть в результате различного воздействия того или иного препарата. К основным классам β-лактамных антибиотиков, используемых для лечения грамотрицательных бактериальных инфекций, относятся (в примерном порядке внутренней устойчивости к расщеплению β-лактамазами) пенициллины (особенно аминопенициллины и уреидопенициллины), цефалоспорины 3-го поколения и карбапенемы. Отдельные варианты β-лактамаз могут быть нацелены на один или несколько из этих классов лекарств, и только подмножество будет ингибироваться данным ингибитором β-лактамаз. [9] Ингибиторы β-лактамаз расширяют полезный спектр этих β-лактамных антибиотиков, ингибируя ферменты β-лактамазы, продуцируемые бактериями, с целью их дезактивации. [11]
- Ингибиторы β-лактамаз с β-лактамным ядром:
- Тебипенем — первый карбапенем, вводимый перорально в форме тебипенем-пивоксила. Структурные и кинетические исследования тебипенема доступны с бета-лактамазой M. Tuberculosis (BlaC). [12]
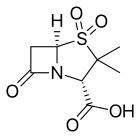
- Клавулановая кислота или клавуланат, обычно в сочетании с амоксициллином ( Аугментин ) или тикарциллином ( Тиментин ).
- Сульбактам , обычно в сочетании с ампициллином ( Унасин ) или цефоперазоном ( Сульперазон ).
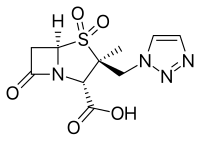
- Тазобактам , обычно в сочетании с пиперациллином ( Зосин, Тазоцин )
- Энметазобактам , обычно в сочетании с цефепимом ( Эксблифеп )
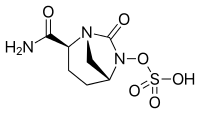
- Ингибиторы β-лактамаз с диазабициклооктановым ядром:
- Авибактам , одобренный в сочетании с цефтазидимом ( Авиказ, Завицефта ), в настоящее время проходит клинические испытания в сочетании с цефтаролином.
- Дурлобактам одобрен в сочетании с сульбактамом ( Xacduro ) для лечения внутрибольничной бактериальной пневмонии и вентилятор-ассоциированной бактериальной пневмонии (HABP/VABP), вызванной Acinetobacter baumannii-calcoaceticus . комплексом
- Релебактам , используемый в сочетании с имипенемом/циластатином ( Recarbrio ). [13] [14]
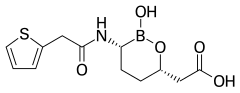
- Ингибиторы β-лактамаз с другими типами неβ-лактамных ядер:
- Ваборбактам , применяется в сочетании с меропенемом ( Вабомер ). Имеет ядро из бороновой кислоты . [15]
Бактерии, продуцирующие бета-лактамазу
[ редактировать ]Бактерии, которые могут продуцировать бета-лактамазы, включают, помимо прочего: [ нужна ссылка ]
- стафилококк
- MRSA (метициллин-резистентный золотистый стафилококк )
- Энтеробактерии :
- Гемофильная инфекция
- Моракселла катаралис
- Нейссерия гонорея
- синегнойная палочка
- Микобактерия туберкулеза
Исследовать
[ редактировать ]Некоторые бактерии могут продуцировать β-лактамазы расширенного спектра (ESBL), что затрудняет лечение инфекции и придает дополнительную устойчивость к пенициллинам , цефалоспоринам и монобактамам . [16] Производные бороновой кислоты в настоящее время подвергаются обширным и обширным исследованиям в качестве новых ингибиторов активного центра бета-лактамаз, поскольку они содержат сайт, имитирующий переходное состояние , которое проходят бета-лактамы при гидролизе бета-лактамазами. Было обнаружено, что они обычно хорошо вписываются в активный центр многих бета-лактамаз и обладают тем удобным свойством, что не поддаются гидролизу и, следовательно, становятся бесполезными. Это более выгодный дизайн лекарств по сравнению со многими конкурирующими препаратами, используемыми в клинических условиях, поскольку большинство из них, например клавулановая кислота, гидролизуются и, следовательно, полезны только в течение ограниченного периода времени. Обычно это вызывает необходимость в более высокой концентрации конкурентного ингибитора, чем это было бы необходимо для негидролизуемого ингибитора. Различные производные бороновой кислоты потенциально могут быть адаптированы к множеству различных изоформ бета-лактамаз и, следовательно, могут восстановить эффективность бета-лактамных антибиотиков. [17]
Ссылки
[ редактировать ]- ^ Эссак С.Ю. (октябрь 2001 г.). «Разработка бета-лактамных антибиотиков в ответ на эволюцию бета-лактамаз». Фармацевтические исследования . 18 (10): 1391–9. дои : 10.1023/а:1012272403776 . ПМИД 11697463 . S2CID 34318096 .
- ^ «Ингибиторы бета-лактамаз» . Кафедра сестринского дела Колледжа здоровья и наук о жизни Государственного университета Форт-Хейс . Октябрь 2000 г. Архивировано из оригинала 27 сентября 2007 г. Проверено 17 августа 2007 г.
- ^ Георгопападаку Н.Х. (октябрь 1993 г.). «Пенициллинсвязывающие белки и устойчивость бактерий к бета-лактамам» . Антимикробные средства и химиотерапия . 37 (10): 2045–53. дои : 10.1128/aac.37.10.2045 . ЧВК 192226 . ПМИД 8257121 .
- ^ Запун А., Контрерас-Мартель С., Верне Т. (март 2008 г.). «Пенициллинсвязывающие белки и устойчивость к бета-лактамам» . Обзоры микробиологии FEMS . 32 (2): 361–85. дои : 10.1111/j.1574-6976.2007.00095.x . ПМИД 18248419 .
- ^ Курелло Дж., МакДугалл С. (июль 2014 г.). «Помимо чувствительности и резистентности, Часть II: Лечение инфекций, вызванных грамотрицательными организмами, продуцирующими β-лактамазы расширенного спектра» . Журнал детской фармакологии и терапии . 19 (3): 156–64. дои : 10.5863/1551-6776-19.3.156 . ПМК 4187532 . ПМИД 25309145 .
- ^ Уолтер DJ, Листер П.Д. (2013). «Механизмы резистентности к β-лактамам среди Pseudomonas aeruginosa». Текущий фармацевтический дизайн . 19 (2): 209–22. дои : 10.2174/13816128130203 . ПМИД 22894618 .
- ^ Патрик, Грэм Л. (2017). Введение в медицинскую химию (6-е изд.). Оксфорд, Великобритания. ISBN 9780198749691 . OCLC 987051883 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Лахири С.Д., Мангани С., Дюран-Ревиль Т., Бенвенути М., Де Лука Ф., Саньял Дж., Докье Дж.Д. (июнь 2013 г.). «Структурное понимание мощного ингибирования широкого спектра действия с механизмом обратимой рециклизации: авибактам в комплексе с β-лактамазами CTX-M-15 и Pseudomonas aeruginosa AmpC» . Антимикробные средства и химиотерапия . 57 (6): 2496–505. дои : 10.1128/AAC.02247-12 . ПМЦ 3716117 . ПМИД 23439634 .
- ^ Jump up to: а б Дроз С.М., Бономо Р.А. (январь 2010 г.). «Три десятилетия ингибиторов бета-лактамаз» . Обзоры клинической микробиологии . 23 (1): 160–201. дои : 10.1128/CMR.00037-09 . ПМК 2806661 . ПМИД 20065329 .
- ^ Биденбах Д., Бушийон С., Хакель М., Хобан Д., Казмерчак К., Хавсер С., Бадал Р. (февраль 2015 г.). «Распространение генов металло-β-лактамаз NDM среди клинических изолятов Enterobacteriaceae, собранных в ходе глобального эпиднадзорного исследования SMART с 2008 по 2012 год» . Антимикробные средства и химиотерапия . 59 (2): 826–30. дои : 10.1128/AAC.03938-14 . ПМЦ 4335866 . ПМИД 25403666 .
- ^ Watson ID, Стюарт MJ, Platt DJ (сентябрь 1988 г.). «Клиническая фармакокинетика ингибиторов ферментов при антимикробной химиотерапии». Клиническая фармакокинетика . 15 (3): 133–64. дои : 10.2165/00003088-198815030-00001 . ПМИД 3052984 . S2CID 2388750 .
- ^ Хазра С., Сюй Х., Бланшар Дж.С. (июнь 2014 г.). «Тебипенем, новый карбапенемовый антибиотик, представляет собой медленный субстрат, ингибирующий β-лактамазу микобактерии туберкулеза» . Биохимия . 53 (22): 3671–8. дои : 10.1021/bi500339j . ПМК 4053071 . ПМИД 24846409 .
- ^ «FDA одобряет новое лечение осложненных инфекций мочевыводящих путей и осложненных внутрибрюшных инфекций» . Управление по контролю за продуктами и лекарствами . 17 июля 2019 года. Архивировано из оригинала 20 ноября 2019 года . Проверено 18 июля 2019 г.
- ^ «Циластатин/имипенем/релебактам — AdisInsight» . Спрингер Интернэшнл Паблишинг АГ. Архивировано из оригинала 31 мая 2016 года . Проверено 29 апреля 2016 г.
- ^ «FDA одобрило новый антибактериальный препарат» (Пресс-релиз). Управление по контролю за продуктами и лекарствами . 29 августа 2017 года. Архивировано из оригинала 23 апреля 2019 года . Проверено 18 июля 2019 г.
- ^ Ливермор DM (октябрь 1995 г.). «Бета-лактамазы в лабораторной и клинической резистентности» . Обзоры клинической микробиологии . 8 (4): 557–84. дои : 10.1128/cmr.8.4.557 . ПМК 172876 . PMID 8665470 .
- ^ Леонард Д.А., Бономо Р.А., Пауэрс Р.А. (ноябрь 2013 г.). «β-лактамазы класса D: переоценка спустя пять десятилетий» . Отчеты о химических исследованиях . 46 (11): 2407–15. дои : 10.1021/ar300327a . ПМК 4018812 . ПМИД 23902256 .
Внешние ссылки
[ редактировать ]- Сюй Х., Хазра С., Бланшар Дж.С. (июнь 2012 г.). «NXL104 необратимо ингибирует β-лактамазу микобактерии туберкулеза» . Биохимия . 51 (22): 4551–7. дои : 10.1021/bi300508r . ПМК 3448018 . ПМИД 22587688 .
- Курц С.Г., Вольф К.А., Хазра С., Вефиль Ч.Р., Худжер А.М., Смит К.М., Сюй Ю., Трембле Л.В., Бланшар Дж.С., Нгуен Л., Бономо Р.А. (декабрь 2013 г.). «Могут ли устойчивые к ингибиторам замены в β-лактамазе BlaC микобактерий туберкулеза привести к устойчивости к клавуланату?: биохимическое обоснование использования комбинаций ингибиторов β-лактамов и ингибиторов β-лактамаз» . Антимикробные средства и химиотерапия . 57 (12): 6085–96. дои : 10.1128/AAC.01253-13 . ПМЦ 3837893 . ПМИД 24060876 .