Красная соль Руссена

| |
| |
| Имена | |
|---|---|
| Название ИЮПАК
тетранитрозил-ди-μ-сульфидодижелезо( Fe – Fe )(2–) калия
| |
| Другие имена
Феррат(2-), тетранитрозилди-мю-тиоксоди-, (Fe-Fe), дикалий
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
ПабХим CID
|
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| Fe 2 Н 4 К 2 О 4 S 2 | |
| Молярная масса | 374.04 g/mol |
| Появление | Темно-красные кристаллы |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Красная соль Руссена представляет собой неорганическое соединение с формулой K 2 [Fe 2 S 2 (NO) 4 ]. Этот металлический нитрозил был впервые описан Закари Руссеном в 1858 году, что сделало его одним из первых синтетических железо-серных кластеров . [ 1 ] [ 2 ]
Структура и связь
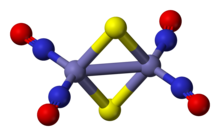
[ редактировать ]Анион красной соли Руссена представляет собой битетраэдр с общими краями, в котором пара звеньев Fe(NO) 2 соединена мостиковой парой сульфидных лигандов. Связи Fe- NO являются линейными, что указывает на то, что NO действует как донор трех электронов. [ 3 ] Диамагнитное правилу соединение подчиняется 18 электронов . Темно-красный цвет комплекса обусловлен рядом взаимодействий с переносом заряда между железным ядром и нитрозильными лигандами. [ 4 ]
Синтез
[ редактировать ]
Французский химик З. Руссен [ 5 ] впервые получил эту соль при исследовании реакций между ионом нитропруссида ([Fe(CN) 5 NO] 2− ) и сера. [ 6 ] Соль можно получить реакцией сульфидных солей с нитрозилгалогенидами железа: [ 7 ]
- Fe 2 I 2 (NO) 4 + 2Li 2 S → Li 2 Fe 2 S 2 (NO) 4 + 2LiI
Другой способ получения красной соли Руссена - подщелачивание раствора родственного соединения черной соли Руссена K[Fe 4 S 3 (NO) 7 ], используя подходящее основание :
- 2K[Fe 4 S 3 (NO) 7 ] + 4KOH → 3K 2 [Fe 2 S 2 (NO) 4 ] + 2Fe(OH) 2 + 2NO
Другая процедура получения состоит из взаимодействия натрия (или калия ) нитрита , аскорбиновой кислоты , сернокислого железа , сульфида натрия натрия (или калия) и гидроксида в указанном порядке. Аскорбиновая кислота действует и как подкислитель, и как восстановитель , превращая нитрит в азотистую кислоту , а затем восстанавливая ее до монооксида азота , который затем связывается с ионами железа, образуя нитрозильные комплексы , которые вступают в реакцию с сульфидом в основной среде, давая красную соль Руссена. . [ 8 ]
- FeSO 4 + 4HNO 2 + 3C 6 H 8 O 6 + 2Na 2 S + 2NaOH → Na 2 [Fe 2 S 2 (NO) 4 ] + 3C 6 H 6 O 6 + 2Na 2 SO 4 + 6H 2 O
Для получения «эфиров» соль алкилируют:
- Li 2 Fe 2 S 2 (NO) 4 + 2 RX → Fe 2 (SR) 2 (NO) 4 + 2 LiX
Эфиры также легко получить реакцией Fe 2 I 2 (NO) 4 с тиолом или тиосульфатом .
Возникновение и потенциальные применения
[ редактировать ]Он встречается в природе в виде его «эфиров» с формулой Fe 2 (SR) 2 (NO) 4 , где «R» — любая алкильная группа. [ 3 ] Кроме того, красная соль Руссена обсуждается в области микробиологии и пищевой науки из-за ее мутагенных свойств. [ 9 ]
Производное сложного эфира исследуется в качестве донора оксида азота в биологии и медицине из-за относительно низкой токсичности и хорошей стабильности красной соли Руссена. [ 10 ] Фотодиссоциация соединения индуцирует высвобождение NO, тем самым повышая чувствительность клеток-мишеней к воздействию радиации. [ 9 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Батлер, Энтони Р. (июль 1982 г.). "Химик З. Руссен (1827-94)". Журнал химического образования . 59 (7): 549. Бибкод : 1982ЖЧЭд..59..549Б . дои : 10.1021/ed059p549 .
- ^ Руссен, ML (1858). «Исследование двойных нитросульфидов железа (новый класс солей)» . Энн. хим. Физ . 52 : 285–303.
- ^ Jump up to: а б Томас, Джей Ти; Робертсон, Дж. Х.; Кокс, Э.Г. (1 сентября 1958 г.). «Кристаллическая структура красного этилового эфира Руссена» . Акта Кристаллографика . 11 (9): 599–604. дои : 10.1107/S0365110X58001602 .
- ^ Яворска, Мария; Стасицкая, Зофья (2005). «Структура и УФ-Вид-спектроскопия биядерных нитрозильных комплексов железа с серой [Fe 2 S 2 (NO) 4 ] 2− и [Fe 2 (SR) 2 (NO) 4 ]». New Journal of Chemistry . 29 (4): 604. doi : 10.1039/B409519G .
- ^ Батлер, Энтони Р. (июль 1982 г.). "Химик З. Руссен (1827-94)". Журнал химического образования . 59 (7): 549. Бибкод : 1982ЖЧЭд..59..549Б . дои : 10.1021/ed059p549 .
- ^ Ханс Райлен, Адольф против. Фридольсхайм (1927). «О сложных соединениях оксидов азота и так называемом одновалентном железе» . «Анналы химии» Юстуса Либиха . 457 : 71–82. дои : 10.1002/jlac.19274570103 .
- ^ ТБ Раухфусс; ТД Уэзерилл (1982). «Возврат к красной соли Руссена: реакционная способность Fe2 (μ-E) 2 (NO) 42-(E = S, Se, Te) и связанных с ней». Неорганическая химия . 21 (2): 827–830. дои : 10.1021/ic00132a071 .
- ^ отсутствуют источники
- ^ Jump up to: а б Гринвуд, штат Нью-Йорк; и Эрншоу, А. (1997). Химия элементов (2-е изд.), Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4 .
- ^ Юн, Х.; Парк, С.; Лим, М. (2020). «Динамика фотовысвобождения оксида азота из красного эфира Руссена, связанного с цистеином» . Журнал физической химии . 11 (9): 3198–3202. doi : 10.1021/acs.jpclett.0c00739 . ПМИД 32250631 . S2CID 215408785 .