гепсидин
| ХЭМП | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
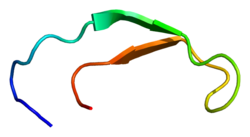 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | HAMP , HEPC, HFE2B, LEAP1, PLTR, антимикробный пептид гепсидин | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 606464 ; МГИ : 2153530 ; Гомологен : 81623 ; GeneCards : HAMP ; ОМА : HAMP – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| гепсидин | |||
|---|---|---|---|
 Структура раствора гепсидина-25. [5] | |||
| Идентификаторы | |||
| Символ | гепсидин | ||
| Пфам | PF06446 | ||
| ИнтерПро | ИПР010500 | ||
| СКОП2 | 1м4ф / СКОПе / СУПФАМ | ||
| Суперсемейство OPM | 153 | ||
| белок OPM | 1м4е | ||
| |||
| гепсидин, противомикробный пептид | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ХЭМП | ||
| ген NCBI | 57817 | ||
| HGNC | 15598 | ||
| МОЙ БОГ | 606464 | ||
| RefSeq | НМ_021175 | ||
| ЮниПрот | P81172 | ||
| Другие данные | |||
| Локус | Хр. 19 q13.1 | ||
| |||
Гепсидин — это белок , который у человека кодируется геном HAMP . Гепсидин является ключевым регулятором поступления железа в кровообращение у млекопитающих. [6]
При состояниях, при которых уровень гепсидина аномально высок, например при воспалении , уровень сывороточного железа падает из-за захвата железа макрофагами и клетками печени и снижения всасывания железа в кишечнике. Обычно это приводит к анемии из-за недостаточного количества сывороточного железа, доступного для развития эритроцитов . Когда уровень гепсидина аномально низкий, например, при гемохроматозе , происходит перегрузка железом из-за увеличения опосредованного ферропортином оттока железа из хранилищ и увеличения всасывания железа в кишечнике.
Структура
[ редактировать ]Гепсидин существует в виде препрогормона (84 аминокислоты), прогормона (60 аминокислот) и гормона (25 аминокислот). Метаболиты гепсидина, состоящие из 22 и 22 аминокислот, также присутствуют в моче. Удаление 5 N -концевых аминокислот приводит к потере функции. Превращение прогепсидина в гепсидин осуществляется прогормоном конвертазой фурином . [7] Это преобразование может регулироваться альфа-1-антитрипсином . [8]
Гепсидин представляет собой плотно свернутый полипептид с 32% содержанием бета-листов и шпилечной структурой, стабилизированной 4 дисульфидными связями . Структура гепсидина была определена методом ЯМР раствора . [5] Исследования ЯМР показали новую модель гепсидина: при температуре окружающей среды белок преобразуется между двумя конформациями, которые можно индивидуально разрешить путем изменения температуры. Структуру раствора гепсидина определяли при 325 К и 253 К в переохлажденной воде. Рентгеновский анализ сокристалла с Fab выявил структуру, аналогичную структуре высокотемпературного ЯМР. [9]
Функция
[ редактировать ]
Гепсидин является регулятором обмена железа. канала экспорта железа Он ингибирует транспорт железа путем связывания с ферропортином , который расположен в базолатеральной плазматической мембране энтероцитов кишечника и плазматической мембране ретикулоэндотелиальных клеток ( макрофагов ), что в конечном итоге приводит к распаду ферропортина в лизосомах . [10] [11] Показано, что гепсидин способен связываться с центральной полостью ферропортина, блокируя экспорт железа из клетки. Это предполагает, что гепсидин способен регулировать экспорт железа независимо от эндоцитоза и убиквитинирования ферропортина и, таким образом, быстро индуцируется и обратим. [12] [13] В энтероцитах это предотвращает передачу железа в портальную систему печени , тем самым снижая всасывание железа с пищей. В макрофагах ингибирование ферропортина вызывает секвестрацию железа внутри клетки. Повышенная активность гепсидина частично ответственна за снижение доступности железа, наблюдаемое при анемии хронического воспаления, например, при почечной недостаточности , и это может объяснить, почему пациенты с терминальной стадией почечной недостаточности могут не реагировать на пероральную заместительную терапию железом. [14]
Любая из нескольких мутаций гепсидина приводит к ювенильному гемохроматозу . Большинство случаев ювенильного гемохроматоза обусловлены мутациями гемоювелина . [15] Мутации в TMPRSS6 могут вызывать анемию из-за нарушения регуляции гепсидина. [16]
Гепсидин обладает сильной антимикробной активностью в отношении штаммов Escherichia coli ML35P и Neisseria cinerea и более слабой антимикробной активностью в отношении Staphylococcus epidermidis , Staphylococcus aureus и Streptococcus agalactiae . Он также активен в отношении грибка Candida albicans , но не активен в отношении Pseudomonas aeruginosa . [17]
Регулирование
[ редактировать ]Синтез и секреция гепсидина печенью контролируются запасами железа, воспалением (гепсидин является реагентом острой фазы ), гипоксией и эритропоэзом . [18] выработка костного морфогенного белка ( BMP В ответ на большие запасы железа индуцируется ), который связывается с рецепторами на гепатоцитах и индуцирует экспрессию гепсидина через путь SMAD . [19] Воспаление вызывает увеличение выработки гепсидина за счет высвобождения сигнальной молекулы интерлейкина-6 (IL-6) , которая связывается с рецептором и активирует ген HAMP через путь JAK/STAT . [19] Гипоксия отрицательно регулирует выработку гепсидина за счет продукции транскрипционного фактора, индуцируемого гипоксией ( HIF ), который в нормальных условиях разрушается под действием фон Хиппеля-Линдау (VHL) и пролилдегидрогеназы (PHD). Однако при индуцировании гипоксии PHD инактивируется, что позволяет HIF подавлять выработку гепсидина. Эритропоэз снижает выработку гепсидина за счет выработки эритропоэтина ( ЭПО ), который, как было показано, подавляет выработку гепсидина. [19]
Тяжелая анемия связана с низким уровнем гепсидина даже при наличии воспаления. [20] эритроферрон , вырабатываемый эритробластами, ингибирует гепсидин и, таким образом, обеспечивает больше железа для синтеза гемоглобина в таких ситуациях, как стрессовый эритропоэз. Было установлено, что [21] [22]
витамин D Было показано, что снижает уровень гепсидина на клеточных моделях, изучающих транскрипцию, и при введении в больших дозах людям-добровольцам. Оптимальная функция гепсидина может быть обусловлена достаточным присутствием витамина D в крови. [23]
История
[ редактировать ]Впервые о пептиде сообщили в январе 1998 г. Валоре Э., Парк С. и Ганц, Т. в базе данных SWISS-PROT как запись P81172 под названием гепсидин. [17] после того, как было замечено, что он вырабатывается в печени («геп-») и обладает бактерицидными свойствами («-цид» означает «уничтожение»). Подробные описания были опубликованы в 2000-2001 гг. [24] [25] [26] Хотя он в основном синтезируется в печени, меньшие количества синтезируются в других тканях, таких как жировые клетки. [27]
Гепсидин был впервые обнаружен в человека . моче и сыворотке [28] Вскоре после этого открытия исследователи обнаружили, что выработка гепсидина у мышей увеличивается в условиях перегрузки железом, а также при воспалении. Генетически модифицированные мыши, созданные для сверхэкспрессии гепсидина, умерли вскоре после рождения от тяжелого дефицита железа, что еще раз указывает на центральную, а не дублирующую роль в регуляции железа. Первые доказательства, связывающие гепсидин с клиническим состоянием, известным как анемия воспаления, были получены в лаборатории Нэнси Эндрюс в Бостоне, когда исследователи изучили ткани двух пациентов с опухолями печени с тяжелой микроцитарной анемией , которые не реагировали на добавки железа . Опухолевая ткань, по-видимому, сверхпродуцировала гепсидин и содержала большие количества мРНК гепсидина . Удаление опухолей хирургическим путем излечило анемию. [ нужна ссылка ]

В совокупности эти открытия позволяют предположить, что гепсидин регулирует всасывание железа в организм.
Клиническое значение
[ редактировать ]Существует множество заболеваний, при которых неспособность адекватного усвоения железа приводит к дефициту железа и железодефицитной анемии . Лечение будет зависеть от присутствующего уровня гепсидина, поскольку пероральное лечение вряд ли будет эффективным, если гепсидин блокирует энтеральную абсорбцию, и в этих случаях парентеральное лечение железом целесообразно . Исследования показали, что измерение гепсидина будет полезно для определения оптимального лечения. [29] хотя, поскольку он не широко доступен, С-реактивный белок в качестве суррогатного маркера используется (СРБ).
β-талассемия , одна из наиболее частых врожденных анемий , возникает в результате частичного или полного отсутствия синтеза β-глобина. Чрезмерная абсорбция железа является одной из основных особенностей β-талассемии и может привести к тяжелой заболеваемости и смертности. Серийные анализы мышей с β-талассемией показывают, что уровень гемоглобина со временем снижается, в то время как концентрация железа в печени , селезенке и почках заметно увеличивается. Перегрузка железом связана с низким уровнем гепсидина. У пациентов с β-талассемией также наблюдаются низкие уровни гепсидина. Наблюдения привели исследователей к гипотезе, что при β-талассемии всасывается больше железа, чем требуется для эритропоэза . Увеличение экспрессии гепсидина у мышей с β-талассемией ограничивает перегрузку железом, а также уменьшает образование нерастворимых мембраносвязанных глобинов и активных форм кислорода и улучшает анемию. [30] Мыши с повышенной экспрессией гепсидина также продемонстрировали увеличение продолжительности жизни их эритроцитов , обращение вспять неэффективного эритропоэза и спленомегалии , а также увеличение общего уровня гемоглобина . На основании этих данных исследователи предположили, что терапия, повышающая уровень гепсидина или действующая в качестве агонистов гепсидина , может помочь в лечении аномального всасывания железа у людей с β-талассемией и связанными с ней расстройствами. [31] В более поздних исследованиях на мышах [32] эритроферрон Предполагается, что является фактором, ответственным за подавление гепсидина. Коррекция уровней гепсидина и железа у этих мышей не улучшила их анемию. [32]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000105697 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000056978 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б ВВП : 1M4F ; Хантер Х.Н., Фултон Д.Б., Ганц Т., Фогель Х.Дж. (октябрь 2002 г.). «Структура раствора человеческого гепсидина, пептидного гормона с противомикробной активностью, который участвует в поглощении железа и наследственном гемохроматозе» . Журнал биологической химии . 277 (40): 37597–37603. дои : 10.1074/jbc.M205305200 . ПМИД 12138110 .
- ^ Ганц Т. (август 2003 г.). «Гепцидин — ключевой регулятор обмена железа и медиатор анемии воспаления» . Кровь . 102 (3): 783–788. дои : 10.1182/кровь-2003-03-0672 . ПМИД 12663437 .
- ^ Валоре Э.В., Ганц Т. (2008). «Посттрансляционный процессинг гепсидина в гепатоцитах человека опосредуется прогормоном конвертазой фурином» . Клетки крови, молекулы и болезни . 40 (1): 132–138. дои : 10.1016/j.bcmd.2007.07.009 . ПМК 2211381 . ПМИД 17905609 .
- ^ Пандур Э., Надь Дж., Пур В.С., Сарньяи А., Хусар А., Мисета А., Сипос К. (апрель 2009 г.). «Альфа-1-антитрипсин связывает препрогепсидин внутриклеточно и прогепсидин в сыворотке» . Журнал ФЭБС . 276 (7): 2012–2021. дои : 10.1111/j.1742-4658.2009.06937.x . ПМИД 19292870 . S2CID 28974553 .
- ^ PDB : 3H0T ; Джордан Дж.Б., Поппе Л., Ханиу М., Арведсон Т., Сайед Р., Ли В. и др. (сентябрь 2009 г.). «Возврат к гепсидину, дисульфидной связи, динамике и структуре» . Журнал биологической химии . 284 (36): 24155–24167. дои : 10.1074/jbc.M109.017764 . ПМК 2782009 . ПМИД 19553669 .
- ^ Росси Э. (август 2005 г.). «Гепцидин — гормон, регулирующий железо» . Клинический биохимик. Отзывы . 26 (3): 47–49. ПМК 1240030 . ПМИД 16450011 .
- ^ Гулек С., Андерсон Г.Дж., Коллинз Дж.Ф. (август 2014 г.). «Механистические и регуляторные аспекты всасывания железа в кишечнике» . Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени . 307 (4): G397–G409. дои : 10.1152/ajpgi.00348.2013 . ПМК 4137115 . ПМИД 24994858 .
- ^ Ашемейер С., Цяо Б., Стефанова Д., Валоре Е.В., Сек А.С., Руве Т.А. и др. (февраль 2018 г.). «Структурно-функциональный анализ ферропортина определяет место связывания и альтернативный механизм действия гепсидина» . Кровь . 131 (8): 899–910. doi : 10.1182/blood-2017-05-786590 . ПМЦ 5824336 . ПМИД 29237594 .
- ^ Немет Э., Ганц Т. (июнь 2021 г.). «Взаимодействие гепсидина и ферропортина контролирует системный гомеостаз железа» . Международный журнал молекулярных наук . 22 (12): 6493. doi : 10.3390/ijms22126493 . ПМЦ 8235187 . ПМИД 34204327 .
- ^ Эшби Д.Р., Гейл Д.П., Басбридж М., Мерфи К.Г., Дункан Н.Д., Кэрнс Т.Д. и др. (май 2009 г.). «Уровни гепсидина в плазме повышены, но реагируют на терапию эритропоэтином при заболевании почек» . Почки Интернешнл . 75 (9): 976–981. дои : 10.1038/ki.2009.21 . ПМИД 19212416 .
- ^ Core AB, Canali S, Babitt JL (2014). «Передача сигналов гемоювелина и костного морфогенетического белка (BMP) в гомеостазе железа» . Границы в фармакологии . 5 : 104. дои : 10.3389/fphar.2014.00104 . ПМК 4026703 . ПМИД 24860505 .
- ^ Железодефицитная анемия: новые идеи для работников здравоохранения: издание 2011 г. ООО «Скалярли Медиа». Декабрь 2012 г. ISBN . 978-1-4649-8960-5 .
- ^ Jump up to: а б «Гепцидин Р81172» . ЮниПрот . 15 декабря 1998 г.
- ^ Чжао Н., Чжан А.С., Энс, Калифорния (июнь 2013 г.). «Регуляция железа гепсидином» . Журнал клинических исследований . 123 (6): 2337–2343. дои : 10.1172/JCI67225 . ПМЦ 3668831 . ПМИД 23722909 .
- ^ Jump up to: а б с Риши Г., Уоллес Д.Ф., Субраманиам В.Н. (март 2015 г.). «Гепцидин: регуляция главного регулятора железа» . Отчеты по биологическим наукам . 35 (3). дои : 10.1042/bsr20150014 . ПМЦ 4438303 . ПМИД 26182354 .
- ^ Абуга К.М., Муриуки Дж.М., Уйога С.М., Мваи К., Макале Дж., Могире Р.М. и др. (июль 2022 г.). «Регуляция гепсидина у кенийских детей с тяжелой малярией и нетифоидной сальмонеллезной бактериемией» . Гематологическая . 107 (7): 1589–1598. дои : 10.3324/haematol.2021.279316 . ПМЦ 9244826 . ПМИД 34498446 . S2CID 237454351 .
- ^ Кури М.Дж. «Эритроферрон: недостающее звено в регуляции железа» . Гематолог . Американское общество гематологии. Архивировано из оригинала 28 января 2019 года . Проверено 26 августа 2015 г.
- ^ Каутц Л., Юнг Г., Валоре Э.В., Ривелла С., Немет Э., Ганц Т. (июль 2014 г.). «Идентификация эритроферрона как эритроидного регулятора обмена железа» . Природная генетика . 46 (7): 678–684. дои : 10.1038/ng.2996 . ПМК 4104984 . ПМИД 24880340 .
- ^ Баккетта Дж., Зарицкий Дж.Дж., Си Дж.Л., Чун Р.Ф., Лиссе Т.С., Завала К. и др. (март 2014 г.). «Подавление железорегулирующего гепсидина витамином D» . Журнал Американского общества нефрологов . 25 (3): 564–572. дои : 10.1681/ASN.2013040355 . ПМЦ 3935584 . ПМИД 24204002 .
- ^ Краузе А., Нейтц С., Мегерт Х.Дж., Шульц А., Форссманн В.Г., Шульц-Кнаппе П., Адерманн К. (сентябрь 2000 г.). «LEAP-1, новый человеческий пептид с высокой степенью дисульфидной связи, проявляет противомикробную активность» . Письма ФЭБС . 480 (2–3): 147–150. дои : 10.1016/S0014-5793(00)01920-7 . ПМИД 11034317 . S2CID 9161764 .
- ^ Голубь С., Ильин Г., Курсло Б., Леройер П., Терлен Б., Бриссо П., Лореаль О (март 2001 г.). «Новый ген, специфичный для печени мыши, кодирующий белок, гомологичный человеческому антимикробному пептиду гепсидину, сверхэкспрессируется во время перегрузки железом» . Журнал биологической химии . 276 (11): 7811–7819. дои : 10.1074/jbc.M008923200 . ПМИД 11113132 .
- ^ Пак Ч., Валор Э.В., Уоринг А.Дж., Ганц Т. (март 2001 г.). «Гепцидин, антимикробный пептид мочи, синтезируемый в печени» . Журнал биологической химии . 276 (11): 7806–7810. дои : 10.1074/jbc.M008922200 . ПМИД 11113131 .
- ^ Бекри С., Гуал П., Анти Р., Лучани Н., Дахман М., Рамеш Б. и др. (сентябрь 2006 г.). «Повышенная экспрессия гепсидина в жировой ткани при тяжелом ожирении не зависит от диабета и НАСГ» . Гастроэнтерология . 131 (3): 788–796. дои : 10.1053/j.gastro.2006.07.007 . ПМИД 16952548 .
- ^ Кемна Э.Х., Тьялсма Х., Виллемс Х.Л., Свинкелс Д.В. (январь 2008 г.). «Гепцидин: от открытия к дифференциальной диагностике» . Гематологическая . 93 (1): 90–97. дои : 10.3324/гематол.11705 . hdl : 2066/70062 . ПМИД 18166790 .
- ^ Брегман Д.Б., Моррис Д., Кох Т.А., Хе А., Гудноф Л.Т. (февраль 2013 г.). «Уровни гепсидина предсказывают отсутствие реакции на пероральную терапию железом у пациентов с железодефицитной анемией» . Американский журнал гематологии . 88 (2): 97–101. дои : 10.1002/ajh.23354 . ПМИД 23335357 . S2CID 42656065 .
- ^ Гарденги С., Рамос П., Маронгиу М.Ф., Мельчиори Л., Бреда Л., Гай Э. и др. (декабрь 2010 г.). «Гепцидин как терапевтический инструмент для ограничения перегрузки железом и улучшения анемии у мышей с β-талассемией» . Журнал клинических исследований . 120 (12): 4466–4477. дои : 10.1172/JCI41717 . ПМЦ 2993583 . ПМИД 21099112 .
- ^ Крут Дж.Дж., Тьялсма Х., Флеминг Р.Э., Свинкелс Д.В. (декабрь 2011 г.). «Гепцидин при заболеваниях железа у человека: диагностические значения» . Клиническая химия . 57 (12): 1650–1669. дои : 10.1373/clinchem.2009.140053 . hdl : 2066/97956 . ПМИД 21989113 .
- ^ Jump up to: а б Моура И.С., Эрмин О. (октябрь 2015 г.). «Эритроферрон: недостающее звено в β-талассемии?» . Кровь . 126 (17): 1974–1975. дои : 10.1182/blood-2015-09-665596 . ПМИД 26494918 .
Дальнейшее чтение
[ редактировать ]- Камашелла С (декабрь 2005 г.). «Понимание гомеостаза железа посредством генетического анализа гемохроматоза и связанных с ним нарушений» . Кровь . 106 (12): 3710–3717. дои : 10.1182/кровь-2005-05-1857 . ПМИД 16030190 .
Внешние ссылки
[ редактировать ]- гепсидин в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Intrinsic LifeSciences - Исследовательский центр гепсидина, компания BioIron
- Hepcidinanaлиз.com - Сервис для измерения гепсидина: научные исследования, пациенты и клинические испытания
- Страница банка данных по белкам
- пептидный магазин
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для гепсидина человека.