Цинк
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цинк | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Появление | серебристо-серый | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(Zn) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цинк в таблице Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блокировать | d-блок | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Ар ] 3d 10 4 с 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 8, 18, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза в СТП | твердый | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 692,68 К (419,53 ° С, 787,15 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 1180 К (907 °С, 1665 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при 20°С) | 7,140 г/см 3 [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при температуре плавления ) | 6,57 г/см 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 7,32 кДж/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 115 кДж/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 25,470 Дж/(моль К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стадии окисления | −2, 0, +1, +2 ( амфотерный оксид) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,65. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 134 вечера | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 122±16:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 139 вечера | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие объекты недвижимости | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное явление | первобытный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | гексагональная плотноупакованная (ГПУ) ( hP2 ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Константы решетки | а = 266,46 вечера с = 494,55 вечера (при 20 ° C) [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 30.08 × 10 −6 /К (при 20 °С) [а] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 116 Вт/(м⋅К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электрическое сопротивление | 59,0 нОм⋅м (при 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | диамагнитный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная магнитная восприимчивость | −11.4 × 10 −6 см 3 /mol (298 K) [4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 108 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 43 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 70 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкого стержня | 3850 м/с (при комнатной температуре ) (в прокате) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| коэффициент Пуассона | 0.25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | 2.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 327–412 МПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-66-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие | Индийские металлурги (до 1000 г. до н. э. ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Первая изоляция | Андреас Сигизмунд Маргграф (1746) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Признан уникальным металлом | Расаратна Самуккая (1300 г.) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изотопы цинка | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Цинк — это химический элемент с символом Zn и атомным номером 30. Это слегка хрупкий металл при комнатной температуре , а после удаления окисления он имеет блестящий сероватый вид. Это первый элемент в группе 12 (IIB) таблицы Менделеева . В некоторых отношениях цинк химически подобен магнию : оба элемента имеют только одну нормальную степень окисления (+2), а Zn 2+ и мг 2+ ионы имеют одинаковый размер. [б] Цинк является 24-м по распространенности элементом в земной коре и имеет пять стабильных изотопов . Наиболее распространенной цинковой рудой является сфалерит (цинковая обманка), минерал сульфид цинка . Крупнейшие работоспособные залежи находятся в Австралии, Азии и США. Цинк очищается путем пенной флотации руды, обжига и окончательной экстракции с использованием электричества ( электродобыча ).
Цинк является важным микроэлементом для человека, [6] [7] [8] животные, [9] растения [10] и для микроорганизмов [11] и необходим для пренатального и постнатального развития. [12] Это второй по распространенности микроэлемент в организме человека после железа и единственный металл, который присутствует во всех классах ферментов . [10] [8] Цинк также является важным питательным элементом для роста кораллов, поскольку он является важным кофактором для многих ферментов. [13]
Дефицит цинка затрагивает около двух миллиардов человек в развивающихся странах и связан со многими заболеваниями. [14] У детей дефицит вызывает задержку роста, задержку полового созревания, восприимчивость к инфекциям и диарею . [12] Ферменты с атомом цинка в реактивном центре широко распространены в биохимии, например алкогольдегидрогеназа человека. [15] Потребление избытка цинка может вызвать атаксию , летаргию и дефицит меди . В морских биомах, особенно в полярных регионах, дефицит цинка может поставить под угрозу жизнеспособность первичных сообществ водорослей, потенциально дестабилизируя сложные морские трофические структуры и, следовательно, влияя на биоразнообразие. [16]
Латунь , сплав меди и цинка в различных пропорциях, использовалась еще в третьем тысячелетии до нашей эры в Эгейском регионе и регионе, который в настоящее время включает Ирак , Объединенные Арабские Эмираты , Калмыкию , Туркменистан и Грузию . Во втором тысячелетии до нашей эры его использовали в таких регионах, как Западная Индия , Узбекистан , Иран , Сирия , Ирак и Израиль . [17] [18] [19] цинк Металлический не производился в больших масштабах до XII века в Индии, хотя он был известен древним римлянам и грекам. [20] Шахты Раджастана предоставили убедительные доказательства производства цинка еще в VI веке до нашей эры. [21] Самые старые свидетельства наличия чистого цинка происходят из Завара в Раджастане еще в 9 веке нашей эры, когда для получения чистого цинка использовался процесс дистилляции. [22] Алхимики сжигали цинк на воздухе, образуя то, что они называли « философской шерстью » или «белым снегом».
Элемент, вероятно, был назван алхимиком Парацельсом в честь немецкого слова Zinke (зубец, зуб). Немецкому химику Андреасу Сигизмунду Маргграфу приписывают открытие чистого металлического цинка в 1746 году. Работы Луиджи Гальвани и Алессандро Вольта открыли электрохимические свойства цинка к 1800 году. цинкование Коррозионностойкое железа ( горячее цинкование ) является основным применением цинка. . Другие области применения — электрические батареи , небольшие неконструкционные отливки и сплавы, такие как латунь. Обычно используются различные соединения цинка, такие как карбонат и глюконат цинка (в качестве пищевых добавок), хлорид цинка (в дезодорантах), пиритион цинка (шампуни против перхоти ), сульфид цинка (в люминесцентных красках), а также диметилцинк или диэтилцинк. в органической лаборатории.
Характеристики
[ редактировать ]Физические свойства
[ редактировать ]Цинк — голубовато-белый блестящий диамагнитный металл. [23] хотя наиболее распространенные коммерческие сорта металла имеют матовую поверхность. [24] Он несколько менее плотен, чем железо , и имеет гексагональную кристаллическую структуру с искаженной формой гексагональной плотной упаковки , в которой каждый атом имеет шесть ближайших соседей (на расстоянии 265,9 пм) в своей плоскости и шесть других на большем расстоянии 290,6 пм. . [25] Металл твердый и хрупкий при большинстве температур, но становится податливым при температуре от 100 до 150 °C. [23] [24] При температуре выше 210 °C металл снова становится хрупким и его можно измельчить при избиении. [26] Цинк является хорошим проводником электричества . [23] Для металла цинк имеет относительно низкие температуры плавления (419,5 °С) и температуры кипения (907 °С). [27] Температура плавления самая низкая из всех металлов d-блока, за исключением ртути и кадмия ; по этой причине, среди прочего, цинк, кадмий и ртуть часто не считаются переходными металлами, как остальные металлы d-блока. [27]
Многие сплавы содержат цинк, в том числе латунь. Другими металлами, которые, как давно известно, образуют бинарные сплавы с цинком, являются алюминий , сурьма , висмут , золото , железо, свинец , ртуть, , олово серебро , магний , кобальт , никель , теллур и натрий . [28] Хотя ни цинк, ни цирконий не являются ферромагнитными , их сплав ZrZn
2 , демонстрирует ферромагнетизм ниже К. 35 [23]
возникновение
[ редактировать ]Цинк составляет около 75 ppm (0,0075%) земной коры , что делает его 24-м по распространенности элементом. [29] Он также составляет 312 частей на миллион в Солнечной системе, где он является 22-м по распространенности элементом. [30] Типичные фоновые концентрации цинка не превышают 1 мкг/м. 3 в атмосфере; 300 мг/кг в почве; 100 мг/кг в растительности; 20 мкг/л в пресной воде и 5 мкг/л в морской воде. [31] Этот элемент обычно встречается в рудах в сочетании с другими , такими как медь и свинец недрагоценными металлами . [32] Цинк является халькофилом , то есть этот элемент чаще всего встречается в минералах вместе с серой и другими тяжелыми халькогенами , а не с легким халькогенным кислородом или с нехалькогенными электроотрицательными элементами, такими как галогены . Сульфиды образовались в результате затвердевания коры в восстановительных условиях ранней атмосферы Земли. [33] Сфалерит , представляющий собой форму сульфида цинка, является наиболее широко добываемой цинксодержащей рудой, поскольку его концентрат содержит 60–62% цинка. [32]
Другие минералы-источники цинка включают смитсонит ( карбонат цинка ), гемиморфит ( силикат цинка ), вюрцит (еще один сульфид цинка) и иногда гидроцинцит (основной карбонат цинка ). [34] За исключением вюрцита, все остальные минералы образовались в результате выветривания первичных сульфидов цинка. [33]
Выявленные мировые ресурсы цинка составляют около 1,9–2,8 млрд тонн . [35] [36] Крупные месторождения находятся в Австралии, Канаде и США, крупнейшие запасы — в Иране . [33] [37] [38] Самая последняя оценка базы запасов цинка (соответствующей установленным минимальным физическим критериям, связанным с текущей практикой добычи и производства) была сделана в 2009 году и составила примерно 480 млн тонн. [39] Запасы цинка, с другой стороны, представляют собой геологически идентифицированные рудные тела, пригодность к извлечению которых экономически обоснована (местоположение, содержание, качество и количество) на момент определения. Поскольку разведка и разработка месторождений являются непрерывным процессом, объем запасов цинка не является фиксированным числом, и об устойчивости поставок цинковой руды нельзя судить, просто экстраполируя совокупный срок службы сегодняшних цинковых рудников. Эта концепция хорошо подтверждается данными Геологической службы США (USGS), которые показывают, что, хотя производство рафинированного цинка увеличилось на 80% в период с 1990 по 2010 год, срок службы запасов цинка остался неизменным. За всю историю до 2002 года было добыто около 346 миллионов тонн, а по оценкам ученых, используется около 109–305 миллионов тонн. [40] [41] [42]

изотопы
[ редактировать ]В природе встречаются пять стабильных изотопов цинка. 64 Zn является наиболее распространенным изотопом (49,17% естественного содержания ). [43] [44] Другие изотопы, встречающиеся в природе: 66
Цинк (27,73%), 67
Цинк (4,04%), 68
Zn (18,45%) и 70
Цинк (0,61%). [44]
несколько десятков радиоизотопов . Охарактеризовано 65
Zn , период полураспада которого составляет 243,66 дней, является наименее активным радиоизотопом, за ним следует 72
Zn с периодом полураспада 46,5 часов. [43] Цинк имеет 10 ядерных изомеров , из которых 69 м Zn имеет самый длинный период полураспада — 13,76 часа. [43] Верхний индекс m указывает на метастабильный изотоп. Ядро метастабильного изотопа находится в возбужденном состоянии и вернется в основное состояние, испуская фотон в виде гамма-излучения . 61
Zn имеет три возбужденных метастабильных состояния и 73
У Зна их два. [45] Изотопы 65
Зн , 71
Зн , 77
Цинк и 78
Каждый Zn имеет только одно возбужденное метастабильное состояние. [43]
Наиболее распространенным способом распада радиоизотопа массовым цинка с числом менее 66 является захват электрона . Продукт распада в результате захвата электронов представляет собой изотоп меди. [43]
- н
30 Зн
+
и −
→ н
29 у.е.
Наиболее распространенным типом распада радиоизотопа цинка с массовым числом более 66 является бета-распад (β − ), который производит изотоп галлия . [43]
Соединения и химия
[ редактировать ]Реактивность
[ редактировать ]Цинк имеет электронную конфигурацию [Ar]3d. 10 4 с 2 и является членом 12 группы периодической таблицы . Это умеренно активный металл и сильный восстановитель . [46] Поверхность чистого металла быстро тускнеет , со временем образуя защитный пассивирующий слой основного цинка карбоната Zn.
5 (О)
6 ( СО3 )
2 , по реакции с атмосферным углекислым газом . [47]
Цинк горит на воздухе ярким голубовато-зеленым пламенем, выделяя пары оксида цинка . [48] Цинк легко реагирует с кислотами , щелочами и другими неметаллами. [49] очень медленно . Чрезвычайно чистый цинк при комнатной температуре реагирует с кислотами [48] Сильные кислоты, такие как соляная или серная кислота , могут удалить пассивирующий слой, и в результате последующей реакции с кислотой выделяется газообразный водород. [48]
В химии цинка преобладает степень окисления +2. При образовании соединений в этой степени окисления электроны внешней теряются оболочки , в результате чего образуется голый ион цинка с электронной конфигурацией [Ar]3d. 10 . [50] В водном растворе октаэдрический комплекс [Zn(H
2О ) 6 ] 2+
является преобладающим видом. [51] Испарение . цинка в сочетании с хлоридом цинка при температуре выше 285 °С указывает на образование Zn
2 кл.
2 , соединение цинка со степенью окисления +1. [48] Никакие соединения цинка в положительных степенях окисления, кроме +1 или +2, не известны. [52] Расчеты показывают, что соединение цинка со степенью окисления +4 маловероятно. [53] Предполагается, что Zn(III) существует в присутствии сильно электроотрицательных трианионов; [54] однако существуют некоторые сомнения относительно этой возможности. [55] Но в 2021 году было сообщено о другом соединении с большим количеством доказательств, которое имело степень окисления +3 с формулой ZnBeB 11 (CN) 12 . [56]
Химия цинка аналогична химии поздних переходных металлов первого ряда, никеля и меди, хотя он имеет заполненную d-оболочку, а соединения диамагнитны и в основном бесцветны. [57] Ионные радиусы цинка и магния почти одинаковы. Из-за этого некоторые из эквивалентных солей имеют одинаковую кристаллическую структуру . [58] а в других обстоятельствах, когда ионный радиус является определяющим фактором, химический состав цинка имеет много общего с химическим составом магния. [48] В остальном сходства с поздними переходными металлами первого ряда мало. Цинк склонен образовывать связи с большей степенью ковалентности и гораздо более устойчивые комплексы с N- и S -донорами. [57] Комплексы цинка преимущественно 4- или 6- координатные , хотя известны и 5-координатные. [48]
Соединения цинка(I)
[ редактировать ]Соединения цинка(I) встречаются очень редко. [Zn 2 ] 2+ Ион участвует в образовании желтого диамагнитного стекла при растворении металлического цинка в расплавленном ZnCl 2 . [59] [Zn 2 ] 2+ ядро будет аналогично [Hg 2 ] 2+ катион присутствует в соединениях ртути (I). Диамагнитная . природа иона подтверждает его димерную структуру Первое соединение цинка(I), содержащее связь Zn–Zn, (η 5 -C 5 Me 5 ) 2 Zn 2 .
Соединения цинка(II)
[ редактировать ]
3 СО
2 )
2

Бинарные соединения цинка известны для большинства металлоидов и всех неметаллов , кроме благородных газов . Оксид ZnO представляет собой белый порошок, почти нерастворимый в нейтральных водных растворах, но амфотерный , растворяющийся как в сильноосновных, так и в кислых растворах. [48] Другие халькогениды ( ZnS , ZnSe и ZnTe ) имеют разнообразное применение в электронике и оптике. [60] Пниктогениды ( Zn
3 Н
2 , Цинк
33П
2 , Цинк
3 Как
2 и цинк
33Сб
2 ), [61] [62] перекись ( ZnO
2 ), гидрид ( ZnH
2 ) и карбид ( ZnC
2 ) также известны. [63] четырех галогенидов ZnF Из
2 имеет наиболее ионный характер, а остальные ( ZnCl
2 , ZnBr
2 и ЗнИ
2 ) имеют относительно низкие температуры плавления и считаются более ковалентными. [64]
В слабых основных растворах, содержащих Zn 2+
ионы, гидроксид Zn(OH)
2 образуется в виде белого осадка . В более сильнощелочных растворах этот гидроксид растворяется с образованием цинкатов ( [Zn(OH) 4 ] 2−
). [48] Нитрат Zn(NO 3 )
2 , хлорат Zn(ClO 3 )
2 , сульфат ZnSO
4 , фосфат Zn
3 (ПО 4 )
2 , молибдат ZnMoO
4 , цианид Zn(CN)
2 , арсенит Zn(AsO 2 )
2 , арсенат Zn(AsO 4 )
2 8Ч
2 O и хромат ZnCrO
4 (одно из немногих цветных соединений цинка) являются несколькими примерами других распространенных неорганических соединений цинка. [65] [66]
Цинкорганические соединения – это соединения, содержащие цинк– углерод ковалентные связи . Диэтилцинк ( (C
2 Ч 5 )
2 Zn ) — реагент в синтетической химии. Впервые о нем сообщили в 1848 году в результате реакции цинка и этилиодида , и это было первое известное соединение, содержащее сигма-связь металл-углерод . [67]
Тест на цинк
[ редактировать ]Кобальтицианидная бумага (тест Риннмана на цинк) может использоваться в качестве химического индикатора цинка. 4 г K 3 Co(CN) 6 и 1 г KClO 3 растворяют в 100 мл воды. Бумагу погружают в раствор и сушат при температуре 100°С. Одну каплю образца капают на сухую бумагу и нагревают. Зеленый диск указывает на наличие цинка. [68]
История
[ редактировать ]Древнее использование
[ редактировать ]Были обнаружены различные единичные примеры использования нечистого цинка в древности. Цинковые руды использовались для изготовления латуни из сплава цинка и меди за тысячи лет до открытия цинка как отдельного элемента. Иудейская латунь XIV-X веков до нашей эры содержит 23% цинка. [18]
Знания о том, как производить латунь, распространились в Древнюю Грецию к VII веку до нашей эры, но ее разновидностей было создано мало. [19] украшения из сплавов , содержащих 80–90% цинка, остальную часть составляют свинец, железо, сурьма и другие металлы, возраст которых составляет 2500 лет. Были обнаружены [32] Возможно, доисторическая статуэтка, содержащая 87,5% цинка, была найдена на археологическом участке Дака . [69]
Страбон , писавший в I веке до нашей эры (но цитируя ныне утерянную работу историка Теопомпа, жившего в IV веке до нашей эры ), упоминает «капли ложного серебра», которые при смешивании с медью образуют латунь. Это может относиться к небольшим количествам цинка, который является побочным продуктом плавки сульфидных руд. [70] Цинк в таких остатках в плавильных печах обычно выбрасывали, поскольку считали его бесполезным. [71]
Производство латуни было известно римлянам примерно к 30 г. до н.э. [72] Они изготавливали латунь, нагревая в тигле порошкообразный каламин ( силикат или карбонат цинка), древесный уголь и медь. [72] Полученную каламиновую латунь затем отливали или заковывали в форму для использования в оружии. [73] Некоторые монеты, отчеканенные римлянами в христианскую эпоху, изготовлены, вероятно, из каламиновой латуни. [74]

Самые старые известные таблетки были изготовлены из карбонатов цинка, гидроцинцита и смитсонита. Таблетки применялись от боли в глазах и были найдены на борту римского корабля «Релитто дель Поццино» , потерпевшего крушение в 140 году до нашей эры. [75] [76]
Бернская цинковая табличка — это вотивная табличка времен Римской Галлии, изготовленная из сплава, состоящего в основном из цинка. [77]
Чарака -самхита , предположительно, была написана между 300 и 500 годами нашей эры. [78] упоминается металл, который при окислении образует пушпанджан , предположительно оксид цинка. [79] Цинковые рудники в Заваре, недалеко от Удайпура в Индии, действовали со времен Маурьев ( ок. 322 и 187 гг. до н. э.). Однако выплавка металлического цинка здесь, по-видимому, началась примерно в 12 веке нашей эры. [80] [81] По одной из оценок, в этом месте с XII по XVI века производилось около миллиона тонн металлического цинка и оксида цинка. [34] По другой оценке, общий объем производства металлического цинка за этот период составит 60 000 тонн. [80] В « Расаратна Самуккая» , написанной примерно в 13 веке нашей эры, упоминаются два типа цинксодержащих руд: один используется для добычи металлов, а другой — в лечебных целях. [81]
Ранние исследования и именование
[ редактировать ]Цинк был четко признан как металл под обозначением Ясада или Джасада в медицинском лексиконе, приписываемом индуистскому королю Маданапале (из династии Така) и написанном около 1374 года. [82] Плавка и извлечение нечистого цинка путем восстановления каламина шерстью и другими органическими веществами была осуществлена в 13 веке в Индии. [23] [83] Китайцы узнали об этой технике только в 17 веке. [83]

Алхимики сжигали металлический цинк на воздухе и собирали полученный оксид цинка на конденсаторе . Некоторые алхимики называли этот оксид цинка lana philosophica , что по латыни означает «философская шерсть», потому что он собирался в шерстяные пучки, тогда как другие считали, что он похож на белый снег, и называли его nix album . [84]
Название металла, вероятно, было впервые задокументировано Парацельсом , немецким алхимиком швейцарского происхождения, который называл этот металл «цинком» или «цинкеном» в своей книге « Liber Mineralium II » в 16 веке. [83] [85] Слово, вероятно, происходит от немецкого zinke и предположительно означает «зубчатый, заостренный или зазубренный» (металлические кристаллы цинка имеют игольчатый вид). [86] Цинк также может означать «похожий на олово» из-за его родства с немецким zinn, означающим олово. [87] Еще одна возможность заключается в том, что это слово происходит от персидского слова سنگ seng, что означает камень. [88] Металл также называли индийским оловом , тутанего , каламином , прядильным . [32]
Немецкий металлург Андреас Либавиус получил некоторое количество того, что он назвал «калай» (от малайского или хинди слова, обозначающего олово), происходящего из Малабара с грузового корабля, захваченного у португальцев в 1596 году. [89] Либавиус описал свойства образца, которым мог быть цинк. Цинк регулярно импортировался в Европу с Востока в 17 и начале 18 веков. [83] но иногда было очень дорого. [с]
Изоляция
[ редактировать ]
Металлический цинк был выделен в Индии к 1300 году нашей эры. [90] [91] [92] Прежде чем он был изолирован в Европе, он был импортирован из Индии примерно в 1600 году нашей эры. [93] Постлуэйта В «Универсальном словаре» , современном источнике технологической информации в Европе, цинк не упоминался до 1751 года, но этот элемент изучался и раньше. [81] [94]
Фламандский металлург и алхимик П. М. де Респур сообщил, что в 1668 году он извлек металлический цинк из оксида цинка. [34] К началу XVIII века Этьен Франсуа Жоффруа описал, как оксид цинка конденсируется в виде желтых кристаллов на железных слитках, помещенных над плавкой цинковой руды. [34] Говорят , что в Великобритании Джон Лейн проводил эксперименты по выплавке цинка, вероятно, в Ландоре , до своего банкротства в 1726 году. [95]
В 1738 году в Великобритании Уильям Чемпион запатентовал процесс извлечения цинка из каламина в плавильной печи с вертикальной ретортой . [96] Его техника напоминала ту, что использовалась на цинковых рудниках Завар в Раджастхане , но нет никаких доказательств того, что он посещал Восток. [93] Процесс Чемпиона использовался до 1851 года. [83]
Немецкому химику Андреасу Маргграфу обычно приписывают выделение чистого металлического цинка на Западе, хотя шведский химик Антон фон Сваб четыре года назад перегнал цинк из каламина. [83] В своем эксперименте 1746 года Маргграф нагрел смесь каламина и древесного угля в закрытом сосуде без меди, чтобы получить металл. [97] [71] Эта процедура стала коммерчески практичной к 1752 году. [98]
Более поздняя работа
[ редактировать ]
Брат Уильяма Чемпиона, Джон, в 1758 году запатентовал процесс обжига сульфида цинка до оксида, пригодного для использования в автоклаве. [32] До этого для производства цинка можно было использовать только каламин. В 1798 году Иоганн Кристиан Руберг усовершенствовал процесс плавки, построив первую горизонтальную ретортную печь. [99] Жан-Жак Даниэль Дони построил в Бельгии горизонтальный цинковый завод другого типа, который перерабатывал еще больше цинка. [83] В 1780 году итальянский врач Луиджи Гальвани обнаружил, что соединение спинного мозга только что препарированной лягушки с железной перекладиной, прикрепленной латунным крючком, вызывает подергивание лапки лягушки. [100] Он ошибочно полагал, что открыл способность нервов и мышц создавать электричество , и назвал этот эффект « животным электричеством ». [101] Гальванический элемент и процесс гальванизации были названы в честь Луиджи Гальвани, и его открытия проложили путь к электрическим батареям , гальванизации и катодной защите . [101]
Друг Гальвани, Алессандро Вольта , продолжил исследование этого эффекта и в 1800 году изобрел Вольтов столб . [100] Кучка Вольты состояла из стопки упрощенных гальванических элементов , каждая из которых представляла собой одну пластину из меди и одну из цинка, соединенных электролитом . При последовательном соединении этих блоков гальваническая батарея (или «батарея») в целом имела более высокое напряжение, и ее можно было использовать легче, чем отдельные элементы. Электричество вырабатывается потому, что потенциал Вольта между двумя металлическими пластинами заставляет электроны течь из цинка в медь и разъедать цинк. [100]
Немагнитный характер цинка и отсутствие цвета в растворе задержали открытие его важности для биохимии и питания. [102] Ситуация изменилась в 1940 году, когда было обнаружено, что карбоангидраза , фермент, очищающий кровь от углекислого газа, содержит цинк в активном центре . [102] Пищеварительный фермент карбоксипептидаза стал вторым известным цинксодержащим ферментом в 1955 году. [102]
Производство
[ редактировать ]Добыча и переработка
[ редактировать ]| Классифицировать | Страна | Тонны |
|---|---|---|
| 1 | Китай | 4,210,000 |
| 2 | Перу | 1,400,000 |
| 3 | Австралия | 1,330,000 |
| 5 | Соединенные Штаты | 753,000 |
| 4 | Индия | 720,000 |
| 6 | Мексика | 677,000 |


27 ° 57'17 "N 016 ° 46'00" E / 27,95472 ° N 16,76667 ° E

27°49′09″S 016°36′28″E / 27.81917°S 16.60778°E
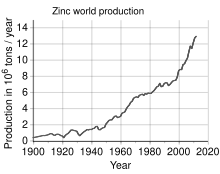
Цинк является четвертым по распространенности используемым металлом, уступая только железу , алюминию и меди , годовой объем производства которого составляет около 13 миллионов тонн. [35] Крупнейшим в мире производителем цинка является компания Nyrstar , образовавшаяся в результате слияния австралийской OZ Minerals и бельгийской Umicore . [104] Около 70% цинка в мире производится в результате добычи полезных ископаемых, а остальные 30% — в результате переработки вторичного цинка. [105]
Коммерчески чистый цинк известен как Special High Grade, часто сокращенно SHG , и имеет чистоту 99,995%. [106]
Во всем мире 95% нового цинка добывается из месторождений сульфидных руд, в которых сфалерит (ZnS) почти всегда смешан с сульфидами меди, свинца и железа. [107] : 6 Цинковые рудники разбросаны по всему миру, основные районы — Китай, Австралия и Перу. В 2014 году Китай произвел 38% мирового производства цинка. [35]
Цинк металлический производят с помощью добывающей металлургии . [108] : 7 Руду тонко измельчают, затем подвергают пенной флотации для отделения минералов от пустой породы (по свойству гидрофобности ) и получения концентрата сульфидной цинковой руды. [108] : 16 состоит примерно из 50% цинка, 32% серы, 13% железа и 5% SiO.
2 . [108] : 16
Обжиг превращает концентрат сульфида цинка в оксид цинка: [107]
Диоксид серы используется для производства серной кислоты, необходимой для процесса выщелачивания. месторождения карбоната цинка , силиката цинка или цинк-шпинелида (например, месторождение Скорпион в Намибии ), то обжиг можно не проводить. Если для производства цинка используются [109]
Для дальнейшей переработки используются два основных метода: пирометаллургия или электролиз . Пирометаллургия восстанавливает оксид цинка углеродом или монооксидом углерода при 950 ° C (1740 ° F) до металла, который перегоняется в виде паров цинка, чтобы отделить его от других металлов, которые не летучие при этих температурах. [110] Пары цинка собираются в конденсаторе. [107] Уравнения ниже описывают этот процесс: [107]
При электролизе цинк выщелачивается из рудного концентрата серной кислотой и осаждаются примеси: [111]
Наконец, цинк восстанавливается электролизом . [107]
Серная кислота регенерируется и возвращается на стадию выщелачивания.
Когда оцинкованное сырье подается в электродуговую печь , цинк извлекается из пыли с помощью ряда процессов, преимущественно вельц-процесса (90% по состоянию на 2014 год). [112]
Воздействие на окружающую среду
[ редактировать ]При переработке сульфидных цинковых руд образуются большие объемы диоксида серы и кадмия паров . Металлургический шлак и другие отходы содержат значительное количество металлов. в бельгийских городах Ла-Каламин и Пломбьер было добыто и выплавлено около 1,1 миллиона тонн металлического цинка и 130 тысяч тонн свинца. С 1806 по 1882 год [113] Отвалы прошлых горных работ выщелачивают цинк и кадмий, а отложения реки Гёль содержат нетривиальные количества металлов. [113] Около двух тысяч лет назад выбросы цинка при добыче и плавке металла составляли 10 тысяч тонн в год. После увеличения в 10 раз по сравнению с 1850 годом выбросы цинка достигли пика в 3,4 миллиона тонн в год в 1980-х годах и снизились до 2,7 миллиона тонн в 1990-х годах, хотя исследование арктической тропосферы в 2005 году показало, что концентрации там не отражают снижения. Техногенные и естественные выбросы происходят в соотношении 20 к 1. [10]
Содержание цинка в реках, протекающих через промышленные и горнодобывающие районы, может достигать 20 частей на миллион. [114] Эффективная очистка сточных вод значительно снижает это явление; обработка вдоль Рейна , например, привела к снижению уровня цинка до 50 частей на миллиард. [114] Концентрация цинка всего в 2 ppm отрицательно влияет на количество кислорода, которое рыбы могут переносить в крови. [115]
Почвы, загрязненные цинком в результате добычи, переработки или внесения цинксодержащих осадков, могут содержать несколько граммов цинка на килограмм сухой почвы. Уровни цинка, превышающие 500 частей на миллион в почве, мешают растениям поглощать другие важные металлы , такие как железо и марганец . В некоторых образцах почвы были зафиксированы уровни цинка от 2000 до 180 000 частей на миллион (18%). [114]
Приложения
[ редактировать ]Основные области применения цинка включают, с процентами, указанными для США. [118]
- Цинкование (55%)
- Латунь и бронза (16%)
- Другие сплавы (21%)
- Разное (8%)
Антикоррозия и аккумуляторы
[ редактировать ]

Цинк чаще всего используется в качестве антикоррозионного агента . [119] и гальванизация (покрытие железа или стали ) является наиболее распространенной формой. В 2009 году в США для гальванизации было использовано 55% или 893 000 тонн металлического цинка. [118]
Цинк более реакционноспособен, чем железо или сталь, и поэтому будет притягивать почти все местные окисления, пока не полностью корродирует. [120] Защитный поверхностный слой из оксида и карбоната ( Zn
5 (О)
6 (КО
3 )
2 ) образуется при коррозии цинка. [121] Эта защита сохраняется даже после того, как слой цинка поцарапается, но со временем ухудшается по мере коррозии цинка. [121] Цинк наносится электрохимически или в виде расплавленного цинка путем горячего цинкования или распыления. Гальванизация применяется при изготовлении сетчатых ограждений, ограждений, подвесных мостов, фонарных столбов, металлических крыш, теплообменников и кузовов автомобилей. [122]
Относительная реакционная способность цинка и его способность притягивать к себе окисление делают его эффективным жертвенным анодом в катодной защите (CP). Например, катодную защиту заглубленного трубопровода можно обеспечить, подключив к трубе аноды из цинка. [121] Цинк действует как анод (отрицательный конец), медленно разъедая при прохождении электрического тока по стальному трубопроводу. [121] [д] Цинк также используется для катодной защиты металлов, подвергающихся воздействию морской воды. [123] Цинковый диск, прикрепленный к железному рулю корабля, будет медленно корродировать, пока руль останется целым. [120] Аналогичным образом временную защиту обеспечивает цинковая заглушка, прикрепленная к гребному винту, или металлическое защитное ограждение киля корабля.
При стандартном электродном потенциале (SEP) -0,76 В цинк используется в качестве анодного материала для батарей. (Более реактивный литий (SEP -3,04 В) используется для анодов в литиевых батареях ). Порошок цинка используется таким образом в щелочных батареях , а корпус (который также служит анодом) цинк-угольных батарей изготавливается из листового цинка. [124] [125] Цинк используется в качестве анода или топлива воздушно-цинковой батареи /топливного элемента. [126] [127] [128] окислительно-восстановительной батарее цинк-цериевой В проточной также используется отрицательный полуэлемент на основе цинка. [129]
Сплавы
[ редактировать ]Широко используемым цинковым сплавом является латунь, в которой медь легирована от 3% до 45% цинка, в зависимости от типа латуни. [121] Латунь, как правило, более пластична и прочна, чем медь, и обладает превосходной коррозионной стойкостью . [121] Эти свойства делают его полезным в коммуникационном оборудовании, оборудовании, музыкальных инструментах и водяных клапанах. [121]

Другие широко используемые сплавы цинка включают нейзильбер , металл пишущей машинки, мягкий и алюминиевый припой , а также техническую бронзу . [23] Цинк также используется в современных органах в качестве заменителя традиционного сплава свинца и олова в трубках. [130] Сплавы 85–88 % цинка, 4–10 % меди и 2–8 % алюминия находят ограниченное применение в некоторых типах машинных подшипников. Цинк является основным металлом в американских одноцентовых монетах (пенни) с 1982 года. [131] Цинковая сердцевина покрыта тонким слоем меди, что придает ей вид медной монеты. В 1994 году 33 200 тонн (36 600 коротких тонн) цинка было использовано для производства 13,6 миллиардов пенни в Соединенных Штатах. [132]
Сплавы цинка с небольшим количеством меди, алюминия и магния полезны при литье под давлением, а также центробежном литье , особенно в автомобильной, электротехнической и аппаратной промышленности. [23] Эти сплавы продаются под названием Zamak . [133] Примером этого является цинк-алюминий . Низкая температура плавления в сочетании с низкой вязкостью сплава делает возможным производство небольших и сложных форм. Низкая рабочая температура приводит к быстрому охлаждению отлитых изделий и быстрой подготовке к сборке. [23] [134] Другой сплав, продаваемый под торговой маркой Prestal, содержит 78% цинка и 22% алюминия. Сообщается, что он почти такой же прочный, как сталь, но такой же податливый, как пластик. [23] [135] Такая сверхпластичность сплава позволяет формовать его с помощью литья под давлением из керамики и цемента. [23]
Подобные сплавы с добавлением небольшого количества свинца можно подвергать холодной прокатке в листы. Сплав, состоящий из 96% цинка и 4% алюминия, используется для изготовления штампов для мелкосерийного производства, для которых штампы из черных металлов были бы слишком дорогими. [136] Для фасадов зданий, кровли и других применений листового металла, полученного методом глубокой вытяжки , профилирования или гибки сплавы цинка с титаном и медью. , используются [137] Нелегированный цинк слишком хрупок для этих производственных процессов. [137]
Как плотный, недорогой и легко обрабатываемый материал, цинк используется в качестве заменителя свинца . В связи с проблемой свинца цинк появляется в гирях для различных применений, начиная от рыбалки и заканчивая рыбной ловлей. [138] для балансировки шин и маховиков. [139]
Теллурид кадмия-цинка (CZT) представляет собой полупроводниковый сплав, который можно разделить на множество небольших сенсорных устройств. [140] Эти устройства похожи на интегральную схему и могут определять энергию входящих гамма- фотонов. [140] Находясь за поглощающей маской, массив датчиков CZT может определять направление лучей. [140]
Другое промышленное использование
[ редактировать ]
Примерно четверть всего производства цинка в США в 2009 году потреблялась в виде соединений цинка; [118] многие из них используются в промышленности. Оксид цинка широко используется в качестве белого пигмента в красках и в качестве катализатора при производстве резины для рассеивания тепла. Оксид цинка используется для защиты резиновых полимеров и пластмасс от ультрафиолетового излучения (УФ). [122] Полупроводниковые варисторах свойства оксида цинка делают его полезным в и фотокопировальных устройствах. [141] Цикл цинк-оксид цинка представляет собой двухэтапный термохимический процесс, основанный на использовании цинка и оксида цинка для производства водорода . [142]
Хлорид цинка часто добавляют в пиломатериалы в качестве антипирена. [143] а иногда и в качестве консерванта для древесины . [144] Его используют при производстве других химикатов. [143] Цинк метил ( Zn(CH 3 )
2 ) используется в ряде органических синтезов . [145] Сульфид цинка (ZnS) используется в люминесцентных пигментах, таких как стрелки часов, рентгеновские и телевизионные экраны, а также в светящихся красках . [146] Кристаллы ZnS используются в лазерах , работающих в средней инфракрасной части спектра. [147] Сульфат цинка входит в состав красителей и пигментов. [143] Цинк-пиритион используется в необрастающих красках. [148]
Цинковый порошок иногда используется в качестве топлива в моделях ракет . [149] При воспламенении сжатой смеси порошка из 70% цинка и 30% серы происходит бурная химическая реакция. [149] При этом образуется сульфид цинка вместе с большим количеством горячего газа, тепла и света. [149]
Листовой цинк используется в качестве прочного покрытия для крыш, стен и столешниц, последнее часто встречается в бистро и устричных барах , и известен своим деревенским видом, придаваемым окислением его поверхности при использовании до сине-серой патины и восприимчивостью к царапая. [150] [151] [152] [153]
64
Zn , наиболее распространенный изотоп цинка, очень восприимчив к нейтронной активации , превращаясь в высокорадиоактивный элемент. 65
Zn , который имеет период полураспада 244 дня и производит интенсивное гамма-излучение . Из-за этого оксид цинка, используемый в ядерных реакторах в качестве антикоррозионного средства, обеднен 64
Zn перед использованием называется обедненным оксидом цинка . По той же причине цинк был предложен в качестве посола для ядерного оружия ( кобальт – еще один, более известный посол). [154] Куртка из изотопно-обогащенного 64
Zn будет облучен интенсивным потоком нейтронов высокой энергии от взрыва термоядерного оружия, образуя большое количество 65
Zn оружия значительно увеличивает радиоактивность осадков . [154] Неизвестно, было ли когда-либо создано, испытано или использовано такое оружие. [154]
65
Zn используется в качестве индикатора для изучения того, как изнашиваются сплавы, содержащие цинк, или пути и роли цинка в организмах. [155]
Комплексы дитиокарбамата цинка применяют в качестве сельскохозяйственных фунгицидов ; к ним относятся Зинеб , Метирам, Пропинеб и Зирам. [156] Нафтенат цинка используется в качестве консерванта древесины. [157] Цинк в форме ZDDP используется в качестве противоизносной присадки металлических деталей в моторном масле. [158]
Органическая химия
[ редактировать ]
Цинкорганическая химия — это наука о соединениях, содержащих связи углерод-цинк, описывающая физические свойства, синтез и химические реакции. Многие цинкорганические соединения имеют коммерческое значение. [160] [161] [162] [163] Среди важных приложений:
- Реакция Франкланда-Дуппы, в которой оксалата эфир (ROCOCOOR) реагирует с алкилгалогенидом R'X, цинком и соляной кислотой с образованием сложных эфиров α-гидроксикарбоновых кислот RR'COHCOOR. [164] [165]
- Цинкорганические соединения обладают такой же реакционной способностью, что и реактивы Гриньяра , но гораздо менее нуклеофильны, дороги и сложны в обращении. Цинкорганические соединения обычно осуществляют нуклеофильное присоединение к электрофилам, таким как альдегиды , которые затем восстанавливаются до спиртов . Коммерчески доступные диорганоцинковые соединения включают диметилцинк , диэтилцинк и дифенилцинк. Как и реактивы Гриньяра, цинкорганические соединения обычно производятся из броморганических предшественников.
Цинк нашел множество применений в катализе органического синтеза, включая энантиоселективный синтез , будучи дешевой и легкодоступной альтернативой комплексам драгоценных металлов. Количественные результаты (выход и энантиомерный избыток ), полученные с использованием хиральных цинковых катализаторов, могут быть сопоставимы с результатами, полученными с палладием, рутением, иридием и другими. [166]
Пищевая добавка
[ редактировать ]

добавок, отпускаемых без рецепта В большинстве витаминных и минеральных , цинк содержится в таких формах, как оксид цинка , ацетат цинка , глюконат цинка или хелат аминокислоты цинка. [167] [168]
Как правило, добавки цинка рекомендуются там, где существует высокий риск дефицита цинка (например, в странах с низким и средним уровнем дохода) в качестве профилактической меры. [169] Хотя сульфат цинка является широко используемой формой цинка, цитрат, глюконат и пиколинат цинка также могут быть приемлемыми вариантами. Эти формы усваиваются лучше, чем оксид цинка. [170]
Гастроэнтерит
[ редактировать ]Цинк является недорогим и эффективным средством лечения диареи у детей в развивающихся странах. Цинк в организме истощается во время диареи, и пополнение запасов цинка в течение 10–14-дневного курса лечения может уменьшить продолжительность и тяжесть эпизодов диареи, а также предотвратить будущие эпизоды на срок до трех месяцев. [171] Гастроэнтерит сильно ослабляется при приеме внутрь цинка, возможно, за счет прямого антимикробного действия ионов в желудочно-кишечном тракте , или за счет абсорбции цинка и его повторного высвобождения из иммунных клеток (все гранулоциты секретируют цинк), или того и другого. [172] [173]
Простуда
[ редактировать ]Добавки цинка (часто ацетата цинка или глюконата цинка таблетки для рассасывания ) представляют собой группу пищевых добавок , которые обычно используются при лечении простуды . [174] Доказательства какой-либо пользы слабы, но кажется, что цинк не может предотвратить простуду, но, возможно, сократит ее продолжительность, не уменьшая при этом тяжесть симптомов. [175] приема добавок цинка Побочные эффекты перорального включают неприятный привкус и тошноту . [174] [176] Интраназальное применение цинксодержащих назальных спреев было связано с потерей обоняния ; [174] следовательно, в июне 2009 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (USFDA) предупредило потребителей прекратить использование интраназального цинка. [174]
Риновирус человека – наиболее распространенный вирусный патоген у человека – является основной причиной простуды. [177] Предполагаемый механизм действия, посредством которого цинк снижает тяжесть и/или продолжительность симптомов простуды, заключается в подавлении воспаления носа и прямом ингибировании связывания риновирусных рецепторов и репликации риновируса в слизистой оболочке носа . [174]Увеличение веса
[ редактировать ]Дефицит цинка может привести к потере аппетита. [178] Использование цинка в лечении анорексии пропагандируется с 1979 года. По крайней мере, 15 клинических исследований показали, что цинк способствует увеличению веса при анорексии. Исследование 1994 года показало, что цинк удвоил скорость увеличения массы тела при лечении нервной анорексии. Дефицит других питательных веществ, таких как тирозин, триптофан и тиамин, может способствовать этому явлению «недоедания, вызванного недоеданием». [179] Метаанализ 33 проспективных интервенционных исследований, посвященных добавкам цинка и его влиянию на рост детей во многих странах, показал, что добавки цинка сами по себе оказывали статистически значимое влияние на линейный рост и прибавку массы тела, указывая на то, что другие недостатки, которые могли присутствовать не были ответственны за задержку роста. [180]
Другой
[ редактировать ]Кокрейновский обзор показал, что у людей, принимающих добавки цинка, вероятность развития возрастной дегенерации желтого пятна может быть меньше . [181] Добавки цинка являются эффективным средством лечения энтеропатического акродерматита , генетического заболевания, влияющего на всасывание цинка, которое ранее было смертельным для больных младенцев. [72] Дефицит цинка связан с большим депрессивным расстройством (БДР), и добавки цинка могут быть эффективным средством лечения. [182] Цинк может помочь людям больше спать. [8]
Местное использование
[ редактировать ]К препаратам цинка для местного применения относятся препараты, наносимые на кожу, часто в форме оксида цинка . Оксид цинка обычно признается FDA безопасным и эффективным. [183] и считается очень фотостабильным. [184] Оксид цинка является одним из наиболее распространенных активных ингредиентов, входящих в состав солнцезащитных кремов для смягчения солнечных ожогов . [72] Наносится тонким слоем на область подгузника ребенка ( промежность ) при каждой смене подгузника и защищает от опрелостей . [72]
Хелатный цинк используется в зубных пастах и средствах для полоскания рта для предотвращения неприятного запаха изо рта ; Цитрат цинка помогает уменьшить образование зубного камня (зубного камня). [185] [186]
Цинк-пиритион широко включается в шампуни для предотвращения перхоти. [187]
Также было показано, что местное применение цинка эффективно лечит и продлевает ремиссию генитального герпеса . [188]
Биологическая роль
[ редактировать ]Цинк является важным микроэлементом для человека. [6] [7] [8] и другие животные, [9] для растений [10] и для микроорганизмов . [11] Цинк необходим для функционирования более 300 ферментов и 1000 факторов транскрипции . [8] и хранится и переносится в металлотионеинах . [189] [190] Это второй по распространенности микроэлемент в организме человека после железа и единственный металл, который присутствует во всех классах ферментов . [10] [8]
В белках ионы цинка часто координируются с боковыми цепями аминокислот аспарагиновой кислоты , глутаминовой кислоты , цистеина и гистидина . Теоретическое и вычислительное описание связывания цинка в белках (а также других переходных металлов) затруднено. [191]
Примерно 2–4 грамма цинка. [192] распределяются по всему телу человека. Больше всего цинка содержится в мозге, мышцах, костях, почках и печени, при этом самые высокие концентрации наблюдаются в предстательной железе и частях глаз. [193] Сперма особенно богата цинком, ключевым фактором функционирования предстательной железы и роста репродуктивных органов . [194]
Гомеостаз цинка в организме в основном контролируется кишечником. Здесь ZIP4 и особенно TRPM7 были связаны с поглощением цинка в кишечнике, необходимым для постнатального выживания. [195] [196]
У людей биологическая роль цинка повсеместна. [12] [7] Он взаимодействует с «широким спектром органических лигандов ». [12] и играет роль в метаболизме РНК и ДНК, передаче сигналов и экспрессии генов . Он также регулирует апоптоз . Обзор 2015 года показал, что около 10% белков человека (~3000) связывают цинк. [197] в дополнение к сотням других, которые перевозят и перевозят цинк; аналогичное исследование in silico на растении Arabidopsis thaliana обнаружило 2367 белков, связанных с цинком. [10]
В мозге цинк хранится в специфических пузырьках нейронов глутаматергических синаптических и может модулировать возбудимость нейронов. [7] [8] [198] Он играет ключевую роль в синаптической пластичности и, следовательно, в обучении. [7] [199] цинка Гомеостаз также играет решающую роль в функциональной регуляции центральной нервной системы . [7] [198] [8] Считается, что нарушение регуляции гомеостаза цинка в центральной нервной системе, приводящее к чрезмерным синаптическим концентрациям цинка, вызывает нейротоксичность вследствие митохондриального окислительного стресса (например, путем разрушения определенных ферментов, участвующих в цепи переноса электронов , включая комплекс I , комплекс III и α-кетоглутарат) . дегидрогеназа ), нарушение регуляции гомеостаза кальция, глутаматергическая нейрональная эксайтотоксичность и вмешательство в передачу внутринейрональных сигналов . [7] [200] L- и D-гистидин способствуют усвоению цинка мозгом. [201] SLC30A3 является основным переносчиком цинка , участвующим в гомеостазе цинка в мозге. [7]
Ферменты
[ редактировать ]

Цинк является эффективной кислотой Льюиса , что делает его полезным каталитическим агентом в гидроксилировании и других ферментативных реакциях. [202] Металл также имеет гибкую координационную геометрию , которая позволяет белкам, использующим его, быстро менять конформации для выполнения биологических реакций. [203] Двумя примерами цинксодержащих ферментов являются карбоангидраза и карбоксипептидаза , которые жизненно важны для процессов выделения углекислого газа ( CO
2 ) регуляция и переваривание белков соответственно. [204]
В крови позвоночных карбоангидраза превращает CO
2 в бикарбонат, и тот же фермент превращает бикарбонат обратно в CO.
2 для выдоха через легкие. [205] Без этого фермента это преобразование происходило бы примерно в миллион раз медленнее. [206] при нормальном pH крови 7 или потребуется pH 10 или более. [207] Неродственная β-карбоангидраза необходима растениям для формирования листьев, синтеза индолуксусной кислоты (ауксина) и спиртового брожения . [208]
Карбоксипептидаза расщепляет пептидные связи во время переваривания белков. Между концевым пептидом и группой C=O, присоединенной к цинку, образуется координационная ковалентная связь , которая придает углероду положительный заряд. Это помогает создать гидрофобный карман на ферменте рядом с цинком, который притягивает неполярную часть перевариваемого белка. [204]
Сигнализация
[ редактировать ]Цинк признан посланником, способным активировать сигнальные пути. Многие из этих путей являются движущей силой аберрантного роста рака. Их можно атаковать через ZIP-транспортеры . [209]
Другие белки
[ редактировать ]Цинк выполняет чисто структурную роль в цинковых пальцах , скрутках и группах. [210] Цинковые пальцы образуют части некоторых факторов транскрипции , которые представляют собой белки, распознающие последовательности оснований ДНК во время репликации и транскрипции ДНК . Каждый из девяти или десяти Zn 2+
Ионы цинкового пальца помогают поддерживать структуру пальца, координируя связывание с четырьмя аминокислотами в факторе транскрипции. [206]
В плазме крови цинк связывается и транспортируется альбумином (60%, низкоаффинное) и трансферрином (10%). [192] Поскольку трансферрин также транспортирует железо, избыток железа снижает абсорбцию цинка, и наоборот. Аналогичный антагонизм существует и с медью. [211] Концентрация цинка в плазме крови остается относительно постоянной независимо от приема цинка. [202] Клетки слюнной железы, предстательной железы, иммунной системы и кишечника используют передачу сигналов цинка для связи с другими клетками. [212]
Цинк может содержаться в запасах металлотионеина внутри микроорганизмов, кишечника или печени животных. [213] Металлотионеин в клетках кишечника способен регулировать всасывание цинка на 15–40%. [214] Однако недостаточное или чрезмерное потребление цинка может быть вредным; избыток цинка особенно ухудшает абсорбцию меди, поскольку металлотионеин абсорбирует оба металла. [215]
человека Транспортер дофамина содержит высокоаффинный цинка внеклеточный сайт связывания , который при связывании цинка ингибирует обратный захват дофамина и усиливает амфетамином индуцированный отток дофамина in vitro . [216] [217] [218] человека Транспортер серотонина и транспортер норадреналина не содержат сайтов связывания цинка. [218] Некоторые EF-hand, кальцийсвязывающие белки такие как S100 или NCS-1, также способны связывать ионы цинка. [219]
Питание
[ редактировать ]Диетические рекомендации
[ редактировать ]Институт медицины США (МОМ) обновил расчетные средние потребности (EAR) и рекомендуемые диетические нормы (RDA) для цинка в 2001 году. Текущие EAR для цинка для женщин и мужчин в возрасте от 14 лет и старше составляют 6,8 и 9,4 мг/день соответственно. Рекомендуемые дозы составляют 8 и 11 мг/день. RDA выше, чем EAR, чтобы определить суммы, которые покроют людей с потребностями выше среднего. Рекомендуемая суточная доза для беременных составляет 11 мг/день. Рекомендуемая суточная доза для лактации составляет 12 мг/день. Для младенцев до 12 месяцев рекомендованная суточная доза составляет 3 мг/день. Для детей в возрасте 1–13 лет рекомендуемая суточная норма увеличивается с возрастом от 3 до 8 мг/день. Что касается безопасности, МОМ устанавливает допустимые верхние уровни потребления (UL) для витаминов и минералов, когда есть достаточные доказательства. В случае цинка допустимая норма для взрослых составляет 40 мг/день, включая пищу и добавки (ниже для детей). В совокупности EAR, RDA, AI и UL называются эталонными диетическими нормами потребления (DRI). [202]
Европейское управление по безопасности пищевых продуктов (EFSA) называет совокупный набор информации эталонными диетическими значениями, с эталонным потреблением для населения (PRI) вместо RDA и средней потребностью вместо EAR. AI и UL определяются так же, как и в США. Для людей в возрасте 18 лет и старше расчеты PRI сложны, поскольку EFSA устанавливает все более высокие значения по мере увеличения содержания фитатов в рационе. Для женщин доза ИПП увеличивается с 7,5 до 12,7 мг/день по мере увеличения потребления фитатов с 300 до 1200 мг/день; для мужчин диапазон составляет от 9,4 до 16,3 мг/день. Эти PRI выше, чем RDA в США. [220] EFSA рассмотрело тот же вопрос безопасности и установило UL на уровне 25 мг/день, что намного ниже значения в США. [221]
Для целей маркировки пищевых продуктов и пищевых добавок в США количество в порции выражается в процентах от дневной нормы (% ДВ). Для целей маркировки цинка 100% дневной нормы составляло 15 мг, но 27 мая 2016 г. она была пересмотрена до 11 мг. [222] [223] Таблица старых и новых дневных норм для взрослых представлена в разделе «Справочная суточная норма» .
Диетический рацион
[ редактировать ]
Продукты животного происхождения, такие как мясо, рыба, моллюски, птица, яйца и молочные продукты, содержат цинк. Концентрация цинка в растениях зависит от его уровня в почве. При достаточном количестве цинка в почве пищевыми растениями, которые содержат больше всего цинка, являются пшеница (зародыши и отруби) и различные семена, включая кунжут , мак , люцерну , сельдерей и горчицу . [224] Цинк также содержится в фасоли , орехах , миндале , цельнозерновых продуктах , семенах тыквы , семечках подсолнечника и черной смородине . [225]
Другие источники включают обогащенные продукты питания и пищевые добавки в различных формах. Обзор 1998 года пришел к выводу, что оксид цинка, одна из наиболее распространенных добавок в Соединенных Штатах, и карбонат цинка практически нерастворимы и плохо усваиваются в организме. [226] В этом обзоре приводятся исследования, которые обнаружили более низкие концентрации цинка в плазме у субъектов, которые потребляли оксид цинка и карбонат цинка, чем у тех, кто принимал ацетат и сульфат цинка. [226] Однако для обогащения в обзоре 2003 года рекомендовались злаки (содержащие оксид цинка) как дешевый и стабильный источник, который так же легко усваивается, как и более дорогие формы. [227] Исследование 2005 года показало, что различные соединения цинка, включая оксид и сульфат, не показали статистически значимых различий в усвоении при добавлении в качестве обогатителей в кукурузные лепешки. [228]
Дефицит
[ редактировать ]Почти два миллиарда человек в развивающихся странах испытывают дефицит цинка. В группы риска входят дети из развивающихся стран и пожилые люди с хроническими заболеваниями. [14] У детей он вызывает рост инфекций и диареи и способствует смерти около 800 000 детей во всем мире в год. [12] Всемирная организация здравоохранения рекомендует принимать добавки цинка при тяжелом недоедании и диарее. [229] Добавки цинка помогают предотвратить заболевания и снизить смертность, особенно среди детей с низким весом при рождении или задержкой роста. [229] Однако добавки цинка не следует принимать отдельно, поскольку многие жители развивающихся стран имеют некоторые недостатки, а цинк взаимодействует с другими микроэлементами. [230] Хотя дефицит цинка обычно возникает из-за недостаточного поступления с пищей, он может быть связан с нарушением всасывания , энтеропатическим акродерматитом , хроническими заболеваниями печени, хроническими заболеваниями почек, серповидно-клеточной анемией , диабетом , злокачественными новообразованиями и другими хроническими заболеваниями. [14]
В Соединенных Штатах федеральное исследование потребления продуктов питания показало, что для женщин и мужчин старше 19 лет среднее потребление составляло 9,7 и 14,2 мг/день соответственно. У женщин 17% потребляли меньше EAR, у мужчин - 11%. Процент ниже EAR увеличивался с возрастом. [231] В самом последнем опубликованном обновлении исследования (NHANES 2013–2014) сообщается о более низких средних показателях – 9,3 и 13,2 мг/день – опять же, при этом потребление снижается с возрастом. [232]
Симптомы легкого дефицита цинка разнообразны. [202] Клинические исходы включают задержку роста, диарею, импотенцию и задержку полового созревания, алопецию , поражения глаз и кожи, нарушение аппетита, изменение когнитивных функций, нарушение иммунных функций, дефекты в использовании углеводов и репродуктивный тератогенез . [202] Дефицит цинка угнетает иммунитет, [233] но избыток цинка тоже влияет. [192]
Несмотря на некоторые опасения, [234] Западные вегетарианцы и веганы страдают от явного дефицита цинка не больше, чем мясоеды. [235] Основные растительные источники цинка включают вареные сушеные бобы, морские овощи, обогащенные крупы, соевые продукты, орехи, горох и семена. [234] Однако фитаты во многих цельнозерновых продуктах и клетчатке могут препятствовать усвоению цинка, а влияние незначительного потребления цинка плохо изучено. цинка хелатор Фитат, , содержащийся в семенах и зерновых отрубях , может способствовать мальабсорбции цинка. [14] Некоторые данные свидетельствуют о том, что тем, чья диета богата фитатами, например, некоторым вегетарианцам, может потребоваться больше рекомендуемой дозы, чем рекомендованная в США (8 мг/день для взрослых женщин; 11 мг/день для взрослых мужчин). [234] Рекомендации Европейского агентства по безопасности пищевых продуктов (EFSA) пытаются компенсировать это, рекомендуя более высокое потребление цинка при большем потреблении фитатов с пищей. [220] Эти соображения должны быть сбалансированы с учетом нехватки адекватных биомаркеров цинка , а наиболее широко используемый индикатор, цинк в плазме, имеет низкую чувствительность и специфичность . [236]
Рекультивация почвы
[ редактировать ]Виды Calluna , Erica и Vaccinium могут расти на цинк-металлоносных почвах, поскольку транслокация токсичных ионов предотвращается действием эрикоидных микоризных грибов . [237]
Сельское хозяйство
[ редактировать ]Дефицит цинка, по-видимому, является наиболее распространенным дефицитом микроэлементов у сельскохозяйственных растений; это особенно распространено в почвах с высоким pH. [238] с дефицитом цинка Почвы возделываются на пахотных землях примерно половины Турции и Индии , трети Китая и большей части Западной Австралии. В этих областях сообщалось о существенной реакции на внесение цинковых удобрений. [10] Растения, произрастающие на почвах с дефицитом цинка, более восприимчивы к болезням. Цинк добавляется в почву в основном в результате выветривания горных пород, но люди добавляют цинк в результате сжигания ископаемого топлива, отходов шахт, фосфатных удобрений, пестицидов ( фосфида цинка ), известняка, навоза, осадка сточных вод и частиц с гальванизированных поверхностей. Избыток цинка токсичен для растений, хотя токсичность цинка распространена гораздо менее широко. [10]
Меры предосторожности
[ редактировать ]Токсичность
[ редактировать ]Хотя цинк является важным требованием для хорошего здоровья, избыток цинка может быть вредным. Чрезмерное всасывание цинка подавляет всасывание меди и железа. [215] Свободный ион цинка в растворе очень токсичен для растений, беспозвоночных и даже позвоночных рыб. [239] Модель активности свободных ионов хорошо известна в литературе и показывает, что даже микромолярные количества свободных ионов убивают некоторые организмы. Недавний пример показал, что 6 микромолярей убивают 93% всех дафний в воде. [240]
Свободный ион цинка является мощной кислотой Льюиса, вплоть до коррозионной активности . Желудочная кислота содержит соляную кислоту , в которой металлический цинк легко растворяется с образованием едкого хлорида цинка. выпуска после 1982 года Проглатывание американской монеты в один цент (97,5% цинка) может привести к повреждению слизистой оболочки желудка из-за высокой растворимости ионов цинка в кислой среде желудка. [241]
Фактические данные показывают, что люди, принимающие 100–300 мг цинка в день, могут страдать от дефицита меди . Исследование 2007 года показало, что пожилые мужчины, принимавшие 80 мг ежедневно, чаще госпитализировались из-за осложнений со стороны мочевыделительной системы, чем те, кто принимал плацебо. [242] Уровни 100–300 мг могут мешать использованию меди и железа или отрицательно влиять на уровень холестерина. [215] Цинк, содержание которого в почве превышает 500 ppm, препятствует усвоению растениями других важных металлов, таких как железо и марганец. [114] Состояние, называемое «цинковым сотрясением » или «цинковым ознобом», может быть вызвано вдыханием паров цинка во время пайки или сварки оцинкованных материалов. [146] Цинк является распространенным ингредиентом крема для зубных протезов , который может содержать от 17 до 38 мг цинка на грамм. Сообщалось об инвалидности и даже смерти в результате чрезмерного употребления этих продуктов. [243]
США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) заявляет, что цинк повреждает нервные рецепторы в носу, вызывая аносмию . Сообщения об аносмии наблюдались также в 1930-х годах, когда препараты цинка использовались в неудачной попытке предотвратить инфекцию полиомиелита . [244] 16 июня 2009 г. FDA распорядилось убрать с полок магазинов средства для интраназальной простуды на основе цинка. В FDA заявили, что потеря обоняния может быть опасной для жизни, поскольку люди с нарушенным обонянием не могут обнаружить утечку газа или дыма и не могут определить, испортилась ли еда, прежде чем съесть ее. [245]
Недавние исследования показывают, что местный противомикробный пиритион цинка является мощным индуктором реакции на тепловой шок , который может нарушать целостность генома, вызывая PARP -зависимый энергетический кризис в культивируемых кератиноцитах и меланоцитах человека . [246]
Отравление
[ редактировать ]В 1982 году Монетный двор США начал чеканить монеты, покрытые медью, но содержащие в основном цинк. Цинковые монеты создают риск цинкового токсикоза, который может привести к летальному исходу. Один зарегистрированный случай хронического проглатывания 425 монет (более 1 кг цинка) привел к смерти из-за желудочно-кишечного бактериального и грибкового сепсиса . У другого пациента, принявшего 12 граммов цинка, наблюдались только летаргия и атаксия (выраженное отсутствие координации мышечных движений). [247] Сообщалось о нескольких других случаях, когда люди страдали от интоксикации цинком в результате проглатывания цинковых монет. [248] [249]
Пенни и другие мелкие монеты иногда проглатываются собаками, что требует ветеринарного удаления посторонних предметов. Содержание цинка в некоторых монетах может вызвать токсичность цинка, которая обычно приводит к летальному исходу у собак из-за тяжелой гемолитической анемии и повреждения печени или почек; возможные симптомы – рвота и диарея. [250] Цинк очень токсичен для попугаев , и отравление часто может привести к летальному исходу. [251] Употребление фруктовых соков, хранящихся в оцинкованных банках, привело к массовым отравлениям попугаев цинком. [72]
См. также
[ редактировать ]- Список стран по производству цинка
- пишется
- Пятно от влажного хранения
- Гальваника цинкового сплава
- Металлическая лихорадка
- Петр Штайнкеллер
Примечания
[ редактировать ]- ^ Тепловое расширение цинка анизотропно . Коэффициенты 13,06 C): α a = для каждой оси кристалла составляют (при 20 ° × 10. −6 /К, α с = 64,12 × 10 −6 /K, а α среднее = α объём /3 = 30,08 × 10 −6 /К.
- ^ Элементы из разных групп металлов. См. таблицу Менделеева.
- ^ Корабль Ост-Индской компании, перевозивший груз почти чистого металлического цинка с Востока, затонул у берегов Швеции в 1745 году ( Эмсли 2001 , стр. 502).
- ^ Электрический ток естественным образом течет между цинком и сталью, но в некоторых случаях используются инертные аноды с внешним источником постоянного тока.
Ссылки
[ редактировать ]- ^ «Стандартные атомные массы: цинк» . ЦИАВ . 2007.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные массы элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Перейти обратно: а б Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Перейти обратно: а б Марет, Вольфганг (2013). «Цинк и болезни человека». В Астрид Сигел; Хельмут Сигель; Роланд К.О. Сигел (ред.). Взаимосвязь между ионами незаменимых металлов и заболеваниями человека . Ионы металлов в науках о жизни. Том. 13. Спрингер. стр. 389–414. дои : 10.1007/978-94-007-7500-8_12 . ISBN 978-94-007-7499-5 . ПМИД 24470098 .
- ^ Перейти обратно: а б с д и ж г час Пракаш А., Бхарти К., Маджид А.Б. (апрель 2015 г.). «Цинк: показания при заболеваниях головного мозга». Фундам Клин Фармакол . 29 (2): 131–149. дои : 10.1111/fcp.12110 . ПМИД 25659970 . S2CID 21141511 .
- ^ Перейти обратно: а б с д и ж г час Черасс Y, Ураде Y (ноябрь 2017 г.). «Диетический цинк действует как модулятор сна» . Международный журнал молекулярных наук . 18 (11): 2334. doi : 10.3390/ijms18112334 . ПМЦ 5713303 . ПМИД 29113075 .
Цинк является вторым по распространенности микроэлементом в организме человека и необходим для многих биологических процессов. ... Следовой металл цинк является важным кофактором более чем 300 ферментов и 1000 транскрипционных факторов [16]. ... В центральной нервной системе цинк является вторым по распространенности микроэлементом и участвует во многих процессах. Помимо своей роли в ферментативной активности, он также играет важную роль в передаче сигналов клетками и модуляции активности нейронов.
- ^ Перейти обратно: а б Прасад А.С. (2008). «Цинк в здоровье человека: влияние цинка на иммунные клетки» . Мол. Мед . 14 (5–6): 353–7. дои : 10.2119/2008-00033.Прасад . ПМК 2277319 . ПМИД 18385818 .
- ^ Перейти обратно: а б с д и ж г час Бродли, MR; Уайт, ПиДжей; Хаммонд, JP; Зелько И.; Люкс А. (2007). «Цинк в растениях» . Новый фитолог . 173 (4): 677–702. дои : 10.1111/j.1469-8137.2007.01996.x . ПМИД 17286818 .
- ^ Перейти обратно: а б Роль цинка в микроорганизмах особенно рассматривается в: Шугармен Б (1983). «Цинк и инфекция». Обзоры инфекционных болезней . 5 (1): 137–47. дои : 10.1093/clinids/5.1.137 . ПМИД 6338570 .
- ^ Перейти обратно: а б с д и Хэмбидж, К.М. и Кребс, Н.Ф. (2007). «Дефицит цинка: особая проблема» . Дж. Нутр . 137 (4): 1101–5. дои : 10.1093/jn/137.4.1101 . ПМИД 17374687 .
- ^ Сяо, Ханфан; Вэй, Ганцзянь; Чжэн, Синьцин, Туо; Ван, Лю, Си (30 октября 2020 г.) . в скелетах мелководных кораллов» . Геохимия, геофизика, геосистемы . 21 (11). Бибкод : 2020GGG....2109430X . doi : 10.1029/2020GC009430 . S2CID 228975484 .
- ^ Перейти обратно: а б с д Прасад, А.С. (2003). «Дефицит цинка: о нем известно уже 40 лет, но его игнорируют глобальные организации здравоохранения» . Британский медицинский журнал . 326 (7386): 409–410. дои : 10.1136/bmj.326.7386.409 . ПМЦ 1125304 . ПМИД 12595353 .
- ^ Марет, Вольфганг (2013). «Цинк и цинковый протеом». В Банки, Люсия (ред.). Металломика и клетка . Ионы металлов в науках о жизни. Том. 12. Спрингер. стр. 479–501. дои : 10.1007/978-94-007-5561-1_14 . ISBN 978-94-007-5561-1 . ПМИД 23595681 .
- ^ Англия, Университет Востока. «Цинк жизненно важен для эволюции сложной жизни в полярных океанах» . физ.орг . Проверено 3 сентября 2023 г.
- ^ Торнтон, CP (2007). Из латуни и бронзы в доисторической Юго-Западной Азии (PDF) . Публикации архетипов. ISBN 978-1-904982-19-7 . Архивировано (PDF) из оригинала 24 сентября 2015 г.
{{cite book}}:|website=игнорируется ( помогите ) - ^ Перейти обратно: а б Гринвуд и Эрншоу 1997 , с. 1201
- ^ Перейти обратно: а б Крэддок, Пол Т. (1978). «Состав медных сплавов, используемых греческой, этрусской и римской цивилизациями. Происхождение и раннее использование латуни». Журнал археологической науки . 5 (1): 1–16. дои : 10.1016/0305-4403(78)90015-8 .
- ^ «Цинк – Королевское химическое общество» . Архивировано из оригинала 11 июля 2017 года.
- ^ «Индия первой начала выплавлять цинк методом дистилляции» . Infinityfoundation.com. Архивировано из оригинала 16 мая 2016 года . Проверено 25 апреля 2014 г.
- ^ Хараквал, Дж. С. и Гурджар, Л. К. (1 декабря 2006 г.). «Цинк и латунь в археологической перспективе» . Древняя Азия . 1 : 139–159. дои : 10.5334/aa.06112 .
- ^ Перейти обратно: а б с д и ж г час я дж КПР 2006 , с. 4 –41
- ^ Перейти обратно: а б Хейзерман 1992 , с. 123
- ^ Уэллс А. Ф. (1984) Структурная неорганическая химия , 5-е издание, стр. 1277 Oxford Science Publications ISBN 0-19-855370-6
- ^ Скоферн, Джон (1861). Полезные металлы и их сплавы . Хоулстон и Райт. стр. 591–603 . Проверено 6 апреля 2009 г.
- ^ Перейти обратно: а б «Свойства цинкового металла» . Американская ассоциация гальванизаторов. 2008. Архивировано из оригинала 28 марта 2015 года . Проверено 7 апреля 2015 г.
- ^ Ингаллс, Уолтер Рентон (1902). «Производство и свойства цинка: трактат о возникновении и распространении цинковой руды, коммерческих и технических условиях, влияющих на производство спелтера, его химических и физических свойствах и использовании в искусстве, вместе с историческим и статистическим обзором Промышленность» . Инженерно-горный журнал : 142–6.
- ^ Эмсли, Джон (25 августа 2011 г.). Строительные блоки природы: Путеводитель по элементам от Аризоны . ОУП Оксфорд. ISBN 978-0-19-960563-7 .
- ^ Брюггер, Джоэл (18 июля 2018 г.), «Цинк» , Энциклопедия геохимии: всеобъемлющий справочный источник по химии Земли , Серия энциклопедии наук о Земле, Springer, стр. 1521–1524, doi : 10.1007/978-3 -319-39312-4_212 , ISBN 978-3-319-39311-7 , получено 21 июня 2024 г.
- ^ Риувертс, Джон (2015). Элементы загрязнения окружающей среды . Лондон и Нью-Йорк: Earthscan Routledge. п. 286. ИСБН 978-0-415-85919-6 . OCLC 886492996 .
- ^ Перейти обратно: а б с д и Лехто 1968 , с.822.
- ^ Перейти обратно: а б с Гринвуд и Эрншоу 1997 , с. 1202
- ^ Перейти обратно: а б с д Эмсли 2001 , с. 502
- ^ Перейти обратно: а б с д Сай Сруджан, А.В. (2021). «Обзор минеральных товаров на 2021 год: цинк» (PDF) . Геологическая служба США . Проверено 21 июня 2021 г.
- ^ Эриксон, Р.Л. (1973). «Коровое изобилие элементов, минеральные запасы и ресурсы». Профессиональный документ Геологической службы США (820): 21–25.
- ^ «Стратегия странового партнерства — Иран: 2011–2012 годы» . Банк торговли и развития ОЭС. Архивировано из оригинала 26 октября 2011 года . Проверено 6 июня 2011 г.
- ^ «ИРАН – растущий рынок с огромным потенциалом» . ИМРГ. 5 июля 2010. Архивировано из оригинала 17 февраля 2013 года . Проверено 3 марта 2010 г.
- ^ Толчин, AC (2009). «Обзор минеральных товаров за 2009 год: цинк» (PDF) . Геологическая служба США . Архивировано (PDF) оригинала 2 июля 2016 г. Проверено 4 августа 2016 г.
- ^ Гордон, РБ; Бертрам, М.; Гредель, Т.Э. (2006). «Запасы металлов и устойчивое развитие» . Труды Национальной академии наук . 103 (5): 1209–14. Бибкод : 2006PNAS..103.1209G . дои : 10.1073/pnas.0509498103 . ПМК 1360560 . ПМИД 16432205 .
- ^ Герст, Майкл (2008). «Используемые запасы металлов: состояние и последствия». Экологические науки и технологии . 42 (19): 7038–45. Бибкод : 2008EnST...42.7038G . дои : 10.1021/es800420p . ПМИД 18939524 .
- ^ Мейлан, Грегуар (2016). «Антропогенный цикл цинка: статус-кво и перспективы». Ресурсы, сохранение и переработка . 123 : 1–10. doi : 10.1016/j.resconrec.2016.01.006 .
- ^ Перейти обратно: а б с д и ж Алехандро А. Сонцогни (менеджер базы данных), изд. (2008). «Таблица нуклидов» . Аптон (Нью-Йорк): Национальный центр ядерных данных, Брукхейвенская национальная лаборатория . Архивировано из оригинала 22 мая 2008 года . Проверено 13 сентября 2008 г.
- ^ Перейти обратно: а б Ауди, Г.; Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С. (2017). «Оценка ядерных свойств NUBASE2016» (PDF) . Китайская физика C . 41 (3): 030001. Бибкод : 2017ChPhC..41c0001A . дои : 10.1088/1674-1137/41/3/030001 .
- ^ Ауди, Жорж; Берсильон, Оливье; Блашо, Жан; Вапстра, Аалдерт Хендрик (2003), « Оценка NUBASE свойств ядра и распада» , Nuclear Physics A , 729 : 3–128, Бибкод : 2003NuPhA.729....3A , doi : 10.1016/j.nuclphysa.2003.11 .001
- ^ CRC 2006 , стр. 8 -29
- ^ Портер, Фрэнк К. (1994). Коррозионная стойкость цинка и цинковых сплавов . ЦРК Пресс. п. 121. ИСБН 978-0-8247-9213-8 .
- ^ Перейти обратно: а б с д и ж г час Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1985). «Цинк». Учебник неорганической химии (на немецком языке) (91–100 изд.). Вальтер де Грюйтер. стр. 1034–1041. ISBN 978-3-11-007511-3 .
- ^ Хиндс, Джон Иределл Диллард (1908). Неорганическая химия: с элементами физической и теоретической химии (2-е изд.). Нью-Йорк: Джон Уайли и сыновья. стр. 506–508.
- ^ Ричи, Роб (2004). Химия (2-е изд.). Леттс и Лонсдейл. п. 71. ИСБН 978-1-84315-438-9 .
- ^ Берджесс, Джон (1978). Ионы металлов в растворе . Нью-Йорк: Эллис Хорвуд. п. 147. ИСБН 978-0-470-26293-1 .
- ^ Брэди, Джеймс Э.; Хьюмистон, Джерард Э.; Хейккинен, Генри (1983). Общая химия: принципы и структура (3-е изд.). Джон Уайли и сыновья. п. 671 . ISBN 978-0-471-86739-5 .
- ^ Каупп М.; Долг М.; Столл Х.; Фон Шнеринг Х.Г. (1994). «Степень окисления +IV в 12 группе химии. Ab initio исследование фторидов цинка(IV), кадмия(IV) и ртути(IV)» . Неорганическая химия . 33 (10): 2122–2131. дои : 10.1021/ic00088a012 .
- ^ Саманта, Девлина; Йена, Пуру (2012). «Цинк в степени окисления +III» . Журнал Американского химического общества . 134 (20): 8400–8403. дои : 10.1021/ja3029119 . ПМИД 22559713 .
- ^ Шлёдер, Тобиас; и др. (2012). «Может ли цинк действительно существовать в степени окисления +III?» . Журнал Американского химического общества . 134 (29): 11977–11979. дои : 10.1021/ja3052409 . ПМИД 22775535 .
- ^ Фанг, Хонг; Банджаде, Хута; Дипика; Йена, Пуру (2021 г.). «Реализация степени окисления Zn3+» . Наномасштаб . 13 (33): 14041–14048. дои : 10.1039/D1NR02816B . ПМИД 34477685 . S2CID 237400349 .
- ^ Перейти обратно: а б Гринвуд и Эрншоу 1997 , с. 1206
- ^ CRC 2006 , стр. 12 –11–12
- ^ Хаускрофт, CE; Шарп, AG (2008). Неорганическая химия (3-е изд.). Прентис Холл. п. 739–741, 843. ISBN. 978-0-13-175553-6 .
- ^ «Сульфид цинка» . Американские элементы . Архивировано из оригинала 17 июля 2012 года . Проверено 3 февраля 2009 г.
- ^ Академическая американская энциклопедия . Дэнбери, Коннектикут : Grolier Inc., 1994. с. 202. ИСБН 978-0-7172-2053-3 .
- ^ «Фосфид цинка» . Американские элементы . Архивировано из оригинала 17 июля 2012 года . Проверено 3 февраля 2009 г.
- ^ Шульженко А.А., Игнатьева И.Ю., Осипов А.С., Смирнова Т.И. (2000). «Особенности взаимодействия в системе Zn–C при высоких давлениях и температурах». Алмаз и родственные материалы . 9 (2): 129–133. Бибкод : 2000DRM.....9..129S . дои : 10.1016/S0925-9635(99)00231-9 .
- ^ Гринвуд и Эрншоу 1997 , с. 1211
- ^ Расмуссен, Дж. К.; Хейльманн, С.М. (1990). «Цианосилилирование карбонильных соединений in situ: О-триметилсилил-4-метоксиманделонитрил» . Органические синтезы, Сборник . 7 : 521. Архивировано из оригинала 30 сентября 2007 года.
- ^ Перри, Д.Л. (1995). Справочник неорганических соединений . ЦРК Пресс. стр. 448–458. ISBN 978-0-8493-8671-8 .
- ^ Франкленд, Э. (1850). «О выделении органических радикалов» . Ежеквартальный журнал Химического общества . 2 (3): 263. дои : 10.1039/QJ8500200263 .
- ^ Лиде, Дэвид (1998). CRC-Справочник по химии и физике . ЦРК Пресс. стр. Раздел 8. Страница 1. ISBN. 978-0-8493-0479-8 .
- ^ Уикс 1933 , с. 20
- ^ Крэддок, ПТ (1998). «Цинк в классической древности». В Крэддоке, штат Пенсильвания (ред.). 2000 лет цинка и латуни (ред.). Лондон: Британский музей. стр. 3–5. ISBN 978-0-86159-124-4 .
- ^ Перейти обратно: а б Уикс 1933 , с. 21
- ^ Перейти обратно: а б с д и ж Эмсли 2001 , с. 501
- ^ «Как производится цинк?» . Как производятся продукты . Группа Гейл. 2002. Архивировано из оригинала 11 апреля 2006 года . Проверено 21 февраля 2009 г.
- ^ Чемберс 1901 , с. 799
- ^ «Самые старые в мире таблетки лечили глаза» . Новый учёный . 7 января 2013. Архивировано из оригинала 22 января 2013 года . Проверено 5 февраля 2013 г.
- ^ Джачи, Джанна; Паллекки, Паскино; Ромуальди, Антонелла; Рибекини, Эрика; Лусейко, Жаннет Жаклин; Коломбини, Мэри Перл; Мариотти Липпи, Марта (2013). «Ингредиенты лекарства, которому 2000 лет, выявленные химическими, минералогическими и ботаническими исследованиями » Труды Национальной академии наук . 110 (4): 1193–1196. Бибкод : 2013PNAS..110.1193G . дои : 10.1073/pnas.1216776110 . ПМК 3557061 . ПМИД 23297212 .
- ^ Ререн, Т. (1996). С. Демирчи; и др. (ред.). Римская цинковая табличка из Берна, Швейцария: реконструкция производства . Археометрия 94. Материалы 29-го Международного симпозиума по археометрии. стр. 35–45.
- ^ Меуленбельд, Г.Дж. (1999). История индийской медицинской литературы . Том. Я. Гронинген: Форстен. стр. 130–141. OCLC 165833440 .
- ^ Крэддок, Пенсильвания; и др. (1998). «Цинк в Индии». 2000 лет цинка и латуни (ред.). Лондон: Британский музей. п. 27. ISBN 978-0-86159-124-4 .
- ^ Перейти обратно: а б п. 46, Древняя горнодобывающая промышленность и металлургия в Раджастане, С.М. Ганди, глава 2 в книге « Эволюция земной коры и металлогения на Северо-Западном Индийском щите: праздничная статья для Асоке Мукерджи» , М. Деб, изд., Alpha Science Int'l Ltd., 2000, ISBN 1-84265-001-7 .
- ^ Перейти обратно: а б с Крэддок, Пенсильвания; Гурджар Л.К.; Хегде КТМ (1983). «Производство цинка в средневековой Индии». Мировая археология . 15 (2): 211–217. дои : 10.1080/00438243.1983.9979899 . JSTOR 124653 .
- ^ Рэй, Прафулла Чандра (1903). История индуистской химии с древнейших времен до середины шестнадцатого века нашей эры: с санскритскими текстами, вариантами, переводами и иллюстрациями . Том. 1 (2-е изд.). Бенгальский химический и фармацевтический завод, ООО, стр. 157–158. (текст, являющийся общественным достоянием)
- ^ Перейти обратно: а б с д и ж г Хабаши, Фатхи. «Открытие восьмого металла» (PDF) . Международная цинковая ассоциация (IZA). Архивировано из оригинала (PDF) 4 марта 2009 г. Проверено 13 декабря 2008 г.
- ^ Арни, Генри Вайнком (1917). Принципы фармации (2-е изд.). Компания WB Saunders. п. 483.
- ^ Гувер, Герберт Кларк (2003). Георгиус Агрикола де Ре Металлика . Издательство Кессинджер. п. 409. ИСБН 978-0-7661-3197-2 .
- ^ Герхарц, Вольфганг; и др. (1996). Энциклопедия промышленной химии Ульмана (5-е изд.). ВХК. п. 509. ИСБН 978-3-527-20100-6 .
- ^ Скит, WW (2005). Краткий этимологический словарь английского языка . Козимо, Inc. с. 622. ИСБН 978-1-59605-092-1 .
- ^ Фатхи Хабаши (1997). Справочник по добывающей металлургии . Вайли-ВХК. п. 642. ИСБН 978-3-527-28792-5 .
- ^ Лах, Дональд Ф. (1994). «Технология и естественные науки» . Азия в процессе создания Европы . Издательство Чикагского университета . п. 426. ИСБН 978-0-226-46734-4 .
- ^ Воган, Л. Брент (1897). "Цинкография". Детская Британская энциклопедия Справочная библиотека общих знаний, том III PZ . Чикаго: EG Melven & Company.
- ^ Кастеллани, Майкл. «Элементы из переходных металлов» (PDF) . Архивировано (PDF) из оригинала 10 октября 2014 г. Проверено 14 октября 2014 г.
- ^ Хабиб, Ирфан (2011). Чатопадхьяя, Д.П. (ред.). Экономическая история средневековой Индии, 1200–1500 гг . Нью-Дели: Пирсон Лонгман. п. 86. ИСБН 978-81-317-2791-1 . Архивировано из оригинала 14 апреля 2016 года.
- ^ Перейти обратно: а б Дженкинс, Рис (1945). «Цинковая промышленность в Англии: первые годы до 1850 года». Труды Общества Ньюкомена . 25 : 41–52. дои : 10.1179/tns.1945.006 .
- ^ Виллис, Линн; Крэддок, Пенсильвания; Гурджар, LJ; Хегде, КТМ (1984). «Древняя добыча свинца и цинка в Раджастане, Индия». Мировая археология . 16 (2, Шахты и карьеры): 222–233. дои : 10.1080/00438243.1984.9979929 . JSTOR 124574 .
- ^ Робертс, Р.О. (1951). «Доктор Джон Лейн и основание промышленности цветных металлов в долине Суонси». Гауэр (4). Общество Гауэра: 19.
- ^ Коминс, Алан Э. (2007). Энциклопедический словарь названных процессов в химической технологии (3-е изд.). ЦРК Пресс. п. 71. ИСБН 978-0-8493-9163-7 .
- ^ Маргграф (1746 г.). по способу извлечения цинка из его истинного минерала; « Опыты т. е. камень каламин]. История Королевской академии наук и беллетристики Берлина (на французском языке). 2 :49–57.
- ^ Хейзерман 1992 , с. 122
- ^ Грей, Леон (2005). Цинк . Маршалл Кавендиш. п. 8 . ISBN 978-0-7614-1922-8 .
- ^ Перейти обратно: а б с Уоррен, Невилл Г. (2000). Excel Предварительная физика . Паскаль Пресс. п. 47. ИСБН 978-1-74020-085-1 .
- ^ Перейти обратно: а б «Гальванический элемент» . Новая международная энциклопедия . Додд, Мид и компания. 1903. с. 80.
- ^ Перейти обратно: а б с Коттон и др. 1999 , с. 626
- ^ Ясински, Стивен М. «Обзор минеральных товаров за 2007 год: цинк» (PDF) . Геологическая служба США. Архивировано (PDF) из оригинала 17 декабря 2008 г. Проверено 25 ноября 2008 г.
- ^ Эттвуд, Джеймс (13 февраля 2006 г.). «Zinifex и Umicore объединяются и образуют ведущего производителя цинка» . Уолл Стрит Джорнал . Архивировано из оригинала 26 января 2017 года.
- ^ «Переработка цинка» . Международная цинковая ассоциация. Архивировано из оригинала 21 октября 2011 года . Проверено 28 ноября 2008 г.
- ^ «Цинк специального высокого качества (SHG) 99,995%» (PDF) . Нирстар. 2008. Архивировано из оригинала (PDF) 4 марта 2009 года . Проверено 1 декабря 2008 г.
- ^ Перейти обратно: а б с д и Портер, Фрэнк К. (1991). Справочник по цинку . ЦРК Пресс. ISBN 978-0-8247-8340-2 .
- ^ Перейти обратно: а б с Розенквист, Теркель (1922). Принципы добывающей металлургии (2-е изд.). Тапир Академик Пресс. стр. 7, 16, 186. ISBN. 978-82-519-1922-7 .
- ^ Борг, Грегор; Кернер, Катрин; Бакстон, Майк; Армстронг, Ричард; ван дер Мерве, Шалк В. (2003). «Геология месторождения супергенного цинка Скорпион, Южная Намибия». Экономическая геология . 98 (4): 749–771. дои : 10.2113/98.4.749 .
- ^ Бодсворт, Колин (1994). Добыча и переработка металлов . ЦРК Пресс. п. 148. ИСБН 978-0-8493-4433-6 .
- ^ Гупта, СК; Мукерджи, ТК (1990). Гидрометаллургия в процессах добычи . ЦРК Пресс. п. 62. ИСБН 978-0-8493-6804-2 .
- ^ Антрекович, Юрген; Штайнлехнер, Стефан; Унгер, Алоис; Рёслер, Гернот; Пихлер, Кристоф; Румпольд, Рене (2014), «9. Переработка цинка и отходов», Уоррелл, Эрнст; Рейтер, Маркус (ред.), Справочник по переработке: современное состояние для практиков, аналитиков и ученых
- ^ Перейти обратно: а б Куча, Х.; Мартенс, А.; Оттенбургс, Р.; Де Вос, В.; Виэне, В. (1996). «Первичные минералы Zn-Pb горнодобывающих и металлургических отвалов и их экологическое поведение в Пломбьере, Бельгия». Экологическая геология . 27 (1): 1–15. Бибкод : 1996EnGeo..27....1K . дои : 10.1007/BF00770598 . S2CID 129717791 .
- ^ Перейти обратно: а б с д Эмсли 2001 , с. 504
- ^ Хит, Алан Г. (1995). Загрязнение воды и физиология рыб . Бока-Ратон, Флорида: CRC Press. п. 57. ИСБН 978-0-87371-632-1 .
- ^ «Устье Дервента – План улучшения качества воды по содержанию тяжелых металлов» . Программа устья Дервента. Июнь 2007. Архивировано из оригинала 21 марта 2012 года . Проверено 11 июля 2009 г.
- ^ «Цинковый завод» . Изменить. Архивировано из оригинала 27 апреля 2009 года . Проверено 11 июля 2009 г.
- ^ Перейти обратно: а б с «Цинк: Мировое горнодобывающее производство (содержание цинка в концентрате) по странам» (PDF) . Ежегодник минералов 2009 г.: Цинк . Вашингтон, округ Колумбия: Геологическая служба США. Февраль 2010 г. Архивировано (PDF) из оригинала 8 июня 2011 г. Проверено 6 июня 2001 г.
- ^ Гринвуд и Эрншоу 1997 , с. 1203
- ^ Перейти обратно: а б Ствертка 1998 , с. 99
- ^ Перейти обратно: а б с д и ж г Лехто 1968 , с.829.
- ^ Перейти обратно: а б Эмсли 2001 , с. 503
- ^ Бунугаз, М.; Салхи, Э.; Бензин, К.; Гали Э.; Далард Ф. (2003). «Сравнительное исследование электрохимического поведения алжирского цинка и цинка из коммерческого жертвенного анода». Журнал материаловедения . 38 (6): 1139–1145. Бибкод : 2003JMatS..38.1139B . дои : 10.1023/А:1022824813564 . S2CID 135744939 .
- ^ Безенхард, Юрген О. (1999). Справочник материалов для аккумуляторов . Вайли-ВЧ. Бибкод : 1999hbm..book.....B . ISBN 978-3-527-29469-5 .
- ^ Вио, Ж.-П.; Вефлер, Ж.-П. (1995). «Утилизация цинковых батарей: экономическая проблема управления потребительскими отходами». Журнал источников энергии . 57 (1–2): 61–65. Бибкод : 1995JPS....57...61W . дои : 10.1016/0378-7753(95)02242-2 .
- ^ Калтер, Т. (1996). «Руководство по проектированию технологии воздушно-цинковых аккумуляторов». Сауткон/96. Протокол конференции . п. 616. дои : 10.1109/SOUTHC.1996.535134 . ISBN 978-0-7803-3268-3 . S2CID 106826667 .
- ^ Уортман, Джонатан; Браун, Ян. «Гибридная воздушно-цинковая батарея-аккумулятор для питания электросамокатов и электробусов» (PDF) . 15-й Международный симпозиум по электромобилям. Архивировано из оригинала (PDF) 12 марта 2006 г. Проверено 8 октября 2008 г.
- ^ Купер, Дж. Ф.; Флеминг, Д.; Харгроув, Д.; Купман, Р.; Петерман, К. (1995). «Перезаправляемая цинково-воздушная батарея для привода электромобилей». Технический отчет NASA Sti/Recon N. 96 . Конференция и выставка будущих транспортных технологий Общества автомобильных инженеров: 11394. Бибкод : 1995STIN...9611394C . ОСТИ 82465 .
- ^ Се, З.; Лю, К.; Чанг, З.; Чжан, X. (2013). «Разработки и проблемы цериевых полуэлементов в цинк-цериевых окислительно-восстановительных батареях для хранения энергии». Электрохимика Акта . 90 : 695–704. дои : 10.1016/j.electacta.2012.12.066 .
- ^ Буш, Дуглас Эрл; Кассель, Ричард (2006). Орган: Энциклопедия . Рутледж. п. 679. ИСБН 978-0-415-94174-7 .
- ^ «Характеристики монет» . Монетный двор США. Архивировано из оригинала 18 февраля 2015 года . Проверено 8 октября 2008 г.
- ^ Ясински, Стивен М. «Ежегодник минералов, 1994 год: цинк» (PDF) . Геологическая служба США. Архивировано (PDF) из оригинала 29 октября 2008 г. Проверено 13 ноября 2008 г.
- ^ «Литье сплавов» . Мэйбрук, Нью-Йорк: Eastern Alloys. Архивировано из оригинала 25 декабря 2008 года . Проверено 19 января 2009 г.
- ^ Апелян, Д.; Паливал, М.; Херршафт, округ Колумбия (1981). «Литье из цинковых сплавов». Журнал металлов . 33 (11): 12–19. Бибкод : 1981JOM....33k..12A . дои : 10.1007/bf03339527 .
- ^ Дэвис, Джефф (2003). Материалы для кузовов автомобилей . Баттерворт-Хайнеманн. п. 157. ИСБН 978-0-7506-5692-4 .
- ^ Саманс, Карл Хуберт (1949). Технические металлы и их сплавы . Компания Макмиллан.
- ^ Перейти обратно: а б Портер, Фрэнк (1994). «Кованый цинк» . Коррозионная стойкость цинка и цинковых сплавов . ЦРК Пресс. стр. 6–7. ISBN 978-0-8247-9213-8 .
- ^ Макклейн, Альберт Жюль и Гарднер, Кейт (1987). Полная книга о рыбалке: руководство по ловле в пресной, морской воде и крупной дичи . Галерея Книги. ISBN 978-0-8317-1565-6 . Архивировано из оригинала 15 ноября 2012 года . Проверено 26 июня 2012 г.
- ^ «Литой маховик на старом тренажере Magturbo отозван с июля 2000 года» . Минура . Архивировано из оригинала 23 марта 2013 года.
- ^ Перейти обратно: а б с Кац, Джонатан И. (2002). Самые большие удары . Издательство Оксфордского университета . п. 18 . ISBN 978-0-19-514570-0 .
- ^ Чжан, Сяогэ Грегори (1996). Коррозия и электрохимия цинка . Спрингер. п. 93. ИСБН 978-0-306-45334-2 .
- ^ Веймер, Эл (17 мая 2006 г.). «Развитие термохимического производства водорода из воды с помощью солнечной энергии» (PDF) . Министерство энергетики США . Архивировано (PDF) из оригинала 5 февраля 2009 г. Проверено 10 января 2009 г.
- ^ Перейти обратно: а б с Хейзерман 1992 , с. 124
- ^ Блю, Джозеф Оскар (1953). «Защитные средства для древесины» (PDF) . Министерство сельского хозяйства, Лесная служба, Лаборатория лесных товаров. HDL : 1957/816 . Архивировано (PDF) из оригинала 14 января 2012 г.
- ^ Франкленд, Эдвард (1849). «Обратите внимание на новый ряд органических тел, содержащих металлы, фосфор и т. д. » Анналы химии и фармации Либиха (на немецком языке). 71 (2): 213–216. дои : 10.1002/jlac.18490710206 .
- ^ Перейти обратно: а б КПР 2006 , с. 4 -42
- ^ Пашотта, Рюдигер (2008). Энциклопедия лазерной физики и техники . Вайли-ВЧ. п. 798. ИСБН 978-3-527-40828-3 .
- ^ Константину, ИК; Альбанис, Т.А. (2004). «Во всем мире распространенность и воздействие биоцидов, усиливающих противообрастающую краску, в водной среде: обзор». Интернационал окружающей среды . 30 (2): 235–248. Бибкод : 2004EnInt..30..235K . дои : 10.1016/S0160-4120(03)00176-4 . ПМИД 14749112 .
- ^ Перейти обратно: а б с Будро, Кевин А. «Цинк + сера» . Государственный университет Анджело. Архивировано из оригинала 2 декабря 2008 года . Проверено 8 октября 2008 г.
- ^ «Прокат и титан-цинковый лист» . Проверено 21 октября 2022 г.
- ^ «Что следует знать о цинковых столешницах» . Проверено 21 октября 2022 г.
- ^ «Руководство по цинковым столешницам: преимущества цинковых кухонных столешниц» . Проверено 21 октября 2022 г.
- ^ «Техническая информация» . Цинковые счетчики. 2008. Архивировано из оригинала 21 ноября 2008 года . Проверено 29 ноября 2008 г.
- ^ Перейти обратно: а б с Вин, Дэвид Тин; Масум, Эл (2003). «Оружие массового поражения» (PDF) . Технологический журнал Успенского университета . 6 (4). Успенский университет: 199. Архивировано (PDF) из оригинала 26 марта 2009 года . Проверено 6 апреля 2009 г.
- ^ Дэвид Э. Ньютон (1999). Химические элементы: от углерода до криптона . УХЛ/Гейл. ISBN 978-0-7876-2846-8 . Архивировано из оригинала 10 июля 2008 года . Проверено 6 апреля 2009 г.
- ^ Агрохимикаты Ульмана . Вили-Вч (COR). 2007. стр. 591–592. ISBN 978-3-527-31604-5 . [ постоянная мертвая ссылка ]
- ^ Уокер, JCF (2006). Первичная обработка древесины: принципы и практика . Спрингер. п. 317. ИСБН 978-1-4020-4392-5 .
- ^ «Моторное масло ZDDP – цинковый фактор» . Мустанг Ежемесячно. Архивировано из оригинала 12 сентября 2009 года . Проверено 19 сентября 2009 г.
- ^ Ким, Юнг Гон; Уолш, Патрик Дж. (2006). «От арилбромидов к энантиообогащенным бензиловым спиртам в одной колбе: каталитическое асимметричное арилирование альдегидов» . Angewandte Chemie, международное издание . 45 (25): 4175–4178. дои : 10.1002/anie.200600741 . ПМИД 16721894 .
- ^ Оверман, Ларри Э.; Карпентер, Нэнси Э. (2005). Аллильная тригалоацетимидатная перегруппировка . Органические реакции. Том. 66. стр. 1–107. дои : 10.1002/0471264180.или066.01 . ISBN 978-0-471-26418-7 .
- ^ Раппопорт, Цви; Марек, Илан (17 декабря 2007 г.). Химия цинкорганических соединений: R-Zn . Джон Уайли и сыновья. ISBN 978-0-470-09337-5 . Архивировано из оригинала 14 апреля 2016 года.
- ^ Кнохель, Пол; Джонс, Филип (1999). Цинкорганические реагенты: Практический подход . Издательство Оксфордского университета. ISBN 978-0-19-850121-3 . Архивировано из оригинала 14 апреля 2016 года.
- ^ Херрманн, Вольфганг А. (январь 2002 г.). Синтетические методы металлоорганической и неорганической химии: катализ . Георг Тиме Верлаг. ISBN 978-3-13-103061-0 . Архивировано из оригинала 14 апреля 2016 года.
- ^ Э. Франкленд, Энн. 126, 109 (1863)
- ^ Э. Франкленд, Б.Ф. Дуппа, Энн. 135, 25 (1865)
- ^ Ловицкий, Даниэль; Бас, Себастьян; Млынарски, Яцек (2015). «Хиральные цинковые катализаторы асимметрического синтеза». Тетраэдр . 71 (9): 1339–1394. дои : 10.1016/j.tet.2014.12.022 .
- ^ ДиСильвестро, Роберт А. (2004). Справочник по минералам в качестве пищевых добавок . ЦРК Пресс. стр. 135, 155. ISBN. 978-0-8493-1652-4 .
- ^ Санчес, Джулиана (13 февраля 2013 г.). Сульфат цинка против хелата аминокислот цинка (ЗАЗО) (отчет). Правительство США. NCT01791608 . Получено 6 апреля 2022 г. - из Национальной медицинской библиотеки США.
- ^ Мэйо-Уилсон, Э; Джуниор, Дж.А.; Имдад, А; Дин, С; Чан, XH; Чан, ES; Джасвал, А; Бхутта, З.А. (15 мая 2014 г.). «Добавка цинка для предотвращения смертности, заболеваемости и задержки роста у детей в возрасте от 6 месяцев до 12 лет». Кокрейновская база данных систематических обзоров (5): CD009384. дои : 10.1002/14651858.CD009384.pub2 . ПМИД 24826920 .
- ^ Сантос ХО, Тейшейра Ф.Д., Шенфельд Б.Дж. (2019). «Диетические и фармакологические дозы цинка: клинический обзор». Клин Нутр . 130 (5): 1345–1353. дои : 10.1016/j.clnu.2019.06.024 . ПМИД 31303527 . S2CID 196616666 .
- ^ Бхутта З.А., Берд С.М., Блэк Р.Э., Браун К.Х., Гарднер Дж.М., Хидаят А., Хатун Ф., Марторелл Р. и др. (2000). «Терапевтические эффекты перорального приема цинка при острой и стойкой диарее у детей в развивающихся странах: объединенный анализ рандомизированных контролируемых исследований» . Американский журнал клинического питания . 72 (6): 1516–1522. дои : 10.1093/ajcn/72.6.1516 . ПМИД 11101480 .
- ^ Айдемир, ТБ; Бланшар, РК; Казинс, Р.Дж. (2006). «Прием цинка молодыми мужчинами изменяет экспрессию металлотионеина, переносчика цинка и цитокинов в популяциях лейкоцитов» . ПНАС . 103 (6): 1699–704. Бибкод : 2006PNAS..103.1699A . дои : 10.1073/pnas.0510407103 . ПМЦ 1413653 . ПМИД 16434472 .
- ^ Валко, М.; Моррис, Х.; Кронин, MTD (2005). «Металлы, токсичность и окислительный стресс» (PDF) . Современная медицинская химия . 12 (10): 1161–208. дои : 10.2174/0929867053764635 . ПМИД 15892631 . Архивировано из оригинала (PDF) 8 августа 2017 года.
- ^ Перейти обратно: а б с д и «Цинк – информационный бюллетень для работников здравоохранения» . Управление пищевых добавок, Национальные институты здравоохранения США. 11 февраля 2016 года . Проверено 7 января 2018 г.
- ^ Наулт Д., Мачинго Т.А., Шиппер А.Г., Антипорта Д.А., Хамель С., Нурузпур С., Константинидис М., Филлипс Е., Липски Э.А., Виланд Л.С. (май 2024 г.). «Цинк для профилактики и лечения простуды». Кокрейновская база данных Syst Rev (Систематический обзор). 5 (5): CD014914. дои : 10.1002/14651858.CD014914.pub2 . ПМИД 38719213 .
- ^ Science M, Джонстон Дж., Рот Д.Е., Гайятт Дж., Леб М. (июль 2012 г.). «Цинк для лечения простуды: систематический обзор и метаанализ рандомизированных контролируемых исследований» . CMAJ . 184 (10): Е551-61. дои : 10.1503/cmaj.111990 . ПМЦ 3394849 . ПМИД 22566526 .
- ^ «Простуда и насморк» . Центры США по контролю и профилактике заболеваний. 26 сентября 2017 г. Проверено 7 января 2018 г.
- ^ Сузуки Х, Асакава А, Ли Дж. Б., Цай М, Амитани Х, Охината К, Комаи М, Инуи А (2011). «Цинк как стимулятор аппетита – возможная роль цинка в прогрессировании таких заболеваний, как кахексия и саркопения». Недавние патенты на продукты питания, питание и сельское хозяйство . 3 (3): 226–231. дои : 10.2174/2212798411103030226 . ПМИД 21846317 .
- ^ Шэй, Нил Ф.; Мангиан, Хизер Ф. (2000). «Нейробиология пищевого поведения под влиянием цинка» . Журнал питания . 130 (5): 1493С–1499С. дои : 10.1093/jn/130.5.1493S . ПМИД 10801965 .
- ^ Рабинович Д., Смади Ю. (2019). «Цинк». StatPearls [Интернет] . ПМИД 31613478 .
- ^ Эванс-младший, Лоуренсон Дж.Г. (2017). «Антиоксидантные витаминно-минеральные добавки для замедления прогрессирования возрастной макулярной дегенерации» . Cochrane Database Syst Rev. 7 (9): CD000254. дои : 10.1002/14651858.CD000254.pub4 . ПМК 6483465 . ПМИД 28756618 .
- ^ Свардфагер В., Херрманн Н., Макинтайр Р.С., Мазереу Г., Гольдбергер К., Ча Д.С., Шварц Ю., Ланкто К.Л. (июнь 2013 г.). «Потенциальная роль цинка в патофизиологии и лечении большого депрессивного расстройства». Неврология. Биоповедение. Преподобный . 37 (5): 911–929. doi : 10.1016/j.neubiorev.2013.03.018 . ПМИД 23567517 . S2CID 1725139 .
- ^ Исследования, Центр оценки лекарств и (16 ноября 2021 г.). «Вопросы и ответы: сообщения FDA считаются окончательным заказом и предлагаемым заказом на солнцезащитный крем, отпускаемый без рецепта» . FDA .
- ^ Чаухан, Рави; Кумар, Амит; Трипати, Рамна; Кумар, Ахилеш (2021), Маллакпур, Шадпур; Хуссейн, Чаудхери Мустансар (ред.), «Продвижение наночастиц оксида цинка для косметического применения» , Справочник по потребительским нанопродуктам , Сингапур: Springer, стр. 1–16, номер документа : 10.1007/978-981-15-6453-6_100-1 , ISBN 978-981-15-6453-6 , S2CID 245778598 , получено 31 октября 2022 г.
- ^ Ролдан, С.; Винкель, Э.Г.; Эррера, Д.; Санс, М.; Ван Винкельхофф, AJ (2003). «Влияние нового средства для полоскания рта, содержащего хлоргексидин, хлорид цетилпиридиния и лактат цинка, на микрофлору пациентов с неприятным запахом изо рта: двухцентровое двойное слепое плацебо-контролируемое исследование». Журнал клинической пародонтологии . 30 (5): 427–434. дои : 10.1034/j.1600-051X.2003.20004.x . ПМИД 12716335 .
- ^ «Зубные пасты» . www.ada.org . Проверено 27 сентября 2020 г.
- ^ Маркс, Р.; Пирс, AD; Уокер, AP (1985). «Влияние шампуня, содержащего пиритион цинка, на борьбу с перхотью». Британский журнал дерматологии . 112 (4): 415–422. дои : 10.1111/j.1365-2133.1985.tb02314.x . ПМИД 3158327 . S2CID 23368244 .
- ^ Махаджан, Б.Б.; Дхаван, М; Сингх, Р. (январь 2013 г.). «Генитальный герпес – сульфат цинка местного применения: альтернативное лечение и метод лечения» . Индийский журнал заболеваний, передающихся половым путем, и СПИДа . 34 (1): 32–4. дои : 10.4103/0253-7184.112867 . ПМЦ 3730471 . ПМИД 23919052 .
- ^ Коттон и др. 1999 , стр. 625–629
- ^ Слива, Лаура; Ринк, Лотар; Хаасе, Хаджо (2010). «Основной токсин: влияние цинка на здоровье человека» . Int J Environ Res Public Health . 7 (4): 1342–1365. дои : 10.3390/ijerph7041342 . ПМЦ 2872358 . ПМИД 20617034 .
- ^ Брандт, Эрик Г.; Хеллгрен, Микко; Бринк, Торе; Бергман, Томас; Эдхольм, Олле (2009). «Молекулярно-динамическое исследование связывания цинка с цистеинами в пептиде, имитирующем структурный участок цинка алкогольдегидрогеназы» . Физ. хим. хим. Физ . 11 (6): 975–83. Бибкод : 2009PCCP...11..975B . дои : 10.1039/b815482a . ПМИД 19177216 .
- ^ Перейти обратно: а б с Ринк, Л.; Габриэль П. (2000). «Цинк и иммунная система» . Проц Нутр Соц . 59 (4): 541–52. дои : 10.1017/S0029665100000781 . ПМИД 11115789 .
- ^ Вапнир, Рауль А. (1990). Белковое питание и усвоение минералов . Бока-Ратон, Флорида: CRC Press. ISBN 978-0-8493-5227-0 .
- ^ Берданье, Кэролайн Д.; Дуайер, Джоанна Т.; Фельдман, Элейн Б. (2007). Справочник по питанию и продуктам питания . Бока-Ратон, Флорида: CRC Press. ISBN 978-0-8493-9218-4 .
- ^ Миттермайер, Лоренц; Гудерманн, Томас; Захарян, Элеонора; Симмонс, Дэвид Г.; Браун, Владимир; Чубанов, Масаюки; Хильгендорф, Энн; Рекордати, Камилла; Брейт, Андреас (15 февраля 2019 г.). «TRPM7 является центральным контролером кишечной абсорбции минералов, необходимого для послеродового выживания» . Труды Национальной академии наук . 116 (10): 4706–4715. Бибкод : 2019PNAS..116.4706M . дои : 10.1073/pnas.1810633116 . ISSN 0027-8424 . ПМК 6410795 . ПМИД 30770447 .
- ^ Касана, Шахенабат; Дин, Джамиля; Марет, Вольфганг (январь 2015 г.). «Генетические причины и взаимодействие генов и питательных веществ при дефиците цинка у млекопитающих: энтеропатический акродерматит и транзиторный неонатальный дефицит цинка в качестве примеров». Журнал микроэлементов в медицине и биологии . 29 : 47–62. Бибкод : 2015JTEMB..29...47K . дои : 10.1016/j.jtemb.2014.10.003 . ISSN 1878-3252 . ПМИД 25468189 .
- ^ Джоко К.Ю., Онг К.Л., Уокер М.Дж., Макьюэн А.Г. (июль 2015 г.). «Роль токсичности меди и цинка во врожденной иммунной защите от бактериальных патогенов» . Журнал биологической химии . 290 (31): 18954–61. дои : 10.1074/jbc.R115.647099 . ПМК 4521016 . ПМИД 26055706 .
Zn присутствует примерно в 10% белков протеома человека, и компьютерный анализ показал, что ~30% из этих ~3000 Zn-содержащих белков являются важнейшими клеточными ферментами, такими как гидролазы, лигазы, трансферазы, оксидоредуктазы и изомеразы (42, 43).
- ^ Перейти обратно: а б Битанихирве Б.К., Каннингем М.Г. (ноябрь 2009 г.). «Цинк: темная лошадка мозга». Синапс . 63 (11): 1029–1049. дои : 10.1002/syn.20683 . ПМИД 19623531 . S2CID 206520330 .
- ^ Накашима А.С.; Дайк Р.Х. (2009). «Цинк и кортикальная пластичность». Мозговой Res Rev. 59 (2): 347–73. дои : 10.1016/j.brainresrev.2008.10.003 . ПМИД 19026685 . S2CID 22507338 .
- ^ Тышка-Чохара М, Гживач А, Гдула-Аргасиньска Дж, Либровски Т, Вилиньски Б, Опока В (май 2014 г.). «Роль цинка в патогенезе и лечении заболеваний центральной нервной системы (ЦНС). Влияние гомеостаза цинка на правильное функционирование ЦНС» (PDF) . Акта Пол. Фарм . 71 (3): 369–377. ПМИД 25265815 . Архивировано (PDF) из оригинала 29 августа 2017 г.
- ^ Йокель, Р.А. (2006). «Поток алюминия, марганца, железа и других металлов через гематоэнцефалический барьер, предположительно способствующих нейродегенерации, вызванной металлами». Журнал болезни Альцгеймера . 10 (2–3): 223–53. дои : 10.3233/JAD-2006-102-309 . ПМИД 17119290 .
- ^ Перейти обратно: а б с д и Медицинский институт (2001). «Цинк» . Рекомендуемая диетическая норма витамина А, витамина К, мышьяка, бора, хрома, меди, йода, железа, марганца, молибдена, никеля, кремния, ванадия и цинка . Вашингтон, округ Колумбия: Издательство Национальной академии. стр. 442–501. дои : 10.17226/10026 . ISBN 978-0-309-07279-3 . ПМИД 25057538 . Архивировано из оригинала 19 сентября 2017 года.
- ^ Стипанюк, Марта Х. (2006). Биохимические, физиологические и молекулярные аспекты питания человека . Компания WB Saunders. стр. 1043–1067. ISBN 978-0-7216-4452-3 .
- ^ Перейти обратно: а б Гринвуд и Эрншоу, 1997 , стр. 1224–1225.
- ^ Коэн, Амнон; Лимбах, Ганс-Генрих (2006). Изотопные эффекты в химии и биологии . Бока-Ратон, Флорида: CRC Press. п. 850. ИСБН 978-0-8247-2449-8 .
- ^ Перейти обратно: а б Гринвуд и Эрншоу 1997 , с. 1225
- ^ Коттон и др. 1999 , с. 627
- ^ Гадаллах, Массачусетс (2000). «Влияние индол-3-уксусной кислоты и цинка на рост, осмотический потенциал и растворимые углеродные и азотные компоненты растений сои, растущих в условиях дефицита воды». Журнал засушливой среды . 44 (4): 451–467. Бибкод : 2000JArEn..44..451G . дои : 10.1006/jare.1999.0610 .
- ^ Зилиотто, Сильвия; Огл, Оливия; Яйлор, Кэтрин М. (2018). «Глава 17. Нацеливание на передачу сигналов цинка (II) для предотвращения рака». В Сигеле, Астрид; Сигель, Хельмут; Фрейзингер, Ева; Сигел, Роланд КО (ред.). Металло-лекарства: разработка и действие противораковых средств . Том. 18. Берлин: де Грюйтер ГмбХ. стр. 507–529. дои : 10.1515/9783110470734-023 . ISBN 9783110470734 . ПМИД 29394036 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Коттон и др. 1999 , с. 628
- ^ Уитни, Элеонора Носс; Рольфес, Шэрон Рэди (2005). Понимание питания (10-е изд.). Томсон Обучение. стр. 447–450. ISBN 978-1-4288-1893-4 .
- ^ Хершфинкель, М; Сильверман В.Ф.; Секлер I (2007). «Рецептор, чувствительный к цинку, связь между цинком и передачей сигналов в клетках» . Молекулярная медицина . 13 (7–8): 331–336. doi : 10.2119/2006-00038.Hershfinkel . ЧВК 1952663 . ПМИД 17728842 .
- ^ Коттон и др. 1999 , с. 629
- ^ Блейк, Стив (2007). Демистификация витаминов и минералов . МакГроу-Хилл Профессионал. п. 242. ИСБН 978-0-07-148901-0 .
- ^ Перейти обратно: а б с Фосмир, Дж.Дж. (1990). «Цинковая токсичность». Американский журнал клинического питания . 51 (2): 225–7. дои : 10.1093/ajcn/51.2.225 . ПМИД 2407097 .
- ^ Краузе Дж. (2008). «ОФЭКТ и ПЭТ переносчика дофамина при синдроме дефицита внимания и гиперактивности». Эксперт преподобный Нейротер . 8 (4): 611–625. дои : 10.1586/14737175.8.4.611 . ПМИД 18416663 . S2CID 24589993 .
- ^ Зульцер Д. (2011). «Как наркотики, вызывающие привыкание, нарушают пресинаптическую дофаминовую нейротрансмиссию» . Нейрон . 69 (4): 628–649. дои : 10.1016/j.neuron.2011.02.010 . ПМК 3065181 . ПМИД 21338876 .
- ^ Перейти обратно: а б Шольце П., Норрегаард Л., Сингер Э.А., Фрейссмут М., Гетер Ю., Ситте Х.Х. (2002). «Роль ионов цинка в обратном транспорте, опосредованном переносчиками моноаминов» . Ж. Биол. Хим . 277 (24): 21505–21513. дои : 10.1074/jbc.M112265200 . ПМИД 11940571 .
Транспортер дофамина человека (hDAT) содержит эндогенный цинк с высоким сродством. 2+ сайт связывания с тремя координирующими остатками на внеклеточной поверхности (His193, His375 и Glu396). ... Таким образом, когда Zn 2+ высвобождается совместно с глутаматом, он может значительно увеличить отток дофамина.
- ^ Цветков, П.О.; Роман, А.Ю.; Бакшеева В.Е.; Назипова А.А.; Шевелева, народный депутат; Владимиров В.И.; Буянова, М.Ф.; Зинченко Д.В.; Замятнин А.А., младший; Девред, Ф; Головин А.В.; Пермяков С.Е.; Зерний, EY (2018). «Функциональное состояние нейронального датчика кальция-1 модулируется связыванием цинка» . Границы молекулярной нейронауки . 11 : 459. дои : 10.3389/fnmol.2018.00459 . ПМК 6302015 . ПМИД 30618610 .
- ^ Перейти обратно: а б «Обзор диетических эталонных значений для населения ЕС, составленный Группой EFSA по диетическим продуктам, питанию и аллергиям» (PDF) . 2017. Архивировано (PDF) из оригинала 28 августа 2017 года.
- ^ Допустимые верхние уровни потребления витаминов и минералов (PDF) , Европейское управление по безопасности пищевых продуктов, 2006 г., заархивировано (PDF) из оригинала 16 марта 2016 г.
- ^ «Федеральный реестр, 27 мая 2016 г. Маркировка пищевых продуктов: пересмотренная версия этикеток с информацией о пищевой ценности и пищевых добавках. Страница FR 33982» (PDF) . Архивировано (PDF) из оригинала 8 августа 2016 г.
- ^ «Справочник по дневной норме базы данных этикеток пищевых добавок (DSLD)» . База данных этикеток пищевых добавок (DSLD) . Архивировано из оригинала 7 апреля 2020 года . Проверено 16 мая 2020 г.
- ^ Энсмингер, Одри Х.; Конланде, Джеймс Э. (1993). Энциклопедия продуктов и питания (2-е изд.). Бока-Ратон, Флорида: CRC Press. стр. 2368–2369. ISBN 978-0-8493-8980-1 .
- ^ «Содержание цинка в отдельных продуктах в пересчете на обычную меру» (PDF) . Национальная база данных по питательным веществам Министерства сельского хозяйства США для стандартных справок, выпуск 20 . Министерство сельского хозяйства США . Архивировано из оригинала (PDF) 5 марта 2009 г. Проверено 6 декабря 2007 г.
- ^ Перейти обратно: а б Аллен, Линдси Х. (1998). «Пищевые добавки с цинком и микроэлементами для детей» . Американский журнал клинического питания . 68 (2 доп.): 495S–498S. дои : 10.1093/ajcn/68.2.495S . ПМИД 9701167 .
- ^ Росадо, JL (2003). «Цинк и медь: предлагаемые уровни обогащения и рекомендуемые соединения цинка» . Журнал питания . 133 (9): 2985С–9С. дои : 10.1093/jn/133.9.2985S . ПМИД 12949397 .
- ^ Хотц, К.; ДеХэн, Дж.; Вудхаус, LR; Вильяльпандо, С.; Ривера, Дж.А.; Кинг, Джей Си (2005). «Абсорбция цинка из оксида цинка, сульфата цинка, оксида цинка + ЭДТА или натрий-цинковой ЭДТА не отличается при добавлении в качестве обогатителя к кукурузным лепешкам» . Журнал питания . 135 (5): 1102–5. дои : 10.1093/jn/135.5.1102 . ПМИД 15867288 .
- ^ Перейти обратно: а б «Влияние добавок цинка на детскую смертность и тяжелую заболеваемость» . Всемирная организация здравоохранения. 2007. Архивировано из оригинала 2 марта 2009 года.
- ^ Шримптон, Р.; Гросс Р; Дарнтон-Хилл I; Молодой М (2005). «Дефицит цинка: какие меры наиболее целесообразны?» . Британский медицинский журнал . 330 (7487): 347–349. дои : 10.1136/bmj.330.7487.347 . ПМЦ 548733 . ПМИД 15705693 .
- ^ Мошфег, Аланна; Гольдман, Джозеф; Кливленд, Линда (2005). «NHANES 2001–2002: Обычное потребление питательных веществ из пищи по сравнению с эталонным потреблением питательных веществ» (PDF) . Министерство сельского хозяйства США, Служба сельскохозяйственных исследований. Таблица A13: Цинк . Проверено 6 января 2015 г.
- ^ Что мы едим в Америке, NHANES 2013–2014. Архивировано 24 февраля 2017 года в Wayback Machine .
- ^ Ибс, К.Х.; Ринк Л. (2003). «Цинк-измененная иммунная функция» . Журнал питания . 133 (5 Приложение 1): 1452С–1456С. дои : 10.1093/jn/133.5.1452S . ПМИД 12730441 .
- ^ Перейти обратно: а б с Американская диетическая ассоциация (2003). «Позиция Американской диетической ассоциации и диетологов Канады: вегетарианская диета» (PDF) . Журнал Американской диетической ассоциации . 103 (6): 748–765. дои : 10.1053/jada.2003.50142 . ПМИД 12778049 . Архивировано (PDF) из оригинала 14 января 2017 г.
- ^ Фриланд-Грейвс Дж. Х.; Бодзий П.В.; Эпрайт М.А. (1980). «Цинковый статус вегетарианцев». Журнал Американской диетической ассоциации . 77 (6): 655–661. дои : 10.1016/S1094-7159(21)03587-X . ПМИД 7440860 . S2CID 8424197 .
- ^ Хэмбидж, М. (2003). «Биомаркеры потребления и статуса микроэлементов» . Журнал питания . 133. 133 (3): 948С–955С. дои : 10.1093/jn/133.3.948S . ПМИД 12612181 .
- ^ Джеффри Майкл Гэдд (март 2010 г.). «Металлы, минералы и микробы: геомикробиология и биоремедиация» . Микробиология . 156 (3): 609–643. дои : 10.1099/mic.0.037143-0 . ПМИД 20019082 . Архивировано из оригинала 25 октября 2014 года.
- ^ Аллоуэй, Брайан Дж. (2008). «Цинк в почвах и питании сельскохозяйственных культур, Международная ассоциация производителей удобрений и Международная ассоциация цинка» . Архивировано из оригинала 19 февраля 2013 года.
- ^ Эйслер, Рональд (1993). «Опасность цинка для рыб, дикой природы и беспозвоночных: обзорный обзор» . Обзоры опасностей загрязняющих веществ (10). Лорел, Мэриленд: Министерство внутренних дел США, Служба рыболовства и дикой природы. Архивировано (PDF) из оригинала 6 марта 2012 г.
- ^ Мюссен, Брита Т.А.; Де Шамфелер, Карел АС; Янссен, Колин Р. (2006). «Механизмы хронической токсичности цинка, передаваемого через воду, у Daphnia magna». Водная токсикология . 77 (4): 393–401. Бибкод : 2006AqTox..77..393M . дои : 10.1016/j.aquatox.2006.01.006 . ПМИД 16472524 .
- ^ Ботвелл, Дон Н.; Майр, Эрик А.; Кейбл, Бенджамин Б. (2003). «Хроническое проглатывание монетки на основе цинка». Педиатрия . 111 (3): 689–91. дои : 10.1542/педс.111.3.689 . ПМИД 12612262 .
- ^ Джонсон А.Р.; Муньос А; Готлиб Дж.Л.; Джаррард Д.Ф. (2007). «Высокие дозы цинка увеличивают количество госпитализаций из-за мочеполовых осложнений». Дж. Урол . 177 (2): 639–43. дои : 10.1016/j.juro.2006.09.047 . ПМИД 17222649 .
- ^ Ричард Мартин (15 февраля 2010 г.). «В судебных процессах клеи для зубных протезов обвиняются в неврологических повреждениях (клеи для зубных протезов упоминаются в судебных процессах)» . «Санкт-Петербург Таймс» . Архивировано из оригинала 11 октября 2012 года . Проверено 31 декабря 2022 г.
- ^ Оксфорд, JS; Оберг, Бо (1985). Покорение вирусных заболеваний: актуальный обзор лекарств и вакцин . Эльзевир. п. 142. ИСБН 978-0-444-80566-9 .
- ^ «FDA заявляет, что назальные продукты Zicam вредят обонянию» . Лос-Анджелес Таймс . 17 июня 2009 г. Архивировано из оригинала 21 июня 2012 г.
- ^ Ламор С.Д.; Кабельо CM; Вондрак ГТ (2010). «Местный антимикробный пиритион цинка является индуктором реакции на тепловой шок, который вызывает повреждение ДНК и PARP-зависимый энергетический кризис в клетках кожи человека» . Клеточные стрессы и шапероны . 15 (3): 309–22. дои : 10.1007/s12192-009-0145-6 . ПМК 2866994 . ПМИД 19809895 .
- ^ Барселу, Дональд Г.; Барселу, Дональд (1999). «Цинк». Клиническая токсикология . 37 (2): 279–292. дои : 10.1081/CLT-100102426 . ПМИД 10382562 .
- ^ Беннетт, Дэниел РМД; Бэрд, Кертис, доктор медицинских наук; Чан, Квок-Минг; Крукс, Питер Ф.; Бремнер, Седрик Г.; Готлиб, Майкл М.; Наритоку, Уэсли ЮМД (1997). «Токсичность цинка после массового проглатывания монет». Американский журнал судебной медицины и патологии . 18 (2): 148–153. дои : 10.1097/00000433-199706000-00008 . ПМИД 9185931 .
- ^ Фернбах, СК; Такер Г.Ф. (1986). «Проглатывание монеты: необычное появление копейки у ребенка». Радиология . 158 (2): 512. doi : 10.1148/radiology.158.2.3941880 . ПМИД 3941880 .
- ^ Стоу, CM; Нельсон, Р.; Вердин, Р.; Фангманн, Г.; Фредрик, П.; Уивер, Г.; Арендт, Т.Д. (1978). «Отравление фосфидом цинка у собак». Журнал Американской ветеринарной медицинской ассоциации . 173 (3): 270. PMID 689968 .
- ^ Рис, РЛ; Диксон, Д.Б.; Берроуз, П.Дж. (1986). «Токсичность цинка (новая проволочная болезнь) у вольерных птиц». Австралийский ветеринарный журнал . 63 (6): 199. doi : 10.1111/j.1751-0813.1986.tb02979.x . ПМИД 3767804 .
Библиография
[ редактировать ]- Чемберс, Уильям и Роберт (1901). Энциклопедия Чемберса: Словарь универсальных знаний (пересмотренная редакция). Лондон и Эдинбург: Компания JB Lippincott.
- Коттон, Ф. Альберт; Уилкинсон, Джеффри; Мурильо, Карлос А.; Бохманн, Манфред (1999). Продвинутая неорганическая химия (6-е изд.). John Wiley & Sons, Inc. Нью-Йорк: ISBN 978-0-471-19957-1 .
- Дэвид Р. Лиде, изд. (2006). Справочник по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press, Taylor & Francisco Group. ISBN 978-0-8493-0487-3 .
- Эмсли, Джон (2001). «Цинк» . Строительные блоки природы: Путеводитель по элементам от Аризоны . Оксфорд, Англия, Великобритания: Издательство Оксфордского университета. стр. 499–505 . ISBN 978-0-19-850340-8 .
- Гринвуд, штат Нью-Йорк; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 978-0-7506-3365-9 .
- Хейзерман, Дэвид Л. (1992). «Элемент 30: Цинк» . Изучение химических элементов и их соединений . Нью-Йорк: TAB Books. ISBN 978-0-8306-3018-9 .
- Лехто, РС (1968). «Цинк» . В Клиффорде А. Хэмпеле (ред.). Энциклопедия химических элементов . Нью-Йорк: Книжная корпорация Рейнхолда. стр. 822–830 . ISBN 978-0-442-15598-8 . LCCN 68-29938 .
- Ствертка, Альберт (1998). «Цинк» . Путеводитель по элементам (пересмотренная ред.). Издательство Оксфордского университета. ISBN 978-0-19-508083-4 .
- Уикс, Мария Эльвира (1933). «III. Некоторые металлы восемнадцатого века». Открытие элементов . Истон, Пенсильвания: Журнал химического образования. ISBN 978-0-7661-3872-8 .
Внешние ссылки
[ редактировать ]- Информационный бюллетень по цинку США. от Национальных институтов здравоохранения
- История и этимология цинка
- Статистика и информация Геологической службы США.
- Восстановители > Цинк
- Американская цинковая ассоциация Информация об использовании и свойствах цинка.
- ISZB Международное общество биологии цинка, основанное в 2008 году. Международная некоммерческая организация, объединяющая ученых, изучающих биологическое действие цинка.
- Zinc-UK Основана в 2010 году для объединения ученых Соединенного Королевства, работающих над цинком.
- Цинк в Периодической таблице видео (Ноттингемский университет)
- ZincBind – база данных биологических сайтов связывания цинка.


![{\displaystyle {\ce {2ZnS + 3O2 ->[t^o] 2ZnO + 2SO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/686cb2d7d73dea23bc0e3431bfab4016d5fd71ed)
![{\displaystyle {\ce {ZnO + C ->[950^oC] Zn + CO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1592f63fc0ae67a24850c33381264f5ca6bd1f55)
![{\displaystyle {\ce {ZnO + CO ->[950^oC] Zn + CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab85d04dfa0b8e0280b72062a5ecbe660fd247b1)


