Металлотионеин
| Надсемейство металлотионеинов (растения) | |||
|---|---|---|---|
 Бета-E-домен металлотионеина пшеницы Ec-1, связанный с ионами цинка . Цистеины — желтые, цинк — фиолетовые. ( PDB : 2КАК ) [1] | |||
| Идентификаторы | |||
| Символ | Металлотионеин_sfam | ||
| Пфам | PF00131 | ||
| ИнтерПро | ИПР003019 | ||
| |||
| Дрожжи МТ | |||
|---|---|---|---|
 Металлотионеин Saccharomyces cerevisiae МТ, связанный с меди ионами . Цистеины — желтые, медь — коричневые. ( PDB : 1AQS ) | |||
| Идентификаторы | |||
| Символ | Дрожжевой металлотионеин | ||
| Пфам | ПФ11403 | ||
| Пфам Клан | CL0461 | ||
| ИнтерПро | ИПР022710 | ||
| |||
| Цианобактериальный SmtA | |||
|---|---|---|---|
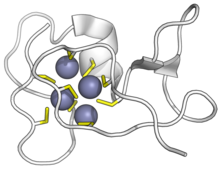 Цианобактериальный металлотионеин SmtA, связанный с ионами цинка. Цистеины — желтые, цинк — фиолетовые. ( PDB : 1JJD ) | |||
| Идентификаторы | |||
| Символ | Бактериальный металлотионеин | ||
| Пфам | PF02069 | ||
| Пфам Клан | CL0461 | ||
| ИнтерПро | IPR000518 | ||
| |||
Металлотионеин (МТ) представляет собой семейство цистеином богатых низкомолекулярных (ММ от 500 до 14000 Да ) белков . Локализуются на мембране аппарата Гольджи . МТ обладают способностью связывать как физиологические (такие как цинк , медь , селен ), так и ксенобиотические (такие как кадмий , ртуть , серебро , мышьяк , свинец ) тяжелые металлы посредством тиоловой группы остатков цистеина, которые составляют почти 30% его содержания. составляющие аминокислотные остатки. [2]
МТ был открыт в 1957 году Валле и Маргоше при очистке кадмий-связывающего белка из коры почек лошади . [3] МТ играет роль в защите от токсичности металлов и окислительного стресса , а также участвует в регуляции содержания цинка и меди. [4] У человека экспрессируются четыре основные изоформы (семейство 1, см. таблицу ниже): MT1 (подтипы A , B , E , F , G , H , L , M , X ), MT2 , MT3 и MT4 . В организме человека большие количества синтезируются преимущественно в печени и почках . Их производство зависит от наличия в рационе минералов, таких как цинк , медь и селен , а также аминокислот гистидина и цистеина.
Металлотионеины богаты тиолами, благодаря чему они связывают ряд микроэлементов. Металлотионеин — один из немногих эукариотических белков, играющих существенную роль в детоксикации металлов. Цинк и кадмий тетраэдрически координированы с остатками цистеина, а каждая молекула белка металлотионеина может связывать до 7 атомов Zn или Cd. [5] Биосинтез металлотионеина, по-видимому, увеличивается в несколько раз в периоды окислительного стресса, чтобы защитить клетки от цитотоксичности и повреждения ДНК. Биосинтез металлотионеина также может быть вызван некоторыми гормонами, фармацевтическими препаратами, спиртами и другими соединениями. [6] Экспрессия металлотионеина повышается во время развития плода, особенно в ткани печени. [7]
Структура и классификация
[ редактировать ]МТ присутствуют в широком диапазоне таксономических групп, начиная от прокариот (таких как цианобактерии Synechococcus sp. ), простейших (таких как инфузории рода Tetrahymena ), растений (таких как Pisum sativum , Triticum durum , Zea mays или Quercus suber). ), дрожжи (такие как Saccharomyces cerevisiae , Candida albicans или Neurospora crassa ), беспозвоночные (такие как нематода Caenorhabditis elegans , насекомое Drosophila melanogaster , моллюск Mytilus edulis или иглокожие Strongylocentrotus purpuratus ) и позвоночные животные (такие как курица Gallus) . Gallus , или млекопитающих Homo Sapiens или Mus musculus ).
МТ из этого разнообразного таксономического диапазона представляют собой последовательность с высокой гетерогенностью (относительно молекулярной массы, количества и распределения остатков Cys) и не проявляют общей гомологии; несмотря на это, гомология обнаруживается внутри некоторых таксономических групп (например, МТ позвоночных).
По своей первичной структуре МТ были классифицированы различными методами. Первый датируется 1987 годом, когда Фаулер и др. установили три класса МТ: класс I, включающий МТ, которые демонстрируют гомологию с МТ лошади, класс II, включающий остальные МТ, не имеющие гомологии с МТ лошади, и класс III, который включает фитохелатины , богатые Cys ферментативно синтезированные пептиды. .Вторая классификация была выполнена Бинцем и Каги в 2001 г. и учитывает таксономические параметры и закономерности распределения остатков Cys вдоль последовательности МТ.Это приводит к классификации 15 семейств белковых МТ. Семейство 15 содержит растительные МТ, которые в 2002 году были дополнительно классифицированы Коббетом и Голдсбро на 4 типа (1, 2, 3 и 4) в зависимости от распределения в них остатков Cys и областей, лишенных Cys (называемых спейсерами), характерных для завод МЦ.
Прилагается таблица, включающая основные аспекты двух последних классификаций.
| Семья | Имя | Шаблон последовательности | Пример |
|---|---|---|---|
| 1 | Позвоночные | Кх(1,2)-CCxCCPx(2)-C | Мышечная мышца MT1 MDPNCSCTTGGSCACAGSCKCKECKCTSCKKCCSCCPPVGCAKCAQGCVCKGSSEKCRCCA |
| 2 | Моллюск | CxCx(3)-CTGx(3)-CxCx(3)-CxCK | Митилус Эдулис 10MTIV MPAPCNCIETNVCICDTGCSGEGCRCGDACKCSGADCKCSGCKVVCKCSGSCACEGGCTGPSTCKCAPGCSCK |
| 3 | ракообразное | P-[GD]-PCCx(3,4)-CxC | Хомарус американский МТХ MPGPCCKDKCECAEGGCKTGCKCTSCRCAPCEKCTSGCKCPSKDECAKTCSKPCKCCP |
| 4 | Иглокожие | PDxKCVCCx(5)-CxCx(4)-CCx(4)-CCx(4,6)-CC | Strongylocentrotus purpuratus SpMTA MPDVKCVCCKEGKECACFGQDCCKTGECCKDGTCCGICTNAACKCANGCKCGSGCSCTEGNCAC |
| 5 | двукрылые | CGx(2)-CxCx(2)-Qx(5)-CxCx(2)DCxC | Дрозофила меланогастер MTNB MVCKGCGTNCQCSAQKCGDNCACNKDCQCVCKNGPKDQCCSNK |
| 6 | Нематоды | KCCx(3)-CC | Ценорхабдитис элегантный MT1 MACKCDCKNKQCKCGDKCECSGDKCCEKYCCEEASEKKCCPAGCKGDCKCANCHCAEQKQCGDKTHQHQGTAAAH |
| 7 | Инфузория | xCCCx ? | Тетрахимена термофила МТТ1 MDKVNSCCCGVNAKPCCTDPNSGCCCVSKTDNCCKSDTKECCTGTGEGCKCVNCKCCKPQANCCCGVNAKPCCFDPNSGCCCVSKTNNCCKSD TKECCTGTGEGCKCTSCQCCKPVQQGCCCGDKAKACCTDPNSGCCCSNKANKCCDATSKQECQTCQCCK |
| 8 | Грибок 1 | CGCSx(4)-CxCx(3,4)-CxCSxC | Нейроспора красса МТ MGDCGCSGASSCNCGSGCSCSNCGSK |
| 9 | Грибок 2 | --- | Кандида гладкая MT2 MANDCKCPNGCSCPNCANGGCQCGDKCECKKQSCHGCGEQCKCGSHGSSCHGSCGCGDKCECK |
| 10 | Грибок 3 | --- | Кандида гладкая MT2 MPEQVNCQYDCHCSNCACENTCNCCAKPACACTNSASNECSCQTCKCQTCKC |
| 11 | Грибок 4 | CXKCxCx(2)-CKC | Ярровия липолитика MT3 MEFTTAMLGASLISTTSTQSKHNLVNNCCCSSSTSESSMPASCACTKCGKKTCKC |
| 12 | Грибок 5 | --- | Сахаромицеты cerevisiae CUP1 MFSELINFQNEGHECQCQCGSCKNNEQCQKSCSCPTGCNSDDKCPCGNKSEETKKSCCSGK |
| 13 | Грибок 6 | --- | Сахаромицеты cerevisiae CRS5 TVKICDCEGECCKDSCHCGSTCLPSCSGGEKCKCDHSTGSPQCKSCGEKCKCETTCTCEKSKCNCEKC |
| 14 | Прокариота | KCACx(2)-CLC | Synechococcus sp SmtA MTTVTQMKCACPHCLCIVSLNDAIMVDGKPYCSEVCANGTCKENSGCGHAGCGCGSA |
| 15 | Растение | [YFH]-x(5,25)-C-[SKD]-C-[GA]-[SDPAT]-x(0,1)-Cx-[REF] | |
| 15.1 | Завод МЦ Тип 1 | CXCX(3)- CXCX(3)- CXCX(3)-проставка-CXCX(3)- CXCX(3)- CXCX(3) | Горох посевной MT MSGCGCGSSCNCGDSCKCNKRSSGLSYSEMETTETVILGVGPAKIQFEGAEMSAASEDGGCKCGDNCTCDPCNCK |
| 15.2 | Завод МЦ Тип 2 | CCX(3)-CXCX(3)- CXCX(3)- CXCX(3)-проставка- CXCX(3)- CXCX(3)- CXCX(3) | Ликоперсикон эскулентум МТ MSCCGGNCGCGSSCKCGNGCGGCKMYPDMSYTESSTTTTTLVLGVGPEKTSFGAMEMGESPVAENGCKCGSDCCNPCTCSK |
| 15.3 | Завод МЦ Тип 3 | --- | Арабидопсис Талиана MT3 MSSNCGSCDCADKTQCVKKGTSYTFDIVETQESYKEAMIMDVGAEENNANCKCKCGSSCSCVNCTCCPN |
| 15.4 | Завод МЦ Тип 4 или ЕС | Cx(4)-CXCX(3)-CX(5)-CXCX(9,11)-HTTCGCGEHC- XCX(20)-CSCGAXCNCASC-X(3,5) | Яровая пшеница МТ MGCNDKCGCAVPCPGGTGCRCTSARSDAAAGEHTTCGCGEHCGCNPCACGREGTPSGRANRRANCSCGAACNCASCGSTTA |
| 99 | Фитохелатины и другие небелковые МТ-подобные полипептиды. | --- | Шизосахаромицеты помбе γEC-γEC-γЭКГ |
Дополнительные данные об этой классификации можно найти на странице металлотионеина Expasy. [8]
Элементы вторичной структуры наблюдаются в нескольких МТ SmtA из Syneccochoccus , МТ3 млекопитающих, Echinoderma SpMTA, рыб Notothenia coriiceps MT, MTH ракообразных, но до настоящего момента содержание таких структур в МТ считается бедным, и их функциональное влияние невелико. не рассматривается.
Третичная структура МТ также весьма неоднородна. В то время как МТ позвоночных, иглокожих и ракообразных демонстрируют бидоминиальную структуру с двухвалентными металлами, такими как Zn(II) или Cd(II) (белок сложен так, что связывает металлы в двух функционально независимых доменах с металлическим кластером в каждом), дрожжи и прокариотические МТ МТ имеют монодоминальную структуру (один домен с одним металлическим кластером ). У дрожжей первые 40 остатков белка обволакивают металл, образуя две большие параллельные петли, разделенные глубокой щелью, содержащей металлический кластер. [9] Хотя структурные данные для МТ моллюсков, нематод и дрозофилы отсутствуют, обычно предполагается, что первые являются бидоминиальными, а вторые монодоминиальными. Для растительных МТ нет убедительных данных, но были предложены две возможные структуры: 1) бидоминиальная структура, аналогичная структуре МТ позвоночных; 2) кодоминиальная структура, в которой два богатых Cys домена взаимодействуют с образованием единого металлического кластера.
Четвертичная структура МТ широко не рассматривалась. Процессы димеризации и олигомеризации наблюдались и объяснялись несколькими молекулярными механизмами, включая образование межмолекулярных дисульфидов, мостиковое соединение металлов, связанных остатками Cys или His на различных МТ, или неорганические фосфат-опосредованные взаимодействия. Показано, что димерные и полимерные МТ приобретают новые свойства при детоксикации металлов, однако физиологическое значение этих процессов показано только на примере прокариотических Synechococcus SmtA. Димер МТ, продуцируемый этим организмом, образует структуры, подобные цинковым пальцам, и обладает Zn-регуляторной активностью.
Металлотионеины имеют разнообразные предпочтения в связывании металлов, которые связаны с функциональной специфичностью. Например, Mus musculus MT1 млекопитающих преимущественно связывает ионы двухвалентных металлов (Zn(II), Cd(II),...), тогда как CUP1 дрожжей селективен в отношении ионов одновалентных металлов (Cu(I), Ag(I), ...). Строго металлоселективные МТ с металлоспецифическими физиологическими функциями были открыты Dallinger et al. (1997) на легочных улитках (Gastropoda, Mollusca). [10] римская улитка ( Helix pomatia ) обладает Cd-селективной (CdMT) и Cu-селективной изоформой (CuMT), участвующими в детоксикации Cd и регуляции Cu соответственно. Например, [10] Хотя обе изоформы содержат неизменное количество и положение остатков Cys, ответственных за лигирование металлов, селективность по металлам, по-видимому, достигается за счет модуляции последовательности аминокислотных остатков, не участвующих непосредственно в связывании металлов (Palacios et al. 2011). [10] [11]
тионеинов . На основе этих функциональных предпочтений в настоящее время разрабатывается новая функциональная классификация МТ как Zn- или Cu-
Функция
[ редактировать ]Основная биологическая функция металлотионеинов заключается в поддержании гомеостаза незаменимых металлов цинка и меди , но металлотионеины также защищают от токсичности металлов и окислительного стресса . [12]
Металлический переплет
[ редактировать ]Доказано, что металлотионеин связывает широкий спектр металлов, включая кадмий, [13] вести, [14] цинк, ртуть, медь, мышьяк, серебро и т. д. Ранее сообщалось, что металлирование МТ происходит совместно. [ нужна ссылка ] но недавние отчеты предоставили убедительные доказательства того, что связывание металлов происходит посредством последовательного, некооперативного механизма. [15] Наблюдение за частично металлизированными МТ (то есть имеющими некоторую способность связывать свободные металлы) позволяет предположить, что эти виды биологически важны.
Металлотионеины, вероятно, участвуют в поглощении, транспортировке и регулировании цинка в биологических системах. МТ млекопитающих связывает три иона Zn(II) в своем бета-домене и четыре в альфа-домене. Цистеин – серосодержащая аминокислота, отсюда и название «-тионеин». Однако для некоторых форм МТ предполагается участие неорганических сульфид- и хлорид-ионов. В некоторых МТ, преимущественно бактериальных, гистидин участвует в связывании цинка. Связывая и высвобождая цинк, металлотионеины (МТ) могут регулировать уровень цинка в организме. Цинк, в свою очередь, является ключевым элементом для активации и связывания определенных факторов транскрипции благодаря его участию в области цинкового пальца белка. [16] [17] Металлотионеин также переносит ионы цинка (сигналы) из одной части клетки в другую. Когда цинк попадает в клетку, он может быть подхвачен тионеином (который, таким образом, становится «металлотионеином») и перенесен в другую часть клетки, где он высвобождается в другую органеллу или белок. [18] Таким образом, тионеин и металлотионеин становятся ключевыми компонентами сигнальной системы цинка в клетках. Эта система особенно важна в мозге, где передача сигналов цинка заметна как между нервными клетками, так и внутри них. Это также, по-видимому, важно для регуляции белка-супрессора опухоли p53.
Контроль окислительного стресса
[ редактировать ]Остатки цистеина из МТ могут захватывать вредные окислительные радикалы, такие как супероксидные и гидроксильные радикалы. [19] В этой реакции цистеин окисляется до цистина , а ионы металлов, которые были связаны с цистеином, высвобождаются в среду. Как поясняется в разделе «Экспрессия и регуляция» , этот Zn может активировать синтез большего количества МТ. Предполагается, что этот механизм является важным механизмом контроля окислительного стресса с помощью МТ. Роль МТ в снижении окислительного стресса была подтверждена мутантами с нокаутом MT, но некоторые эксперименты предполагают также прооксидантную роль МТ. [ нужна ссылка ]
В клетках млекопитающих спонтанный мутагенез в значительной степени обусловлен окислительным повреждением ДНК , возникновение такого повреждения может блокироваться металлотионеином. [20]
Металлотионеин также играет роль в дифференцировке и пролиферации гемопоэтических клеток, а также в предотвращении апоптоза рано дифференцированных клеток. Индуцированные уровни МТ были отрицательно связаны с чувствительностью к апоптозу, индуцированному этопозидом, что означает, что МТ является потенциальным негативным регулятором апоптоза. [21]
Выражение и регулирование
[ редактировать ]Экспрессия гена металлотионеина индуцируется множеством стимулов, таких как воздействие металлов, окислительный стресс, глюкокортикоиды, витамин D , водный стресс, голодание , физические упражнения и т. д. Бета-гидроксилбутирование белков - гистонов активирует MT2. [22] Уровень ответа на эти индукторы зависит от гена МТ. Гены MT представлены в своих промоторах специфическими последовательностями для регуляции экспрессии, элементами в виде элементов ответа на металлы (MRE), элементов ответа на глюкокортикоиды (GRE), GC-богатых боксов, элементов базального уровня (BLE) и элементов ответа щитовидной железы (TRE). . [23] [24]
Металлотионеин и болезни
[ редактировать ]Рак
[ редактировать ]Поскольку МТ играют важную роль в регуляции транскрипционных факторов, дефекты функции или экспрессии МТ могут привести к злокачественной трансформации клеток и, в конечном итоге, к раку . [25] Исследования обнаружили повышенную экспрессию МТ при некоторых видах рака молочной железы, толстой кишки, почек, печени, кожи (меланома), легких, носоглотки, яичников, простаты, рта, слюнной железы, яичек, щитовидной железы и мочевого пузыря; они также обнаружили более низкие уровни экспрессии МТ при гепатоцеллюлярной карциноме и аденокарциноме печени. [26]
Имеющиеся данные свидетельствуют о том, что более высокая экспрессия МТ может вызвать устойчивость к химиотерапии . [27]
Аутизм
[ редактировать ]Токсичность тяжелых металлов была предложена в качестве гипотетической этиологии аутизма , и в этом может играть роль дисфункция синтеза и активности МТ. Многие тяжелые металлы, в том числе ртуть , свинец и мышьяк, связаны с симптомами, напоминающими неврологические симптомы аутизма. [28] Однако дисфункция МТ не была конкретно связана с расстройствами аутистического спектра. Исследование 2006 года, в котором изучались дети, подвергшиеся воздействию вакцинного консерванта тиомерсала , показало, что уровни МТ и антител к МТ у детей с аутизмом существенно не отличаются от детей, не страдающих аутизмом. [29]
Низкое соотношение цинка и меди рассматривается как биомаркер аутизма и считается признаком поражения металлотионеиновой системы. [30]
Кроме того, есть признаки того, что уровень цинка у матери может повлиять на иммунологическое состояние развивающегося ребенка, что может привести к аутизму и снова может быть признаком поражения металлотионеиновой системы. [31]
Роль металлотионеина в сердечно-сосудистых заболеваниях
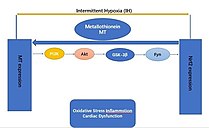
[ редактировать ]Металлотионеин (МТ) является косвенным регулятором окислительно-восстановительного баланса, который регулирует фактор 2, связанный с ядерным фактором эритроцитов 2 (Nrf2) в организме. Однако МТ играет важную роль в противотравматической защите сердечно-сосудистой системы, главным образом благодаря своему ингибирующему действию на ишемически-реперфузионное повреждение. Кроме того, активация MT Nrf2 опосредует защиту кардиомиопатии от перемежающейся гипоксии (ИГ). [32]
Трансгенные мыши с делецией любого гена Nrf2 (Nrf2-KO) высоко восприимчивы к сердечно-сосудистым эффектам периодической гипоксии (ИГ) через окислительное повреждение сердца, воспаление, фиброз и дисфункцию. [32]
Более того, специфическая сверхэкспрессия Nrf2 (Nrf2-TG) в кардиомиоцитах у трансгенных мышей [KC1] невосприимчива к окислительному повреждению сердца, воспалению, фиброзу и дисфункции, вызванным периодической гипоксией (IH) [KC2]. В ответ на ИГ Nrf2 и его нижестоящие антиоксиданты сильно зависят от MT Nrf2 и могут [KC3] действовать как компенсаторный ответ на воздействие ИГ путем активации MT (нижних генов-мишеней антиоксидантов) для защиты сердца. [32]
Длительное воздействие ИГ снижает связывание фактора Nrf2 с геном промотора МТ, тем самым ингибируя трансляцию и экспрессию МТ. Более того, сложная сигнальная сеть PI3K/Akt/GSK3B/Fyn обеспечивает кардиозащиту от ИГ, когда Nrf2 или MT сверхэкспрессируются в сердце. Активируя сигнальный путь PI3K/Akt/GSK3B/Fyn, MT увеличивает экспрессию Nrf2 и транскрипционную функцию в ответ на воздействие ИГ. Хотя эти эффекты еще не доказаны, эти эффекты позволяют предположить, что можно активировать PI3K/Akt/GSK3B/Fyn-зависимые сигнальные пути посредством сверхэкспрессии сердечного МТ, чтобы предотвратить хроническую ИГ-индуцированную кардиомиопатию и подавление Nrf2. [32]
Таким образом, Nrf2 или МТ могут быть потенциальным средством лечения хронической ИГ-индуцированной кардиомиопатии.
| Идентификаторы | |
|---|---|
| Символ | Человеческий металлотионеин |
| PDB-код | 2FJ4 |
| Классификация | Металлосвязывающий белок |
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ ВВП : 2КАК ; Пероза Э.А., Шмуки Р., Гюнтерт П., Фрейзингер Э., Зербе О (март 2009 г.). «Бета (E)-домен металлотионеина E (c)-1 пшеницы: металлсвязывающий домен с отличительной структурой». Журнал молекулярной биологии . 387 (1): 207–18. дои : 10.1016/j.jmb.2009.01.035 . ПМИД 19361445 .
- ^ Сигел Х, Сигел А, ред. (2009). Металлотионеины и родственные им хелаторы (ионы металлов в науках о жизни) . Том. 5. Кембридж, Англия: Королевское химическое общество. ISBN 978-1-84755-899-2 .
- ^ Маргошес М., Валле Б.Л. (1957). «Белок кадмия из коры почек лошади». Журнал Американского химического общества . 79 (17): 4813–4814. дои : 10.1021/ja01574a064 .
- ^ Фелисола С.Дж., Накамура Ю., Арата Ю., Исе К., Сато Ф., Рейни В.Е., Мидорикава С., Сузуки С., Сасано Х. (сентябрь 2014 г.). «Металлотионеин-3 (МТ-3) в коре надпочечников человека и его нарушения». Эндокринная патология . 25 (3): 229–35. дои : 10.1007/s12022-013-9280-9 . ПМИД 24242700 . S2CID 39871076 .
- ^ Сухи Д.А., Саймон К.Д., Линцер Д.И., O'Halloran TV (апрель 1999 г.). «Металлотионеин является частью механизма удаления цинка, обеспечивающего выживание клеток в условиях крайнего дефицита цинка» . Журнал биологической химии . 274 (14): 9183–92. дои : 10.1074/jbc.274.14.9183 . ПМИД 10092590 .
- ^ Ван В.К., Мао Х., Ма Д.Д., Ян В.С. (август 2014 г.). «Характеристики, функции и применение металлотионеина у водных позвоночных» . Границы морской науки . 1 : 34. дои : 10.3389/fmars.2014.00034 .
- ^ Чериан М.Г. (сентябрь 1994 г.). «Значение ядерной и цитоплазматической локализации металлотионеина в печени и опухолевых клетках человека» . Перспективы гигиены окружающей среды . 102 (Приложение 3): 131–5. дои : 10.2307/3431776 . JSTOR 3431776 . ПМЦ 1567399 . ПМИД 7843087 .
- ^ «Металлотионеины: классификация и список позиций» . www.uniprot.org.
- ^ Петерсон CW, Нарула СС, Армитидж IM (январь 1996 г.). «Трехмерная структура раствора медь- и сереброзамещенных дрожжевых металлотионеинов» . Письма ФЭБС . 379 (1): 85–93. дои : 10.1016/0014-5793(95)01492-6 . PMID 8566237 .
- ^ Jump up to: а б с Даллинджер Р., Бергер Б., Хунцикер П., Кеги Дж.Х. (1997). «Металлотионеин в метаболизме Cd и Cu улиток» . Природа . 388 (6639): 237–238. Бибкод : 1997Natur.388..237D . дои : 10.1038/40785 . ПМИД 9230430 . S2CID 4404470 .
- ^ Паласиос О, Пагани А, Перес-Рафаэль С, Эгг М, Хекнер М, Брандштеттер А, Капдевила М, Атриан С, Даллинджер Р (январь 2011 г.). «Механизмы формирования металлоспецифичности в семействе металлотионеинов многоклеточных животных: эволюционная дифференциация металлотионеинов моллюсков» . БМК Биология . 9 (4): 4. дои : 10.1186/1741-7007-9-4 . ПМК 3033865 . ПМИД 21255385 .
- ^ Секованич А, Юрасович Ю, Пясек М (2020). «Полиморфизмы гена металлотионеина 2А в зависимости от заболеваний и уровней микроэлементов у человека» . Архив За Хигиену Рады и Токсикологии . 71 (1): 27–47. дои : 10.2478/aiht-2020-71-3349 . ПМЦ 7837243 . ПМИД 32597135 .
- ^ Фрейзингер Э., Вашак М (2013). «Кадмий в металлотионинах». Кадмий: от токсичности к незаменимости . Ионы металлов в науках о жизни. Том. 11. С. 339–71. дои : 10.1007/978-94-007-5179-8_11 . ISBN 978-94-007-5178-1 . ПМИД 23430778 .
- ^ Вонг Д.Л., Меррифилд-Макрей М.Э., Стиллма М.Дж. (2017). «Глава 9. Связывание свинца (II) в металлотионеинах». В Астрид С., Хельмут С., Сигел Р.К. (ред.). Свинец: его влияние на окружающую среду и здоровье . Ионы металлов в науках о жизни. Том. 17. де Грюйтер. стр. 241–270. дои : 10.1515/9783110434330-009 . ПМИД 28731302 .
- ^ Крезель А., Марет В. (сентябрь 2007 г.). «Двойные наномолярные и пикомолярные свойства металлотионеина связывания Zn (II)». Журнал Американского химического общества . 129 (35): 10911–21. дои : 10.1021/ja071979s . ПМИД 17696343 .
- ^ Хуан М., Крепкий Д., Ху В., Петеринг Д.Х. (май 2004 г.). «Zn-, Cd- и Pb-фактор транскрипции IIIA: свойства, связывание ДНК и сравнение с комплексами металлов TFIIIA-палец 3» . Журнал неорганической биохимии . 98 (5): 775–85. дои : 10.1016/j.jinorgbio.2004.01.014 . ПМЦ 3516448 . ПМИД 15134923 .
- ^ Хуанг М., Шоу III CF, Петеринг Д.Х. (апрель 2004 г.). «Межбелковый обмен металлов между фактором транскрипции IIIa и апо-металлотионеином» . Журнал неорганической биохимии . 98 (4): 639–48. дои : 10.1016/j.jinorgbio.2004.02.004 . ПМЦ 3535305 . ПМИД 15041244 .
- ^ Паласиос О, Атриан С, Капдевила, М (2011). «Zn- и Cu-тионеины: функциональная классификация металлотионеинов?». Журнал биологической неорганической химии . 16 (7): 991–1009. дои : 10.1007/s00775-011-0827-2 . ПМИД 21823038 . S2CID 26786966 .
- ^ Кумари М.В., Хирамацу М., Эбади М. (август 1998 г.). «Действие изоформ I и II металлотионеина по улавливанию свободных радикалов». Свободные радикальные исследования . 29 (2): 93–101. дои : 10.1080/10715769800300111 . ПМИД 9790511 .
- ^ Россман Т.Г., Гончарова Е.И. Спонтанный мутагенез в клетках млекопитающих вызван главным образом окислительными событиями и может блокироваться антиоксидантами и металлотионеином. Мутат Рес. 18 июня 1998 г.; 402(1-2):103-10. doi: 10.1016/s0027-5107(97)00287-x. ПМИД 9675254
- ^ Такахаши С. (июль 2012 г.). «Молекулярные функции металлотионеина и его роль в гематологических злокачественных новообразованиях» . Журнал гематологии и онкологии . 5 (1): 41. дои : 10.1186/1756-8722-5-41 . ПМЦ 3419633 . ПМИД 22839501 .
- ^ Стаббс Б.Дж., Кутник А.П., Волек Дж.С., Ньюман Дж.К. (2021). «От постели до поля битвы: пересечение механизмов кетонового тела в геронауке с военной устойчивостью» . Геронаука . 43 (3): 1071–1081. дои : 10.1007/s11357-020-00277-y . ПМК 8190215 . ПМИД 33006708 .
- ^ Клаассен К.Д., Лю Дж., Чоудхури С. (1999). «Металлотионеин: внутриклеточный белок для защиты от токсичности кадмия». Ежегодный обзор фармакологии и токсикологии . 39 : 267–94. doi : 10.1146/annurev.pharmtox.39.1.267 . ПМИД 10331085 .
- ^ Мостафа В.З., Хегази РА (ноябрь 2015 г.). «Витамин D и кожа: фокус на сложных отношениях: обзор» . Журнал перспективных исследований . 6 (6): 793–804. дои : 10.1016/j.jare.2014.01.011 . ПМЦ 4642156 . ПМИД 26644915 .
- ^ Krizkova S, Fabrik I, Adam V, Hrabeta J, Eckschlager T, Kizek R (2009). "Metallothionein--a promising tool for cancer diagnostics". Bratislavske Lekarske Listy . 110 (2): 93–7. PMID 19408840 .
- ^ Чериан М.Г., Джаясурья А., Бэй Б.Х. (декабрь 2003 г.). «Металлотионеины в опухолях человека и потенциальная роль в канцерогенезе». Мутационные исследования . 533 (1–2): 201–9. дои : 10.1016/j.mrfmmm.2003.07.013 . ПМИД 14643421 .
- ^ Басу А., Кришнамурти С. (август 2010 г.). «Клеточные ответы на повреждение ДНК, вызванное цисплатином» . Журнал нуклеиновых кислот . 2010 : 1–16. дои : 10.4061/2010/201367 . ПМК 2929606 . ПМИД 20811617 .
- ^ Барабан DA (октябрь 2009 г.). «Уничтожают ли токсичные биометаллы будущее ваших детей?». Биометаллы . 22 (5): 697–700. дои : 10.1007/s10534-009-9212-9 . ПМИД 19205900 . S2CID 31579963 .
- ^ Сингх В.К., Хэнсон Дж. (июнь 2006 г.). «Оценка металлотионеина и антител к металлотионеину у нормальных детей и детей с аутизмом, подвергшихся воздействию тимеросала вакцинного происхождения». Детская аллергия и иммунология . 17 (4): 291–6. дои : 10.1111/j.1399-3038.2005.00348.x . ПМИД 16771783 . S2CID 2843402 .
- ^ Фабер С., Зинн Г.М., Керн Дж.К., Кингстон Х.М. (май 2009 г.). «Соотношение цинка в плазме и меди в сыворотке крови как биомаркер у детей с расстройствами аутистического спектра». Биомаркеры . 14 (3): 171–80. дои : 10.1080/13547500902783747 . ПМИД 19280374 . S2CID 205770002 .
- ^ Вела Г., Старк П., Соча М., Зауэр А.К., Хагмейер С., Грабрукер А.М. (2015). «Цинк во взаимодействии кишечника и мозга при аутизме и неврологических расстройствах» . Нейронная пластичность . 2015 : 972791. doi : 10.1155/2015/972791 . ПМЦ 4386645 . ПМИД 25878905 .
- ^ Jump up to: а б с д Чжоу С., Инь Х, Цзинь Дж., Тан Ю., Конклин Д.Д., Синь Ю. и др. (ноябрь 2017 г.). «Интермиттирующая кардиомиопатия, вызванная гипоксией, и ее профилактика с помощью Nrf2 и металлотионеина» . Свободно-радикальная биология и медицина . 112 : 224–239. doi : 10.1016/j.freeradbiomed.2017.07.031 . ПМЦ 7453314 . ПМИД 28778483 .
Дальнейшее чтение
[ редактировать ]- Чериан М.Г., Джаясурья А., Бэй Б.Х. (декабрь 2003 г.). «Металлотионеины в опухолях человека и потенциальная роль в канцерогенезе». Мутационные исследования . 533 (1–2): 201–9. дои : 10.1016/j.mrfmmm.2003.07.013 . ПМИД 14643421 .
