Развивающее биоэлектричество
Данная статья может содержать чрезмерное количество цитат . ( Ноябрь 2023 г. ) |

Биоэлектричество развития — это регуляция формирования и поведения на уровне клеток , тканей и органов с помощью электрических сигналов во время развития эмбриональных животных и растений . Носителем заряда в развивающемся биоэлектричестве является ион (заряженный атом), а не электрон , и электрический ток и поле генерируются всякий раз, когда возникает чистый поток ионов. Клетки и ткани всех типов используют потоки ионов для электрической связи. Эндогенные электрические токи и поля , потоки ионов и различия в потенциале покоя в тканях составляют сигнальную систему. Он функционирует вместе с биохимическими факторами, транскрипционными сетями и другими физическими силами, регулируя поведение клеток и крупномасштабное формирование паттернов в таких процессах, как эмбриогенез , регенерация и подавление рака .
Overview
[edit]Developmental bioelectricity is a sub-discipline of biology, related to, but distinct from, neurophysiology and bioelectromagnetics. Developmental bioelectricity refers to the endogenous ion fluxes, transmembrane and transepithelial voltage gradients, and electric currents and fields produced and sustained in living cells and tissues.[2][3] This electrical activity is often used during embryogenesis, regeneration, and cancer suppression—it is one layer of the complex field of signals that impinge upon all cells in vivo and regulate their interactions during pattern formation and maintenance. This is distinct from neural bioelectricity (classically termed electrophysiology), which refers to the rapid and transient spiking in well-recognized excitable cells like neurons and myocytes (muscle cells);[4] and from bioelectromagnetics, which refers to the effects of applied electromagnetic radiation, and endogenous electromagnetics such as biophoton emission and magnetite.[5][6]


The inside/outside discontinuity at the cell surface enabled by a lipid bilayer membrane (capacitor) is at the core of bioelectricity. The plasma membrane was an indispensable structure for the origin and evolution of life itself. It provided compartmentalization permitting the setting of a differential voltage/potential gradient (battery or voltage source) across the membrane, probably allowing early and rudimentary bioenergetics that fueled cell mechanisms.[9][10] During evolution, the initially purely passive diffusion of ions (charge carriers), become gradually controlled by the acquisition of ion channels, pumps, exchangers, and transporters. These energetically free (resistors or conductors, passive transport) or expensive (current sources, active transport) translocators set and fine tune voltage gradients – resting potentials – that are ubiquitous and essential to life's physiology, ranging from bioenergetics, motion, sensing, nutrient transport, toxins clearance, and signaling in homeostatic and disease/injury conditions. Upon stimuli or barrier breaking (short-circuit) of the membrane, ions powered by the voltage gradient (electromotive force) diffuse or leak, respectively, through the cytoplasm and interstitial fluids (conductors), generating measurable electric currents – net ion fluxes – and fields. Some ions (such as calcium) and molecules (such as hydrogen peroxide) modulate targeted translocators to produce a current or to enhance, mitigate or even reverse an initial current, being switchers.[11][12]
Endogenous bioelectric signals are produced in cells by the cumulative action of ion channels, pumps, and transporters. In non-excitable cells, the resting potential across the plasma membrane (Vmem) of individual cells propagate across distances via electrical synapses known as gap junctions (conductors), which allow cells to share their resting potential with neighbors. Aligned and stacked cells (such as in epithelia) generate transepithelial potentials (such as batteries in series) and electric fields, which likewise propagate across tissues.[13] Tight junctions (resistors) efficiently mitigate the paracellular ion diffusion and leakage, precluding the voltage short circuit. Together, these voltages and electric fields form rich and dynamic and patterns inside living bodies that demarcate anatomical features, thus acting like blueprints for gene expression and morphogenesis in some instances. More than correlations, these bioelectrical distributions are dynamic, evolving with time and with the microenvironment and even long-distant conditions to serve as instructive influences over cell behavior and large-scale patterning during embryogenesis, regeneration, and cancer suppression.[3][14][8][15][16] Bioelectric control mechanisms are an important emerging target for advances in regenerative medicine, birth defects, cancer, and synthetic bioengineering.[17][18]
History
[edit]18th century
[edit]Developmental bioelectricity began in the 18th century. Several seminal works stimulating muscle contractions using Leyden jars culminated with the publication of classical studies by Luigi Galvani in 1791 (De viribus electricitatis in motu musculari) and 1794. In these, Galvani thought to have uncovered intrinsic electric-producing ability in living tissues or "animal electricity". Alessandro Volta showed that the frog's leg muscle twitching was due to a static electricity generator and from dissimilar metals undergoing or catalyzing electrochemical reactions. Galvani showed, in a 1794 study, twitching without metal electricity by touching the leg muscle with a deviating cut sciatic nerve, definitively demonstrating "animal electricity".[19][20][21] Unknowingly, Galvani with this and related experiments discovered the injury current (ion leakage driven by the intact membrane/epithelial potential) and injury potential (potential difference between injured and intact membrane/epithelium). The injury potential was, in fact, the electrical source behind the leg contraction, as realized in the next century.[22][23] Subsequent work ultimately extended this field broadly beyond nerve and muscle to all cells, from bacteria to non-excitable mammalian cells.
19th century
[edit]Building on earlier studies, further glimpses of developmental bioelectricity occurred with the discovery of wound-related electric currents and fields in the 1840s, when the electrophysiologist Emil du Bois-Reymond reported macroscopic level electrical activities in frog, fish and human bodies. He recorded minute electric currents in live tissues and organisms with a then state-of-the-art galvanometer made of insulated copper wire coils. He unveiled the fast-changing electricity associated with muscle contraction and nerve excitation – the action potentials.[24][25][26] Du Bois-Reymond also reported in detail less fluctuating electricity at wounds – injury current and potential – he made to himself.[27][28]

Early 20th century
[edit]Developmental bioelectricity work began in earnest at the beginning of the 20th century.[30] Ida H. Hyde studied the role of electricity in the development of eggs.[31]T. H. Morgan and others studied the electrophysiology of the earthworm.[32]Oren E. Frazee studied the effects of electricity on limb regeneration in amphibians.[33]E. J. Lund explored morphogenesis in flowering plants.[34]Libbie Hyman studied vertebrate and invertebrate animals.[35][36]
In the 1920s and 1930s, Elmer J. Lund[37] and Harold Saxton Burr[38] wrote multiple papers about the role of electricity in embryonic development.[29] Lund measured currents in a large number of living model systems, correlating them to changes in patterning. In contrast, Burr used a voltmeter to measure voltage gradients, examining developing embryonic tissues and tumors, in a range of animals and plants. Applied electric fields were demonstrated to alter the regeneration of planarian by Marsh and Beams in the 1940s and 1950s,[39][40] inducing the formation of heads or tails at cut sites, reversing the primary body polarity.
Late 20th century
[edit]In the 1970s, Lionel Jaffe and Richard Nuccittelli's introduction and development of the vibrating probe, the first device for quantitative non-invasive characterization of the extracellular minute ion currents, revitalized the field.[41][42][43][44][45]
Researchers such as Joseph Vanable, Richard Borgens, Ken Robinson, and Colin McCaig explored the roles of endogenous bioelectric signaling in limb development and regeneration, embryogenesis, organ polarity, and wound healing.[46][47][23][48]
C.D. Cone studied the role of resting potential in regulating cell differentiation and proliferation.[49][50] Subsequent work has identified specific regions of the resting potential spectrum that correspond to distinct cell states such as quiescent, stem, cancer, and terminally differentiated.[51]
Although this body of work generated a significant amount of high-quality physiological data, this large-scale biophysics approach has historically come second to the study of biochemical gradients and genetic networks in biology education, funding, and overall popularity among biologists. A key factor that contributed to this field lagging behind molecular genetics and biochemistry is that bioelectricity is inherently a living phenomenon – it cannot be studied in fixed specimens. Working with bioelectricity is more complex than traditional approaches to developmental biology, both methodologically and conceptually, as it typically requires a highly interdisciplinary approach.[15]
Study techniques
[edit]Electrodes
[edit]The gold standard techniques to quantitatively extract electric dimensions from living specimens, ranging from cell to organism levels, are the glass microelectrode (or micropipette), the vibrating (or self-referencing) voltage probe, and the vibrating ion-selective microelectrode. The former is inherently invasive, and the two latter are non-invasive, but all are ultra-sensitive[52] and fast-responsive sensors extensively used in a plethora of physiological conditions in widespread biological models.[53][54][11][55][23][excessive citations]
The glass microelectrode was developed in the 1940s to study the action potential of excitable cells, deriving from the seminal work by Hodgkin and Huxley in the giant axon squid.[56][57] It is simply a liquid salt bridge connecting the biological specimen with the electrode, protecting tissues from leachable toxins and redox reactions of the bare electrode. Owing to its low impedance, low junction potential and weak polarization, silver electrodes are standard transducers of the ionic into electric current that occurs through a reversible redox reaction at the electrode surface.[58]
The vibrating probe was introduced in biological studies in the 1970s.[59][60][41] The voltage-sensitive probe is electroplated with platinum to form a capacitive black tip ball with large surface area. When vibrating in an artificial or natural DC voltage gradient, the capacitive ball oscillates in a sinusoidal AC output. The amplitude of the wave is proportional to the measuring potential difference at the frequency of the vibration, efficiently filtered by a lock-in amplifier that boosts probe's sensitivity.[41][61][62]
The vibrating ion-selective microelectrode was first used in 1990 to measure calcium fluxes in various cells and tissues.[63] The ion-selective microelectrode is an adaptation of the glass microelectrode, where an ion-specific liquid ion exchanger (ionophore) is tip-filled into a previously silanized (to prevent leakage) microelectrode. Also, the microelectrode vibrates at low frequencies to operate in the accurate self-referencing mode. Only the specific ion permeates the ionophore, therefore the voltage readout is proportional to the ion concentration in the measuring condition. Then, flux is calculated using the Fick's first law.[61][64]
Emerging optic-based techniques,[65] for example, the pH optrode (or optode), which can be integrated into a self-referencing system may become an alternative or additional technique in bioelectricity laboratories. The optrode does not require referencing and is insensitive to electromagnetism[66] simplifying system setting up and making it a suitable option for recordings where electric stimulation is simultaneously applied.
Much work to functionally study bioelectric signaling has made use of applied (exogenous) electric currents and fields via DC and AC voltage-delivering apparatus integrated with agarose salt bridges.[67] These devices can generate countless combinations of voltage magnitude and direction, pulses, and frequencies. Currently, lab-on-a-chip mediated application of electric fields is gaining ground in the field with the possibility to allow high-throughput screening assays of the large combinatory outputs.[68]

Fluorescence
[edit]Progress in molecular biology over the last six decades has produced powerful tools that facilitate the dissection of biochemical and genetic signals; yet, they tend to not be well-suited for bioelectric studies in vivo. Prior work relied extensively on current applied directly by electrodes, reinvigorated by significant recent advances in materials science[70][71][72][73][74][75][excessive citations] and extracellular current measurements, facilitated by sophisticated self-referencing electrode systems.[76][77] While electrode applications for manipulating neuraly-controlled body processes have recently attracted much attention,[78][79] there are other opportunities for controlling somatic processes, as most cell types are electrically active and respond to ionic signals from themselves and their neighbors.
In the early part of the 21st century, a number of new molecular techniques were developed that allowed bioelectric pathways to be investigated with a high degree of mechanistic resolution, and to be linked to canonical molecular cascades.[80] These include:
- Pharmacological screens to identify endogenous channels and pumps responsible for specific patterning events;[81][82][83]
- Voltage-sensitive fluorescent reporter dyes and genetically encoded fluorescent voltage indicators for the characterization of the bioelectric state in vivo.[84][85][86][87][88]
- Panels of well-characterized dominant ion channels that can be misexpressed in cells of interest to alter the bioelectric state in desired ways;[83][89][90] and
- Computational platforms that are coming on-line[91][92] to assist in building predictive models of bioelectric dynamics in tissues.[93][94][95]
Compared with the electrode-based techniques, the molecular probes provide a wider spatial resolution and facilitated dynamic analysis over time. Although calibration or titration can be possible, molecular probes are typically semi-quantitative, whereas electrodes provide absolute bioelectric values. Another advantage of fluorescence and other probes is their less-invasive nature and spatial multiplexing, enabling the simultaneous monitoring of large areas of embryonic or other tissues in vivo during normal or pathological pattering processes.[96]
Roles in organisms
[edit]Early development
[edit]Work in model systems such as Xenopus laevis and zebrafish has revealed a role for bioelectric signaling in the development of heart,[97][98] face,[99][100] eye,[89] brain,[101][102] and other organs. Screens have identified roles for ion channels in size control of structures such as the zebrafish fin,[103] while focused gain-of-function studies have shown for example that body parts can be re-specified at the organ level – for example creating entire eyes in gut endoderm.[89] As in the brain, developmental bioelectrics can integrate information across significant distance in the embryo, for example such as the control of brain size by bioelectric states of ventral tissue.[102] and the control of tumorigenesis at the site of oncogene expression by bioelectric state of remote cells.[104][105]
Human disorders, as well as numerous mouse mutants show that bioelectric signaling is important for human development (Tables 1 and 2). Those effects are pervasively linked to channelopathies, which are human disorders that result from mutations that disrupt ion channels.
Several channelopathies result in morphological abnormalities or congenital birth defects in addition to symptoms that affect muscle and or neurons. For example, mutations that disrupt an inwardly rectifying potassium channel Kir2.1 cause dominantly inherited Andersen-Tawil Syndrome (ATS). ATS patients experience periodic paralysis, cardiac arrhythmias, and multiple morphological abnormalities that can include cleft or high arched palate, cleft or thin upper lip, flattened philtrum, micrognathia, dental oligodontia, enamel hypoplasia, delayed dentition eruption, malocclusion, broad forehead, wide set eyes, low set ears, syndactyly, clinodactyly, brachydactyly, and dysplastic kidneys.[106][107] Mutations that disrupt another inwardly rectifying K+ channel Girk2 encoded by KCNJ6 cause Keppen-Lubinsky syndrome which includes microcephaly, a narrow nasal bridge, a high arched palate, and severe generalized lipodystrophy (failure to generate adipose tissue).[108] KCNJ6 is in the Down syndrome critical region such that duplications that include this region lead to craniofacial and limb abnormalities and duplications that do not include this region do not lead to morphological symptoms of Down syndrome.[109][110][111][112] Mutations in KCNH1, a voltage gated potassium channel lead to Temple-Baraitser (also known as Zimmermann- Laband) syndrome. Common features of Temple-Baraitser syndrome include absent or hypoplastic of finger and toe nails and phalanges and joint instability. Craniofacial defects associated with mutations in KCNH1 include cleft or high arched palate, hypertelorism, dysmorphic ears, dysmorphic nose, gingival hypertrophy, and abnormal number of teeth.[113][114][115][116][117][118][119][excessive citations]
Mutations in CaV1.2, a voltage gated Ca2+ channel, lead to Timothy syndrome, which causes severe cardiac arrhythmia (long-QT) along with syndactyly and similar craniofacial defects to Andersen-Tawil syndrome including cleft or high-arched palate, micrognathia, low set ears, syndactyly and brachydactyly.[120][121] While these channelopathies are rare, they show that functional ion channels are important for development. Furthermore, in utero exposure to anti-epileptic medications that target some ion channels also cause increased incidence of birth defects such as oral cleft.[122][123][124][125][126][excessive citations] The effects of both genetic and exogenous disruption of ion channels lend insight into the importance of bioelectric signaling in development.
Wound healing and cell guidance
[edit]One of the best-understood roles for bioelectric gradients is at the tissue-level endogenous electric fields utilized during wound healing. It is challenging to study wound-associated electric fields, because these fields are weak, less fluctuating, and do not have immediate biological responses when compared to nerve pulses and muscle contraction. The development of the vibrating and glass microelectrodes, demonstrated that wounds indeed produced and, importantly, sustained measurable electric currents and electric fields.[41][127][60][128][129][130] These techniques allow further characterization of the wound electric fields/currents at cornea and skin wounds, which show active spatial and temporal features, suggesting active regulation of these electrical phenomena. For example, the wound electric currents are always the strongest at the wound edge, which gradually increased to reach a peak about 1 hour after injury.[131][132][62] At wounds in diabetic animals, the wound electric fields are significantly compromised.[133] Understanding the mechanisms of generation and regulation of the wound electric currents/fields is expected to reveal new approaches to manipulate the electrical aspect for better wound healing.
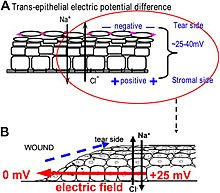
How are the electric fields at a wound produced? Epithelia actively pump and differentially segregate ions. In the cornea epithelium, for example, Na+ and K+ are transported inwards from tear fluid to extracellular fluid, and Cl− is transported out of the extracellular fluid into the tear fluid. The epithelial cells are connected by tight junctions, forming the major electrical resistive barrier, and thus establishing an electrical gradient across the epithelium – the transepithelial potential (TEP).[134][135] Breaking the epithelial barrier, as occurs in any wounds, creates a hole that breaches the high electrical resistance established by the tight junctions in the epithelial sheet, short-circuiting the epithelium locally. The TEP therefore drops to zero at the wound. However, normal ion transport continues in unwounded epithelial cells beyond the wound edge (typically <1 mm away), driving positive charge flow out of the wound and establishing a steady, laterally-oriented electric field (EF) with the cathode at the wound. Skin also generates a TEP, and when a skin wound is made, similar wound electric currents and fields arise, until the epithelial barrier function recovers to terminate the short-circuit at the wound. When wound electric fields are manipulated with pharmacological agents that either stimulate or inhibit transport of ions, the wound electric fields also increase or decrease, respectively. Wound healing can be speed up or slowed down accordingly in cornea wounds.[131][132][136]
How do electric fields affect wound healing? To heal wounds, cells surrounding the wound must migrate and grow directionally into the wound to cover the defect and restore the barrier. Cells important to heal wounds respond remarkably well to applied electric fields of the same strength that are measured at wounds. The whole gamut of cell types and their responses following injury are affected by physiological electric fields. Those include migration and division of epithelial cells, sprouting and extension of nerves, and migration of leukocytes and endothelial cells.[137][138][139][140] The most well studied cellular behavior is directional migration of epithelial cells in electric fields – electrotaxis. The epithelial cells migrate directionally to the negative pole (cathode), which at a wound is the field polarity of the endogenous vectorial electric fields in the epithelium, pointing (positive to negative) to the wound center. Epithelial cells of the cornea, keratinocytes from the skin, and many other types of cells show directional migration at electric field strengths as low as a few mV mm−1.[141][142][143][144] Large sheets of monolayer epithelial cells, and sheets of stratified multilayered epithelial cells also migrate directionally.[132][145] Such collective movement closely resembles what happens during wound healing in vivo, where cell sheets move collectively into the wound bed to cover the wound and restore the barrier function of the skin or cornea.
How cells sense such minute extracellular electric fields remains largely elusive. Recent research has started to identify some genetic, signaling and structural elements underlying how cells sense and respond to small physiological electric fields. These include ion channels, intracellular signaling pathways, membrane lipid rafts, and electrophoresis of cellular membrane components.[146][147][148][149][150][151][152][excessive citations]
Limb regeneration in animals
[edit]In the early 20th century, Albert Mathews seminally correlated regeneration of a cnidarian polyp with the potential difference between polyp and stolon surfaces, and affected regeneration by imposing countercurrents. Amedeo Herlitzka, following on the wound electric currents footsteps of his mentor, du Bois-Raymond, theorized about electric currents playing an early role in regeneration, maybe initiating cell proliferation.[153] Using electric fields overriding endogenous ones, Marsh and Beams astoundingly generated double-headed planarians and even reversed the primary body polarity entirely, with tails growing where a head previously existed.[154] After these seed studies, variations of the idea that bioelectricity could sense injury and trigger or at least be a major player in regeneration have spurred over the decades until the present day. A potential explanation lies on resting potentials (primarily Vmem and TEP), which can be, at least in part, dormant sensors (alarms) ready to detect and effectors (triggers) ready to react to local damage.[127][155][156][12]
Following up on the relative success of electric stimulation on non-permissive frog leg regeneration using an implanted bimetallic rod in the late 1960s,[157] the bioelectric extracellular aspect of amphibian limb regeneration was extensively dissected in the next decades. Definitive descriptive and functional physiological data was made possible owing to the development of the ultra-sensitive vibrating probe and improved application devices.[41][158] Amputation invariably leads to a skin-driven outward current and a consequent lateral electric field setting the cathode at the wound site. Although initially pure ion leakage, an active component eventually takes place and blocking ion translocators typically impairs regeneration. Using biomimetic exogenous electric currents and fields, partial regeneration was achieved, which typically included tissue growth and increased neuronal tissue. Conversely, precluding or reverting endogenous electric current and fields impairs regeneration.[60][159][158][160] These studies in amphibian limb regeneration and related studies in lampreys and mammals [161] combined with those of bone fracture healing[162][163] and in vitro studies,[132] led to the general rule that migrating (such as keratinocytes, leucocytes and endothelial cells) and outgrowing (such as axons) cells contributing to regeneration undergo electrotaxis towards the cathode (injury original site). Congruently, an anode is associated with tissue resorption or degeneration, as occurs in impaired regeneration and osteoclastic resorption in bone.[162][160][164] Despite these efforts, the promise for a significant epimorphic regeneration in mammals remains a major frontier for future efforts, which includes the use of wearable bioreactors to provide an environment within which pro-regenerative bioelectric states can be driven[165][166] and continued efforts at electrical stimulation.[167]
Recent molecular work has identified proton and sodium flux as being important for tail regeneration in Xenopus tadpoles,[12][168][169] and shown that regeneration of the entire tail (with spinal cord, muscle, etc.) could be triggered in a range of normally non-regenerative conditions by either molecular-genetic,[170] pharmacological,[171] or optogenetic[172] methods. In planaria, work on bioelectric mechanism has revealed control of stem cell behavior,[173] size control during remodeling,[174] anterior-posterior polarity,[175] and head shape.[69][176] Gap junction-mediated alteration of physiological signaling produces two-headed worms in Dugesia japonica; remarkably, these animals continue to regenerate as two-headed in future rounds of regeneration months after the gap junction-blocking reagent has left the tissue.[177][178][179] This stable, long-term alteration of the anatomical layout to which animals regenerate, without genomic editing, is an example of epigenetic inheritance of body pattern, and is also the only available "strain" of planarian species exhibiting an inherited anatomical change that is different from the wild-type.[180]



Cancer
[edit]Defection of cells from the normally tight coordination of activity towards an anatomical structure results in cancer; it is thus no surprise that bioelectricity – a key mechanism for coordinating cell growth and patterning – is a target often implicated in cancer and metastasis.[181][182] Indeed, it has long been known that gap junctions have a key role in carcinogenesis and progression.[183][184][185] Channels can behave as oncogenes and are thus suitable as novel drug targets.[3][93][183][186][187][188][189][190][191][192][excessive citations] Recent work in amphibian models has shown that depolarization of resting potential can trigger metastatic behavior in normal cells,[193][194] while hyperpolarization (induced by ion channel misexpression, drugs, or light) can suppress tumorigenesis induced by expression of human oncogenes.[195] Depolarization of resting potential appears to be a bioelectric signature by which incipient tumor sites can be detected non-invasively.[196] Refinement of the bioelectric signature of cancer in biomedical contexts, as a diagnostic modality, is one of the possible applications of this field.[181] Excitingly, the ambivalence of polarity – depolarization as marker and hyperpolarization as treatment – make it conceptually possible to derive theragnostic (portmanteau of therapeutics with diagnostics) approaches, designed to simultaneously detect and treat early tumors, in this case based on the normalization of the membrane polarization.[195]
Pattern regulation
[edit]Recent experiments using ion channel opener/blocker drugs, as well as dominant ion channel misexpression, in a range of model species, has shown that bioelectricity, specifically, voltage gradients instruct not only stem cell behavior[197][198][199][200][201][202][excessive citations] but also large-scale patterning.[29][203][204] Patterning cues are often mediated by spatial gradients of cell resting potentials, or Vmem, which can be transduced into second messenger cascades and transcriptional changes by a handful of known mechanisms. These potentials are set by the function of ion channels and pumps, and shaped by gap junctional connections which establish developmental compartments (isopotential cell fields).[205] Because both gap junctions and ion channels are themselves voltage-sensitive, cell groups implement electric circuits with rich feedback capabilities. The outputs of developmental bioelectric dynamics in vivo represent large-scale patterning decisions such as the number of heads in planarian,[179] the shape of the face in frog development,[99] and the size of tails in zebrafish.[103] Experimental modulation of endogenous bioelectric prepatterns have enabled converting body regions (such as the gut) to a complete eye,[89] inducing regeneration of appendages such as tadpole tails at non-regenerative contexts,[172][171][170] and conversion of flatworm head shapes and contents to patterns appropriate to other species of flatworms, despite a normal genome.[176] Recent work has shown the use of physiological modeling environments for identifying predictive interventions to target bioelectric states for repair of embryonic brain defects under a range of genetic and pharmacologically induced teratologies.[90][101]
Future research
[edit]Life is ultimately an electrochemical enterprise; research in this field is progressing along several frontiers. First is the reductive program of understanding how bioelectric signals are produced, how voltage changes in the cell membrane are able to regulate cell behavior, and what the genetic and epigenetic downstream targets of bioelectric signals are. A few mechanisms that transduce bioelectric change into alterations of gene expression are already known, including the bioelectric control of movement of small second-messenger molecules through cells, including serotonin and butyrate, voltage sensitive phosphatases, among others.[206][207] Also known are numerous gene targets of voltage signaling, such as Notch, BMP, FGF, and HIF-1α.[128] Thus, the proximal mechanisms of bioelectric signaling within single cells are becoming well-understood, and advances in optogenetics[80][172][4][208][209][excessive citations] and magnetogenetics[210] continue to facilitate this research program. More challenging however is the integrative program of understanding how specific patterns of bioelectric dynamics help control the algorithms that accomplish large-scale pattern regulation (regeneration and development of complex anatomy). The incorporation of bioelectrics with chemical signaling in the emerging field of probing cell sensory perception and decision-making[211][212][213][214][215][216][excessive citations] is an important frontier for future work.
Bioelectric modulation has shown control over complex morphogenesis and remodeling, not merely setting individual cell identity. Moreover, a number of the key results in this field have shown that bioelectric circuits are non-local – regions of the body make decisions based on bioelectric events at a considerable distance.[101][104][105] Such non-cell-autonomous events suggest distributed network models of bioelectric control;[217][218][219] new computational and conceptual paradigms may need to be developed to understand spatial information processing in bioelectrically active tissues. It has been suggested that results from the fields of primitive cognition and unconventional computation are relevant[218][220][69] to the program of cracking the bioelectric code. Finally, efforts in biomedicine and bioengineering are developing applications such as wearable bioreactors for delivering voltage-modifying reagents to wound sites,[166][165] and ion channel-modifying drugs (a kind of electroceutical) for repair of birth defects[90] and regenerative repair.[171] Synthetic biologists are likewise starting to incorporate bioelectric circuits into hybrid constructs.[221]
Table 1: Ion Channels and Pumps Implicated in Patterning
| Protein | Morphogenetic role or LOF (loss of function) phenotype | Species | Reference |
|---|---|---|---|
| TRH1 K+ transporter | Root hair patterning | Arabidopsis | [222] |
| Kir2.1potassium channel | Wing patterning | Drosophila | [223] |
| Kir7.1 K+ channel | Craniofacial patterning, lung development | Mus musculus | [224] |
| NHE2 Na+/H+ exchanger | Epithelial patterning | Drosophila | [225] |
| V-ATPase proton pump | Wing hair patterning, Pigmentation and brain patterning, Craniofacial patterning | Drosophila, Oryzias latipes, Homo sapiens | [226][227][228] |
| HCN1, Kv3.1 K+ channels | Forebrain patterning | Mus musculus | [229][230] |
| KCNC1 K+ channel | Growth deficits | Mus musculus | [231] |
| TWIK-1 K+ channel (KCNK1) | Cardiac (atrial) size | Mus musculus | [232] |
| KCNJ6 K+channel | Keppen-Lubinsky syndrome – craniofacial and brain | Homo sapiens | [108] |
| KCNH1 (hEAG1) K+ channel and ATP6V1B2 V-ATPase proton pump | Zimmermman-Laband and Temple-Baraitser syndrome – craniofacial and brain defects, dysplasia/aplasia of nails of thumb and great toe. | Homo sapiens | [116][233] |
| GLRa4 chloride channel | Craniofacial anomalies | Homo sapiens | [234] |
| KCNJ8 K+ | Cantu syndrome – face, heart, skeleton, brain defects | Homo sapiens | [235][236][237] |
| NALCN (Na+ leak channel) | Freeman-Sheldon syndrome – limbs, face, brain | Homo sapiens | [238] |
| CFTR chloride channel | Bilateral absence of vas deferens | Homo sapiens | [239][240] |
| KCNC1 | Head/face dysmorphias | Homo sapiens | [241] |
| KCNK9, TASK3 K+ channels | Birk-Barel Dysmorphism Syndrome – craniofacial defects, brain (cortical patterning) defects | Homo sapiens | [242][243][244] |
| Kir6.2 K+ channel | Craniofacial defects | Homo sapiens | [244] |
| KCNQ1 K+ channel (via epigenetic regulation) | Hypertrophy of tongue, liver, spleen, pancreas, kidneys, adrenals, genitalia – Beckwith-Wiedemann syndrome; craniofacial and limb defects, early development | Homo sapiens, Mus musculus, Drosophila | [245][246][247][248] |
| KCNQ1 K+ channel | Jervell and Lange-Nielsen syndrome - inner ear and limb | Homo sapiens, Mus musculus | [249][250][251] |
| Kir2.1 K+ channel (KNCJ2) | Andersen-Tawil syndrome – craniofacial, limb, ribs | Homo sapiens, Mus musculus | [106][223][252] |
| GABA-A receptor (chloride channel) | Angelman Syndrome - craniofacial (e.g., cleft palate) and hand patterning | Homo sapiens, Mus musculus | [253][254][255] |
| TMEM16A chloride channel | Tracheal morphogenesis | Mus musculus | [256] |
| Girk2 K+ channel | Cerebellar development defects | Mus musculus | [257][258][259][260] |
| KCNH2 K+ channel | Cardiac, craniofacial patterning defects | Mus musculus | [261] |
| KCNQ1 K+ channel | Abnormalities of rectum, pancreas, and stomach | Mus musculus | [262] |
| NaV1.2 | Muscle and nerve repair defects | Xenopus | [171] |
| Kir6.1 K+ channel | Eye patterning defects | Xenopus | [89] |
| V-ATPase ion pump | Left-right asymmetry defects, muscle and nerve repair | Xenopus, Gallus gallus domesticus, Danio rerio | [170][82] |
| H,K-ATPase ion pump | Left-right asymmetry defects | Xenopus, Echinoidea | [263][264][265] |
| Kir7.1 K+ channel | Melanosome development defects | Danio rerio | [266] |
| Kv channels | Fin size regulation, heart size regulation | Danio rerio, Mus musculus | [103][267] |
| NaV 1.5, Na+/K+-ATPase | Cardiac morphogenesis | Danio rerio | [268][269] |
| KCNC3 | Dominant mutations cause cerebellar displasia in humans, and wing venation and eye defects in Drosophila. | Homo sapiens, Drosophila | [270] |
Table 2: Gap Junctions Implicated in Patterning
| Gap Junction Protein | Morphogenetic role or LOF phenotype | Species | References |
|---|---|---|---|
| Innexins | Gonad and germline morphogenesis | C. Elegans | [271] |
| Innexin1,2 | Cuticle (epithelial) patterning, foregut development | Drosophila | [272][273] |
| Innexin 2 | Eye size | Drosophila | [274] |
| Cx43 | Oculodentodigital dysplasia (ODDD), heart defects (outflow tract and conotruncal), left-right asymmetry randomization, Osteoblast differentiation problems, craniofacial defects, myogenesis | Homo sapiens, Mus musculus, Gallus gallus domesticus | [275][276][277][278][279][280][281][282][283][284][excessive citations] |
| Cx37 | Lymphatic system patterning | Mus musculus | [285][286] |
| Cx45 | Cardiac defects (cushion patterning) | Mus musculus | [287][288] |
| Cx50, Cx46 | Eye defects (differentiation and proliferation problems, especially lens), | Mus musculus | [289] |
| Cx26 | Cochlear development defects | Mus musculus | [290] |
| Cx41.8 | Pigmentation pattern defects | Danio rerio | [291] |
| Cx43 | Fin size and pattern regulation Craniofrontonasal syndrome | Danio rerio, Mus musculus | [292][293][294][295] |
| Inx4,Inx2 | Germline differentiation and spermatogenesis | Drosophila | [296] |
| Pannexin3 | Skeletal development | Mus musculus | [297] |
Table 3: Ion Channel Oncogenes
| Protein | Species | References | Cancer-role |
|---|---|---|---|
| NaV 1.5 channel | Homo sapiens | [298][299] | Oncogene |
| ERG potassium channels | Homo sapiens | [300][301] | Oncogene |
| 9 potassium channel | Mus musculus | [302] | Oncogene |
| Ductin (proton V-ATPase component) | Mus musculus | [303] | Oncogene |
| SLC5A8 sodium/butyrate transporter | Homo sapiens | [304] | Oncogene |
| KCNE2 potassium channel | Mus musculus | [305] | Oncogene |
| KCNQ1 potassium channel | Homo sapiens, mouse | [246][262][306] | Oncogene |
| SCN5A voltage-gated sodium channel | Homo sapiens | [299] | Oncogene |
| Metabotropic glutamate receptor | Mus musculus, Human | [307][308] | Oncogene |
| CFTR chloride channel | Homo sapiens | [309][310] | Tumor suppressor |
| Connexin43 | Homo sapiens | [311] | Tumor suppressor |
| BKCa | Homo sapiens | [312] | Oncogene |
| Muscarinic Acetylcholine receptor | Homo sapiens, Mus musculus | [313] | Tumor suppressor |
| KCNJ3 (Girk) | Homo sapiens | [314][315] | Oncogene |
References
[edit]- ^ Levin, Michael (2011). "The wisdom of the body: Future techniques and approaches to morphogenetic fields in regenerative medicine, developmental biology and cancer". Regenerative Medicine. 6 (6): 667–673. doi:10.2217/rme.11.69. PMID 22050517.
- ^ Levin, M (2014). "Molecular bioelectricity: How endogenous voltage potentials control cell behavior and instruct pattern regulation in vivo". Molecular Biology of the Cell. 25 (24): 3835–3850. doi:10.1091/mbc.E13-12-0708. PMC 4244194. PMID 25425556.
- ^ Jump up to: a b c Bates, Emily (2015). "Ion Channels in Development and Cancer". Annual Review of Cell and Developmental Biology. 31: 231–247. doi:10.1146/annurev-cellbio-100814-125338. PMID 26566112.
- ^ Jump up to: a b Cohen, Adam E; Venkatachalam, Veena (2014). "Bringing Bioelectricity to Light". Annual Review of Biophysics. 43: 211–232. doi:10.1146/annurev-biophys-051013-022717. PMID 24773017.
- ^ Funk, R. H; Monsees, T; Ozkucur, N (2009). "Electromagnetic effects - from cell biology to medicine". Progress in Histochemistry and Cytochemistry. 43 (4): 177–264. doi:10.1016/j.proghi.2008.07.001. PMID 19167986.
- ^ Funk, R. H; Monsees, T. K (2006). "Effects of electromagnetic fields on cells: Physiological and therapeutic approaches and molecular mechanisms of interaction. A review". Cells Tissues Organs. 182 (2): 59–78. doi:10.1159/000093061. PMID 16804297. S2CID 10705650.
- ^ Jump up to: a b Zhao, Min; Chalmers, Laura; Cao, Lin; Vieira, Ana C; Mannis, Mark; Reid, Brian (2012). "Electrical signaling in control of ocular cell behaviors". Progress in Retinal and Eye Research. 31 (1): 65–88. doi:10.1016/j.preteyeres.2011.10.001. PMC 3242826. PMID 22020127.
- ^ Jump up to: a b c d Levin, Michael; Martyniuk, Christopher J (2018). "The bioelectric code: A old computational medium for dynamic control of growth and form". Biosystems. 164: 76–93. doi:10.1016/j.biosystems.2017.08.009. PMC 10464596. PMID 28855098.
- ^ Lane, N; Allen, J. F; Martin, W (2010). "How did LUCA make a living? Chemiosmosis in the origin of life". BioEssays. 32 (4): 271–280. doi:10.1002/bies.200900131. PMID 20108228.
- ^ Lane, N; Martin, W. F (2012). "The origin of membrane bioenergetics". Cell. 151 (7): 1406–16. doi:10.1016/j.cell.2012.11.050. PMID 23260134.
- ^ Jump up to: a b Luxardi, G; Reid, B; Maillard, P; Zhao, M (2014). "Single cell wound generates electric current circuit and cell membrane potential variations that requires calcium influx". Integr. Biol. 6 (7): 662–672. doi:10.1039/c4ib00041b. PMID 24801267. S2CID 7313742.
- ^ Jump up to: a b c Ferreira, Fernando; Luxardi, Guillaume; Reid, Brian; Zhao, Min (2016). "Early bioelectric activities mediate redox-modulated regeneration". Development. 143 (24): 4582–4594. doi:10.1242/dev.142034. PMC 5201032. PMID 27827821.
- ^ Robinson, K.; Messerli, M. (1996). "Electric Embryos: the embryonic epithelium as a generator of development information". In McCaig, C (ed.). Nerve growth and guidance. Portland. pp. 131–141.
- ^ McLaughlin, K. A; Levin, M (2018). "Bioelectric signaling in regeneration: Mechanisms of ionic controls of growth and form". Developmental Biology. 433 (2): 177–189. doi:10.1016/j.ydbio.2017.08.032. PMC 5753428. PMID 29291972.
- ^ Jump up to: a b c Levin, Michael; Pezzulo, Giovanni; Finkelstein, Joshua M (2017). "Endogenous Bioelectric Signaling Networks: Exploiting Voltage Gradients for Control of Growth and Form". Annual Review of Biomedical Engineering. 19: 353–387. doi:10.1146/annurev-bioeng-071114-040647. PMC 10478168. PMID 28633567.
- ^ Pitcairn, Emily; McLaughlin, Kelly A. (2016). "Bioelectric signaling coordinates patterning decisions during embryogenesis". Trends in Developmental Biology. 9: 1–9.
- ^ Pullar, C. E. The physiology of bioelectricity in development, tissue regeneration, and cancer., (CRC Press, 1996).[page needed]
- ^ Nuccitelli, R (2003). "A role for endogenous electric fields in wound healing". Current Topics in Developmental Biology. 58: 1–26. doi:10.1016/s0070-2153(03)58001-2. ISBN 978-0-12-153158-4. PMID 14711011.
- ^ Clarke, Edwin (1987). Nineteenth-century origins of neuroscientific concepts. Jacyna, L. S. Berkeley: University of California Press. ISBN 0-520-05694-9. OCLC 13456516.
- ^ Pera, Marcello (1992). The ambiguous frog: the Galvani-Volta controversy on animal electricity. Tr. Mandelbaum, Jonathan. Princeton, New Jersey: Princeton University Press. ISBN 978-1-4008-6249-8. OCLC 889251161.
- ^ Piccolino, Marco; Bresadola, Marco (2013). Shocking frogs: Galvani, Volta, and the electric origins of neuroscience. Oxford; New York: Oxford University Press. ISBN 978-0-19-978221-5. OCLC 859536612.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Maden, M. A history of regeneration research. (Cambridge University Press, 1991).[page needed]
- ^ Jump up to: a b c McCaig, Colin D.; Rajnicek, Ann M; Song, Bing; Zhao, Min (2005). "Controlling Cell Behavior Electrically: Current Views and Future Potential". Physiological Reviews. 85 (3): 943–978. doi:10.1152/physrev.00020.2004. PMID 15987799.
- ^ Bernstein, J (1868). "Ueber den zeitlichen Verlauf der negativen Schwankung des Nervenstroms" [About the time course of the negative fluctuation of the nerve current]. Pflügers Archiv für die gesamte Physiologie des Menschen und der Tiere (in German). 1 (1): 173–207. doi:10.1007/BF01640316. S2CID 32435163.
- ^ Du Bois-Reymond, Emil (1848). "Untersuchungen über thierische Elektricität" [Investigations on animal electricity]. Annalen der Physik und Chemie (in German). 151 (11): 463–464. Bibcode:1848AnP...151..463D. doi:10.1002/andp.18481511120.
- ^ Schuetze, Stephen M (1983). "The discovery of the action potential". Trends in Neurosciences. 6: 164–8. doi:10.1016/0166-2236(83)90078-4. S2CID 53175297.
- ^ Du Bois-Reymond, Emil (1860). Untersuchungen uber thierische Elektricitat [Investigations on Animal Electricity] (in German). Berlin: Georg Reimer.[page needed]
- ^ Finkelstein, Gabriel (2013). Emil du Bois-Reymond: neuroscience, self, and society in nineteenth-century Germany. The MIT Press. ISBN 978-1-4619-5032-5. OCLC 864592470.
- ^ Jump up to: a b c Levin, Michael; Stevenson, Claire G (2012). "Regulation of Cell Behavior and Tissue Patterning by Bioelectrical Signals: Challenges and Opportunities for Biomedical Engineering". Annual Review of Biomedical Engineering. 14: 295–323. doi:10.1146/annurev-bioeng-071811-150114. PMC 10472538. PMID 22809139.
- ^ Mathews, Albert P. (1903). "Electrical Polarity in the Hydroids". American Journal of Physiology. Legacy Content. 8 (4): 294–299. doi:10.1152/ajplegacy.1903.8.4.294.
- ^ Hyde, Ida H. (1904). "Differences in Electrical Potential in Developing Eggs". American Journal of Physiology. Legacy Content. 12 (3): 241–275. doi:10.1152/ajplegacy.1904.12.3.241.
- ^ Morgan, T. H.; Dimon, Abigail C. (1904). "An examination of the problems of physiological "polarity" and of electrical polarity in the earthworm". Journal of Experimental Zoology. 1 (2): 331. Bibcode:1904JEZ.....1..331M. doi:10.1002/jez.1400010206. hdl:2027/hvd.32044107333023.
- ^ Frazee, Oren E. (1909). "The effect of electrical stimulation upon the rate of regeneration in Rana pipiens and Amblystoma jeffersonianum". Journal of Experimental Zoology. 7 (3): 457–475. Bibcode:1909JEZ.....7..457F. doi:10.1002/jez.1400070304.
- ^ Lund, E. J. (1917). "Reversibility of morphogenetic processes in Bursaria". Journal of Experimental Zoology. 24 (1): 1–33. Bibcode:1917JEZ....24....1L. doi:10.1002/jez.1400240102.
- ^ Hyman, Libbie Henrietta (1992-09-15). Hyman's Comparative Vertebrate Anatomy. University of Chicago Press. pp. 192–236. ISBN 978-0-226-87013-7.
- ^ Hyman, Libbie Henrietta (1918). "Special Articles". Science. 48 (1247): 518–524. doi:10.1126/science.48.1247.518. PMID 17795612.
- ^ Lund, E. Bioelectric fiends and growth, (University of Texas Press, 1947).[page needed]
- ^ Burr, H. S.; Northrop, F. S. C. (1935). "The Electro-Dynamic Theory of Life". The Quarterly Review of Biology. 10 (3): 322–333. doi:10.1086/394488. JSTOR 2808474. S2CID 84480134.
- ^ Marsh, G.; Beams, H. W. (1949). "Electrical control of axial polarity in a regenerating annelid". Anatomical Record. 105 (3): 513–514.
- ^ Marsh, G.; Beams, H. W. (1947). "Electrical control of growth polarity in regenerating Dugesia tigrina". Federation Proceedings. 6 (1 Pt 2): 163. PMID 20342775.
- ^ Jump up to: a b c d e Jaffe, Lionel F.; Nuccitelli, Richard (1974). "An Ultrasensitive Vibrating Probe for Measuring Steady Extracellular Currents". The Journal of Cell Biology. 63 (2): 614–28. doi:10.1083/jcb.63.2.614. PMC 2110946. PMID 4421919.
- ^ Jaffe, L. (1982). "Developmental Currents Voltages and Gradients". Developmental Order, Its Origin and Regulation. pp. 183–215. ISBN 978-0-8451-1501-5.
- ^ Jaffe, L. F (1981). "The Role of Ionic Currents in Establishing Developmental Pattern". Philosophical Transactions of the Royal Society B: Biological Sciences. 295 (1078): 553–566. Bibcode:1981RSPTB.295..553J. doi:10.1098/rstb.1981.0160. JSTOR 2395645. PMID 6117911.
- ^ Nuccitelli, Richard (1995). "Endogenous Electric Fields Measured in Developing Embryos". Electromagnetic Fields. Advances in Chemistry. Vol. 250. pp. 109–24. doi:10.1021/ba-1995-0250.ch007. ISBN 978-0-8412-3135-1.
- ^ Jaffe, L. F.; Nuccitelli, R. (1977). "Electrical Controls of Development". Annual Review of Biophysics and Bioengineering. 6: 445–476. doi:10.1146/annurev.bb.06.060177.002305. PMID 326151.
- ^ Borgens, R. B (1986). "The role of natural and applied electric fields in neuronal regeneration and development". Progress in Clinical and Biological Research. 210: 239–250. PMID 3960913.
- ^ Borgens, Richard B. (1982). "What Is the Role of Naturally Produced Electric Current in Vertebrate Regeneration and Healing?". International Review of Cytology Volume 76. Vol. 76. pp. 245–298. doi:10.1016/S0074-7696(08)61793-3. ISBN 978-0-12-364476-3. PMID 6749746.
- ^ McCaig, Colin D.; Rajnicek, Ann M.; Song, Bing; Zhao, Min (2002). "Has electrical growth cone guidance found its potential?". Trends in Neurosciences. 25 (7): 354–9. doi:10.1016/S0166-2236(02)02174-4. PMID 12079763. S2CID 7534545.
- ^ Cone, C. D. Jr; Tongier, M. Jr (1971). "Control of Somatic Cell Mitosis by Simulated Changes in the Transmembrane Potential Level". Oncology. 25 (2): 168–182. doi:10.1159/000224567. PMID 5148061.
- ^ Stillwell, E. F.; Cone, C. M.; Cone, C. D. (1973). "Stimulation of DNA Synthesis in CNS Neurones by Sustained Depolarisation". Nature New Biology. 246 (152): 110–111. doi:10.1038/newbio246110a0. PMID 4518935.
- ^ Binggeli, Richard; Weinstein, Roy C. (1986). "Membrane potentials and sodium channels: Hypotheses for growth regulation and cancer formation based on changes in sodium channels and gap junctions". Journal of Theoretical Biology. 123 (4): 377–401. Bibcode:1986JThBi.123..377B. doi:10.1016/S0022-5193(86)80209-0. PMID 2443763.
- ^ Hodgkin, A. L; Huxley, A. F (1939). "Action Potentials Recorded from Inside a Nerve Fibre". Nature. 144 (3651): 710. Bibcode:1939Natur.144..710H. doi:10.1038/144710a0. S2CID 4104520.
- ^ Monteiro, Joana; Aires, Rita; Becker, Jörg D; Jacinto, António; Certal, Ana C; Rodríguez-León, Joaquín (2014). "V-ATPase Proton Pumping Activity is Required for Adult Zebrafish Appendage Regeneration". PLOS ONE. 9 (3): e92594. Bibcode:2014PLoSO...992594M. doi:10.1371/journal.pone.0092594. PMC 3966808. PMID 24671205.
- ^ Kunkel, Joseph G; Cordeiro, Sofia; Xu, Yu (Jeff); Shipley, Alan M; Feijó, José A (2006). "Use of Non-Invasive Ion-Selective Microelectrode Techniques for the Study of Plant Development". Plant Electrophysiology. pp. 109–137. doi:10.1007/978-3-540-37843-3_5. ISBN 978-3-540-32717-2.
- ^ Shen, Y; Pfluger, T; Ferreira, F; Liang, J; Navedo, M. F; Zeng, Q; Reid, B; Zhao, M (2016). "Diabetic cornea wounds produce significantly weaker electric signals that may contribute to impaired healing". Scientific Reports. 6: 26525. Bibcode:2016NatSR...626525S. doi:10.1038/srep26525. PMC 4901296. PMID 27283241.
- ^ Hodgkin, A. L; Huxley, A. F (1939). "Action Potentials Recorded from Inside a Nerve Fibre". Nature. 144 (3651): 710–711. Bibcode:1939Natur.144..710H. doi:10.1038/144710a0. S2CID 4104520.
- ^ Graham, Judith; Gerard, R. W (1946). "Membrane potentials and excitation of impaled single muscle fibers". Journal of Cellular and Comparative Physiology. 28 (1): 99–117. doi:10.1002/jcp.1030280106. PMID 21002959. S2CID 45361295.
- ^ Zhao, Y; Inayat, S; Dikin, D A; Singer, J H; Ruoff, R S; Troy, J B (2009). "Patch clamp technique: Review of the current state of the art and potential contributions from nanoengineering". Proceedings of the Institution of Mechanical Engineers, Part N: Journal of Nanoengineering and Nanosystems. 222: 1–11. doi:10.1243/17403499JNN149. S2CID 53316098.
- ^ Borgens, Richard B; Vanable, Joseph W; Jaffe, Lionel F (1979). "Role of subdermal current shunts in the failure of frogs to regenerate". Journal of Experimental Zoology. 209 (1): 49–56. Bibcode:1979JEZ...209...49B. doi:10.1002/jez.1402090106. PMID 314968.
- ^ Jump up to: a b c Borgens, R. B; Vanable, J. W; Jaffe, L. F (1977). "Bioelectricity and regeneration. I. Initiation of frog limb regeneration by minute currents". Journal of Experimental Zoology. 200 (3): 403–416. Bibcode:1977JEZ...200..403B. doi:10.1002/jez.1402000310. PMID 301554.
- ^ Jump up to: a b Shipley, A. M; Feijó, J. A (1999). "The Use of the Vibrating Probe Technique to Study Steady Extracellular Currents During Pollen Germination and Tube Growth". Fertilization in Higher Plants. pp. 235–252. doi:10.1007/978-3-642-59969-9_17. ISBN 978-3-642-64202-9.
- ^ Jump up to: a b Reid, Brian; Nuccitelli, Richard; Zhao, Min (2007). "Non-invasive measurement of bioelectric currents with a vibrating probe". Nature Protocols. 2 (3): 661–669. doi:10.1038/nprot.2007.91. PMID 17406628. S2CID 15237787.
- ^ Kuhtreiber, W. M.; Jaffe, L. F. (1990). "Detection of extracellular calcium gradients with a calcium-specific vibrating electrode". J Cell Biol. 110 (5): 1565–1573. doi:10.1083/jcb.110.5.1565. PMC 2200169. PMID 2335563.
- ^ Luxardi, Guillaume; Reid, Brian; Ferreira, Fernando; Maillard, Pauline; Zhao, Min (2015). "Measurement of Extracellular Ion Fluxes Using the Ion-selective Self-referencing Microelectrode Technique". Journal of Visualized Experiments (99): e52782. doi:10.3791/52782. PMC 4541607. PMID 25993490.
- ^ Tantama, Mathew; Hung, Yin Pun; Yellen, Gary (2012). "Optogenetic reporters". Optogenetics: Tools for Controlling and Monitoring Neuronal Activity. Progress in Brain Research. Vol. 196. pp. 235–263. doi:10.1016/B978-0-444-59426-6.00012-4. ISBN 978-0-444-59426-6. PMC 3494096. PMID 22341329.
- ^ Chatni, Mohammad Rameez; Li, Gang; Porterfield, David Marshall (2009). "Frequency-domain fluorescence lifetime optrode system design and instrumentation without a concurrent reference light-emitting diode". Applied Optics. 48 (29): 5528–5536. Bibcode:2009ApOpt..48.5528C. doi:10.1364/AO.48.005528. PMID 19823237.
- ^ Song, Bing; Gu, Yu; Pu, Jin; Reid, Brian; Zhao, Zhiqiang; Zhao, Min (2007). "Application of direct current electric fields to cells and tissues in vitro and modulation of wound electric field in vivo". Nature Protocols. 2 (6): 1479–1489. doi:10.1038/nprot.2007.205. PMID 17545984. S2CID 25924011.
- ^ Zhao, Siwei; Zhu, Kan; Zhang, Yan; Zhu, Zijie; Xu, Zhengping; Zhao, Min; Pan, Tingrui (2014). "ElectroTaxis-on-a-Chip (ETC): An integrated quantitative high-throughput screening platform for electrical field-directed cell migration". Lab Chip. 14 (22): 4398–4405. doi:10.1039/C4LC00745J. PMC 4437771. PMID 25242672.
- ^ Jump up to: a b c Sullivan, Kelly G; Emmons-Bell, Maya; Levin, Michael (2016). "Physiological inputs regulate species-specific anatomy during embryogenesis and regeneration". Communicative & Integrative Biology. 9 (4): e1192733. doi:10.1080/19420889.2016.1192733. PMC 4988443. PMID 27574538.
- ^ Bornat, Yannick; Raoux, Matthieu; Boutaib, Youssef; et al. (2010). "Detection of Electrical Activity of Pancreatic Beta-cells Using Micro-electrode Arrays". 2010 Fifth IEEE International Symposium on Electronic Design, Test & Applications (PDF). pp. 233–236. doi:10.1109/DELTA.2010.60. ISBN 978-1-4244-6025-0. S2CID 12107878.
- ^ Kojima, Junichiro; Shinohara, Hiroaki; Ikariyama, Yosihito; et al. (1991). "Electrically controlled proliferation of human carcinoma cells cultured on the surface of an electrode". Journal of Biotechnology. 18 (1–2): 129–139. doi:10.1016/0168-1656(91)90241-M. PMID 1367098.
- ^ Langhammer, Christopher G; Kutzing, Melinda K; Luo, Vincent; et al. (2011). "Skeletal myotube integration with planar microelectrode arrays in vitro for spatially selective recording and stimulation: A comparison of neuronal and myotube extracellular action potentials". Biotechnology Progress. 27 (3): 891–5. doi:10.1002/btpr.609. PMC 4557870. PMID 21574266.
- ^ McCullen, Seth D; McQuilling, John P; Grossfeld, Robert M; et al. (2010). "Application of Low-Frequency Alternating Current Electric Fields Via Interdigitated Electrodes: Effects on Cellular Viability, Cytoplasmic Calcium, and Osteogenic Differentiation of Human Adipose-Derived Stem Cells". Tissue Engineering Part C: Methods. 16 (6): 1377–86. doi:10.1089/ten.tec.2009.0751. PMC 3003917. PMID 20367249.
- ^ Aryasomayajula, Aditya; Derix, Jonathan; Perike, Srikant; Gerlach, Gerald; Funk, R.H (2010). "DC microelectrode array for investigating the intracellular ion changes". Biosensors and Bioelectronics. 26 (4): 1268–1272. doi:10.1016/j.bios.2010.06.068. PMID 20656468.
- ^ Jayaram, Dhanya T; Luo, Qingjie; Thourson, Scott B; Finlay, Adam H; Payne, Christine K (2017). "Controlling the Resting Membrane Potential of Cells with Conducting Polymer Microwires". Small. 13 (27): 1700789. doi:10.1002/smll.201700789. PMC 5560653. PMID 28556571.
- ^ Smith, Peter J.S; Hammar, Katherine; Porterfield, D. Marshall; Sanger, Richard H; Trimarchi, James R (1999). "Self-referencing, non-invasive, ion selective electrode for single cell detection of trans-plasma membrane calcium flux". Microscopy Research and Technique. 46 (6): 398–417. doi:10.1002/(SICI)1097-0029(19990915)46:6<398::AID-JEMT8>3.0.CO;2-H. PMID 10504217. S2CID 25177705.
- ^ Smith, Peter J. S.; Sanger, Richard H.; Messerli, Mark A. (2006). "Principles, Development and Applications of Self-Referencing Electrochemical Microelectrodes to the Determination of Fluxes at Cell Membranes". In Michael, Adrian C.; Borland, Laura (eds.). Electrochemical Methods for Neuroscience. CRC. pp. 373–405. ISBN 978-1-4200-0586-8. PMID 21204387.
- ^ Sinha, Gunjan (2013). "Charged by GSK investment, battery of electroceuticals advance". Nature Medicine. 19 (6): 654. doi:10.1038/nm0613-654. PMID 23744134. S2CID 2260750.
- ^ Famm, Kristoffer; Litt, Brian; Tracey, Kevin J; Boyden, Edward S; Slaoui, Moncef (2013). "A jump-start for electroceuticals". Nature. 496 (7444): 159–161. doi:10.1038/496159a. PMC 4179459. PMID 23579662.
- ^ Jump up to: a b Spencer Adams, Dany; Lemire, Joan M.; Kramer, Richard H.; Levin, Michael (2014). "Optogenetics in Developmental Biology: Using light to control ion flux-dependent signals in Xenopus embryos". The International Journal of Developmental Biology. 58 (10–12): 851–861. doi:10.1387/ijdb.140207ml. PMC 10468825. PMID 25896279.
- ^ Адамс, Дэни С; Левин, Майкл (2006). «Обратный скрининг наркотиков: быстрый и недорогой метод выявления молекулярных мишеней» . Бытие . 44 (11): 530–540. дои : 10.1002/dvg.20246 . ПМК 3142945 . ПМИД 17078061 .
- ^ Перейти обратно: а б Адамс, Д.С.; Робинсон, КР; Фукумото, Т.; Юань, С; Альбертсон, Колорадо; Йелик, П; Куо, Л.; Максвини, М.; Левин, М. (2006). «На ранних этапах H+-V-АТФаза-зависимый поток протонов необходим для последовательного формирования левого и правого паттерна у немлекопитающих позвоночных» . Разработка . 133 (9): 1657–1671. дои : 10.1242/dev.02341 . ПМК 3136117 . ПМИД 16554361 .
- ^ Перейти обратно: а б Адамс, Дэни С; Левин, Майкл (2012). «Эндогенные градиенты напряжения как медиаторы межклеточной коммуникации: стратегии исследования биоэлектрических сигналов во время формирования паттернов» . Исследования клеток и тканей . 352 (1): 95–122. дои : 10.1007/s00441-012-1329-4 . ПМЦ 3869965 . ПМИД 22350846 .
- ^ Адамс, Д.С.; Левин, М (2012). «Общие принципы измерения мембранного потенциала покоя и концентрации ионов с использованием флуоресцентных репортеров биоэлектричества» . Протоколы Колд-Спринг-Харбора . 2012 (4): 385–397. дои : 10.1101/pdb.top067710 . ПМК 4001120 . ПМИД 22474653 .
- ^ Адамс, Д.С.; Левин, М (2012). «Измерение мембранного потенциала покоя с использованием репортеров флуоресцентного напряжения DiBAC4 (3) и CC2-DMPE» . Протоколы Колд-Спринг-Харбора . 2012 (4): 459–464. дои : 10.1101/pdb.prot067702 . ПМК 4001116 . ПМИД 22474652 .
- ^ Браунер, Томас; Хюльзер, Дитер Ф; Штрассер, Рето Дж (1984). «Сравнительные измерения мембранных потенциалов с помощью микроэлектродов и потенциалчувствительных красителей» . Biochimica et Biophysical Acta (BBA) – Биомембраны . 771 (2): 208–216. дои : 10.1016/0005-2736(84)90535-2 . ПМИД 6704395 .
- ^ Дил, Паркер Э; Кулкарни, Ришикеш У; Аль-Абдуллатиф, Сара Х; Миллер, Эван В. (2016). «Репортеры напряжения изомерно чистого тетраметилродамина» . Журнал Американского химического общества . 138 (29): 9085–9088. дои : 10.1021/jacs.6b05672 . ПМЦ 5222532 . ПМИД 27428174 .
- ^ Овьедо, Нью-Джерси; Николас, CL; Адамс, Д.С.; Левин, М (2008). «Живое изображение потенциала планарийной мембраны с использованием DiBAC4 (3)» . Протоколы Колд-Спринг-Харбора . 2008 (11): pdb.prot5055. дои : 10.1101/pdb.prot5055 . ПМЦ 10468776 . ПМИД 21356693 .
- ^ Перейти обратно: а б с д и Пай, В.П.; Ой, С; Шомрат, Т; Лемир, Дж. М.; Левин, М (2011). «Потенциал трансмембранного напряжения контролирует структуру глаз эмбриона у Xenopus laevis» . Разработка . 139 (2): 313–323. дои : 10.1242/dev.073759 . ПМК 3243095 . ПМИД 22159581 .
- ^ Перейти обратно: а б с Пай, Вайбхав П; Пиетак, Алексис; Уиллок, Валери; Да, Бин; Ши, Нянь-Цин; Левин, Майкл (2018). «HCN2 устраняет дефекты головного мозга, создавая предварительные шаблоны эндогенного напряжения» . Природные коммуникации . 9 (1): 998. Бибкод : 2018NatCo...9..998P . дои : 10.1038/s41467-018-03334-5 . ПМЦ 5843655 . ПМИД 29519998 .
- ^ Пиетак, Алексис; Левин, Майкл (2016). «Изучение инструктивной физиологической передачи сигналов с помощью механизма моделирования биоэлектрической ткани» . Границы биоинженерии и биотехнологии . 4 : 55. дои : 10.3389/fbioe.2016.00055 . ПМЦ 4933718 . ПМИД 27458581 .
- ^ Пиетак, Алексис; Левин, Майкл (2017). «Биоэлектрические гены и реакционные сети: компьютерное моделирование генетической, биохимической и биоэлектрической динамики в паттерн-регуляции» . Журнал интерфейса Королевского общества . 14 (134): 20170425. doi : 10.1098/rsif.2017.0425 . ПМК 5636277 . ПМИД 28954851 .
- ^ Перейти обратно: а б Сервера, Хавьер; Алькарас, Антонио; Мафе, Сальвадор (2016). «Биоэлектрические сигналы и ионные каналы в моделировании многоклеточных структур и биофизике рака» . Научные отчеты . 6 : 20403. Бибкод : 2016NatSR...620403C . дои : 10.1038/srep20403 . ПМЦ 4740742 . ПМИД 26841954 .
- ^ Сервера, Хавьер; Месегер, Сальвадор; Мафе, Сальвадор (2016). «Взаимодействие между генетической и биоэлектрической передачей сигналов позволяет осуществлять пространственную регионализацию мембранных потенциалов в модельных многоклеточных ансамблях» . Научные отчеты . 6 : 35201. Бибкод : 2016NatSR...635201C . дои : 10.1038/srep35201 . ПМК 5059667 . ПМИД 27731412 .
- ^ Сервера, Хавьер; Мансанарес, Хосе Антонио; Мафе, Сальвадор (2015). «Электрическая связь в ансамблях невозбудимых клеток: моделирование пространственной карты потенциалов отдельных ячеек». Журнал физической химии Б. 119 (7): 2968–2978. дои : 10.1021/jp512900x . ПМИД 25622192 .
- ^ Муто, Хироки; Перрон, Амели; Акеманн, Вальтер; Ивамото, Юка; Кнопфель, Томас (2011). «Оптогенетический мониторинг мембранных потенциалов» . Экспериментальная физиология . 96 (1): 13–18. doi : 10.1113/expphysicalol.2010.053942 . ПМИД 20851856 . S2CID 5265189 .
- ^ Питкэрн, Эмили; Харрис, Ханна; Эпини, Жюстин; Пай, Вайбхав П; Лемир, Джоан М; Да, Бин; Ши, Нянь-Цин; Левин, Майкл; Маклафлин, Келли А. (2017). «Координация морфогенеза сердца: новая роль гиперполяризационно-активируемых циклических нуклеотид-зависимых (HCN) каналов во время кардиогенеза у Xenopus laevis» . Коммуникативная и интегративная биология . 10 (3): e1309488. дои : 10.1080/19420889.2017.1309488 . ПМК 5501196 . ПМИД 28702127 .
- ^ Пай, Вайбхав П; Уиллок, Валери; Питкэрн, Эмили Дж; Лемир, Джоан М; Паре, Жан-Франсуа; Ши, Нянь-Цин; Маклафлин, Келли А; Левин, Майкл (2017). «Функция ионного канала HCN4 необходима для ранних событий, которые регулируют анатомическое лево-правое паттернирование узловым и левоасимметричным образом, независимо от экспрессии генов» . Биология Открытая . 6 (10): 1445–1457. дои : 10.1242/bio.025957 . ПМЦ 5665463 . ПМИД 28818840 .
- ^ Перейти обратно: а б Адамс, Дэни Спенсер; Узель, Себастьен Г.М; Акаги, Джин; Влодкович, Дональд; Андреева Виктория; Йелик, Памела Кротти; Девитт-Ли, Адриан; Паре, Жан-Франсуа; Левин, Майкл (2016). «Биоэлектрическая передача сигналов через калиевые каналы: механизм черепно-лицевого дисморфогенеза при KCNJ2-ассоциированном синдроме Андерсена-Тавиля» . Журнал физиологии . 594 (12): 3245–3270. дои : 10.1113/JP271930 . ПМК 4908029 . ПМИД 26864374 .
- ^ Ванденберг, Лаура Н; Морри, Райан Д; Адамс, Дэни Спенсер (2011). «V-АТФаза-зависимая эктодермальная напряженность и регионализация ph необходимы для краниофациального морфогенеза» . Динамика развития . 240 (8): 1889–1904. дои : 10.1002/dvdy.22685 . ПМЦ 10277013 . ПМИД 21761475 . S2CID 205768092 .
- ^ Перейти обратно: а б с Пай, В.П.; Лемир, Дж. М.; Паре, Ж.-Ф; Лин, Г; Чен, Ю; Левин, М (2015). «Эндогенные градиенты потенциала покоя инструктивно структурируют эмбриональную нервную ткань посредством передачи сигналов Notch и регуляции пролиферации» . Журнал неврологии . 35 (10): 4366–85. doi : 10.1523/JNEUROSCI.1877-14.2015 . ПМК 4355204 . ПМИД 25762681 .
- ^ Перейти обратно: а б Пай, Вайбхав П; Лемир, Джоан М; Чен, Ин; Лин, Гуфа; Левин, Майкл (2015). «Локальные и дальнодействующие эндогенные градиенты потенциала покоя антагонистически регулируют апоптоз и пролиферацию в эмбриональной ЦНС» . Международный журнал биологии развития . 59 (7–8–9): 327–40. дои : 10.1387/ijdb.150197ml . ПМЦ 10505512 . ПМИД 26198142 .
- ^ Перейти обратно: а б с Ператонер, Саймон; Даан, Джейкоб М; Генрион, Ульрика; Сибом, Гвискар; Хигдон, Чарльз В.; Джонсон, Стивен Л; Нюсляйн-Фольхард, Кристиана; Харрис, Мэтью П. (2014). «Биоэлектрическая сигнализация регулирует размер плавников данио» . ПЛОС Генетика . 10 (1): e1004080. дои : 10.1371/journal.pgen.1004080 . ПМЦ 3894163 . ПМИД 24453984 .
- ^ Перейти обратно: а б Чернет, Брук Т; Филдс, Крис; Левин, Майкл (2015). «Передача сигналов через щелевые соединения дальнего действия контролирует онкогенно-опосредованный онкогенез у эмбрионов Xenopus laevis» . Границы в физиологии . 5 : 519. doi : 10.3389/fphys.2014.00519 . ПМК 4298169 . ПМИД 25646081 .
- ^ Перейти обратно: а б Чернет, Брук Т; Левин, Майкл (2014). «Трансмембранный потенциал соматических клеток контролирует опосредованный онкогенами онкогенез на больших расстояниях» . Онкотаргет . 5 (10): 3287–306. doi : 10.18632/oncotarget.1935 . ПМК 4102810 . ПМИД 24830454 .
- ^ Перейти обратно: а б Юн, Джи; Оберой, С; Тристани-Фирузи, М; Этеридж, СП; Китания, Л; Крамер, Дж. Х.; Миллер, БЛ; Фу, Ю.Х.; Птачек, ЖЖ (2006). «Синдром Андерсена-Тавиля: проспективный когортный анализ и расширение фенотипа». Американский журнал медицинской генетики, часть A. 140А (4): 312–321. дои : 10.1002/ajmg.a.31092 . ПМИД 16419128 . S2CID 33899188 .
- ^ Пластер, Никки М; Тавил, Лави; Тристани-Фирузи, Мартин; Канун, Соня; Бендаху, Саид; Цунода, Акико; Дональдсон, Мэтью Р.; Ианнакконе, Сьюзан Т; Брант, Юаут; Барон, Ричард; Кларк, Джон; Деймер, Феза; Джордж, Альфред Л; Фиш, Фрэнк А; Хан, Анжелика; Ниту, Александру; Оздемир, Джошкун; Сердароглу, Пирайе; Субрамони, Ш.Х.; Вулф, Гил; Фу, Ин-Хуэй; Птачек, Луи Дж (2001). «Мутации в Kir2.1 вызывают развитие и эпизодические электрические фенотипы синдрома Андерсена» . Клетка . 105 (4): 511–519. дои : 10.1016/S0092-8674(01)00342-7 . ПМИД 11371347 . S2CID 17015195 .
- ^ Перейти обратно: а б Масотти, Андреа; Ува, Паоло; Дэвис-Кеппен, Лаура; Базель-Ванагайте, Лина; Коэн, Лиор; Писанески, Элиза; Селлуцци, Антонелла; Бенчивенга, Паола; Фанг, Мингьян; Тиан, Мингю; Сюй, Сюнь; Каппа, Марко; Даллапиккола, Бруно (2015). «Синдром Кеппена-Любинского вызван мутациями во внутреннем выпрямляющем канале K+, кодируемом KCNJ6» . Американский журнал генетики человека . 96 (2): 295–300. дои : 10.1016/j.ajhg.2014.12.011 . ПМК 4320262 . ПМИД 25620207 .
- ^ Папулидис, И.; Папагеоргиу, Э.; Сиому, Э.; и др. (2014). «Пациент с частичной трисомией 21 и делецией 7q демонстрирует легкий фенотип синдрома Дауна». Джин . 536 (2): 441–443. дои : 10.1016/j.gene.2013.11.078 . ПМИД 24334122 .
- ^ Вальо, Стефано (2010). «Изменчивые сигналы во время беременности». Феромоны . Витамины и гормоны. Том. 83. С. 289–304. дои : 10.1016/S0083-6729(10)83012-2 . ISBN 978-0-12-381516-3 . ПМИД 20831951 .
- ^ Ямамото, Тецуо; Киносита, Манабу; Шиномия, Нариёси; и др. (2010). «Предварительная обработка аскорбиновой кислотой предотвращает летальный желудочно-кишечный синдром у мышей, получивших огромное количество радиации» . Журнал радиационных исследований . 51 (2): 145–156. Бибкод : 2010JRadR..51..145Y . дои : 10.1269/jrr.09078 . ПМИД 19959877 .
- ^ Чапкова, Павлина; Мисовикова, Надежда; Врбицка, Дита (2013). «Частичная трисомия и тетрасомия хромосомы 21 без фенотипа синдрома Дауна и краткий обзор корреляции генотип-фенотип. Отчет о случае» . Биомедицинские статьи . 158 (2): 321–325. дои : 10.5507/bp.2013.077 . ПМИД 24145769 .
- ^ Мегарбане, Андре; Аль-Али, Рашид; Шукайр, Нэнси; и др. (2016). «Синдром Темпла-Барайтцера и синдром Циммермана-Лабанда: одна клиническая форма?» . BMC Медицинская генетика . 17 (1): 42. дои : 10.1186/s12881-016-0304-4 . ПМК 4901505 . ПМИД 27282200 .
- ^ Мастранжело, М.; Шеффер, И.Е.; Брамсвиг, Северная Каролина; Наир, LD; Майерс, Коннектикут; Дентичи, М.Л.; Коренке, Г.К.; Шох, К; Кампо, премьер-министр; Уайт, С.М.; Шаши, В; Кансагра, С; Ван Эссен, AJ; Леуцци, В. (2016). «Эпилепсия при синдромах, связанных с KCNH1». Эпилептические расстройства . 18 (2): 123–136. дои : 10.1684/epd.2016.0830 . ПМИД 27267311 .
- ^ Брамсвиг, Нурия С; Окелоен, CW; Чещик, Дж. К.; Ван Эссен, AJ; Пфундт, Р; Смитинк, Дж; Опрос-The, BT; Энгельс, Х; Стром, Т.М; Вечорек, Д; Клифстра, Т; Людеке, Х.-Ю (2015). « Расщепление против объединения в кучу: синдромы Темпла-Барайцера и Циммермана-Лабанда». Генетика человека . 134 (10): 1089–1097. дои : 10.1007/s00439-015-1590-1 . ПМИД 26264464 . S2CID 14238362 .
- ^ Перейти обратно: а б Кортюм, Фанни; Капуто, Вивиана; Бауэр, Кристиана К; и др. (2015). «Мутации в KCNH1 и ATP6V1B2 вызывают синдром Циммермана-Лабанда». Природная генетика . 47 (6): 661–7. дои : 10.1038/ng.3282 . hdl : 2108/118197 . ПМИД 25915598 . S2CID 12060592 .
- ^ Кастори, Марко; Морлино, Сильвия; Рителли, Марко; и др. (2014). «Поздняя диагностика синдрома латерального менингоцеле у женщины 55 лет с симптомами нестабильности суставов и хронической скелетно-мышечной болью». Американский журнал медицинской генетики, часть A. 164 (2): 528–534. дои : 10.1002/ajmg.a.36301 . ПМИД 24311540 . S2CID 12063113 .
- ^ Перкс, Т; Попат, Х.; Кронин, AJ; Дёрнинг, П; Мэггс, Р. (2013). «Ортодонтическое и хирургическое лечение синдрома Циммермана-Лабанда». Ортодонтия . 14 (1): e168–176. дои : 10.11607/ortho.897 . ПМИД 23646327 .
- ^ Саваки, К.; Мисима, К.; Сато, А.; и др. (2012). «Синдром Циммермана-Лабанда». Журнал клинической детской стоматологии . 36 (3): 297–300. дои : 10.17796/jcpd.36.3.k854128176u764l8 . ПМИД 22838235 .
- ^ Дуфендач, Калифорния; Джудисесси, младший; Бочек, Нью-Джерси; Акерман, MJ (2013). «Материнский мозаицизм затрудняет неонатальную диагностику синдрома Тимоти 1 типа» . Педиатрия . 131 (6): e1991–1995. дои : 10.1542/пед.2012-2941 . ПМК 3666110 . ПМИД 23690510 .
- ^ Сплавский, Игорь; Тимоти, Кэтрин В.; Шарп, Лия М; и др. (2004). «Дисфункция кальциевых каналов CaV1.2 вызывает мультисистемное расстройство, включая аритмию и аутизм» . Клетка . 119 (1): 19–31. дои : 10.1016/j.cell.2004.09.011 . ПМИД 15454078 . S2CID 15325633 .
- ^ Маргулис, Андреа В.; Митчелл, Аллен А.; Гильбоа, Сюзанна М.; Верлер, Марта М.; Миттлман, Мюррей А; Глинн, Роберт Дж.; Эрнандес-Диас, Соня (2012). «Использование топирамата во время беременности и риск расщелины рта» . Американский журнал акушерства и гинекологии . 207 (5): 405.e1–7. дои : 10.1016/j.ajog.2012.07.008 . ПМЦ 3484193 . ПМИД 22917484 .
- ^ Хилл, Дениз С.; Влодарчик, Богдан Ю.; Паласиос, Ана М.; Финнелл, Ричард Х. (2014). «Тератогенное действие противоэпилептических препаратов» . Экспертный обзор нейротерапии . 10 (6): 943–959. дои : 10.1586/ern.10.57 . ПМК 2970517 . ПМИД 20518610 .
- ^ Уайт, Х. Стив; Смит, Мисти Д.; Уилкокс, Карен С. (2007). «Механизмы действия противоэпилептических препаратов» . Нейробиология эпилепсии и старения . Международное обозрение нейробиологии. Том. 81. С. 85–110 . дои : 10.1016/S0074-7742(06)81006-8 . ISBN 978-0-12-374018-2 . ПМИД 17433919 .
- ^ Фриц, Х.; Мюллер, Д.; Хесс, Р. (1976). «Сравнительное исследование тератогенности фенобарбитона, дифенгидатоина и карбамазепина на мышах». Токсикология . 6 (3): 323–330. дои : 10.1016/0300-483X(76)90036-6 . ПМИД 996878 .
- ^ Фельдман, Джеральд Л.; Уивер, Д.Д.; Ловриен, EW (1977). «Фетальный триметадионовый синдром». Американский журнал болезней детей . 131 (12): 1389–1392. дои : 10.1001/archpedi.1977.02120250071012 . ПМИД 412416 .
- ^ Перейти обратно: а б Баркер, AT; Яффе, LF; Ванейбл, JW (1982). «Голый эпидермис кариеса содержит мощную батарею». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология . 242 (3): Р358–366. дои : 10.1152/ajpregu.1982.242.3.R358 . ПМИД 7065232 .
- ^ Перейти обратно: а б Блю, О; Скотт, БиГ (1950). «Вибрационный зондовый электрометр для измерения биоэлектрических потенциалов». Обзор научных инструментов . 21 (10): 867–868. Бибкод : 1950RScI...21..867B . дои : 10.1063/1.1745444 . ПМИД 14786543 .
- ^ Чан, Мэйчэн; Робинсон, Кеннет Р.; Ванейбл, Джозеф В. (1992). «Электрические поля вблизи эпителиальных ран изолированного бычьего глаза». Экспериментальное исследование глаз . 54 (6): 999–1003. дои : 10.1016/0014-4835(92)90164-N . ПМИД 1521590 .
- ^ Чан, Мэйчэн; Краго, Эдвард Дж; Ванейбл, Джозеф В. (1991). «Собственные электрические поля способствуют эпителизации ран у тритона Notophthalmus viridescens». Биология развития . 146 (2): 377–385. дои : 10.1016/0012-1606(91)90239-Y . ПМИД 1864462 .
- ^ Перейти обратно: а б Рид, Брайан; Сонг, Бинг; Маккейг, Колин Д.; Чжао, Мин (2005). «Заживление ран роговицы крыс: роль электрического тока» . Журнал ФАСЭБ . 19 (3): 379–386. дои : 10.1096/fj.04-2325com . ПМЦ 1459277 . ПМИД 15746181 .
- ^ Перейти обратно: а б с д Чжао, Мин; Сонг, Бинг; Пу, Джин; и др. (2006). «Электрические сигналы контролируют заживление ран посредством фосфатидилинозитол-3-ОН-киназы-γ и PTEN». Природа . 442 (7101): 457–460. Бибкод : 2006Natur.442..457Z . дои : 10.1038/nature04925 . ПМИД 16871217 . S2CID 4391475 .
- ^ Шен, Юньюнь; Пфлюгер, Триша; Феррейра, Фернандо; Лян, Цзебин; Наведо, Мануэль Ф; Цзэн, Цюньли; Рид, Брайан; Чжао, Мин (2016). «Диабетические раны роговицы производят значительно более слабые электрические сигналы, что может способствовать ухудшению заживления» . Научные отчеты . 6 : 26525. Бибкод : 2016NatSR...626525S . дои : 10.1038/srep26525 . ПМК 4901296 . ПМИД 27283241 .
- ^ Морис, Д.М. Проницаемость для ионов натрия роговицы живого кролика. J Physiol 112, 367–391. Опубликованный центральный ссылочный номер: PMC1393020.
- ^ Клайс, С.Д. Электрические профили эпителия роговицы. J Physiol 226, 407-429. Опубликованный центральный справочный номер: PMC1331188.
- ^ Песня, Б (2004). «Регенерация нервов и заживление ран стимулируются и направляются эндогенным электрическим полем in vivo» . Журнал клеточной науки . 117 (20): 4681–4690. дои : 10.1242/jcs.01341 . ПМИД 15371524 .
- ^ Лин, Ф.; Балдессари, Ф.; Дьенге, CC; и др. (2008). «Электротаксис лимфоцитов in vitro и in vivo» . Журнал иммунологии . 181 (4): 2465–2471. дои : 10.4049/jimmunol.181.4.2465 . ПМЦ 2572691 . ПМИД 18684937 .
- ^ Ян, Х.-й; Чарльз, Р.-П; Хаммлер, Э; Бэйнс, Д.Л.; Иссеров, Р.Р. (2013). «Эпителиальный натриевый канал обеспечивает направленность гальванотаксиса в кератиноцитах человека» . Журнал клеточной науки . 126 (9): 1942–1951. дои : 10.1242/jcs.113225 . ПМЦ 3666251 . ПМИД 23447677 .
- ^ Аллен, Грег М.; Могильнер, Алекс; Териот, Джули А. (2013). «Электрофорез компонентов клеточных мембран создает сигнал направления, управляющий гальванотаксисом кератоцитов» . Современная биология . 23 (7): 560–568. Бибкод : 2013CBio...23..560A . дои : 10.1016/j.cub.2013.02.047 . ПМЦ 3718648 . ПМИД 23541731 .
- ^ Чанг, Фред; Минк, Николас (2014). «Электрохимический контроль полярности клеток и тканей» . Ежегодный обзор клеточной биологии и биологии развития . 30 : 317–336. doi : 10.1146/annurev-cellbio-100913-013357 . ПМИД 25062359 .
- ^ Робинсон, КР (1985). «Реакция клеток на электрические поля: обзор» . Журнал клеточной биологии . 101 (6): 2023–2037. дои : 10.1083/jcb.101.6.2023 . ПМК 2114002 . ПМИД 3905820 .
- ^ Нисимура, Кентукки; Иссеров, Р.Р.; Нуччителли, Р. (1996). «Человеческие кератиноциты мигрируют к отрицательному полюсу в электрических полях постоянного тока, сравнимых с теми, которые измеряются в ранах млекопитающих» . Журнал клеточной науки . 109 (1): 199–207. дои : 10.1242/jcs.109.1.199 . ПМИД 8834804 .
- ^ Чжао, М.; Агиус-Фернандес, А.; Форрестер, СП; Маккейг, компакт-диск (1996). «Ориентация и направленная миграция культивируемых эпителиальных клеток роговицы в небольших электрических полях зависят от сыворотки» . Журнал клеточной науки . 109 (6): 1405–1414. дои : 10.1242/jcs.109.6.1405 . ПМИД 8799828 .
- ^ Грулер, Ганс; Нуччителли, Ричард (2000). «Механизм реакции гальванотаксиса кератиноцитов можно смоделировать как пропорциональный контроллер». Клеточная биохимия и биофизика . 33 (1): 33–51. дои : 10.1385/CBB:33:1:33 . ПМИД 11322511 . S2CID 11731666 .
- ^ Чжао, М; Агиус-Фернандес, А; Форрестер, СП; Маккейг, CD (1996). «Направленная миграция эпителиальных листов роговицы в физиологических электрических полях» . Исследовательская офтальмология и визуальные науки . 37 (13): 2548–2558. ПМИД 8977469 .
- ^ Накадзима, Кен-Ичи; Чжу, Кан; Сунь, Яо-Хуэй; и др. (2015). «KCNJ15/Kir4.2 соединяется с полиаминами, чувствуя слабые внеклеточные электрические поля при гальванотаксисе» . Природные коммуникации . 6 : 8532. Бибкод : 2015NatCo...6.8532N . дои : 10.1038/ncomms9532 . ПМЦ 4603535 . ПМИД 26449415 .
- ^ Гао, Ранчи; Чжао, Сивэй; Цзян, Сюпин; и др. (2015). «Крупномасштабный скрининг выявил гены, которые опосредуют электротаксис у Dictyostelium discoideum » . Научная сигнализация . 8 (378): ра50. doi : 10.1126/scisignal.aab0562 . ПМЦ 4470479 . ПМИД 26012633 .
- ^ Джамгоз, МБ А; Мисельска, М; Мадея, З; и др. (2001). «Направленное движение клеток рака предстательной железы крыс в электрическом поле постоянного тока: участие активности потенциалзависимых Na+-каналов» . Журнал клеточной науки . 114 (14): 2697–2705. дои : 10.1242/jcs.114.14.2697 . ПМИД 11683396 .
- ^ Чжан, Гаофэн; Эдмундсон, Мэтью; Тележкин, Всеволод; и др. (2016). «Роль канала Kv1.2 в миграции клеток электротаксиса» . Журнал клеточной физиологии . 231 (6): 1375–1384. дои : 10.1002/jcp.25259 . ПМЦ 4832312 . ПМИД 26580832 .
- ^ Чжан, Гаофэн; Гу, Ю; Бегум, Румена; и др. (2016). «Киндлин-1 регулирует электротаксис кератиноцитов» . Журнал исследовательской дерматологии . 136 (11): 2229–2239. дои : 10.1016/j.jid.2016.05.129 . ПМЦ 5756539 . ПМИД 27427485 .
- ^ Чжао, МИН; Пу, Цзинь; Форрестер, Джон В.; и др. (2002). «Мембранные липиды, рецепторы ЭФР и внутриклеточные сигналы колокализуются и поляризуются в эпителиальных клетках, движущихся направленно в физиологическом электрическом поле» . Журнал ФАСЭБ . 16 (8): 857–859. doi : 10.1096/fj.01-0811fje . ПМИД 11967227 . S2CID 31682478 .
- ^ Линь, Бо-Цзянь; Цао, Шунь-хао; Чен, Алекс; и др. (2017). «Липидные рафты чувствуют и направляют миграцию, вызванную электрическим полем» . Труды Национальной академии наук . 114 (32): 8568–8573. Бибкод : 2017PNAS..114.8568L . дои : 10.1073/pnas.1702526114 . ПМК 5559012 . ПМИД 28739955 .
- ^ Маден, М. (1991). История исследований регенерации . Кембриджский университет. [ нужна страница ]
- ^ Марш, Гордон; Бимс, HW (1952). «Электрический контроль морфогенеза у регенерирующей dugesia tigrina. I. Связь осевой полярности с силой поля». Журнал клеточной и сравнительной физиологии . 39 (2): 191–213. дои : 10.1002/jcp.1030390203 . ПМИД 14946235 .
- ^ Боргенс, Ричард Б. (1984). «Инициируются ли развитие конечностей и регенерация конечностей повреждением покровов?». Дифференциация . 28 (2): 87–93. дои : 10.1111/j.1432-0436.1984.tb00270.x . ПМИД 6526168 .
- ^ Ликкен, Дэвид Т. (1970). «Прямоугольный анализ импеданса кожи». Психофизиология . 7 (2): 262–275. дои : 10.1111/j.1469-8986.1970.tb02232.x . ПМИД 5499129 .
- ^ Смит, Стивен Д. (1967). «Индукция частичной регенерации конечностей у Rana pipiens путем гальванической стимуляции». Анатомическая запись . 158 (1): 89–97. дои : 10.1002/ar.1091580110 . ПМИД 6033441 . S2CID 22547794 .
- ^ Перейти обратно: а б Дженкинс, Лиза С; Дуэрсток, Брэдли С; Боргенс, Ричард Б. (1996). «Уменьшение тока травмы, выходящей за пределы ампутации, тормозит регенерацию конечностей у краснопятнистого тритона» . Биология развития . 178 (2): 251–262. дои : 10.1006/dbio.1996.0216 . ПМИД 8812127 .
- ^ Боргенс, Р.Б.; Ванейбл, Дж. В.; Яффе, Л.Ф. (1977). «Биоэлектричество и регенерация: сильные токи оставляют культи регенерирующих конечностей тритона» . Труды Национальной академии наук . 74 (10): 4528–32. Бибкод : 1977PNAS...74.4528B . дои : 10.1073/pnas.74.10.4528 . ПМК 431978 . ПМИД 270701 .
- ^ Перейти обратно: а б Боргенс, Ричард Б; Ванейбл, Джозеф В.; Яффе, Лайонел Ф (1979). «Небольшие искусственные токи усиливают регенерацию конечностей Xenopus ». Журнал экспериментальной зоологии . 207 (2): 217–226. Бибкод : 1979JEZ...207..217B . дои : 10.1002/jez.1402070206 .
- ^ Маккейг, CD «Электрические поля при восстановлении позвоночных». (Физиологическое общество, 1989).
- ^ Перейти обратно: а б Ясуда, Ивао (1974). «Механическая и электрическая мозоль». Анналы Нью-Йоркской академии наук . 238 : 457–465. дои : 10.1111/j.1749-6632.1974.tb26812.x . ПМИД 4531275 . S2CID 84676921 .
- ^ Фукада, Эйичи; Ясуда, Ивао (1957). «О пьезоэлектрическом эффекте кости». Журнал Физического общества Японии . 12 (10): 1158–1162. Бибкод : 1957JPSJ...12.1158F . дои : 10.1143/JPSJ.12.1158 .
- ^ Брюс М. Карлсон, доктор медицинских наук, доктор философии. Принципы регенеративной биологии. (Академическая пресса, 2007). [ нужна страница ]
- ^ Перейти обратно: а б Голдинг, Энн; Гуэй, Джастин А; Эррера-Ринкон, Селия; Левин, Майкл; Каплан, Дэвид Л. (2016). «Настраиваемое устройство из гидрогеля шелка для изучения регенерации конечностей у взрослых Xenopus Laevis» . ПЛОС ОДИН . 11 (6): e0155618. Бибкод : 2016PLoSO..1155618G . дои : 10.1371/journal.pone.0155618 . ПМЦ 4892606 . ПМИД 27257960 .
- ^ Перейти обратно: а б Хечаваррия, Даниэль; Девильде, Абиш; Браунхут, Сьюзен; Левин, Майкл; Каплан, Дэвид Л. (2010). «Регенеративная манжета BioDome для биохимической и биофизической стимуляции регенерации тканей» . Медицинская инженерия и физика . 32 (9): 1065–1073. дои : 10.1016/j.medengphy.2010.07.010 . ПМК 2967604 . ПМИД 20708956 .
- ^ Леппик, Людмила П; Фремель, Дара; Славичи, Андрей; Овадия, Закри Н; Худак, Лукаш; Генрих, Дирк; Марци, Инго; Баркер, Джон Х (2015). «Влияние электростимуляции на регенерацию конечностей крыс: новый взгляд на старую модель» . Научные отчеты . 5 : 18353. Бибкод : 2015NatSR...518353L . дои : 10.1038/srep18353 . ПМЦ 4683620 . ПМИД 26678416 .
- ^ Рид, Брайан; Сонг, Бинг; Чжао, Мин (2009). «Электрические токи при регенерации хвоста головастика Xenopus» . Биология развития . 335 (1): 198–207. дои : 10.1016/j.ydbio.2009.08.028 . ПМИД 19733557 .
- ^ Ценг, Айсун; Левин, Майкл (2014). «Взлом биоэлектрического кода: исследование эндогенного ионного контроля формирования паттернов» . Коммуникативная и интегративная биология . 6 (1): e22595. дои : 10.4161/cib.22595 . ПМЦ 3689572 . ПМИД 23802040 .
- ^ Перейти обратно: а б с Адамс, Д.С.; Маси, А; Левин, М. (2007). «H+-насос-зависимые изменения мембранного напряжения являются ранним механизмом, необходимым и достаточным для индукции регенерации хвоста Xenopus» . Разработка . 134 (7): 1323–1335. дои : 10.1242/dev.02812 . ПМИД 17329365 .
- ^ Перейти обратно: а б с д Ценг, А.-С; Бин, Вашингтон; Лемир, Дж. М.; Маси, А; Левин, М (2010). «Индукция регенерации позвоночных кратковременным натриевым током» . Журнал неврологии . 30 (39): 13192–13200. doi : 10.1523/JNEUROSCI.3315-10.2010 . ПМЦ 2965411 . ПМИД 20881138 .
- ^ Перейти обратно: а б с Адамс, Д.С.; Ценг, А.-С; Левин, М (2013). «Световая активация архаэрродопсинового H+-насоса обращает вспять возрастную потерю регенерации позвоночных: активный контроль на системном уровне in vivo» . Биология Открытая . 2 (3): 306–313. дои : 10.1242/bio.20133665 . ПМК 3603412 . ПМИД 23519324 .
- ^ Овьедо, Нью-Джерси; Левин, М. (2007). «Smedinx-11 — это ген щелевого соединения планарных стволовых клеток, необходимый для регенерации и гомеостаза» . Разработка . 134 (17): 3121–3131. дои : 10.1242/dev.006635 . ПМИД 17670787 .
- ^ Бин, Вашингтон; Морокума, Дж; Лемир, Дж. М.; Левин, М (2012). «Биоэлектрическая передача сигналов регулирует размер головы и органов во время регенерации планарий» . Разработка . 140 (2): 313–322. дои : 10.1242/dev.086900 . ПМЦ 3597208 . ПМИД 23250205 .
- ^ Бин, Венди С; Морокума, Джунджи; Адамс, Дэни С; Левин, Майкл (2011). «Подход химической генетики показывает, что для регенерации головы планарий необходимо мембранное напряжение, опосредованное H,K-АТФазой» . Химия и биология . 18 (1): 77–89. doi : 10.1016/j.chembiol.2010.11.012 . ПМЦ 3278711 . ПМИД 21276941 .
- ^ Перейти обратно: а б Эммонс-Белл, Майя; Дюрант, Фэллон; Хаммельман, Дженнифер; Бессонов, Николай; Вольперт, Виталий; Морокума, Джунджи; Пинет, Кайлиннетт; Адамс, Дэни; Пиетак, Алексис; Лобо, Дэниел; Левин, Майкл (2015). «Блокада щелевого соединения стохастически индуцирует различную видоспецифичную анатомию головы у генетически диких плоских червей Girardia dorotocephala» . Международный журнал молекулярных наук . 16 (11): 27865–27896. дои : 10.3390/ijms161126065 . ПМЦ 4661923 . ПМИД 26610482 .
- ^ Ноги, Тайсаку; Левин, Майкл (2005). «Характеристика экспрессии гена иннексина и функциональной роли щелевых соединений в регенерации планарий» . Биология развития . 287 (2): 314–335. дои : 10.1016/j.ydbio.2005.09.002 . ПМИД 16243308 .
- ^ Овьедо, Нестор Х; Морокума, Джунджи; Валентек, Питер; Кема, Идо П; Гу, Ман Бок; Ан, Джу-Мён; Хван, Юнг Шан; Годобори, Такаши; Левин, Майкл (2010). «Дальнодействующие сигналы, опосредованные нейронами и белками щелевых соединений, контролируют полярность во время регенерации планарий» . Биология развития . 339 (1): 188–199. дои : 10.1016/j.ydbio.2009.12.012 . ПМЦ 2823934 . ПМИД 20026026 .
- ^ Перейти обратно: а б Дюрант, Фэллон; Морокума, Джунджи; Филдс, Кристофер; Уильямс, Кэтрин; Адамс, Дэни Спенсер; Левин, Майкл (2017). «Долгосрочное стохастическое редактирование регенеративной анатомии посредством нацеливания на эндогенные биоэлектрические градиенты» . Биофизический журнал . 112 (10): 2231–2243. Бибкод : 2017BpJ...112.2231D . дои : 10.1016/j.bpj.2017.04.011 . ПМЦ 5443973 . ПМИД 28538159 .
- ^ Нойхоф, Моран; Левин, Майкл; Рехави, Одед (2016). «Вертикально- и горизонтально передаваемые воспоминания – стирание границ между регенерацией и наследованием у планарий» . Биология Открытая . 5 (9): 1177–1188. дои : 10.1242/bio.020149 . ПМК 5051648 . ПМИД 27565761 .
- ^ Перейти обратно: а б Лобикин, Мария; Чернет, Брук; Лобо, Дэниел; Левин, Майкл (2012). «Потенциал покоя, индуцированный онкогенами онкогеногенез и метастазирование: биоэлектрическая основа рака in vivo» . Физическая биология . 9 (6): 065002. Бибкод : 2012PhBio...9f5002L . дои : 10.1088/1478-3975/9/6/065002 . ПМК 3528107 . ПМИД 23196890 .
- ^ Ян, Мин; Брекенбери, Уильям Дж. (2013). «Мембранный потенциал и прогрессирование рака» . Границы в физиологии . 4 : 185. дои : 10.3389/fphys.2013.00185 . ПМЦ 3713347 . ПМИД 23882223 .
- ^ Перейти обратно: а б Кандуз, Мустафа; Батист, Джеральд (2010). «Щелевые соединения и коннексины как терапевтические мишени при раке». Мнение экспертов о терапевтических целях . 14 (7): 681–692. дои : 10.1517/14728222.2010.487866 . ПМИД 20446866 . S2CID 30844116 .
- ^ Лейт, Эдвард; Сирнес, Сольвейг; Омори, Ясуфуми; Риведал, Эдгар (2006). «Понижение уровня щелевых соединений в раковых клетках». Критические обзоры онкогенеза . 12 (3–4): 225–256. дои : 10.1615/CritRevOncog.v12.i3-4.30 . ПМИД 17425504 .
- ^ Троско, Дж. Э. (2005). «Роль стволовых клеток и щелевых соединений как мишеней для химиопрофилактики рака и химиотерапии». Биомедицина и фармакотерапия . 59 : С326–331. дои : 10.1016/S0753-3322(05)80065-4 . ПМИД 16507402 .
- ^ Пардо, Луис А; Штюмер, Вальтер (2013). «Роль K+-каналов при раке». Обзоры природы Рак . 14 (1): 39–48. дои : 10.1038/nrc3635 . ПМИД 24336491 . S2CID 28497543 .
- ^ Хуан, Си; Ян, Лили Йе (2014). «Нацеливание на калиевые каналы при раке» . Журнал клеточной биологии . 206 (2): 151–162. дои : 10.1083/jcb.201404136 . ПМК 4107787 . ПМИД 25049269 .
- ^ Арканджели, Аннароса; Беккетти, Андреа (2010). «Новые тенденции в терапии рака: воздействие на ионные каналы и транспортеры» . Фармацевтика . 3 (4): 1202–1224. дои : 10.3390/ph3041202 . ПМК 4034029 . ПМИД 27713296 .
- ^ Фрейзер, С.П.; Озерлат-Гюндуз, I; Брэкенбери, WJ; Фицджеральд, Э.М.; Кэмпбелл, Т.М; Кумбс, Р.К.; Джамгоз, МБ А (2014). «Регуляция экспрессии потенциалзависимых натриевых каналов при раке: гормоны, факторы роста и ауторегуляция» . Философские труды Королевского общества B: Биологические науки . 369 (1638): 20130105. doi : 10.1098/rstb.2013.0105 . ПМЦ 3917359 . ПМИД 24493753 .
- ^ Джамгоз, МБ А; Кумбс, Р.К.; Шваб, А (2014). «Ионный транспорт и рак: от инициации до метастазирования» . Философские труды Королевского общества B: Биологические науки . 369 (1638): 20130092. doi : 10.1098/rstb.2013.0092 . ПМЦ 3917347 . ПМИД 24493741 .
- ^ Фреде, Джулия; Фрейзер, Скотт П.; Оскай-Озчелик, Гюльтен; Хон, Ёсон; Иоана Браику, Э; Сехули, Джалид; Габра, Хани; Джамгоз, Мустафа Б.А. (2013). «Рак яичников: ионный канал и экспрессия аквапоринов как новые цели клинического потенциала». Европейский журнал рака . 49 (10): 2331–2344. дои : 10.1016/j.ejca.2013.03.016 . ПМИД 23683551 .
- ^ Йылдирим, Сенай; Алтун, Сейхан; Гумушан, Хатидже; Патель, Ануп; Джамгоз, Мустафа Б.А. (2012). «Активность потенциалзависимых натриевых каналов способствует метастазированию рака простаты in vivo». Письма о раке . 323 (1): 58–61. дои : 10.1016/j.canlet.2012.03.036 . ПМИД 22484465 .
- ^ Блэкистон, Д; Адамс, Д.С.; Лемир, Дж. М.; Лобикин М.; Левин, М (2010). «Трансмембранный потенциал инструкторских клеток, экспрессирующих Gly Cl, индуцирует неопластическую конверсию меланоцитов по серотонинергическому пути» . Модели и механизмы заболеваний . 4 (1): 67–85. дои : 10.1242/dmm.005561 . ПМК 3008964 . ПМИД 20959630 .
- ^ Морокума, Дж; Блэкистон, Д; Адамс, Д.С.; Сибом, Г; Триммер, Б; Левин, М (2008). «Модуляция функции калиевых каналов придает эмбриональным стволовым клеткам гиперпролиферативный инвазивный фенотип» . Труды Национальной академии наук . 105 (43): 16608–13. Бибкод : 2008PNAS..10516608M . дои : 10.1073/pnas.0808328105 . JSTOR 25465142 . ПМЦ 2575467 . ПМИД 18931301 .
- ^ Перейти обратно: а б Чернет, Брук Т; Адамс, Дэни С; Лобикин, Мария; Левин, Майкл (2016). «Использование генетически закодированных светозависимых ионных транслокаторов для контроля онкогенеза» . Онкотаргет . 7 (15): 19575–19588. дои : 10.18632/oncotarget.8036 . ПМЦ 4991402 . ПМИД 26988909 .
- ^ Чернет, Б.Т; Левин, М (2013). «Потенциал трансмембранного напряжения является важным клеточным параметром для обнаружения и контроля развития опухоли в модели Xenopus» . Модели и механизмы заболеваний . 6 (3): 595–607. дои : 10.1242/dmm.010835 . ПМЦ 3634644 . ПМИД 23471912 .
- ^ Ли, Чунмей; Левин, Майкл; Каплан, Дэвид Л. (2016). «Биоэлектрическая модуляция поляризации макрофагов» . Научные отчеты . 6 : 21044. Бибкод : 2016NatSR...621044L . дои : 10.1038/srep21044 . ПМЦ 4751571 . ПМИД 26869018 .
- ^ Озкукур, Нурдан; Куинн, Кайл П.; Панг, Джин С; Ду, Чуан; Георгакуди, Ирен; Миллер, Эрик; Левин, Майкл; Каплан, Дэвид Л. (2015). «Деполяризация мембранного потенциала вызывает изменения в расположении и связности нейронов в совместных культурах» . Мозг и поведение . 5 (1): 24–38. дои : 10.1002/brb3.295 . ПМЦ 4321392 . ПМИД 25722947 .
- ^ Лобикин, Мария; Паре, Жан-Франсуа; Каплан, Дэвид Л; Левин, Майкл (2015). «Селективная деполяризация трансмембранного потенциала изменяет структуру мышц и локализацию мышечных клеток у эмбрионов Xenopus laevis» . Международный журнал биологии развития . 59 (7–8–9): 303–311. дои : 10.1387/ijdb.150198ml . ПМЦ 10461602 . ПМИД 26198143 .
- ^ Сунделакруз, Сара; Ли, Чунмей; Чхве, Ён Джун; Левин, Майкл; Каплан, Дэвид Л. (2013). «Биоэлектрическая модуляция заживления ран в 3D-модели тканеинженерной кости in vitro» . Биоматериалы . 34 (28): 6695–6705. doi : 10.1016/j.bimaterials.2013.05.040 . ПМЦ 3724996 . ПМИД 23764116 .
- ^ Сунделакруз, Сара; Левин, Майкл; Каплан, Дэвид Л. (2013). «Деполяризация изменяет фенотип, поддерживает пластичность предифференцированных мезенхимальных стволовых клеток» . Тканевая инженерия, часть А. 19 (17–18): 1889–1908. дои : 10.1089/ten.tea.2012.0425.rev . ПМЦ 3726227 . ПМИД 23738690 .
- ^ Хинард, В.; Белин, Д; Кениг, С; Бадер, CR; Бернхейм, Л. (2008). «Инициация дифференцировки миобластов человека посредством дефосфорилирования каналов Kir2.1 K+ по тирозину 242» . Разработка . 135 (5): 859–867. дои : 10.1242/dev.011387 . ПМИД 18216177 .
- ^ Левин, Майкл (2012). «Молекулярное биоэлектричество в биологии развития: новые инструменты и недавние открытия» . Биоэссе . 34 (3): 205–217. doi : 10.1002/bies.201100136 . ПМК 3430077 . ПМИД 22237730 .
- ^ Левин, Майкл (2013). «Перепрограммирование клеток и структурирования тканей с помощью биоэлектрических путей: молекулярные механизмы и биомедицинские возможности» . Междисциплинарные обзоры Wiley: системная биология и медицина . 5 (6): 657–676. дои : 10.1002/wsbm.1236 . ПМЦ 3841289 . ПМИД 23897652 .
- ^ Мэтьюз, Хуанита; Левин, Майкл (2017). «Передача сигналов через щелевые соединения в регуляции паттернов: связь физиологических сетей управляет ростом и формой» . Развивающая нейробиология . 77 (5): 643–673. дои : 10.1002/dneu.22405 . ПМЦ 10478170 . ПМИД 27265625 .
- ^ Ценг, Ай-Сун; Левин, Майкл (2012). «Преобразование биоэлектрических сигналов в эпигенетические пути во время регенерации хвоста головастика» . Анатомическая запись . 295 (10): 1541–1451. дои : 10.1002/ar.22495 . ПМЦ 3442154 . ПМИД 22933452 .
- ^ Левин, Майкл (2007). «Крупномасштабная биофизика: потоки ионов и регенерация». Тенденции клеточной биологии . 17 (6): 261–270. дои : 10.1016/j.tcb.2007.04.007 . ПМИД 17498955 .
- ^ Кнопфель, Т; Лин, М.З.; Левская, А; Тиан, Л; Лин, Дж. Ю.; Бойден, ES (2010). «На пути ко второму поколению оптогенетических инструментов» . Журнал неврологии . 30 (45): 14998–5004. doi : 10.1523/JNEUROSCI.4190-10.2010 . ПМЦ 2997431 . ПМИД 21068304 .
- ^ Фенно, Лиф; Йижар, Офер; Дейсерот, Карл (2011). «Развитие и применение оптогенетики» . Ежегодный обзор неврологии . 34 : 389–412. doi : 10.1146/annurev-neuro-061010-113817 . ПМК 6699620 . ПМИД 21692661 .
- ^ Лонг, Сяоян; Йе, Цзин; Чжао, Ди; Чжан, Шэн-Цзя (2015). «Магнитогенетика: Дистанционная неинвазивная магнитная активация активности нейронов с помощью магниторецептора» . Научный вестник . 60 (24): 2107–2119. Бибкод : 2015SciBu..60.2107L . дои : 10.1007/s11434-015-0902-0 . ПМК 4692962 . ПМИД 26740890 .
- ^ Уилсон, Максвелл З.; Равиндран, Павитран Т; Лим, Венделл А; Тетчер, Джаред Э. (2017). «Отслеживание потока информации от Erk до индукции целевого гена раскрывает механизмы динамического и комбинаторного контроля» . Молекулярная клетка . 67 (5): 757–769.e5. doi : 10.1016/j.molcel.2017.07.016 . ПМК 5591080 . ПМИД 28826673 .
- ^ Бугай, Лукаш Дж; о'Донохью, Джефф П.; Лим, Венделл А. (2017). «Опрос клеточного восприятия и принятия решений с помощью оптогенетических инструментов» . Журнал клеточной биологии . 216 (1): 25–28. дои : 10.1083/jcb.201612094 . ПМЦ 5223619 . ПМИД 28003330 .
- ^ Митчелл, Амир; Лим, Венделл (2016). «Клеточное восприятие и неправильное восприятие: внутренние модели принятия решений, сформированные эволюционным опытом» . Биоэссе . 38 (9): 845–849. doi : 10.1002/bies.201600090 . ПМЦ 4996742 . ПМИД 27461864 .
- ^ Фишбах, Массачусетс; Блустоун, Дж. А.; Лим, Вашингтон (2013). «Клеточная терапия: следующий столп медицины» . Наука трансляционной медицины . 5 (179): 179пс7. doi : 10.1126/scitranslmed.3005568 . ПМЦ 3772767 . ПМИД 23552369 .
- ^ Чау, Анджела Х; Уолтер, Джессика М; Жерарден, Жалин; Тан, Чао; Лим, Венделл А. (2012). «Проектирование синтетических регуляторных сетей, способных к самоорганизации поляризации клеток» . Клетка . 151 (2): 320–332. дои : 10.1016/j.cell.2012.08.040 . ПМЦ 3498761 . ПМИД 23039994 .
- ^ Башор, Калеб Дж; Хорвиц, Эндрю А; Пейсайович, Серджио Г; Лим, Венделл А. (2010). «Перемонтирование клеток: синтетическая биология как инструмент исследования принципов организации живых систем» . Ежегодный обзор биофизики . 39 : 515–37. doi : 10.1146/annurev.biophys.050708.133652 . ПМЦ 2965450 . ПМИД 20192780 .
- ^ Пеццуло, Джованни; Левин, Майкл (2016). «Нисходящие модели в биологии: объяснение и контроль сложных живых систем выше молекулярного уровня» . Журнал интерфейса Королевского общества . 13 (124): 20160555. doi : 10.1098/rsif.2016.0555 . ПМК 5134011 . ПМИД 27807271 .
- ^ Перейти обратно: а б Пеццуло, Дж; Левин, М (2015). «Воспоминание о теле: применение вычислительной нейробиологии для нисходящего контроля регенерации конечностей и других сложных органов» . Интегративная биология . 7 (12): 1487–1517. дои : 10.1039/c5ib00221d . ПМЦ 4667987 . ПМИД 26571046 .
- ^ Фристон, К; Левин, М; Сенгупта, Б; Пеццуло, Дж. (2015). «Знать свое место: подход свободной энергии к регулированию моделей» . Журнал интерфейса Королевского общества . 12 (105): 20141383. doi : 10.1098/rsif.2014.1383 . ПМЦ 4387527 . ПМИД 25788538 .
- ^ Левин, Майкл (2014). «Эндогенные биоэлектрические сети хранят негенетическую информацию о паттернах во время развития и регенерации» . Журнал физиологии . 592 (11): 2295–2305. дои : 10.1113/jphysicalol.2014.271940 . ПМК 4048089 . ПМИД 24882814 .
- ^ Макнамара, Гарольд М; Чжан, Гонконг; Верли, Кристофер А; Коэн, Адам Э (2016). «Оптически управляемые генераторы в инженерной биоэлектрической ткани» . Физический обзор X . 6 (3): 031001. Бибкод : 2016PhRvX...6c1001M . дои : 10.1103/PhysRevX.6.031001 .
- ^ Ригас, С; Дебросы, Г; Харалампидис, К; Висенте-Агулло, нападающий; Фельдманн, К.А.; Грабов А; Долан, Л; Хацопулос, П. (2001). «TRH1 кодирует переносчик калия, необходимый для роста кончиков корневых волосков арабидопсиса» . Растительная клетка . 13 (1): 139–151. дои : 10.1105/tpc.13.1.139 . ПМК 102205 . ПМИД 11158535 .
- ^ Перейти обратно: а б Дахал, Г.Р.; Роусон, Дж; Гассауэй, Б; Квок, Б; Тонг, Ю; Птачек, Л.Дж.; Бейтс, Э. (2012). «Для формирования паттерна необходим внутренний выпрямляющий канал K+» . Разработка . 139 (19): 3653–3664. дои : 10.1242/dev.078592 . ПМЦ 3436115 . ПМИД 22949619 .
- ^ Вильянуэва, С; Бургос, Дж.; Лопес-Каюкео, К.И.; и др. (2015). «Расщелина нёба, умеренная задержка развития легких и ранняя послеродовая летальность у мышей с дефицитом канала Kir7.1, внутренне исправляющего K+» . ПЛОС ОДИН . 10 (9): e0139284. Бибкод : 2015PLoSO..1039284V . дои : 10.1371/journal.pone.0139284 . ПМК 4581704 . ПМИД 26402555 .
- ^ Саймонс, М; Голт, штат Вашингтон; Готхардт, Д.; и др. (2009). «Электрохимические сигналы регулируют сборку комплекса «Вьющиеся/Растрепанные» на плазматической мембране во время плоской эпителиальной поляризации» . Природная клеточная биология . 11 (3): 286–294. дои : 10.1038/ncb1836 . ПМК 2803043 . ПМИД 19234454 .
- ^ Гермле, Т; Салтукоглу, Д.; Грюневальд, Дж.; и др. (2010). «Регуляция передачи сигналов планарной полярности, зависимой от Frizzled, с помощью субъединицы V-АТФазы» . Современная биология . 20 (14): 1269–1276. Бибкод : 2010CBio...20.1269H . дои : 10.1016/j.cub.2010.05.057 . ПМИД 20579879 . S2CID 15407237 .
- ^ Мюллер, К.; Маэзо, я; Витбродт, Дж.; Мартинес-Моралес-младший (2013). «Мутация тинтахины медаки проливает свет на эволюцию субъединиц V-АТФазы B у позвоночных» . Научные отчеты . 3 : 3217. Бибкод : 2013NatSR...3E3217M . дои : 10.1038/srep03217 . ПМЦ 3827601 . ПМИД 24225653 .
- ^ Бортвик, Кей Джей; Кандемир, Н.; Топалоглу, Р.; и др. (2003). «Фенокопия дефицита CAII: новое генетическое объяснение наследственного детского остеопетроза с дистальным почечным тубулярным ацидозом» . Журнал медицинской генетики . 40 (2): 115–121. дои : 10.1136/jmg.40.2.115 . ПМЦ 1735376 . ПМИД 12566520 .
- ^ Олдрич, Ричард В. (2015). «Новый стандарт: обзор Справочника по ионным каналам» . Журнал общей физиологии . 146 (2): 119–121. дои : 10.1085/jgp.201511461 . ПМЦ 4516783 . ПМИД 26216856 .
- ^ Дуке, А.; Газула, ВР; Качмарек, Л.К. (2013). «Экспрессия калиевых каналов Kv1.3 регулирует плотность корковых интернейронов» . Развивающая нейробиология . 73 (11): 841–855. дои : 10.1002/dneu.22105 . ПМЦ 3829632 . ПМИД 23821603 .
- ^ Чжэн, Дж. А. Т., М.С. Справочник по ионным каналам. (ЦРК Пресс, 2015). [ нужна страница ]
- ^ Кристенсен, А.Х; Шатлен, ФК; Хаттнер, И.Г.; и др. (2016). «Двухпоровый калиевый канал, TWIK-1, играет роль в регуляции частоты сердечных сокращений и размера предсердий». Журнал молекулярной и клеточной кардиологии . 97 : 24–35. дои : 10.1016/j.yjmcc.2016.04.006 . ПМИД 27103460 .
- ^ Саймонс, К; Раш, Л.Д.; Кроуфорд, Дж; и др. (2015). «Мутации в гене потенциалзависимого калиевого канала KCNH1 вызывают синдром Темпла-Барайтсера и эпилепсию». Природная генетика . 47 (1): 73–77. дои : 10.1038/ng.3153 . ПМИД 25420144 . S2CID 52799681 .
- ^ Лабонн, доктор медицинских наук; Грейвс, Т.Д.; Шен, Ю.; и др. (2016). «Микроделеция Xq22.2 приводит к вовлечению глицинового рецептора GLRA4 в умственную отсталость, поведенческие проблемы и черепно-лицевые аномалии» . БМК Неврология . 16 : 132. дои : 10.1186/s12883-016-0642-z . ПМЦ 4979147 . ПМИД 27506666 .
- ^ Хираки, Ю.; Миятаке, С.; Хаяшидани, М.; и др. (2014). «Аневризма аорты и краниосиностоз в семье с синдромом Канту». Американский журнал медицинской генетики, часть A. 164А (1): 231–236. дои : 10.1002/ajmg.a.36228 . ПМИД 24352916 . S2CID 73121 .
- ^ Купер, ЧП; Ройтер, Х.; Вулфле, Дж.; и др. (2014). «Синдром Канту, возникающий в результате активации мутации гена KCNJ8» . Человеческая мутация . 35 (7): 809–813. дои : 10.1002/humu.22555 . ПМЦ 4277879 . ПМИД 24700710 .
- ^ Браунштейн, Калифорния; Таун, MC; Люкетт, LJ; и др. (2013). «Мутация KCNJ8 у пациента с синдромом Канту с уникальными сосудистыми аномалиями - подтверждение роли каналов K (АТФ) в этом состоянии» . Европейский журнал медицинской генетики . 56 (12): 678–682. дои : 10.1016/j.ejmg.2013.09.009 . ПМК 3902017 . ПМИД 24176758 .
- ^ Чонг, JX; Макмиллин, MJ; Шивели, К.М.; и др. (2015). «Мутации de novo в NALCN вызывают синдром, характеризующийся врожденными контрактурами конечностей и лица, гипотонией и задержкой развития» . Американский журнал генетики человека . 96 (3): 462–473. дои : 10.1016/j.ajhg.2015.01.003 . ПМЦ 4375444 . ПМИД 25683120 .
- ^ Узун, С; Гекче, С.; Вагнер, К. (2005). «Мутации гена регулятора трансмембранной проводимости при муковисцидозе у бесплодных мужчин с врожденным двусторонним отсутствием семявыносящих протоков» . Журнал экспериментальной медицины Тохоку . 207 (4): 279–285. дои : 10.1620/tjem.207.279 . ПМИД 16272798 .
- ^ Вильшанский, М.; Дюпюи, А.; Эллис, Л.; и др. (2006). «Мутации в гене трансмембранного регулятора муковисцидоза и трансэпителиальные потенциалы in vivo» . Американский журнал респираторной медицины и интенсивной терапии . 174 (7): 787–794. дои : 10.1164/rccm.200509-1377OC . ПМК 2648063 . ПМИД 16840743 .
- ^ Пуарье, К.; Виот, Г.; Ломбарди, Л.; Жони, К.; Биллюарт, П.; Бьенвеню, Т. (2017). «Потеря функции KCNC1 связана с умственной отсталостью без судорог» . Европейский журнал генетики человека . 25 (5): 560–564. дои : 10.1038/ejhg.2017.3 . ПМЦ 5437909 . ПМИД 28145425 .
- ^ Вил, Э.Л; Хасан, М.; Уолш, Ю.; и др. (2014). «Восстановление тока через мутированные калиевые каналы TASK3, лежащие в основе синдрома Бирка Бареля». Молекулярная фармакология . 85 (3): 397–407. дои : 10.1124/моль.113.090530 . ПМИД 24342771 . S2CID 14790826 .
- ^ Барель, О; Шалев, С.А.; Офир Р.; и др. (2008). «Наследственный по материнской линии синдром умственной отсталости Бирка Бареля, вызванный мутацией геномно импринтированного калиевого канала KCNK9» . Американский журнал генетики человека . 83 (2): 193–199. дои : 10.1016/j.ajhg.2008.07.010 . ПМК 2495061 . ПМИД 18678320 .
- ^ Перейти обратно: а б Глойн, Анна Л; Пирсон, Юэн Р.; Антклифф, Дженнифер Ф.; и др. (2004). «Активация мутаций в гене, кодирующем АТФ-чувствительную субъединицу Kir6.2 калийного канала, и постоянный неонатальный диабет» (PDF) . Медицинский журнал Новой Англии . 350 (18): 1838–1849. doi : 10.1056/NEJMoa032922 . ПМИД 15115830 .
- ^ Ли, член парламента; Равенел, доктор медицинских наук; Ху, Р.Дж.; и др. (2000). «Направленное нарушение гена Kvlqt1 вызывает глухоту и гиперплазию желудка у мышей» . Журнал клинических исследований . 106 (12): 1447–1455. дои : 10.1172/JCI10897 . ПМЦ 387258 . ПМИД 11120752 .
- ^ Перейти обратно: а б Вексберг, Р; Нисикава, Дж.; Калусериу, О.; и др. (2001). «Развитие опухоли при синдроме Беквита-Видемана связано с различными конституциональными молекулярными изменениями 11p15, включая дефекты импринтинга KCNQ1OT1» . Молекулярная генетика человека . 10 (26): 2989–3000. дои : 10.1093/hmg/10.26.2989 . ПМИД 11751681 .
- ^ Мур, ES; Уорд, Р.Э; Эскобар, ЛФ; Карлин, Мэн (2000). «Гетерогенность синдрома Видемана-Беквита: антропометрические данные». Американский журнал медицинской генетики . 90 (4): 283–290. doi : 10.1002/(SICI)1096-8628(20000214)90:4<283::AID-AJMG4>3.0.CO;2-F . ПМИД 10710224 .
- ^ Вэнь, Х.; Вейгер, ТМ; Фергюсон, Т.С.; и др. (2005). «Канал KCNQ дрозофилы, необходимый для раннего эмбрионального развития» . Журнал неврологии . 25 (44): 10147–10156. doi : 10.1523/JNEUROSCI.3086-05.2005 . ПМК 6725806 . ПМИД 16267222 .
- ^ Ривас, А; Фрэнсис, HW (2005). «Аномалии внутреннего уха у мышей с нокаутом Kcnq1 (Kvlqt1): модель синдрома Джервелла и Ланге-Нильсена». Отология и невротология . 26 (3): 415–424. дои : 10.1097/01.mao.0000169764.00798.84 . ПМИД 15891643 . S2CID 1700736 .
- ^ Казимиро, MC; Ноллманн, Британская Колумбия; Ямоа, Э. Н.; Не, Л; Вари-младший, Джей Си; Сиренко С.Г.; Грин, А.Е.; Гринберг, А; Хуанг, СП; Эберт, С.Н.; Пфайфер, К. (2004). «Направленный точечный мутагенез мышиного Kcnq1: фенотипический анализ мышей с точечными мутациями, вызывающими синдром Романо-Уорда у людей». Геномика . 84 (3): 555–564. дои : 10.1016/j.ygeno.2004.06.007 . ПМИД 15498462 .
- ^ Шуабе, К; Нейруд, Н; Гишени, П; и др. (1997). «Свойства мутаций K+-канала KvLQT1 у Романо-Уорда, Джервелла и Ланге-Нильсена, унаследовавших сердечные аритмии» . Журнал ЭМБО . 16 (17): 5472–5479. дои : 10.1093/emboj/16.17.5472 . ПМК 1170178 . ПМИД 9312006 .
- ^ Бендаху, С; Дональдсон, MR; Пластер, Нью-Йорк; и др. (2003). «Дефектный трафик Kir2.1 калиевого канала лежит в основе синдрома Андерсена-Тавиля» . Журнал биологической химии . 278 (51): 51779–51785. дои : 10.1074/jbc.M310278200 . ПМИД 14522976 .
- ^ Кулиат, Коннектикут; Стаббс, Эл Джей; Войчик Р.П.; Рассел, LB; Джонсон, ДК; Ринчик, Э.М. (1995). «Дефицит субъединицы бета-3 типа рецептора гамма-аминомасляной кислоты вызывает расщелину неба у мышей». Природная генетика . 11 (3): 344–346. дои : 10.1038/ng1195-344 . ПМИД 7581464 . S2CID 19397785 .
- ^ Ви, Э.Л; Циммерман, Э. Ф. (1985). «Поглощение ГАМК в мезенхимальных клетках эмбрионального неба двух линий мышей». Нейрохимические исследования . 10 (12): 1673–1688. дои : 10.1007/bf00988609 . ПМИД 4088436 . S2CID 26049392 .
- ^ Хоманикс, GE; Делори, ТМ; Файерстоун, LL; и др. (1997). «Мыши, лишенные субъединицы бета3-рецептора гамма-аминобутиратного типа, страдают эпилепсией, расщелиной неба и сверхчувствительным поведением» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (8): 4143–4148. Бибкод : 1997PNAS...94.4143H . дои : 10.1073/pnas.94.8.4143 . ПМК 20582 . ПМИД 9108119 .
- ^ Рок, младший; Футтнер, ЧР; Харф, Б.Д. (2008). «Трансмембранный белок TMEM16A необходим для нормального развития трахеи мыши» . Биология развития . 321 (1): 141–149. дои : 10.1016/j.ydbio.2008.06.009 . ПМИД 18585372 .
- ^ Ракич, П; Сидман, Р.Л. (1973). «Последовательность аномалий развития, приводящих к дефициту гранулярных клеток в коре мозжечка мышей-мутантов Weaver». Журнал сравнительной неврологии . 152 (2): 103–132. дои : 10.1002/cne.901520202 . ПМИД 4128371 . S2CID 6553698 .
- ^ Ракич, П; Сидман, Р.Л. (1973). «Мозжечок мыши-мутанта Уивера: дефектная миграция нейронов, вторичная по отношению к аномалии глии Бергмана» . Труды Национальной академии наук Соединенных Штатов Америки . 70 (1): 240–244. Бибкод : 1973ПНАС...70..240Р . дои : 10.1073/pnas.70.1.240 . ПМК 433223 . ПМИД 4509657 .
- ^ Хаттен, МЭ; Лием, Р.К.; Мейсон, Калифорния (1986). «Нейроны гранул мозжечка мыши Weaver не могут мигрировать по астроглиальным отросткам дикого типа in vitro» . Журнал неврологии . 6 (9): 2676–2683. doi : 10.1523/jneurosci.06-09-02676.1986 . ПМК 6568692 . ПМИД 3528411 .
- ^ Патил, Н.; Кокс, Д.Р.; Бхат, Д; Фахам, М; Майерс, Р.М.; Петерсон, А.С. (1995). «Мутация калиевого канала у мышей-ткачей влияет на возбудимость мембраны при дифференцировке гранулярных клеток». Природная генетика . 11 (2): 126–129. дои : 10.1038/ng1095-126 . ПМИД 7550338 . S2CID 23470275 .
- ^ Дэн, GQ; Чжао, X.; Лиз-Миллер, JP; Куинн, Франция; Ли, П.; Ранкур, Делавэр; Лондон, Б.; Кросс, Дж. К.; Дафф, HJ (2008). «Гомозиготная миссенс-мутация калиевого канала N629D hERG (KCNH2) вызывает дефекты развития правого желудочка и его выносящего тракта, а также эмбриональную летальность» . Исследование кровообращения . 103 (12): 1483–1491. дои : 10.1161/CIRCRESAHA.108.177055 . ПМЦ 2774899 . ПМИД 18948620 .
- ^ Перейти обратно: а б Чем, Б.Л.; Гус, Дж.А.; Сарвер, Алабама; и др. (2014). «Роль KCNQ1 в развитии рака желудочно-кишечного тракта у мышей и человека» . Онкоген . 33 (29): 3861–3868. дои : 10.1038/onc.2013.350 . ПМЦ 3935979 . ПМИД 23975432 .
- ^ Монтейро, Дж; Айрес, Р; Беккер, JD; Хасинто, А; Серталь, AC; Родригес-Леон, Дж (2014). «Активность протонной накачки V-АТФазы необходима для регенерации придатков взрослых рыбок данио» . ПЛОС ОДИН . 9 (3): е92594. Бибкод : 2014PLoSO...992594M . дои : 10.1371/journal.pone.0092594 . ПМЦ 3966808 . ПМИД 24671205 .
- ^ Левин, М; Торлин, Т; Робинсон, КР; Ноги, Т; Меркола, М. (2002). «Асимметрия H+/K+-АТФазы и потенциалов клеточных мембран представляет собой очень раннюю стадию формирования паттерна «лево-право» . Клетка . 111 (1): 77–89. дои : 10.1016/s0092-8674(02)00939-x . ПМИД 12372302 . S2CID 2502945 .
- ^ Дубок, В; Реттингер, Э; Лапраз, Ф; и др. (2005). «Лево-правая асимметрия у эмбриона морского ежа регулируется узловой передачей сигналов на правой стороне» . Развивающая клетка . 9 (1): 147–158. дои : 10.1016/j.devcel.2005.05.008 . ПМИД 15992548 .
- ^ Ивашита, М; Ватанабэ, М; Исии, М; и др. (2006). «Пигментный рисунок у ягуара/обеликса данио вызван мутацией Kir7.1: значение для регуляции движения меланосом» . ПЛОС Генетика . 2 (11): е197. doi : 10.1371/journal.pgen.0020197 . ПМК 1657052 . ПМИД 17121467 .
- ^ Тур, Дж; Чапаламадугу, К.К.; Падавер, Т; Бадоле, С.Л.; Килфойл Пи Джей, 2-й; Бхатнагар, А; Типпараджу, С.М. (2016). «Удаление субъединицы Kvβ1.1 приводит к электрическим и гемодинамическим изменениям, вызывающим гипертрофию сердца в сердце самок мышей» . Экспериментальная физиология . 101 (4): 494–508. дои : 10.1113/EP085405 . ПМЦ 4827621 . ПМИД 27038296 .
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Чопра, С.С.; Страуд, Д.М.; Ватанабэ, Х; Беннетт, Дж. С.; Бернс, К.Г.; Уэллс, К.С.; Ян, Т; Чжун, Т.П; Роден, Д.М. (2010). «Потенциал-управляемые натриевые каналы необходимы для развития сердца у рыбок данио» . Исследование кровообращения . 106 (8): 1342–1350. дои : 10.1161/CIRCRESAHA.109.213132 . ПМЦ 2869449 . ПМИД 20339120 .
- ^ Шу, Х; Ченг, К; Патель, Н; и др. (2003). «Na,K-АТФаза необходима для эмбрионального развития сердца рыбок данио» . Разработка . 130 (25): 6165–6173. дои : 10.1242/dev.00844 . ПМИД 14602677 .
- ^ Харе, С; Ник, Дж. А.; Чжан, Ю; и др. (2017). «Мутация KCNC3 вызывает непрогрессирующий подтип SCA13, связанный с развитием нервной системы, связанный с доминирующими негативными эффектами и аберрантной торговлей EGFR» . ПЛОС ОДИН . 12 (5): e0173565. Бибкод : 2017PLoSO..1273565K . дои : 10.1371/journal.pone.0173565 . ПМЦ 5414954 . ПМИД 28467418 .
- ^ Старич, Т.А.; Холл, ДХ; Гринштейн, Д. (2014). «Два класса каналов щелевых соединений опосредуют взаимодействия сомы и зародышевой линии, необходимые для пролиферации зародышевой линии и гаметогенеза у Caenorhabditis elegans» . Генетика . 198 (3): 1127–1153. дои : 10.1534/genetics.114.168815 . ПМЦ 4224157 . ПМИД 25195067 .
- ^ Бауэр, Р; Леманн, К; Мартини, Дж; Экардт, Ф; Хох, М (2004). «Белок канала щелевого соединения иннексин 2 необходим для морфогенеза эпителия у эмбриона дрозофилы» . Молекулярная биология клетки . 15 (6): 2992–3004. дои : 10.1091/mbc.E04-01-0056 . ПМК 420120 . ПМИД 15047872 .
- ^ Бауэр, Р; Леманн, К; Фусс, Б; и др. (2002). «Ген канала щелевого соединения дрозофилы иннексин 2 контролирует развитие передней кишки в ответ на передачу сигналов Wingless» . Журнал клеточной науки . 115 (Часть 9): 1859–1867. дои : 10.1242/jcs.115.9.1859 . ПМИД 11956317 .
- ^ Ричард, М.; Хох, М (2015). «Размер глаз дрозофилы определяется иннексин-2-зависимой декапентаплегической передачей сигналов» . Биология развития . 408 (1): 26–40. дои : 10.1016/j.ydbio.2015.10.011 . ПМИД 26455410 .
- ^ Дебир, П; Ван Эш, Х; Гюисманс, К; Пейкелс, Э; Де Смет, Л; Ван Де Вен, Ж; Девриендт, К; Фринс, JP (2005). «Новые мутации GJA1 у пациентов с окуло-денто-цифровой дисплазией (ODDD)». Европейский журнал медицинской генетики . 48 (4): 377–387. дои : 10.1016/j.ejmg.2005.05.003 . ПМИД 16378922 .
- ^ Пиццути, А; Флекс, Э; Мингарелли, Р; Сальпьетро, К; Зеланте, Л; Даллапиккола, Б. (2004). «Гомозиготная мутация гена GJA1 вызывает фенотип спектра Халлермана-Штрайффа/ODDD» . Человеческая мутация . 23 (3): 286. doi : 10.1002/humu.9220 . ПМИД 14974090 . S2CID 13345970 .
- ^ Юарт, Дж. Л.; Коэн, МФ; Мейер, Р.А.; Хуанг, Г.Ю.; Весселс, А; Гурди, Р.Г.; Чин, Эй Джей; Парк, С.М.; Лазатин Б. О; Виллабон, С; Ло, CW (1997). «Дефекты сердца и нервной трубки у трансгенных мышей со сверхэкспрессией гена щелевого соединения Cx43». Разработка . 124 (7): 1281–1292. дои : 10.1242/dev.124.7.1281 . ПМИД 9118799 . S2CID 189036 .
- ^ Реоме, AG; Де Соуза, Пенсильвания; Кулкарни, С; Ланжиль, Б.Л.; Чжу, Д; Дэвис, ТК; Джунеха, Южная Каролина; Киддер, GM; Россант, Дж (1995). «Пороки развития сердца у новорожденных мышей, лишенных коннексина43». Наука . 267 (5205): 1831–1834. Бибкод : 1995Sci...267.1831R . дои : 10.1126/science.7892609 . ПМИД 7892609 .
- ^ Бритц-Каннингем, С.Х; Шах, ММ; Зуппан, CW; Флетчер, WH (1995). «Мутации гена щелевого соединения Connexin43 у пациентов с пороками развития сердца и дефектами латеральности» . Медицинский журнал Новой Англии . 332 (20): 1323–1329. дои : 10.1056/NEJM199505183322002 . ПМИД 7715640 .
- ^ Чивителли, Р. (2008). «Клеточно-клеточная связь в линии остеобластов/остеоцитов» . Архив биохимии и биофизики . 473 (2): 188–192. дои : 10.1016/j.abb.2008.04.005 . ПМК 2441851 . ПМИД 18424255 .
- ^ Левин, М; Меркола, М. (1999). «Передача сигналов формирования левого и правого паттернов, опосредованная щелевыми соединениями, в ранней бластодерме цыпленка находится выше асимметрии Shh в узле». Разработка . 126 (21): 4703–4714. дои : 10.1242/dev.126.21.4703 . ПМИД 10518488 .
- ^ Беккер, Д.Л.; МакГоннелл, я; Макаренкова, Х.П.; Патель, К; Щекотать, С; Лоример, Дж; Грин, CR (1999). «Роль альфа-1-коннексина в морфогенезе куриных эмбрионов выявлена с использованием нового антисмыслового подхода». Генетика развития . 24 (1–2): 33–42. doi : 10.1002/(SICI)1520-6408(1999)24:1/2<33::AID-DVG5>3.0.CO;2-F . ПМИД 10079509 .
- ^ Леканда, Ф; Варлоу, П.М.; Шейх, С; Фурлан, Ф; Стейнберг, TH; Чивителли, Р. (2000). «Дефицит коннексина 43 вызывает задержку окостенения, черепно-лицевые аномалии и дисфункцию остеобластов» . Журнал клеточной биологии . 151 (4): 931–944. дои : 10.1083/jcb.151.4.931 . ПМК 2169447 . ПМИД 11076975 .
- ^ Арайя, Р; Экардт, Д; Рикельме, Массачусетс; Виллеке, К; Саес, Дж. К. (2003). «Присутствие и важность коннексина 43 во время миогенеза». Клеточная связь и адгезия . 10 (4–6): 451–456. дои : 10.1080/cac.10.4-6.451.456 . hdl : 10533/174413 . ПМИД 14681056 . S2CID 33491307 .
- ^ Канади, JD; Деллинджер, М.Т; Мангер, С.Дж.; Витте, М.Х.; Саймон, AM (2011). «Дефицит коннексина 37 и коннексина 43 у мышей нарушает развитие лимфатических клапанов и приводит к лимфатическим расстройствам, включая лимфедему и хилоторакс» . Биология развития . 354 (2): 253–266. дои : 10.1016/j.ydbio.2011.04.004 . ПМК 3134316 . ПМИД 21515254 .
- ^ Канади, JD; Мангер, С.Дж.; Витте, М.Х.; Саймон, AM (2015). «Сочетание делеций Foxc2 и Connexin37 у мышей приводит к серьезным нарушениям роста и ремоделирования лимфатических сосудов» . Биология развития . 405 (1): 33–46. дои : 10.1016/j.ydbio.2015.06.004 . ПМЦ 4529811 . ПМИД 26079578 .
- ^ Кумаи, М; Нишии, К; Накамура, К; Такеда, Н.; Сузуки, М; Шибата, Ю (2000). «Потеря коннексина 45 вызывает дефект подушки на раннем этапе кардиогенеза». Разработка . 127 (16): 3501–3512. дои : 10.1242/dev.127.16.3501 . ПМИД 10903175 .
- ^ Нишии, К; Кумаи, М; Шибата, Ю (2001). «Регуляция эпителиально-мезенхимальной трансформации через каналы щелевых соединений в развитии сердца». Тенденции сердечно-сосудистой медицины . 11 (6): 213–218. дои : 10.1016/s1050-1738(01)00103-7 . ПМИД 11673050 .
- ^ Уайт, Т.В. (2002). «Уникальный и избыточный вклад коннексина в развитие хрусталика». Наука . 295 (5553): 319–320. Бибкод : 2002Sci...295..319W . дои : 10.1126/science.1067582 . ПМИД 11786642 . S2CID 25744002 .
- ^ Чанг, К; Тан, Вт; Ким, Ю; Лин, X (2015). «Временное условное отсутствие коннексина26 у мышей показывает временную потребность в коннексине26 в ключевых событиях развития улитки до появления слуха». Нейробиология болезней . 73 : 418–427. дои : 10.1016/j.nbd.2014.09.005 . ПМИД 25251605 . S2CID 207068577 .
- ^ Ватанабэ, М; Ивашита, М; Исии, М; Курачи, Ю; Каваками, А; Кондо, С; Окада, Н. (2006). «Пятнистый рисунок леопарда Danio вызван мутацией в гене коннексина 41.8 рыбки данио» . Отчеты ЭМБО . 7 (9): 893–897. дои : 10.1038/sj.embor.7400757 . ПМЦ 1559663 . ПМИД 16845369 .
- ^ Айовин, М.К.; Хиггинс, Э.П.; Хиндес, А; Коблиц, Б; Джонсон, С.Л. (2005). «Мутации в коннексине 43 (GJA1) нарушают рост костей в плавниках рыбок данио» . Биология развития . 278 (1): 208–219. дои : 10.1016/j.ydbio.2004.11.005 . ПМИД 15649473 .
- ^ Дэви, А; Буш, Дж.О.; Сориано, П. (2006). «Подавление связи щелевых соединений на эктопических границах Эф/эфрин лежит в основе краниофронтоназального синдрома» . ПЛОС Биология . 4 (10): е315. дои : 10.1371/journal.pbio.0040315 . ПМЦ 1563491 . ПМИД 16968134 .
- ^ Симс-младший, К.; Эбл, Д.М.; Айовин, МК (2009). «Коннексин43 регулирует расположение суставов в плавниках рыбок данио» . Биология развития . 327 (2): 410–418. дои : 10.1016/j.ydbio.2008.12.027 . ПМЦ 2913275 . ПМИД 19150347 .
- ^ Хоптак-Солга, А.Д.; Нильсен, С; Джайн, я; Таммел, Р; Хайд, Д.Р.; Айовин, МК (2008). «Коннексин43 (GJA1) необходим в популяции делящихся клеток во время регенерации плавников» . Биология развития . 317 (2): 541–548. дои : 10.1016/j.ydbio.2008.02.051 . ПМК 2429987 . ПМИД 18406403 .
- ^ Смендзюк, С.М.; Мессенберг, А; Фогль, А.В.; Таненцапф, Г (2015). «Двунаправленная связь сомы и зародышевой линии, опосредованная щелевыми соединениями, необходима для сперматогенеза» . Разработка . 142 (15): 2598–2609. дои : 10.1242/dev.123448 . ПМК 6514411 . ПМИД 26116660 .
- ^ О, С. К.; Шин, Дж.О.; Бэк, Дж. И.; Ли, Дж; Бэ, JW; Анкамердди, Х; Ким, MJ; Ха, Т.Л.; Рю, З.Ю.; Ким, Великобритания; Бок, Дж; Ли, К.Ю. (2015). «Паннексин 3 необходим для нормального развития скелета у позвоночных» . Журнал ФАСЭБ . 29 (11): 4473–4484. дои : 10.1096/fj.15-273722 . ПМИД 26183770 . S2CID 8219978 .
- ^ Онкал, Р; Джамгоз, МБ (2009). «Молекулярная фармакология экспрессии потенциалзависимых натриевых каналов при метастатическом заболевании: клинический потенциал неонатального Nav1.5 при раке молочной железы». Европейский журнал фармакологии . 625 (1–3): 206–219. дои : 10.1016/j.ejphar.2009.08.040 . ПМИД 19835862 .
- ^ Перейти обратно: а б Хаус, CD; Васке, CJ; Шварц, AM; Обиас, В; Фрэнк, Б; Луу, Т; Сарвазян Н; Ирби, Р; Штраусберг, Р.Л.; Хейлз, Т.Г.; Стюарт, Дж. М.; Ли, Нью-Хэмпшир (2010). «Потенциал-управляемый Na+-канал SCN5A является ключевым регулятором сети транскрипции генов, которая контролирует инвазию рака толстой кишки» . Исследования рака . 70 (17): 6957–6967. дои : 10.1158/0008-5472.CAN-10-1169 . ПМЦ 2936697 . ПМИД 20651255 .
- ^ Перес-Нейт, М; Рао, В.Р.; Джентиле, С. (2016). «Активация HERG1/Kv11.1 стимулирует транскрипцию p21waf/cip в клетках рака молочной железы посредством кальциневрин-зависимого механизма» . Онкотаргет . 7 (37): 58893–58902. дои : 10.18632/oncotarget.3797 . ПМЦ 5312283 . ПМИД 25945833 .
- ^ Лансу, К; Джентиле, С. (2013). «Активация калиевых каналов подавляет пролиферацию клеток рака молочной железы, активируя программу старения» . Смерть клеток и болезни . 4 (6): е652. дои : 10.1038/cddis.2013.174 . ПМЦ 3698542 . ПМИД 23744352 .
- ^ Пей, Л; Мудрец, О; Славин А; Грязь; Пауэрс, С; Ян, Л.Ю.; Хоуи, Т. (2003). «Онкогенный потенциал TASK3 (Kcnk9) зависит от функции K+-канала» . Труды Национальной академии наук . 100 (13): 7803–7807. Бибкод : 2003PNAS..100.7803P . дои : 10.1073/pnas.1232448100 . ПМК 164668 . ПМИД 12782791 .
- ^ Сайто, Цуёси; Шлегель, Ричард; Андрессон, Тиркелл; Юге, Луи; Ямамото, Масао; Ямасаки, Хироши (1998). «Индукция клеточной трансформации мутированной вакуолярной H+-аттазой 16К (дуктином) сопровождается подавлением межклеточной коммуникации щелевых соединений и транслокацией коннексина 43 в клетках NIH3T3» . Онкоген . 17 (13): 1673–1680. дои : 10.1038/sj.onc.1202092 . ПМИД 9796696 .
- ^ Гупта, Н; Мартин, П.М.; Прасад, П.Д.; Ганапати, В. (2006). «SLC5A8 (SMCT1)-опосредованный транспорт бутирата составляет основу опухолесупрессирующей функции транспортера». Науки о жизни . 78 (21): 2419–2425. дои : 10.1016/j.lfs.2005.10.028 . ПМИД 16375929 .
- ^ Репке, Т.К.; Пертелл, К; Кинг, EC; Ла Перль, К.М.; Лернер, диджей; Эбботт, GW (2010). «Направленное удаление Kcne2 вызывает глубокий кистозный гастрит и неоплазию желудка» . ПЛОС ОДИН . 5 (7): е11451. Бибкод : 2010PLoSO...511451R . дои : 10.1371/journal.pone.0011451 . ПМЦ 2897890 . ПМИД 20625512 .
- ^ Ли, член парламента; Ху, Р.Дж.; Джонсон, Лос-Анджелес; и др. (1997). «Человеческий ген KVLQT1 демонстрирует тканеспецифический импринтинг и включает хромосомные перестройки синдрома Беквита-Видемана». Природная генетика . 15 (2): 181–185. дои : 10.1038/ng0297-181 . ПМИД 9020845 . S2CID 24715509 .
- ^ Мартино, Джей Джей; Уолл, бакалавр искусств; Мастрантони, Э; Вилимчик, Б.Дж.; Ла Кава, С.Н.; Дегенхардт, К; Уайт, Э; Чен, С. (2013). «Метаботропный глутаматный рецептор 1 (Grm1) является онкогеном в эпителиальных клетках» . Онкоген . 32 (37): 4366–4376. дои : 10.1038/onc.2012.471 . ПМК 3910169 . ПМИД 23085756 .
- ^ Шпейер, CL; Смит, Дж. С.; Банда, М; и др. (2012). «Метаботропный глутаматный рецептор-1: потенциальная терапевтическая мишень для лечения рака молочной железы» . Исследование и лечение рака молочной железы . 132 (2): 565–573. дои : 10.1007/s10549-011-1624-x . ПМЦ 3898178 . ПМИД 21681448 .
- ^ Чжан, Дж. Т; Цзян, X. H; Се, С; Ченг, Х; Да Донг, Дж; Ван, Ю; Фок, К.Л.; Чжан, XH; Солнце, Т.Т; Цанг, Л.Л; Чен, Х; Сан, XJ; Чанг, Ю.В.; Цай, З.М; Цзян, WG; Чан, ХК (2013). «Понижение уровня CFTR способствует эпителиально-мезенхимальному переходу и связано с плохим прогнозом рака молочной железы» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1833 (12): 2961–2969. дои : 10.1016/j.bbamcr.2013.07.021 . ПМИД 23916755 .
- ^ Се, С; Цзян, X. H; Чжан, Дж. Т; и др. (2013). «CFTR подавляет прогрессирование опухоли посредством миР-193b, воздействующих на активатор урокиназы плазминогена (uPA) при раке простаты». Онкоген . 32 (18): 2282–2291, 2291.e1–7. дои : 10.1038/onc.2012.251 . ПМИД 22797075 . S2CID 21255355 .
- ^ Сирнес, С.; Брюун, Дж.; Кольберг, М.; и др. (2012). «Коннексин43 действует как супрессор опухоли колоректального рака и предсказывает исход заболевания». Международный журнал рака . 131 (3): 570–581. дои : 10.1002/ijc.26392 . ПМИД 21866551 . S2CID 6293505 .
- ^ Шиклинг, Б.М.; Англия, Южная Каролина; Айкин-Бернс, Н.; и др. (2015). «Ингибитор каналов BKCa модулирует туморогенную способность гормон-независимых клеток рака молочной железы через путь Wnt» . Отчеты онкологии . 33 (2): 533–538. дои : 10.3892/или.2014.3617 . ПМК 4306270 . ПМИД 25422049 .
- ^ Фельдер, CC; Макартур, Л; Ма, А.Л; и др. (1993). «Опухолесупрессорная функция мускариновых рецепторов ацетилхолина связана с активацией рецептор-управляемого притока кальция» . Труды Национальной академии наук Соединенных Штатов Америки . 90 (5): 1706–1710. Бибкод : 1993PNAS...90.1706F . дои : 10.1073/pnas.90.5.1706 . ПМК 45948 . ПМИД 7680475 .
- ^ Резания, С; Каммерер, С; Ли, С; Штайнекер-Фронвизер, Б; Горишек, А; Девани, Т.Т; Верхейен, С; Пассеггер, Калифорния; Тебризи-Визси, Н.Г.; Хакл, Х; Платцер, Д; Зарнани, А.Х; Малле, Э; Ян, SW; Бауэрнхофер, Т; Шрайбмайер, В. (2016). «Сверхэкспрессия вариантов сплайсинга гена KCNJ3 противоположным образом влияет на жизненно важные параметры линии клеток злокачественного рака молочной железы MCF-7» . БМК Рак . 16 : 628. doi : 10.1186/s12885-016-2664-8 . ПМК 4983040 . ПМИД 27519272 .
- ^ Каммерер, С; Соколовский, А; Хакл, Х; и др. (2016). «KCNJ3 является новым независимым прогностическим маркером для пациентов с раком молочной железы с положительным рецептором эстрогена» . Онкотаргет . 7 (51): 84705–84717. дои : 10.18632/oncotarget.13224 . ПМЦ 5356693 . ПМИД 27835900 .
Внешние ссылки
[ редактировать ] Цитаты, связанные с развитием биоэлектричества в Wikiquote
Цитаты, связанные с развитием биоэлектричества в Wikiquote